Через что осуществляется связь между клетками
Научная электронная библиотека
§ 3.1.4. Строение клетки
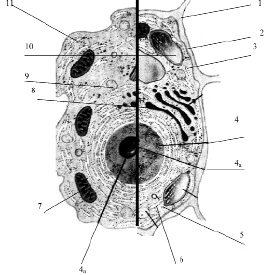
Размеры клетки широко варьируют от 0,1 мкм (некоторые бактерии) до 155 мм (яйцо страуса). У всех клеток, независимо от их формы, размеров, функциональной нагрузки обнаруживается сходное строение (рис. 3.13).
Рис. 3.13. Схема строения живой клетки: 1 – оболочка; 2 – мембрана; 3 – цитоплазма; 4 – ядро; 4а – ядрышко; 5 – рибосомы; 6 – эндоплазматическая сеть (ЭПС); 7 – митохондрии; 8 – комплекс гольджи; 9 – лизосомы; 10 – пластиды; 11 – клеточные включения
Снаружи клетка одета мембраной. Внутренняя часть клетки содержит многочисленные органоиды – структурные образования клетки, выполняющие определенные функции жизнедеятельности клетки.
1. Оболочка. Присутствует только у растительных клеток. Состоит из волокон целлюлозы. Функции оболочки: защита клетки от внешних повреждений, придает стабильную форму клетки, эластичность растительным тканям.
Повреждение наружной оболочки приводит к гибели клетки (цитолиз).
2. Мембрана. Тончайшая структура (75 Ǻ), состоит из двойного слоя молекул липидов и одного слоя белков. Такая структура обеспечивает уникальную эластичность и прочность мембране

Явление фагоцитоза – поглощение клеткой твердых частиц – впервые было описано русским врачом Мечниковым. Фагоцитарная особенность лежит в основе процесса иммунитета. Особенно развита у лейкоцитов, клеток костного мозга, лимфатических узлов, селезенки, надпочечников и гипофиза.
Пиноцитоз – поглощение клеткой растворов – состоит в том, что мельчайшие пузырьки жидкости втягиваются через образующуюся воронку, проникают через мембрану и усваиваются клеткой.
3. Цитоплазма – внутренняя среда клетки. Представляет собой гелеобразную жидкость (коллоидная система), состоит на 80 % из воды, в которой растворены белки, липиды, углеводы, неорганические вещества. Цитоплазма живой клетки находится в постоянном движении (циклоз).




4. Ядро – обязательный органоид эукариотических клеток. Впервые было исследовано и описано Р. Броуном в 1831 г. В молодых клетках расположено в центре клетки, в старых – смещается в сторону. Снаружи ядро окружено мембраной с крупными порами, способными пропускать крупные макромолекулы. Внутри ядро заполнено клеточным соком – кариоплазмой, основная часть ядра заполнена хроматином – ядерным веществом, содержащим ДНК и белок. Перед делением хроматин образует палочковидные хромосомы. Причём, хромосомы одинакового строения (но содержащие разные ДНК!) образуют пары, зрительно воспринимаемые как одно целое (рис. 3.14).
Рис. 3.14. Хромосомный набор человеческой клетки перед началом деления
Структурирование всех хромосом в пары свидетельствует о том, что число хромосом – чётное. Поэтому, его часто обозначают 2n, где n – количество хромосомных пар, а соответствующий набор хромосом называют диплоидным. Например, у голубей n = 40 (80 хромосом), у мухи n = 6 (12 хромосом), у собаки n = 39 (78 хромосом), у аскариды n = 1 (2 хромосомы). У человека n = 23 (46 хромосом). Однако, в половых клетках число хромосом в два раза меньше. Поэтому набор хромосом в половых клетках называется гаплоидным. Клетки, не являющиеся половыми называются соматическими. Иногда клетки с гаплоидным набором хромосом называют гаплоидными клетками, а с диплоидным набором хромосом – диплоидными клетками.
При слиянии двух родительских гаплоидных половых клеток образуется диплоидная клетка, дающая начало новому организму с набором генов отца и матери
Совокупность всех хромосом ядра (а значит и генов) клетки называется генотип. Именно генотип определяет все внешние и внутренние признаки конкретного организма.
В соматических клетках 44 Х-образные хромосомы (22 пары) у женщин и мужчин идентичны (сходны по строению), их называют аутосомами. А 23-я пара имеет конфигурацию ХХ – у женщин и ХY – у мужчин. Эти пары хромосом именуются половыми хромосомами.
В половых клетках 22 хромосомы также одинаковые у яйцеклеток и у сперматозоидов, а 23-я хромосома конфигурации Х – у яйцеклетки и Х или Y – у сперматозоидов. Поэтому при слиянии половых клеток и образовании пар хромосом, 23-я пара будет ( <ХY>или <ХХ>) определять пол будущего ребенка.
Необходимо помнить, что хотя в соматических клетках набор хромосом диплоидный (2n), однако, перед началом деления клеток происходит репликация ДНК, то есть, удвоение их количества, а, значит, и удвоение
количества хромосом. Поэтому перед началом деления соматической клетки в ней насчитывается 4n хромосом (рис. 16). Она становится тетраплоидной.
– хранение генетической информации;
– контроль за всеми процессами, происходящими в клетке: делением, дыханием, питанием и др.
4а. Ядрышко – структура, содержащаяся в ядре. Ядро может содержат 1, 2 или более ядрышек. Функция ядрышка – формирование рибосом.
Следует отметить, что не все клетки имеют оформленное ядро. Клетки, имеющие ядро называются эукариотическими или эукариотами. Клетки, не имеющие ядра, называются прокариотическими или прокариотами. Функции ядра у прокариот несёт одна нить ДНК (именуется хромосома), в которой хранится вся генетическая информация. К прокариотам относятся бактерии и сине-зеленые водоросли. Как правило, у прокариотов отсутствуют и некоторые другие органоиды. Размеры прокариотических клеток меньше, чем размеры эукариот.
5. Рибосомы – самые мелкие органоиды клетки. Были обнаружены в 1954 г. Французским ученым Паладом. Рибосомы были обнаружены в цитоплазме, а также на гранулярной ЭПС и в ядре.
Функция рибосом: обеспечение биосинтеза белка.
6. Эндоплазматическая сеть. Представляет собой каналы и полости, ограниченные мембраной. Различают две разновидности ЭПС: гранулярная ЭПС и агранулярная ЭПС. Гранулярная ЭПС морфологически отличается от агранулярной наличием на ее поверхности многочисленных рибосом (на агранулярной ЭПС рибосомы отсутствуют).
Функции эндоплазматической сети:
– участие в синтезе органических веществ: на гранулярной ЭПС синтезируются белки, на агранулярной – липиды и углеводы;
– транспортировка продуктов синтеза ко всем частям клетки.
Несложно уяснить, что гранулярная ЭПС характерна для клеток, синтезирующих белки (например клетки желез внутренней секреции), агранулярная ЭПС характерна для клеток-производителей углеводов и липидов (например клетки жировой ткани).
7. Митохондрии – крупные органоиды, состоящие из двойного слоя мембран: наружная – гладкая, внутренняя образует многочисленные гребнеобразные складки – кристы. Внутри митохондрии заполнены жидкостью (матрикс).
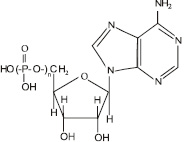
Функции митохондрий: основная функция митохондрий – обеспечение клетки энергией. Этот процесс происходит за счет синтеза аденозинтрифосфорной кислоты (АТФ) (рис. 3.15), в которой фрагмент
Рис. 3.15. Структурная формула аденозинфосфорных кислот. Для аденозинтрифосфорной кислоты n = 3, для аденозиндифосфорной кислоты n = 2, для аденозинмонофосфорной кислоты n = 1
При взаимодействии молекулы аденозинтрифосфорной кислоты с водой отщепляется один остаток фосфорной кислоты, в результате чего образуется аденозиндифосфорная кислота – АДФ и выделяется огромное количество энергии:
АТФ + Н2О = АДФ + Н3РО4 + 10 000 калорий.
Впоследствии от АДФ может отщепляться еще один остаток фосфорной кислоты, образуя АМФ – аденозинмонофосфорную кислоту.
АДФ + Н2О = АМФ + Н3РО4 + 10 000 калорий[37].
Освободившаяся энергия используется для жизнедеятельности клетки (КПД процесса превышает 80 %!).
Наряду с распадом АТФ и выделением энергии в клетке постоянно происходит синтез АТФ и накопление энергии (обратные реакции).
Количество митохондрий в клетке зависит от потребности последней в энергии. Так, в клетках кожи человека находится в среднем 5–6 митохондрий, в клетках мышц – до 1000, в клетках печени – до 2500!
8. Комплекс Гольджи. Итальянский ученый Гольджи обнаружил и описал структуру клетки, напоминающую стопки мембран, цистерны, пузырьки и трубочки. Расположена эта система чаще всего возле ядра.
Функции комплекса Гольджи: в полостях комплекса накапливаются всевозможные продукты обмена клетки, которые по каким-либо причинам не вывелись наружу. В последствии эти продукты могут быть использованы клеткой для процессов жизнедеятельности. Из пузырьков и цистерночек комплекса Гольджи в растительных клетках образуются вакуоли, заполненные клеточным соком.
9. Лизосомы – мелкие органоиды. Представляют собой пузырьки, окруженные мембраной. Внутри лизосомы заполнены пищеварительными ферментами (обнаружено 12 ферментов), которые расщепляют и переваривают крупные макромолекулы (белки, полисахариды, нуклеиновые кислоты).
Функции лизосом: растворение и переваривание макромолекул. Лизосомы участвуют в фагоцитозе. Понятно, что основная функция по перевариванию поступающих в клетку частиц принадлежит лизосомам.
10. Пластиды. Эти органоиды характерны только для растительных клеток. Форма напоминает двояковыпуклую линзу. Структура пластид напоминает таковую у митохондрий: двойной слой мембраны. Наружная – гладкая, внутренняя образует складки, называемые тилакоидами. На тилакоидах происходит основной жизненно важный для всех зеленых растений процесс – фотосинтез:
Пластиды бывают трех типов:
1) Хлоропласты – зеленые пластиды. Их цвет обусловлен наличием хлорофилла. Хлорофилл – основное вещество хлоропластов (имеет зеленый цвет). Только благодаря хлорофиллу возможен процесс фотосинтеза (см. раздел 4.2). Хлоропласты придают зеленый цвет растительным организмам.
2) Хромопласты – пластиды, имеющие различные окраски: от ярко-желтого до пурпурно-багряного. Наличие различных пигментов окрашивают плоды, цветки и осенние листья растений в соответствующие цвета. Этот факт особенно важен для привлечения насекомых к цветкам, как природный индикатор созревания плодов и др.
3) Лейкопласты – бесцветные пластиды, в которых происходит накопление запасных питательных веществ (например, крахмала).
Некоторые виды пластид могут переходить друг в друга: например, переход хлоропластов в хромопласты: созревание томатов, яблок, вишни, и т. д.; изменение окраски листьев в осенний период времени. Лейкопласты могут переходить в хлоропласты: позеленение картофеля на свету. Это доказывает общность происхождения пластид.
11. Клеточные включения. Вакуоли. Это непостоянные и необязательные составляющие клетки. Они могут появляться и исчезать в течение всей жизни клетки. К ним относятся капли жира, зерна крахмала и гликогена, кристаллы щавелево-кислого кальция и др. Жидкие продукты обмена называются клеточным соком и накапливаются они в вакуолях. В клеточном соке растворены сахара, минеральные соли, пигменты и т. д. Чем старше клетка, тем больше клеточного сока накапливает клетка. Молодые клетки практически не содержат вакуолей.
Помимо перечисленного некоторые специализированные клетки обладают специальными органоидами. К ним относятся:
– реснички и жгутики, представляющие собой выросты мембраны клетки, осуществляющие движения клетки. Они имеются у одноклеточных организмов и многоклеточных (кишечный эпителий, сперматозоиды, эпителий дыхательных путей);
– миофибриллы – тонкие нити мышечных клеток, участвующие в сокращении мышц;
– нейрофибриллы – органоиды, характерные для нервных клеток и участвующие в проведении нервных импульсов. Кроме того, в состав клеток входят центриоли – две (иногда более) цилиндрические структуры диаметром около 0,1 мкм и длиной 0,3 мкм. Место расположения центриолей в период между делениями клетки считается серединой клеточного центра. При делении клетки центриоли расходятся в противоположные стороны – к полюсам, определяя ориентацию веретена деления (рис. 16).
Следует иметь в виду, что, хотя животные и растительные клетки имеют много общего, но между ними существуют и серьёзные различия (табл. 3.1).
Более общая классификация клеток представлена на рис. 3.16.
Одно из основных отличий бактерий от архей, состоит в химическом составе мембраны. Бактерии отделены от внешней среды двойным слоем липидов (жиров и жироподобных веществ). Мембраны архей состоят из терпеновых спиртов.
Клетки организма общаются с помощью посланий, упакованных в микровезикулы
Организм представляет собой интегрированное сообщество дифференцированных клеток. Их слаженное функционирование обеспечивается благодаря сложной системе межклеточной коммуникации. Коммуникация предполагает производство сигналов одними клетками, их восприятие другими клетками, а также адекватную их интерпретацию и реакцию на эти сигналы благодаря наличию внутриклеточных сигнальных путей. Неожиданные возможности, выводящие межклеточную коммуникацию на качественно новый уровень, обнаружились при исследовании функциональной роли микровезикул — мембранных пузырьков, повсеместно встречающихся в жидких средах организма и до недавнего времени считавшихся лишь побочным продуктом жизнедеятельности клеток.
Многоклеточный организм, осуществляющий свою жизнедеятельность как единое целое, в то же время представляет собой сложное сообщество из образующих его клеток, обладающих определенной автономностью. Клетки можно рассматривать как конструктивные элементы организма, предназначенные обеспечить правильную его работу как целого. В конечном счете, каждой клетке выгодно и удобно жить в составе сообщества себе подобных. Можно сказать, что в каком-то смысле все клетки организма сообща работают на поддержание каждой индивидуальной клетки.
При таком взгляде возникает соблазн провести параллели с человеческим обществом. Каждый член этого общества выполняет определенную функцию (подобно клеткам тех или иных тканей организма), будучи при этом отнюдь не самодостаточным, а следовательно, нуждающимся в поддержании со стороны всех прочих членов того же общества (организма). Сложность организма, как и сложность человеческого общества, задается степенью разнокачественности, дифференцированности составляющих его клеток, или членов. Слаженная деятельность индивидуальных членов дифференцированного общества требует существования сложных систем коммуникации, которые позволяют взаимно координировать эту деятельность. Именно существование разнообразных способов взаимной координации обеспечивает как общество в целом, так и каждого отдельного его члена возможностью адаптироваться к изменчивым условиям среды. К примеру, во время эпидемии гриппа больной (скажем, рабочий фармацевтического завода) обращается к врачу, способному поставить диагноз и назначить правильное лечение. Врачи побуждают поставщиков фармпрепаратов снабдить аптеки соответствующими лекарствами, поставщики делают заказ соответствующим фармацевтическим заводам, и т. д.
В организме также существуют разнообразные системы коммуникаций, обеспечивающие взаимное координирование деятельности клеток и тканей при адаптации к тем или иным изменениям среды. Широко известны и общепризнанны: 1) коммуникация посредством секретируемых молекул (таких как гормоны, ростовые факторы, нейротрансмиттеры) и рецепторов к ним и 2) коммуникация посредством межклеточных контактов (адгезионных молекул и рецепторов к ним).
Оба эти механизма предусматривают взаимодействие между сигнальной молекулой и связывающей ее молекулой-рецептором, которое должно опосредовать запуск определенной цепочки последовательных реакций (signal-transduction chain) в соответствии с генетически обусловленной программой. Такой тип коммуникации можно уподобить отдаче/приему команды, предполагающей реакцию в виде стереотипного набора действий (пусть даже очень сложного). Так, повышение в крови концентрации инсулина, выделяемого клетками поджелудочной железы, означает для мышечной и жировой тканей команду к откачке из крови глюкозы, для клеток печени — команду к активации синтеза гликогена, и т. д.
Всегда ли такого типа коммуникации будет достаточно для самоподдержания организма в сложной, изменчивой и зачастую непредсказуемой среде? Возвращаясь к аналогии с обществом, можно предположить, что не всегда. В частности, такой механизм не предусматривает возможности поиска и распространения среди себе подобных принципиально нового эффективного решения при необходимости адаптации к неожиданным стрессовым факторам.
Что может быть альтернативой для клеток организма? Теоретически, клетки могли бы отдавать друг другу более конкретные и детальные инструкции, передавая и принимая непосредственно информационные молекулы, каковыми являются мРНК, а также разнообразные молекулы — регуляторы метаболизма и активности генов, в частности транскрипционные факторы, ферменты и микроРНК.
Среди известных типов межклеточной коммуникации, предполагающих такой обмен крупными молекулами и даже целыми органеллами, можно назвать щелевые контакты, формирующиеся между клетками эпителия. Но возможно ли подобное общение между клетками, находящимися на расстоянии друг от друга или даже относящимися к разным типам тканей? Авторы обсуждаемой статьи отвечают утвердительно.
В последние 10 лет внимание ученых было привлечено к обнаруживаемым в разнообразных биологических жидкостях (включая плазму крови, межклеточную жидкость, плевральную жидкость и др.) мембранным везикулам размером от 30 нм до 1–4 мкм. Об их существовании вообще-то было известно давно, но вплоть до недавнего времени их рассматривали как клеточный дебрис — побочный продукт апоптоза, не несущий функциональной нагрузки. Однако исследования последних лет показали, что такие структуры (упоминаемые в разных источниках как «микровезикулы», «микрочастицы», «эктосомы» и «экзосомы») испускаются нормальными, жизнеспособными клетками самых разных тканей организма. В одних случаях их производит наружная мембрана клетки, образующая выпячивания («эктосомы», d = 0,1–4 мкм), в других случаях они высвобождаются путем экзоцитоза из мультивезикулярных телец, образующихся из эндоцитозных пузырьков («экзосомы», d = 30–100 нм). При этом продукция микровезикул усиливается при патологии ткани in vivo и при стрессовом воздействии на клетки in vitro.
Под патологией ткани подразумеваются разнообразные воспалительные процессы, вызванные инфекцией или чем-либо еще, злокачественные опухоли и т. п. Например, при заболеваниях почек в крови и даже в моче будут обнаруживаться микровезикулы, содержимое которых при анализе на белки и РНК укажет на то, что они были «высланы» именно тканью почек (как будто они высылают призыв о помощи). В норме таких микровезикул будет обнаруживаться гораздо меньше, и состав их содержимого будет несколько иной.
Особенностью этих структур является экспонирование на внешней поверхности фосфатидилсерина. Анализ содержимого микровезикул показал, что они включают в себя целые молекулы мРНК, белки, регуляторные микроРНК, а в их мембрану встроены рецепторные белки. Конкретный состав зависит от ткани, производящей микровезикулы, и от функционального состояния этой ткани. Существует база данных (см. ExoCarta), описывающая белки и РНК, обнаруживаемые в микровезикулах разного происхождения. Выяснилось, что производство клетками микровезикул энергозатратно, регулируемо (в частности, зависит от поступления в клетки ионов кальция) и требует участия специальных белковых молекул. По-видимому, имеет место сортировка молекул, заключенных в микровезикулы, так как их концентрации и количественные соотношения в цитоплазме клеток и в производимых клетками микровезикулах не эквивалентны друг другу. Можно предположить, что часть молекул РНК производится исключительно на экспорт, так как они практически полностью оказываются сконцентрированы в микровезикулах.
Все эти факты наталкивают на предположение, что эти структуры выполняют некую функциональную роль, связанную с межклеточной коммуникацией. По своей форме и содержанию они очень напоминают липосомы, используемые в генной инженерии для доставки в клетки тех или иных молекул. Чтобы подтвердить возможность влияния тканей друг на друга, опосредованного микровезикулами, ученые поставили следующий эксперимент. Мыши подвергались облучению 500 сГр (сантигрей), стимулируя таким образом стрессовую реакцию. Затем ткани легких, мозга, печени и сердца облученных мышей переводили в культуру на искусственную питательную среду. После недельного культивирования клетки отделяли, а полученную кондиционную среду использовали в дальнейшей работе.
Из кондиционной среды выделяли микровезикулы (центрифугированием с ускорением 100000g на протяжении 1 часа при температуре 4°), которые затем отмывали и ресуспендировали в искусственной питательной среде, используя полученную суспензию как среду для культивирования клеток костного мозга. Состав РНК в клетках костного мозга проводили через неделю культивирования в присутствии либо в отсутствие микровезикул.
Исследователи провели количественный ПЦР-анализ мРНК 14 генов, из которых шесть специфичны для легочной ткани, три — для головного мозга, три сердечных и два печеночных гена. Оказалось, что состав мРНК микровезикул хорошо отражает их тканевое происхождение. В то же время обнаружилась положительная зависимость между присутствием тканеспецифичных мРНК в микровезикулах и изменениями в количестве тех же мРНК в клетках костного мозга, культивируемых в присутствии микровезикул, по сравнению с клетками костного мозга, культивируемыми без добавления микровезикул. Причем в клетках повышенный уровень экспрессии определенных мРНК сохранялся на протяжении трех недель наблюдения. В случае предварительной обработки микровезикул рибонуклеазой количество соответствующих мРНК как в микровезикулах, так и в культивируемых в их присутствии клеток костного мозга, оказывается намного ниже, чем без такой обработки. В своей более ранней работе авторы показывали, что изменения в содержании определенных РНК сопровождались соответствующими изменениями в содержании кодируемых ими белков в клетках костного мозга. Также наблюдались изменения и в морфологии клеток.
В части экспериментов микровезикулы подвергались предварительному двойному окрашиванию — зеленым флуоресцентным красителем CFSE и красным PKH26, используемыми соответственно для окрашивания цитоплазматической компоненты и мембран таких частиц. Это позволило выяснить, как часто происходит включение микровезикул в сокультивируемые клетки. Двойное окрашивание обнаруживалось у 2,5% культивируемых с микровезикулами клеток костного мозга. В то же время, если костный мозг заменялся на культуру миелоидных либо лимфоидных клеток, процент клеток с двойным окрашиванием составлял соответственно 27% и 0,7%.
Можно сделать вывод о разной степени восприимчивости тканей к такого рода «общению». Вероятно, определенную роль здесь играют лиганд-рецепторные взаимодействия между мембранами клеток и микровезикул. Далее авторы провели анализ экспрессии тканеспецифичных генов в окрашенных (проглотивших микровезикулы) и неокрашенных клетках, которые были отделены друг от друга с помощью проточного сортера (этот прибор не просто измеряет флуоресценцию, а еще и разбрасывает клетки с разным уровнем флуоресценции по разным пробиркам в соответствии с заданными критериями для разделения; в данном случае отделяли клетки, имеющие две флуоресцентных метки — красную и зеленую, — от всех прочих клеток). Оказалось, что экспрессия анализируемых мРНК в окрашенных клетках костного мозга была увеличена в десятки раз по сравнению с контрольными клетками и практически не изменилась в неокрашенных.

Пожалуй, самая интересная часть исследования заключается в оценке влияния культивирования клеток в присутствии микровезикул, полученных от разных тканей мыши, на спектр РНК-клеток костного мозга крысы, то есть другого вида животных. Оказалось, что сокультивирование клеток костного мозга крысы с микровезикулами, полученными от легочной либо печеночной ткани мыши после облучения приводили к повышению в клетках содержания как мРНК, типичных для данных тканей мышиных генов, так и мРНК крысиных гомологов этих генов. В качестве механизма такого влияния авторы предлагают рассматривать микроРНК, регулирующие активность этих генов. Действительно, такие микроРНК в большом количестве обнаруживались как в самих микровезикулах, так и в сокультивируемых с ними клетках костного мозга. В общей сложности в составе микровезикул, полученных от клеток легких, авторы обнаружили 185 различных микроРНК и 65 белков.
Всё это говорит о том, что поврежденные ткани, по-видимому, могут стимулировать в стволовых клетках костного мозга определенное направление дифференцировки, способное обеспечить регенерацию этих тканей и восстановление функционального состояния организма.
В то же время эти данные наталкивают на мысли о дарвиновских геммулах, нередко упоминаемых Александром Марковым, способных якобы переносить наследственные факторы от соматических клеток к генеративным. Марков указывает на возможность такого рода переноса генетического материала с помощью вирусных частиц, способных с некоторой частотой проникать в генеративные ткани. Хочется обратить внимание на то, что, по-видимому, организм и сам владеет достаточным набором инструментов для осуществления контролируемого переноса генетической информации от одних клеток к другим. Если учесть существование таких гибко управляемых систем многоклеточного организма, как 1) перенос между клетками микровезикул, содержащих РНК-копии различных генов (которые в соматических клетках могут приобретать какие-либо мутации), 2) обратная транскрипция и 3) рекомбинация генетического материала в генеративных клетках, то процесс «осознанного» переноса новых вариантов генов из соматических клеток в генеративные видится не таким уж невероятным событием, как это казалось прежде.
См. также:
1) Bénédicte Hugel, M. Carmen Martínez, Corinne Kunzelmann, Jean-Marie Freyssinet. Membrane Microparticles: Two Sides of the Coin (текст доступен полностью) // Physiology. V. 20. No. 1. P. 22–27. February 2005.
2) Jason M. Aliotta, Fermin M. Sanchez-Guijo, et al. Alteration of Marrow Cell Gene Expression, Protein Production, and Engraftment into Lung by Lung-Derived Microvesicles: A Novel Mechanism for Phenotype Modulation (текст доступен полностью) // Stem Cells. V. 25. Issue 9. P. 2245–2256. September 2007.