Что борется с бактериями в организме человека
Как устроен иммунитет: Объясняем по пунктам
Андрей Смирнов СПИД.ЦЕНТР
«Йогурт для укрепления иммунитета», «Иммуностимулирующие витамины», «Да простудился, наверное, иммунитет упал»… Мы слышим слово «иммунитет» так часто, что уже почти не задумываемся, как он устроен и работает. На уроках биологии нам рассказывали, что иммунитет защищает от микробов, но только ли этим ограничивается его функция и как именно он понимает, от кого нужно нас защищать? СПИД.ЦЕНТР объясняет, как устроена иммунная система.
Наш организм непрерывно меняется, но при этом очень «любит» постоянство и может нормально работать только при определенных параметрах своей внутренней среды. Например, нормальная температура тела колеблется между 36 и 37 градусами по Цельсию. Вспомните последнюю простуду и то, как плохо вы себя чувствовали, стоило температуре подняться всего на полградуса. Такая же ситуация и с другими показателями: артериальным давлением, рН крови, уровнем кислорода и глюкозы в крови и другими. Постоянство значений этих параметров называется гомеостазом, а поддержкой его стабильного уровня занимаются практически все органы и системы организма: сердце и сосуды поддерживают постоянное артериальное давление, легкие — уровень кислорода в крови, печень — уровень глюкозы и так далее.
Иммунная же система отвечает за генетический гомеостаз. Она помогает поддерживать постоянство генетического состава организма. То есть ее задача — уничтожать не только все чужеродные организмы и продукты их жизнедеятельности, проникающие извне (бактерии, вирусы, грибки, токсины и прочее), но также и клетки собственного организма, если «что-то пошло не так» и, например, они превратились в злокачественную опухоль, то есть стали генетически чужеродными.
Как клетки иммунной системы уничтожают «врагов»?
Чтобы разобраться с этим, сначала нужно понять, как иммунная система устроена и какие бывают виды иммунитета.
Иммунитет бывает врожденным (он же неспецифический) и приобретенным (он же адаптивный, или специфический). Врожденный иммунитет одинаков у всех людей и идентичным образом реагирует на любых «врагов». Реакция начинается немедленно после проникновения микроба в организм и не формирует иммунологическую память. То есть, если такой же микроб проникнет в организм снова, система неспецифического иммунитета его «не узнает» и будет реагировать «как обычно». Неспецифический иммунитет очень важен — он первым сигнализирует об опасности и немедленно начинает давать отпор проникшим микробам.
по теме
Мнение
«Иммунитет пациента с ВИЧ похож на иммунитет пожилого человека»
Однако эти реакции не могут защитить организм от серьезных инфекций, поэтому после неспецифического иммунитета в дело вступает приобретенный иммунитет. Здесь уже реакция организма индивидуальна для каждого «врага», поэтому «арсенал» специфического иммунитета у разных людей различается и зависит от того, с какими инфекциями человек сталкивался в жизни и какие прививки делал.
Специфическому иммунитету нужно время, чтобы изучить проникшую в организм инфекцию, поэтому реакции при первом контакте с инфекцией развиваются медленнее, зато работают гораздо эффективнее. Но самое главное, что, один раз уничтожив микроба, иммунная система «запоминает» его и в следующий раз при столкновении с таким же реагирует гораздо быстрее, часто уничтожая его еще до появления первых симптомов заболевания. Именно так работают прививки: когда в организм вводят ослабленных или убитых микробов, которые уже не могут вызвать заболевание, у иммунной системы есть время изучить их и запомнить, сформировать иммунологическую память. Поэтому, когда человек после вакцинации сталкивается с реальной инфекцией, иммунная система уже полностью готова дать отпор, и заболевание не начинается вообще или протекает гораздо легче.
Кто отвечает за работу различных видов иммунитета?
Таким образом, органы иммунной системы обеспечивают образование, созревание и место для жизни иммунных клеток. В нашем организме есть много их видов, вот основные из них.
Как клетки иммунной системы отличают «своих» от «чужих» и понимают, с кем нужно бороться?
В этом им помогает главный комплекс гистосовместимости первого типа (MHC-I). Это группа белков, которая располагается на поверхности каждой клетки нашего организма и уникальна для каждого человека. Это своего рода «паспорт» клетки, который позволяет иммунной системе понимать, что перед ней «свои». Если с клеткой организма происходит что-то нехорошее, например, она поражается вирусом или перерождается в опухолевую клетку, то конфигурация MHC-I меняется или же он исчезает вовсе. Натуральные киллеры и Т-киллеры умеют распознавать MHC-I рецептор, и как только они находят клетку с измененным или отсутствующим MHC-I, они ее убивают. Так работает клеточный иммунитет.
по теме
Эпидемия
Учёные выяснили, как вирусы обманывают иммунитет
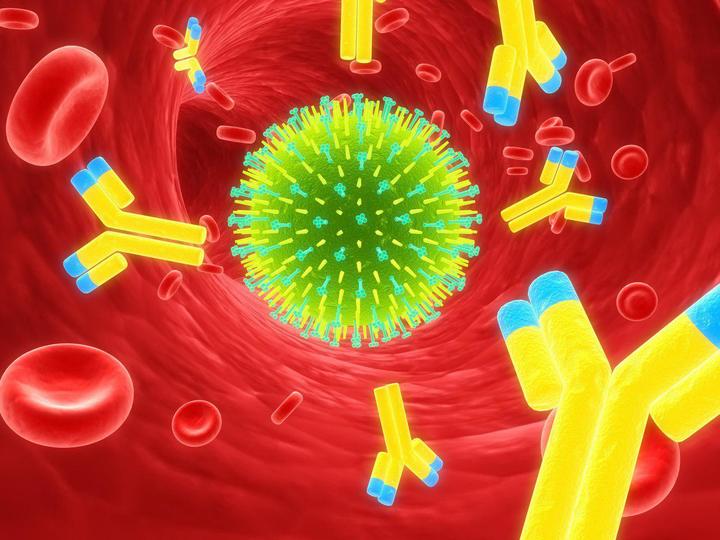
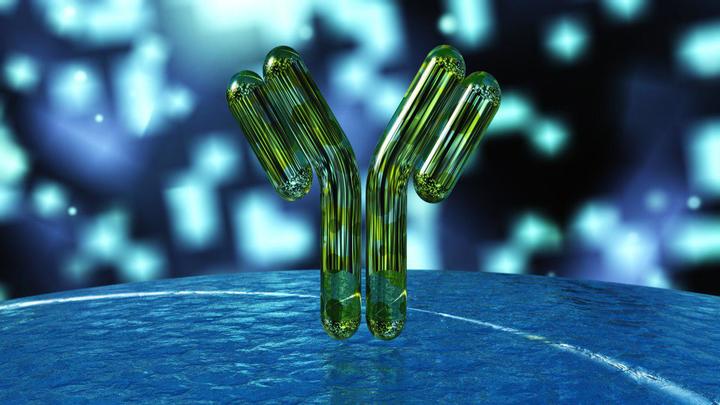
Но у нас есть еще один вид иммунитета — гуморальный. Основными защитниками в этом случае являются антитела — специальные белки, синтезируемые B-лимфоцитами, которые связываются с чужеродными объектами (антигенами), будь то бактерия, вирусная частица или токсин, и нейтрализуют их. Для каждого вида антигена наш организм умеет синтезировать специальные, подходящие именно для этого антигена антитела. Молекулу каждого антитела, также их называют иммуноглобулинами, можно условно разделить на две части: Fc-участок, который одинаков у всех иммуноглобулинов, и Fab-участок, который уникален для каждого вида антител. Именно с помощью Fab-участка антитело «прилипает» к антигену, поэтому строение этого участка молекулы зависит от строения антигена.
Как наша иммунная система понимает устройство антигена и подбирает подходящее для него антитело?
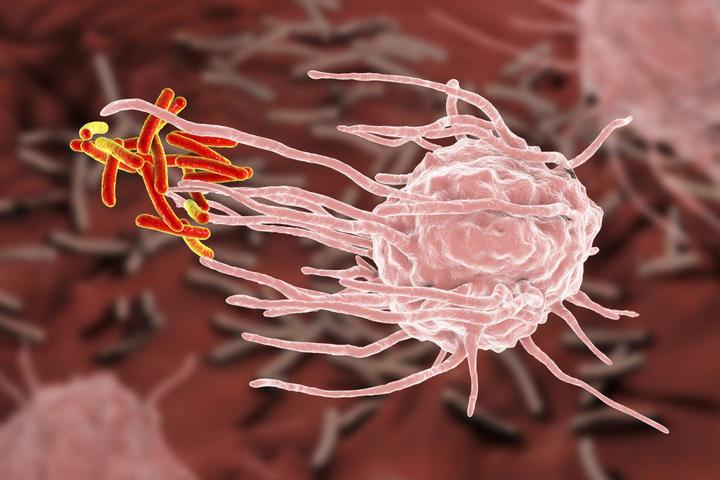
Рассмотрим этот процесс на примере развития бактериальной инфекции. Например, вы поцарапали палец. При повреждении кожи в рану чаще всего попадают бактерии. При повреждении любой ткани организма сразу же запускается воспалительная реакция. Поврежденные клетки выделяют большое количество разных веществ — цитокинов, к которым очень чувствительны нейтрофилы и макрофаги. Реагируя на цитокины, они проникают через стенки капилляров, «приплывают» к месту повреждения и начинают поглощать и переваривать попавших в рану бактерий — так запускается неспецифический иммунитет, но до синтеза антител дело пока еще не дошло.
Расправляясь с бактериями, макрофаги выводят на свою поверхность разные их кусочки, чтобы познакомить Т-хелперов и B-лимфоцитов со строением этих бактерий. Этот процесс называется презентацией антигена. Т-хелпер и B-лимфоцит изучают кусочки переваренной бактерии и подбирают соответствующую структуру антитела так, чтобы потом оно хорошо «прилипало» к таким же бактериям. Так запускается специфический гуморальный иммунитет. Это довольно длительный процесс, поэтому при первом контакте с инфекцией организму может понадобиться до двух недель, чтобы подобрать структуру и начать синтезировать нужные антитела.
После этого успешно справившийся с задачей B-лимфоцит превращается в плазматическую клетку и начинает в большом количестве синтезировать антитела. Они поступают в кровь, разносятся по всему организму и связываются со всеми проникшими бактериями, вызывая их гибель. Кроме того, бактерии с прилипшими антителами гораздо быстрее поглощаются макрофагами, что также способствует уничтожению инфекции.
Есть ли еще какие-то механизмы?
Специфический иммунитет не был бы столь эффективен, если бы каждый раз при встрече с инфекцией организм в течение двух недель синтезировал необходимое антитело. Но здесь нас выручает другой механизм: часть активированных Т-хелпером В-лимфоцитов превращается в так называемые клетки памяти. Эти клетки не синтезируют антитела, но несут в себе информацию о структуре проникшей в организм бактерии. Клетки памяти мигрируют в лимфатические узлы и могут сохраняться там десятилетиями. При повторной встрече с этим же видом бактерий благодаря клеткам памяти организм намного быстрее начинает синтезировать нужные антитела и иммунный ответ запускается раньше.
Таким образом, наша иммунная система имеет целый арсенал различных клеток, органов и механизмов, чтобы отличать клетки собственного организма от генетически чужеродных объектов, уничтожая последние и выполняя свою главную функцию — поддержание генетического гомеостаза.
Антихеликобактерные средства (ч. 2)
Схема эрадикации бактерии H. pylori подбирается в индивидуальном порядке в зависимости от чувствительности бактерии и реакции организма на выбранные препараты.
Преферанская Нина Германовна
Доцент кафедры фармакологии института фармации им. А.П. Нелюбина Первого МГМУ им. И.М. Сеченова (Сеченовский университет), к.фарм.н.
Амоксициллин (табл./капс. 250 мг, 500 мг) — полусинтетический антибиотик пенициллинового ряда широкого спектра действия, с умеренной активностью в отношении H. pylori. Биодоступность составляет 70–80%, растворимая лекарственная форма — 90%. В тканях достигается терапевтическая концентрация. Амоксициллин характеризуется широким спектром антимикробного действия, низким уровнем резистентности, хорошей всасываемостью в желудочно–кишечном тракте, высокой биодоступностью и кислотостойкостью. Блокада амоксициллином пенициллиносвязывающих белков приводит к остановке роста и гибели микробной клетки.
Период полувыведения — 1–1,5 ч. Выводится на 50–70% почками в неизмененном виде путем канальцевой секреции (80%) и клубочковой фильтрации (20%), печенью — 10–20%. В небольшом количестве выделяется с грудным молоком.
Противопоказаниями служит повышенная чувствительность к амоксициллину, детский возраст до 3 лет.
Важно! Вызывает аллергические реакции, тошноту, нарушения со стороны крови и лимфатической системы очень редко, диарею, очень редко кристаллурию.
Кларитромицин (табл. 250 мг, 500 мг; капс. 250 мг) — относится к группе полусинтетических макролидов, оказывает дозозависимый бактериостатический эффект за счет блокирования белковых систем микробной клетки, взаимодействует с 50S рибосомальной субъединицей, подавляет синтез белка бактерий. Однако при достижении концентрации, которая в 2–3 раза превышает минимальную ингибирующую концентрацию, оказывает бактерицидное действие. Бактерицидное действие оказывает в отношении H. pylori, данная активность Кларитромицина выше при нейтральном pH, чем при кислом. Кларитромицин по эффективности в отношению к H. pylori превышает все другие активные субстанции этой группы. Обладает широким спектром действия и является одним из наиболее эффективных и распространенных макролидов. При приеме внутрь хорошо всасывается, концентрация его в тканях намного превышает сывороточную. Максимальное накопление также наблюдается в слизистой ЖКТ.
Препарат хорошо проникает внутрь клеток (моноцитов, макрофагов, фагоцитов), создавая высокие внутриклеточные концентрации. Высокие концентрации в очаге воспаления делают его средством выбора при H. pylori — ассоциированной патологии желудка и 12-перстной кишки. Благодаря лиофильности способен проникать в клетки и накапливаться в высоких концентрациях в слизистой оболочке желудка и двенадцатиперстной кишки, что имеет большое значение при эрадикации H. pylori.
Также нельзя не вспомнить позитивный эффект санации, присущий Кларитромицину. Широкий спектр активности данного антибиотика по отношению к грампозитивным и грамнегативным бактериям позволяет элиминировать патогенные и условно–патогенные возбудители из полости ЖКТ, колонизация которых наблюдается в условиях хеликобактер–ассоциированных заболеваний. Препарат обладает собственной противовоспалительной активностью, что обусловлено угнетением продукции провоспалительных цитокинов и стимуляцией синтеза противовоспалительных гуморальных факторов. Однако самым главным его качеством является способность разрушать матрикс биопленки. 99% микроорганизмов, к которым относится и H. pylori, существуют не в виде отдельных микроорганизмов, а в составе сложно организованных сообществ — биопленок, которые представляют собой совокупность бактериальных клеток, которые окружены внеклеточным матриксом, который имеет полисахаридную природу. Матрикс выполняет защитную функцию и часто является причиной устойчивости микроорганизмов к действию антибиотиков, резистентность бактерий в составе биопленки возрастает в 10–1000 раз.
Важно! При применении препарата могут возникать диарея, гиперчувствительность, аллергические реакции, часто сыпь, очень редко может вызвать анафилактоидную реакцию, дерматит, нарушение слуха, звон в ушах (частота неизвестна), а также снижение числа лейкоцитов и тромбоцитов.
Метронидазол (ТН «Трихопол», «Флагил», табл. 250 мг) — противопротозойный препарат, относится к производным 5-нитроимидазола, активен в отношении микроаэрофилов H. pylori. Механизм действия заключается в биохимическом восстановлении 5-нитрогруппы внутриклеточными транспортными протеинами анаэробных микроорганизмов и простейших. Препарат оказывает избирательный бактерицидный эффект в отношении тех микроорганизмов, ферментные системы которых способны восстанавливать нитрогруппу. Восстановленная 5-нитрогруппа взаимодействует с дезоксирибонуклеиновой кислотой (ДНК) клетки микроорганизмов. Возникает ингибирование тканевого дыхание, нарушается репликация ДНК, синтез нуклеиновых кислот и синтез белка, что ведет к гибели бактерий.
Метронидазол быстро проникает в ткани (легкие, почки, печень, кожу, желчь, спинномозговую жидкость, слюну, семенную жидкость, вагинальный секрет), в грудное молоко и проходит через плацентарный барьер. Около 30–60 % метронидазола метаболизируется путем гидроксилирования, окисления и глюкуронирования.
Препарат медленно выводится из организма, период полувыведения 8–10 час., при повторных введениях кумулирует. Проникает в ткани и жидкости организма, обеспечивая терапевтические концентрации.
Важно! Вызывает темное окрашивание мочи, металлический привкус во рту, тошноту, рвоту, диарею, могут возникать аллергические реакции: крапивница, кожная сыпь, нарушения со стороны иммунной системы: ангионевротический отек, анафилактический шок.
КОМПЛЕКСНОЕ ПРИМЕНЕНИЕ ЛС
Успешная схема лечения основана на сочетании препаратов, которые предотвращают возникновение резистентности и настигают бактерию в различных участках желудка. Терапия должна гарантировать, что даже небольшая популяция микроорганизмов не останется жизнеспособной. В схемы терапии обязательно включают препараты висмута, химиотерапевтические препараты и ингибиторы протонной помпы (о последних препаратах мы писали в предыдущей статье).
Существуют стандартные схемы лечения двух-, трех- или четырехкомпонентной терапии в период лечения и обострения гастритов, язвенной болезни12-перстной кишки и желудка.
Используют:
√ БИТЕРАПИЮ: Ранитидин + Висмута цитрат (Пилорид);
Амоксициллин + Метронидазол (Хеликоцин);
√ ТРОЙНУЮ ТЕРАПИЮ:
Кларитромицин + Омепразол + Тинидазол (Пилобакт);
√ КВАДРОТЕРАПИЮ:
ЭРАДИКАЦИОННАЯ ТЕРАПИЯ H. pylori включает комплекс нескольких препаратов. Распространенная ошибка, которая зачастую приводит к непредсказуемым результатам, замена даже одного хорошо изученного препарата из стандартной схемы на другой препарат той же группы. Использование данных схем лечения значительно улучшает состояние больных и предупреждают развитие рецидивов.
Применение комбинированных лекарственных препаратов «Пилобакт», «Пилорид», «Хеликоцин» и др. значительно улучшает состояние больных и предупреждает развитие рецидивов. Как правило, терапия обязательно включает антисекреторные препараты, химиотерапевтические средства, гастропротекторы и препараты коллоидного висмута.
Интенсивную терапию проводят до достижения устойчивой ремиссии и отсутствия рецидивов у больных в течение 1,5–2 лет. При необходимости проводят профилактическую противорецидивную терапию. При применении комбинированной терапии необходимо убедиться в безопасном применении сочетанных препаратов, их переносимости и эффективности. При применении таких препаратов могут наблюдаться нежелательные побочные явления: тошнота, рвота (20%), диарея (10%), псевдомембранозный колит (1%), головокружение (2%), чувство жжения в ротовой полости, глотке, кандидоз (15%). Неэффективность лечения может быть обусловлена нарушением правил приема препаратов или развитием устойчивости бактерии к ним. Но несмотря на применение комбинированных схем лечения, у 10–20% пациентов, инфицированных H. pylori, не удается достичь элиминации возбудителя.
Повышают клиническую эффективность эрадикационной терапии комбинации ингибиторов протонной помпы (ИПП) с противомикробными препаратами.
Предполагается, что антисекреторные препараты из группы ИПП могут способствовать повышению концентрации антимикробных средств (Метронидазола и Кларитромицина) в просвете желудка. ИПП уменьшают объем желудочного сока, вследствие чего вымывание антибиотиков с поверхности слизистой уменьшается, а концентрация антибиотиков, соответственно, увеличивается. Кроме того, снижение объема соляной кислоты поддерживает стабильную терапевтическую концентрацию антимикробных препаратов. При проведении эрадикационной антихеликобактерной терапии совместно с ИПП является одним из необходимых условий.
Успешность комбинированных схем терапии определяется во многом правильным выбором антибактериального средства и обеспечением постоянно высокого уровня эрадикации бактерии. Удлинение курса лечения до 10–14 дней также повышает эффективность эрадикации в среднем на 5%, а назначение высоких (двойных) доз ИПП позволяет дополнительно получить 8% показателей эффективности эрадикации H. pylori.
Именно два антибактериальных агента Амоксициллин и Кларитромицин определяют высокую эффективность в отношении микроорганизмов, которые находятся в фазе деления. Поддержка уровня рН в желудке выше чем 3,0 при помощи антисекреторных препаратов резко тормозит процесс деградации Кларитромицина (при рН 1,0 в желудочном соке Т½ составляет 1 час, а при рН 7,0 205 час.), что обеспечивает полноценную эрадикацию H. pylori. На протяжении последних 20 лет в основных схемах эрадикационной терапии сохраняется стойкая комбинация указанных антибиотиков, что связано с фармакокинетическими и фармакодинамическими особенностями данных препаратов.
Схема эрадикации бактерии H. pylori подбирается в индивидуальном порядке в зависимости от чувствительности бактерии и реакции организма на выбранные препараты. Продолжительность курса лечения определяется лечащим врачом. Самолечение такого опасного заболевания, как хеликобактериоз, категорически противопоказано.
Механизмы защиты от болезнетворных микроорганизмов
В борьбе с микроорганизмами участвуют следующие защитные механизмы: естественные барьеры – слизистые оболочки носа, горла, дыхательных путей, кожа; неспецифические механизмы – привлечение определенных типов лейкоцитов и повышение температуры тела (лихорадка), а также специфические механизмы, в частности антитела.
Как правило, если микроб проникает через естественные барьеры, неспецифические и специфические механизмы защиты уничтожают его прежде, чем он начнет размножаться.
Естественные барьеры
В норме неповрежденная кожа препятствует вторжению в организм микробов, и подавляющее большинство их преодолевает этот барьер только в результате травмы или ожога, при укусе насекомых и т. п. Правда, существуют исключения: заражение человеческим папилломавирусом, вызывающим бородавки.
К другим эффективным естественным барьерам относятся слизистые оболочки, в частности, дыхательных путей и кишечника. В норме слизистые оболочки покрыты слизью, которая препятствует проникновению микробов.
Например, слизистые оболочки глаз орошаются слезной жидкостью, содержащей фермент, называемый лизоцимом. Он атакует бактерии, помогая защищать глаза от них. Дыхательные пути эффективно очищают поступающий в них воздух. В извилистых носовых ходах, на их стенках, покрытых слизью, задерживаются многие инородные вещества, попадающие с воздухом, в том числе и микробы. Если микроорганизм достигает нижних отделов дыхательных путей (бронхов), скоординированное движение ресничек (напоминающих волоски), покрытых слизью, выводит его из легких. Кашель также способствует удалению микроорганизмов.
Желудочно-кишечный тракт имеет ряд эффективных барьеров: кислота в желудке, панкреатические ферменты, желчь и кишечные секреты обладают антибактериальной активностью. Сокращения кишечника (перистальтика) и нормальное слущивание клеток, выстилающих кишечник, помогают удалять вредные микроорганизмы.
Что касается органов мочевыделительной системы, то у мужчин они защищены от попадания бактерий благодаря большой длине мочеиспускательного канала (приблизительно 25 см). Исключение составляют случаи, когда бактерии вносятся туда хирургическими инструментами. Влагалище женщины защищено благодаря кислой среде. Смывающий эффект при опорожнении мочевого пузыря — еще один механизм защиты у обоих полов.
Люди с нарушенными механизмами защиты более восприимчивы к некоторым инфекционным болезням /см. стр. Например, при пониженной кислотности желудочного сока повышается восприимчивость к туберкулезу и сальмонеллезам. Для поддержания механизмов защиты организма важен баланс различных видов микроорганизмов условно-патогенной флоры кишечника. Иногда под воздействием антибиотика, который принимают для лечения инфекции, не связанного с кишечником, нарушается баланс условно-патогенной флоры, в результате чего количество болезнетворных микроорганизмов увеличивается.
Неспецифические механизмы защиты
Любое повреждение, в том числе вторжение болезнетворных микроорганизмов, сопровождается воспалением. Оно мобилизует некоторые защитные силы организма в направлении к участку повреждения или инфекции. При развитии воспаления усиливается кровоснабжение, и лейкоциты могут легче проходить из кровеносных сосудов в воспаленную область.
Число лейкоцитов в крови также увеличивается; костный мозг выделяет больше клеток из депо и усиленно синтезирует новые. Нейтрофилы, появляющиеся в месте воспаления, начинают захватывать микроорганизмы и пытаются задержать их в ограниченном пространстве /см. стр. 665/. Если это не удается, к месту повреждения в увеличивающемся количестве устремляются моноциты, обладающие еще большей способностью захватывать микроорганизмы. Однако эти неспецифические механизмы защиты могут быть недостаточны при большом количестве микробов или из_за влияния других факторов, например загрязнения воздуха (в том числе табачным дымом), которые уменьшают силу механизмов защиты организма.
Повышение температуры тела
Повышение температуры тела (лихорадка) до более чем 37° С является фактически защитной реакцией организма на внедрение болезнетворных микроорганизмов или иное повреждение. Такая реакция усиливает механизмы защиты организма, вызывая у человека лишь относительно небольшой дискомфорт.
В норме температура тела в течение каждого дня колеблется. Наиболее низкие ее показатели (уровень) отмечаются в 6 часов, а самые высокие — в 16–18 часов. Хотя нормальной температурой тела обычно считают 36,6° С, верхняя граница нормы в 6 часов составляет 36,0° С, а в 16 часов — 36,9° С.
Часть мозга, называемая гипоталамусом, управляет температурой тела, и поэтому повышение температуры — следствие регулирующего влияния гипоталамуса. Температура тела повышается до нового более высокого уровня за счет перераспределения крови от поверхности кожи к внутренним органам, в результате чего уменьшается потеря тепла. Может возникать дрожь, свидетельствующая об увеличении выработки тепла в результате сокращений мышц. Изменения в организме, направленные на сохранение и выработку большего количества тепла, продолжаются, пока кровь новой более высокой температуры не достигает гипоталамуса. Затем эта температура поддерживается обычным образом. Позже, когда она возвращается к нормальному уровню, организм устраняет избыточное тепло через потоотделение и перераспределение крови к коже. При понижении температуры тела может развиваться озноб.
Температура тела может каждый день повышаться и возвращаться к норме. В других случаях повышение температуры может быть ремиттирующим, то есть она изменяется, но не возвращается к норме.
При тяжелых инфекционных болезнях в некоторых случаях, например у алкоголиков, стариков и маленьких детей, температура тела может снижаться.
Вещества, которые вызывают повышение температуры тела, называются пирогенами. Они могут образовываться внутри организма или поступать извне. К пирогенам, сформированным вне организма, относятся микроорганизмы и вещества, которые они вырабатывают, например токсины.
Фактически, пирогены, поступающие в организм извне, вызывают повышение температуры тела, стимулируя образование в организме собственных пирогенов. Пирогены внутри организма обычно вырабатываются моноцитами. Однако инфекционное заболевание — не единственная причина повышения температуры тела; температура может повышаться вследствие воспаления, злокачественной опухоли или аллергической реакции.
Причины повышения температуры тела
Обычно повышение температуры тела имеет очевидную причину. Это может быть, например, грипп или воспаление легких. Но иногда причину трудно обнаружить, например при инфицировании оболочки сердечного клапана (септический эндокардит). Когда у человека повысилась температура по крайней мере до 38,0 °С и тщательное обследование не позволяет выявить причину, врач может обозначить состояние как повышение температуры неясного происхождения.
К таким случаям можно отнести любые заболевания, сопровождаемые повышением температуры тела, но наиболее распространенные причины у взрослых — это инфекционные болезни, состояния, связанные с образованием антител против собственных тканей организма (аутоиммунные заболевания), и злокачественные опухоли (особенно лейкозы и лимфомы).
Для определения причины повышения температуры тела врач расспрашивает пациента о существующих и предшествовавших симптомах и заболеваниях, о принимаемых лекарствах, о возможных контактах с инфекционными больными, о недавних путешествиях и так далее, так как характер повышения температуры обычно не помогает при диагностике. Однако имеются некоторые исключения. Например, для малярии типично повышение температуры, возникающее через день или каждый третий день.
Сведения о недавнем путешествии, особенно за границу, или контакте с некоторыми материалами или животными могут дать ключ к диагнозу. Человек, употреблявший загрязненную воду (или лед, сделанный из загрязненной воды), может заболеть брюшным тифом. Работающий на мясокомбинате может заразиться бруцеллезом.
После выяснения таких вопросов врач проводит полное обследование, чтобы найти источник инфекции и другие признаки заболевания. В зависимости от степени повышения температуры тела и состояния пациента обследование может проводиться в амбулаторных условиях или в больнице. Исследование крови позволяет обнаружить антитела против микроорганизмов. Можно также сделать посев крови на различные питательные среды; определить число лейкоцитов в анализе крови. Повышенное содержание определенных антител помогает выявить «виновный» микроорганизм. Увеличение числа лейкоцитов обычно указывает на инфекцию.
Лейкоцитарная формула (пропорциональное содержание различных разновидностей лейкоцитов в крови) дает дополнительную информацию. Увеличение числа нейтрофилов, в частности, предполагает острую бактериальную инфекцию; увеличение количества эозинофилов — паразитарную инвазию, например, ленточными или круглыми глистами.
Ультразвуковое исследование (УЗИ), компьютерная томография (КТ) и магнитно-резонансная томография (MРТ) также помогают в диагностике. Для выявления очага воспаления может использоваться сканирование радиоактивно-мечеными лейкоцитами. Поскольку лейкоциты поступают к областям скопления инфекционных агентов, а введенные лейкоциты имеют радиоактивный маркер, сканирование помогает обнаружить инфицированную область. Если результаты сканирования отрицательные, врач может произвести биопсию ткани печени, костного мозга или другого «подозреваемого» органа с последующим исследованием под микроскопом.
Снижать ли повышенную температуру тела
Уже упоминалось о положительном эффекте повышения температуры тела. Однако вопрос о необходимости ее снижения вызывает некоторые разногласия. Так у ребенка, имевшего ранее приступ судорог из-за повышения температуры тела (фебрильные судороги), ее следует снижать.
Такого же подхода требует и взрослый с заболеваниями сердца или легких, поскольку высокая температура тела увеличивает потребность в кислороде на 7% на каждый градус свыше 36,6° С. Повышение температуры тела может также вызывать нарушения функции мозга. Лекарства, способные снижать температуру тела, называются жаропонижающими средствами. Наиболее широко используемые и эффективные жаропонижающие средства — парацетамол и нестероидные противовоспалительные средства, например аспирин. Однако для снижения температуры тела детям и подросткам применять аспирин не следует, поскольку он увеличивает риск развития синдрома Рея, который может закончиться летальным исходом.
Специфические механизмы защиты
Инфекция приводит в действие всю мощь иммунной системы. Иммунная система вырабатывает вещества, специфически атакующие болезнетворные микроорганизмы. Например, антитела присоединяются к микроорганизму и помогают иммобилизовать его. Антитела могут непосредственно уничтожать микроорганизмы или облегчать лейкоцитам «работу» по их распознаванию и уничтожению. Иммунная система также может посылать клетки, называемые киллерными Т-клетками (разновидность лейкоцитов), которые специфически атакуют болезнетворный микроорганизм. Естественным механизмам защиты организма помогают противоинфекционные лекарства, например антибиотики, противогрибковые или противовирусные средства. Однако, если функции иммунной системы человека значительно нарушены, эти лекарства часто неэффективны.