Что будет если caco3 нагреть
Карбонат кальция: способы получения и химические свойства
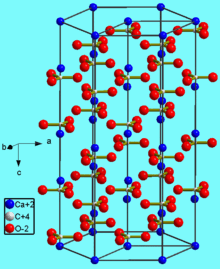
Карбонат кальция CaCO3 — соль кальция и угольной кислоты. Белый, при прокаливании разлагается, плавится без разложения под избыточным давлением CO2. Практически не растворяется в воде.
Относительная молекулярная масса Mr = 100,09; относительная плотность для тв. и ж. состояния d= 2,93; tпл = 1242º C при избыточном давлении.
Способ получения
2. В результате взаимодействия при комнатной температуре оксида кальция и углекислого газа происходит образование карбоната кальция:
3. Гидроксид кальция вступает в взаимодействие с углекислым газом и образует карбонат кальция и воду:
Качественная реакция
Качественная реакция на карбонат кальция — взаимодействие его с раствором сильных кислот. В результате реакции происходит бурное выделение углекислого газа, образование которого можно проверить, если пропустить его через известковую воду, которая мутнеет из-за образования осадка:
1. При взаимодействии с хлороводородной кислотой, карбонат кальция образует хлорид кальция, углекислый газ и воду:
Химические свойства
1. Карбонат кальция разлагается при температуре выше 900 — 1200º С, с образованием оксида кальция и углекислого газа:
2. Карбонат кальция вступает в реакцию со многими сложными веществами :
2.1. Карбонат кальция реагирует с оксидами :
2.1.1. Карбонат лития вступает в взаимодействие с оксидом кремния при 800º С и образует на выходе силикат кальция и углекислый газ:
2.2. Карбонат кальция реагирует с кислотами :
2.2.1. При взаимодействии с разбавленной хлороводородной кислотой карбонат кальция образует хлорид кальция, углекислый газ и воду:
2.2.3. Карбонат кальция взаимодействует с сероводородной кислотой при 900º С и образует сульфид кальция, воду и углекислый газ:
3. Карбонат кальция реагирует с простыми веществами:
3.1. Карбонат кальция при 800 — 850º С вступает в реакцию с углеродом (коксом) образуя оксид кальция и угарный газ:
CaCO3 + C = CaO + 2CO
Разложение CaCO3, напишите уравнение реакции
Необходимо рассмотреть следующий процесс: разложение CaCO3, напишите уравнение реакции, а также укажите основные физические и химические свойства карбоната кальция и приведите способы получения этого вещества.
Карбонат кальция в обычных условиях представляет собой вещество белого цвета, которое при прокаливании разлагается, однако плавится без разложения (условие – избыточное давление 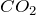
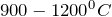
Карбонат кальция практически не растворяется в воде. В водном растворе карбонат кальция подвергается сильному гидролизу по аниону. Наличие гидроксид-анионов свидетельствует о щелочном характере среды:
Карбонат кальция взаимодействует с концентрированными растворами сильных минеральных кислот (1), а также с щелочами в водных растворах (2).
Взаимодействие карбоната кальция с другими солями возможно только если продукт взаимодействия выводится из реакционной среды. При нагревании данная соль разлагается.
Основной способ получения карбоната кальция заключается в смешивании твердого оксида кальция с водой — образуется так называемое известковое молоко. Так как гидроксид кальция немного растворяется в воде, то после отфильтровывания известкового молока получается прозрачный раствор – известковая вода, которая мутнеет при пропускании через неё диоксида углерода.
Что будет если caco3 нагреть
При нагревании карбоната кальция часть вещества разложилась, при этом выделился газ объемом 4,48 л (в пересчете на н. у.). К твердому остатку массой 41,2 г добавили избыток соляной кислоты. Масса добавленного раствора равнялась 465,5 г. Определите массовую долю соли в образовавшемся растворе. В ответе напишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления.
При прокаливании карбоната кальция образуется оксид кальция и выделяется углекислый газ:
Вычислим количество вещества углекислого газа: следовательно,
и
Масса и количество вещества непрокаленного карбоната кальция равна:
С соляной кислотой реагируют и оксид кальция, и карбонат кальция:
Поскольку в реакции карбоната кальция с соляной кислотой выделяется углекислый газ, необходимо учитывать его массу:
Общие количество вещества и масса хлорида кальция равны:
Массовая доля соли рассчитывается по формуле:
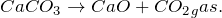
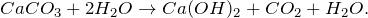
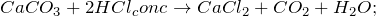
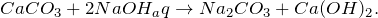

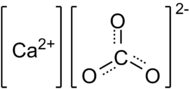


 . В природе встречается в виде минералов — кальцита, арагонита и ватерита, является главной составной частью известняка, мрамора. Нерастворим в воде и этаноле.
. В природе встречается в виде минералов — кальцита, арагонита и ватерита, является главной составной частью известняка, мрамора. Нерастворим в воде и этаноле.