Что будет если в соляную кислоту добавить цинк
Что будет если в соляную кислоту добавить цинк
Курс общей и неорганической химии
(для студентов биологического факультета (биофизиков)
и для студентов факультета биоинженерии и биоинформатики)
Программа курса. Материалы лекций. Презентации лекций. Программа сетевых контрольных мероприятий
Окислительно-восстановительные процессы.
Гальваническая пара медь-цинк в соляной кислоте.
Ускорение реакции цинка с соляной кислотой
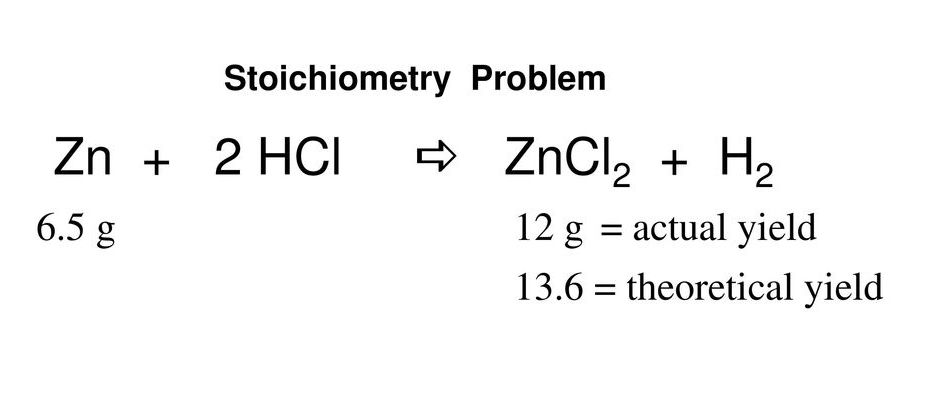
Zn + 2HCl = ZnCl2 + H2Реакцию выделения водорода при взаимодействии цинка с соляной кислотой можно ускорить, если добавить к соляной кислоте немного растворимой соли меди (II). Менее активная медь выделится на поверхности цинка в виде рыхлого темного осадка с большой поверхностью. При этом электроны будут переходить с цинка на медь, и именно на поверхности меди будет бурно выделяться водород. С поверхности цинка, не закрытой пузырьками водорода, ионы цинка быстрее переходят в раствор. В результате выделение водорода после добавления соли меди заметно ускорится. Автор (постановка, съемка, монтаж) Ассистенты Подготовка Интернет-публикации |


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
Что будет если в соляную кислоту добавить цинк
Курс общей и неорганической химии
(для студентов биологического факультета (биофизиков)
и для студентов факультета биоинженерии и биоинформатики)
Программа курса. Материалы лекций. Презентации лекций. Программа сетевых контрольных мероприятий
Окислительно-восстановительные процессы.
Гальваническая пара золото-цинк в соляной кислоте
(«растворение» золотого кольца)
Zn + 2HCl = ZnCl2 + H2Если в соляную кислоту поместить цинк в контакте с золотом, то растворяться будет по-прежнему только цинк, однако электроны с него будут переходить на золото, и именно на золоте станут разряжаться протоны и выделяться водород. Пока гранула цинка и кольцо лежат в соляной кислоте без взаимного контакта, водород выделяется на поверхности цинка. Как только кольцо кладем на гранулу цинка, водород начинает бурно выделяться на кольце из менее активного металла. Автор (постановка, съемка, монтаж) Ассистенты Подготовка Интернет-публикации |


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
Как реагирует цинк с соляной кислотой?
Физические свойства металла
Цинк — это хрупкий металл серебристо-голубого цвета, он очень ковок и пластичен.
Кристаллы этого металла похожи на иголки, поэтому, вероятнее всего, название тридцатого элемента происходит от немецкого zinke, что переводится как «зубец». Цинк настолько хрупкий, что если согнуть палочку этого металла при нормальной температуре, можно услышать хруст, даже более отчетливый, чем у олова. При температурах 100–150 °С цинк становится тягучим и используется для соединения деталей между собой. Но если температура воздействия на цинк поднимется, к примеру, до 210 °С, серебристый металл вновь станет хрупким.
Химические свойства цинка
Тридцатый элемент таблицы Менделеева является мощным восстановителем. При высоких температурах металл сгорает и тем самым образует атмосферный белый оксид цинка. Реакция сопровождается голубым пламенем:
При горении цинк весьма бурно реагирует с серой. Взаимодействие сопровождается красивым зеленоватым пламенем:
С галогенами цинк реагирует в присутствии влаги:
Также цинк реагирует с парами воды при 600–800 °С с образованием водорода и оксида цинка:
Если опустить кусочек цинка в разбавленную серную кислоту, пойдет выделение пузырьков водорода:
Цинк — тяжелый металл (например, по сравнению с литием), поэтому такой металл не всплывает на поверхность под действием пузырьков.
Реакция цинка и соляной кислоты
Рассмотрим взаимодействие серебристого металла с соляной кислотой. С НСl цинк реагирует также медленно, с образованием небольших пузырьков и выделением водорода. В результате реакции получается хлорид цинка ZnCl₂:
Десятки экспериментов у вас дома
Один из самых интересных и амбициозных образовательных химических проектов
Положение в периодической системе химических элементов
Цинк расположены в побочной подгруппе II группы (или в 12 группе в современной форме ПСХЭ) и в четвертом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение цинка и свойства
Электронная конфигурация цинка в основном состоянии :
+30Zn 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2
Характерная степень окисления цинка в соединениях +2.
Физические свойства
Цинк при нормальных условиях — хрупкий переходный металл голубовато-белого цвета (быстро тускнеет на воздухе, покрываясь тонким слоем оксида цинка).
Нахождение в природе
Цинк играет важную роль в процессах, протекающих в живых организмах.
В природе цинк как самородный металл не встречается.
Способы получения
Цинк получают из сульфидной руды. На первом этапе руду обогащают, повышая концентрацию сульфидов металлов. Сульфид цинка обжигают в печи кипящего слоя:
2ZnS + 3O2 → 2ZnO + 2SO2
Чистый цинк из оксида получают двумя способами.
ZnO + С → Zn + CO
Далее цинк очищают от примесей.
При это получаемый раствор сульфата цинка очищают от примесей (осаждением их цинковой пылью) и подвергают электролизу.
При электролизе чистый цинк осаждается на алюминиевых катодах, с которых его удаляют и подвергают плавлению в индукционных печах. Таким образом можно получить цинк с высокой чистотой (до 99,95 %).
Качественные реакции
ZnCl2 + 2NaOH → Zn(OH)2 + 2NaCl
При дальнейшем добавлении щелочи амфотерный гидроксид цинка растворяется с образованием комплексной соли тетрагидроксоцинката:
Цинк находится в группе элементов из периодической таблицы, называемой переходными металлами. Эти металлы имеют переменную реакционную способность и различаются в природе в элементарной форме. Цинк встречается в природе как в элементарной форме – как блестящий серый металл, так и в виде соли. Люди и многие другие организмы зависят от определенного количества неметаллического цинка, то есть цинка в форме соли, для поддержания клеточной функции.
Соли, в которых цинк образует кислотный остаток (цинкаты) — образуются из оксида цинка при сплавлении с щелочами и основными оксидами:
Для понимания свойств цинкатов их также можно мысленно разбить на два отдельных вещества.
Например, цинкат натрия мы разделим мысленно на два вещества: оксид цинка и оксид натрия.
Na2ZnO2 разбиваем на Na2O и ZnO
Тогда нам станет очевидно, что цинкаты реагируют с кислотами с образованием солей цинка :
Нитрат цинка при нагревании разлагается на оксид цинка, оксид азота (IV) и кислород:
Сульфат цинка при сильном нагревании разлагается аналогично — на оксид цинка, сернистый газ и кислород:
Под действием избытка воды цинкаты переходят в комплексные соли:
Сульфид цинка — так называемый «белый сульфид». В воде сульфид цинка нерастворим, зато минеральные кислоты вытесняют из сульфида цинка сероводород (например, соляная кислота):
ZnS + 2HCl → ZnCl2 + H2S
Под действием азотной кислоты сульфид цинка окисляется до сульфата:
(в продуктах также можно записать нитрат цинка и серную кислоту).
Концентрированная серная кислота также окисляет сульфид цинка:
При окислении сульфида цинка сильными окислителями в щелочной среде образуется комплексная соль:
Z nS + 4NaOH + Br2 = Na2[Zn(OH)4] + S + 2NaBr
Растворимые соли цинка и сильных кислот гидролизуются по катиону. Гидролиз протекает ступенчато и обратимо, т.е. чуть-чуть:
I ступень: Zn 2+ + H2O = ZnOH + + H +
II ступень: ZnOH + + H2O = Zn(OH )2 + H +
Для описания свойств комплексных солей цинка — гидроксоцинкатов, удобно использоваться следующий прием: мысленно разбейте тетрагидроксоцинкат на две отдельные частицы — гидроксид цинка и гидроксид щелочного металла.
Na2[Zn(OH)4] разбиваем на NaOH и Zn(OH)2
Свойства всего комплекса можно определять, как свойства этих отдельных соединений.
Аналогично тетрагидроксоцинкат калия реагирует с углекислым газом:
А вот под действием избытка сильной кислоты осадок не выпадает, т.к. амфотерный гидроксид цинка реагирует с сильными кислотами.
Правда, под действием небольшого количества ( недостатка ) сильной кислоты осадок все-таки выпадет, для растворения гидроксида цинка кислоты не будет хватать:
Аналогично с недостатком азотной кислоты выпадает гидроксид цинка:
Если выпарить воду из раствора комплексной соли и нагреть образующееся вещество, то останется обычная соль-цинкат:
Гидроксид цинка растворяется в избытке щелочи с образованием тетрагидроксоцинката:
4. Г идроксид цинка разлагается при нагревании :
Оксид цинка можно получить различными методами :
1. Окислением цинка кислородом:
2Zn + O2 → 2ZnO
2. Разложением гидроксида цинка при нагревании:
3. Оксид цинка можно получить разложением нитрата цинка :
1. При взаимодействии оксида цинка с основными оксидами образуются соли-цинкаты.
Оксид цинка растворяется в избытке раствора щелочи с образованием тетрагидроксоцинката:
3. Оксид цинка не взаимодействует с водой.
ZnO + H2O ≠
5. Оксид цинка взаимодействует с растворимыми кислотами с образованием солей.
ZnO + 2HCl = ZnCl2 + H2O
ZnO + С(кокс) → Zn + СО
ZnO + СО → Zn + СО2
7. Оксид цинка — твердый, нелетучий. А следовательно, он вытесняет более летучие оксиды (как правило, углекислый газ) из солей при сплавлении.
Цинк и соляная кислота
Хотя не все металлы реагируют с соляной кислотой или HCl, некоторые делают. Способность металла реагировать с HCl зависит от так называемой активности металла, когда металлы с высокой активностью реагируют с HCl. Активность металлического цинка достаточно высока, чтобы позволить ему вступать в реакцию с HCl, которая производит газ H2 и хлорид соединения, или ZnCl2, объясняет д-р Мартин Зильберберг в своей книге «Химия: молекулярная природа материи и изменений».
Цинк как минерал
Цинк в теле
Пока у вас HCl в желудке – он помогает в переваривании пищи – вы не производите ни H2, ни ZnCl2, когда потребляете цинк в пище. Это потому, что цинк вы взятие через продукты питания или дополнения не в металлической форме. Вместо этого оно имеет потеряли некоторые из его электронов, образуя положительно заряженные частицы, называемые ионами цинка. Тело не использует металлический цинк, а цинк в пище не реагирует с HCl.
Цинк как типичный щелочной металл
Цинк – это типичный представитель металлов, в нормальном состоянии имеет голубовато-серый цвет, легко окисляется на воздухе, приобретая на поверхности оксидную пленку (ZnO).
Как типичный амфотерный металл цинк взаимодействует с кислородом воздуха: 2Zn+O2=2ZnO – без температуры, с образованием оксидной пленки. При нагревании образуется белый порошок.
Сам оксид реагирует с кислотами с образованием соли и воды:
С растворами кислот. Если цинк обычной чистоты, то уравнение реакции HCl Zn ниже.
Zn+2HCl= ZnCl2+H2↑ – молекулярное уравнение реакции.
Zn + 2H(+) = Zn(2+) +H2 – С.И.У. (сокращенное ионное уравнение реакции).
Реакция цинка с соляной кислотой
Данное уравнение реакции HCl Zn относится к типу окислительно-восстановительных. Это можно доказать тем, что у Zn и H2 в ходе реакции изменился заряд, наблюдалось качественное проявление реакции, а также наблюдалось присутствие окислителя и восстановителя.
В данном случае H2 является окислителем, так как с. о. водорода до начала реакции была “+”, а после стала “0”. Он участвовал в процессе восстановления, отдавая 2 электрона.
Zn является восстановителем, он участвует в окислении, принимая 2 электрона, повышая с.о. (степень окисления).
Также это реакция замещения. В ходе нее участвовало 2 вещества, простое Zn и сложное – HCl. В результате реакции образовалось 2 новых вещества, а также одно простое – H2 и одно сложное – ZnCl2. Так как Zn расположен в ряду активности металлов до H2, он вытеснил его из вещества, которое реагировала с ним.
Что будет если в соляную кислоту добавить цинк
Курс общей и неорганической химии
(для студентов биологического факультета (биофизиков)
и для студентов факультета биоинженерии и биоинформатики)
Программа курса. Материалы лекций. Презентации лекций. Программа сетевых контрольных мероприятий
Окислительно-восстановительные процессы.
Гальваническая пара медь-цинк в соляной кислоте.
Ускорение реакции цинка с соляной кислотой
Zn + 2HCl = ZnCl2 + H2Реакцию выделения водорода при взаимодействии цинка с соляной кислотой можно ускорить, если добавить к соляной кислоте немного растворимой соли меди (II). Менее активная медь выделится на поверхности цинка в виде рыхлого темного осадка с большой поверхностью. При этом электроны будут переходить с цинка на медь, и именно на поверхности меди будет бурно выделяться водород. С поверхности цинка, не закрытой пузырьками водорода, ионы цинка быстрее переходят в раствор. В результате выделение водорода после добавления соли меди заметно ускорится. Автор (постановка, съемка, монтаж) Ассистенты Подготовка Интернет-публикации |


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
Цинк. Химия цинка и его соединений
Положение в периодической системе химических элементов
Цинк расположены в побочной подгруппе II группы (или в 12 группе в современной форме ПСХЭ) и в четвертом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение цинка и свойства
Электронная конфигурация цинка в основном состоянии :
+30Zn 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2
3s 

Характерная степень окисления цинка в соединениях +2.
Физические свойства
Цинк при нормальных условиях — хрупкий переходный металл голубовато-белого цвета (быстро тускнеет на воздухе, покрываясь тонким слоем оксида цинка).
Нахождение в природе
Цинк играет важную роль в процессах, протекающих в живых организмах.
В природе цинк как самородный металл не встречается.
Способы получения
Цинк получают из сульфидной руды. На первом этапе руду обогащают, повышая концентрацию сульфидов металлов. Сульфид цинка обжигают в печи кипящего слоя:
2ZnS + 3O2 → 2ZnO + 2SO2
Чистый цинк из оксида получают двумя способами.
ZnO + С → Zn + CO
Далее цинк очищают от примесей.
При это получаемый раствор сульфата цинка очищают от примесей (осаждением их цинковой пылью) и подвергают электролизу.
При электролизе чистый цинк осаждается на алюминиевых катодах, с которых его удаляют и подвергают плавлению в индукционных печах. Таким образом можно получить цинк с высокой чистотой (до 99,95 %).
Качественные реакции
ZnCl2 + 2NaOH → Zn(OH)2 + 2NaCl
При дальнейшем добавлении щелочи амфотерный гидроксид цинка растворяется с образованием комплексной соли тетрагидроксоцинката:
Химические свойства
1.1. Цинк реагируют с галогенами с образованием галогенидов:
Реакция цинка с иодом при добавлении воды:
1.2. Цинк реагирует с серой с образованием сульфидов:
Zn + S → ZnS
1.4. С азотом цинк непосредственно не реагирует.
1.5. Цинк непосредственно не реагирует с водородом, углеродом, кремнием и бором.
1.6. Цинк взаимодействует с кислородом с образованием оксида:
2Zn + O2 → 2ZnO
2. Цинк взаимодействует со сложными веществами:
2.1. Цинк реагирует с парами воды при температуре красного каления с образованием оксида цинка и водорода:
Zn 0 + H2 + O → Zn +2 O + H2 0
2.2. Цинк взаимодействуют с минеральными кислотами (с соляной, фосфорной и разбавленной серной кислотой и др.). При этом образуются соль и водород.
Zn + 2HCl → ZnCl2 + H2↑
Демонстрация количества выделения водорода при реакции цинка с кислотой:
Цинк реагирует с разбавленной серной кислотой:
Порошковый цинк реагирует с концентрированной серной кислотой с образованием сероводорода, сульфата цинка и воды:
2.5. Цинк – амфотерный металл, он взаимодействует с щелочами. При взаимодействии алюминия с раствором щелочи образуется тетрагидроксоалюминат и водород:
Zn + 2KOH + 2H2O = K2[Zn(OH)4] + H2
Цинк реагирует с расплавом щелочи с образованием цинката и водорода:
В отличие от алюминия, цинк растворяется и в водном растворе аммиака:
Zn + CuO → Cu + ZnO
Еще пример : цинк восстанавливает медь из раствора сульфата меди (II):
CuSO4 + Zn = ZnSO4 + Cu
И свинец из раствора нитрата свинца (II):
Восстановительные свойства цинка также проявляются при взаимодействии его с сильными окислителями: нитратами и сульфитами в щелочной среде, перманганатами, соединениями хрома (VI):
Оксид цинка
Способы получения
Оксид цинка можно получить различными методами :
1. Окислением цинка кислородом:
2Zn + O2 → 2ZnO
2. Разложением гидроксида цинка при нагревании:
3. Оксид цинка можно получить разложением нитрата цинка :
Химические свойства
1. При взаимодействии оксида цинка с основными оксидами образуются соли-цинкаты.
Оксид цинка растворяется в избытке раствора щелочи с образованием тетрагидроксоцинката:
3. Оксид цинка не взаимодействует с водой.
ZnO + H2O ≠
5. Оксид цинка взаимодействует с растворимыми кислотами с образованием солей.
ZnO + 2HCl = ZnCl2 + H2O
ZnO + С(кокс) → Zn + СО
ZnO + СО → Zn + СО2
7. Оксид цинка — твердый, нелетучий. А следовательно, он вытесняет более летучие оксиды (как правило, углекислый газ) из солей при сплавлении.
Гидроксид цинка
Способы получения
1. Гидроксид цинка можно получить пропусканием углекислого газа, сернистого газа или сероводорода через раствор тетрагидроксоцинката натрия:
Чтобы понять, как протекает эта реакция, можно использовать несложный прием: мысленно разбить исходное вещество Na2[Zn(OH)4] на составные части: NaOH и Zn(OH)2. Далее мы определяем, как реагирует углекислый газ с каждым из этих веществ, и записываем продукты их взаимодействия. Т.к. Zn(OH)2 не реагирует с СО2, то мы записываем справа Zn(OH)2 без изменения.
2. Гидроксид цинка можно получить действием недостатка щелочи на избыток соли цинка.
Химические свойства
Гидроксид цинка растворяется в избытке щелочи с образованием тетрагидроксоцинката:
4. Г идроксид цинка разлагается при нагревании :
Соли цинка
Нитрат и сульфат цинка
Нитрат цинка при нагревании разлагается на оксид цинка, оксид азота (IV) и кислород:
Сульфат цинка при сильном нагревании разлагается аналогично — на оксид цинка, сернистый газ и кислород:
Комплексные соли цинка
Для описания свойств комплексных солей цинка — гидроксоцинкатов, удобно использоваться следующий прием: мысленно разбейте тетрагидроксоцинкат на две отдельные частицы — гидроксид цинка и гидроксид щелочного металла.
Na2[Zn(OH)4] разбиваем на NaOH и Zn(OH)2
Свойства всего комплекса можно определять, как свойства этих отдельных соединений.
Аналогично тетрагидроксоцинкат калия реагирует с углекислым газом:
А вот под действием избытка сильной кислоты осадок не выпадает, т.к. амфотерный гидроксид цинка реагирует с сильными кислотами.
Правда, под действием небольшого количества ( недостатка ) сильной кислоты осадок все-таки выпадет, для растворения гидроксида цинка кислоты не будет хватать:
Аналогично с недостатком азотной кислоты выпадает гидроксид цинка:
Если выпарить воду из раствора комплексной соли и нагреть образующееся вещество, то останется обычная соль-цинкат:
Гидролиз солей цинка
Растворимые соли цинка и сильных кислот гидролизуются по катиону. Гидролиз протекает ступенчато и обратимо, т.е. чуть-чуть:
I ступень: Zn 2+ + H2O = ZnOH + + H +
II ступень: ZnOH + + H2O = Zn(OH )2 + H +
Более подробно про гидролиз можно прочитать в соответствующей статье.
Цинкаты
Соли, в которых цинк образует кислотный остаток (цинкаты) — образуются из оксида цинка при сплавлении с щелочами и основными оксидами:
Для понимания свойств цинкатов их также можно мысленно разбить на два отдельных вещества.
Например, цинкат натрия мы разделим мысленно на два вещества: оксид цинка и оксид натрия.
Na2ZnO2 разбиваем на Na2O и ZnO
Тогда нам станет очевидно, что цинкаты реагируют с кислотами с образованием солей цинка :
Под действием избытка воды цинкаты переходят в комплексные соли:
Сульфид цинка
Сульфид цинка — так называемый «белый сульфид». В воде сульфид цинка нерастворим, зато минеральные кислоты вытесняют из сульфида цинка сероводород (например, соляная кислота):
ZnS + 2HCl → ZnCl2 + H2S
Под действием азотной кислоты сульфид цинка окисляется до сульфата:
(в продуктах также можно записать нитрат цинка и серную кислоту).
Концентрированная серная кислота также окисляет сульфид цинка:
При окислении сульфида цинка сильными окислителями в щелочной среде образуется комплексная соль:
Z nS + 4NaOH + Br2 = Na2[Zn(OH)4] + S + 2NaBr