дерматосклероз что это такое и как лечить
Склеродермия
Склеродермия — довольно редкая болезнь (а если быть точнее — группа заболеваний), которая относится к системным заболеваниям соединительной ткани. В основном болеют люди в возрасте от 30 до 50 лет, женщины — чаще, чем мужчины. Вылечить склеродермию невозможно, но существуют методы лечения, которые помогают улучшить состояние больного и качество его жизни.
Соединительная ткань в организме человека образует каркас для кожи, внутренних органов, входит в состав сосудистой стенки. При склеродермии повышается выработка одного из основных компонентов соединительной ткани — белка-коллагена. Он накапливается в тканях, что приводит к уплотнению кожи, внутренних органов, сосудистым расстройствам.
Почему возникает склеродермия?
Ученые в настоящее время пока еще не могут точно ответить на этот вопрос. Считается, что играют роль нарушения работы иммунитета, наследственная предрасположенность, вирусные инфекции, контакт с некоторыми веществами (пестицидами, смолами, растворителями).
К возникновению первых симптомов болезни или очередного обострения зачастую приводят травмы, переохлаждения, расстройства со стороны нервной и эндокринной системы, действие вибрации (у людей, которые работают на производстве).
Разновидности склеродермии
Выделяют две формы заболевания:
Симптомы склеродермии
Нет практически ни одного органа, который не мог бы пострадать при системной склеродермии.
Поражение кожи начинается с отеков на лице и руках, постепенно эти участки кожи уплотняются и приобретают цвет воска. Появляются обесцвеченные пятна, лишенные пигмента, участки, на которых усилен сосудистый рисунок. Рот уменьшается в размерах, потому что уплотненная кожа стягивает его, как кисет. Лицо становится маскообразным, пальцы рук напоминают муляж. Постепенно процесс распространяется на другие участки кожи.
Для склеродермии характерен синдром Рейно — побеление и онемение кожи лица, губ, кистей, стоп в результате спазма сосудов. Обычно это происходит после переохлаждения, эмоциональных потрясений.
Поражение суставов кистей приводит к укорочению пальцев, истончению их кончиков. Ногти деформированы, а пальцы постоянно согнуты таким образом, что кисть напоминает «птичью лапу».
Миозит (воспаление в мышцах) при системной склеродермии проявляется в виде мышечной слабости, нарушения движений. Мышцы атрофируются — уменьшаются в размерах, в них появляются болезненные уплотнения.
Расстройства со стороны пищеварительной системы проявляются в виде изжоги, кислой отрыжки, или упорных запоров. Развивается эзофагит (воспаление слизистой оболочки пищевода), дуоденит (воспаление слизистой оболочки двенадцатиперстной кишки).
Также системная склеродермия может приводить к нарушению работы сердца, легких, почек. Если не лечиться, со временем эти расстройства могут стать опасны для жизни.
Современные методы диагностики
Симптомы системной склеродермии многолики, бывают выражены в разной степени, поэтому диагностировать заболевание зачастую очень сложно. Врач-ревматолог должен внимательно осмотреть пациента и оценить симптомы, назначить полноценное обследование.
Всем пациентам назначают общий анализ мочи и крови. Оценить состояние различных органов помогают дыхательные тесты, ЭКГ, ЭХО-кардиография, КТ и МРТ. В диагностике системной склеродермии сильно помогают специальные иммунологические анализы крови, которые позволяют обнаружить ревматоидный фактор, антинуклеарные антитела, LE-клетки, оценить уровни антител. При необходимости врач назначит биопсию кожи, мышц или других органов.
Склеродермия
Склеродермия относится к системным аутоиммунным заболеваниям с высоким уровнем рисков. В данном случае речь идет о болезни соединительной ткани. Маленькие сосуды, капилляры поражаются собственными иммунными клетками организма, в результате чего обменные процессы в тканях значительно ухудшаются. Кожа, а также подкожная клетчатка сильно уплотняются, как бы становятся однородными, похожими на сплошную рубцовую ткань. Заболевание прогрессирует, захватывает суставы, внутренние органы и в результате может привести к смерти пациента.
Чаще всего склеродермией заболевают женщины, а с возрастом риски такой патологии повышаются.
Классификации заболевания по нескольким признакам
Если говорить о клинической форме, то классификация склеродермии включает такие варианты:
А еще склеродермия бывает быстро прогрессирующей (острой), умеренно прогрессирующей (подострой) и медленно прогрессирующей (хронической).
Прогнозы
Наиболее благоприятные прогнозы наблюдаются при хронической форме заболевания. В этом случае выживаемость в течение 15 лет составляет до 80%. Острая форма наиболее опасная, прогноз неблагоприятный: в течение пяти лет выживают только 4% пациентов, а в течение 2 лет – не более 20%.
Симптомы
Поскольку заболевание бывает разных видов и имеет массу особенностей, с симптомами тоже нет никакой однозначной картины. По этой причине принято выделять общие тенденции, а уже дальше, в нюансах, врачи разбираются в процессе диагностики.
Итак, общими признаками склеродермии являются:
Очевидно, что не все эти симптомы склеродермии люди могут сами увидеть и вовремя обнаружить. Если визуально болезнь протекает без особых изменений, то тут подскажет об опасности состояние больного. Слабость, быстрая утомляемость, температура до 38 градусов – это тоже признаки, свидетельствующие о том, что пора отправиться к врачу и пройти диагностику.
Поскольку патогенез склеродермии часто предполагает вовлечение в процесс слизистых тканей, есть признаки, которые характерны конкретно для этих участков. Например, у пациентов развиваются ринит, стоматит и другие подобные проблемы.
Что касается костей и суставов, то человек может наблюдать скованность движений, невозможность быстро согнуть и разогнуть конечность, а также отечность. Доходит до того, что в некоторых областях кости небольшого размера могут даже рассасываться, вызывая искривления и другие неприятные последствия. Из-за нарушений суставной подвижности некоторые мышцы могут атрофироваться или значительно ослабевать.
Признаки, связанные с внутренними органами
Поскольку заболевание захватывает соединительную ткань и сильно влияет на внутренние органы, у пациентов может быть весь спектр проблем с ЖКТ, сердцем, почками и другими системами. Они проявляются любыми признаками соответствующих болезней. Очень часто (в 70% случаев) поражаются легкие – именно болезни легких нередко становятся причиной смерти больного. В данном случае склеродермия может вызывать пневмонии, абсцессы и даже рак легких, который у людей с таким заболеванием встречается в 3-5 раз чаще, чем у других представителей тех же возрастных групп.
Важно понимать, что четкого списка симптомов в данном случае нет – иначе он был бы огромным. Заболевание тем и опасно, что затрагивает практически весь организм и может проявить себя как угодно.
Диагностика
Комплексный подход и тщательный визуальный осмотр пациента помогают поставить диагноз максимально точно.
Лечение
Эта аутоиммунная патология пока не устраняется – такого лекарства на данный момент не существует. Все действия сводятся к тому, чтобы стабилизировать состояние больного и продлить ему жизнь. Лечение склеродермии с такой целью включает:
Пациентам, страдающим такой патологией, рекомендуется и отказ от вредных привычек, движение в сторону здорового образа жизни.
Вопросы-ответы
Можно ли вылечить склеродермию полностью?
К сожалению, сейчас это невозможно, такого лекарства пока не существует. Это хронический патологический процесс, который рано или поздно ведет к серьезным негативным последствиям.
Сколько живут с таким диагнозом?
Продолжительность жизни сильно зависит от формы болезни. При хронической, то есть вялотекущей форме и соблюдении всех клинических рекомендаций при склеродермии, большая часть пациентов может прожить 15 и более лет. Если формы более острые, продолжительность жизни, как правило, снижается до 2-5 лет.
В каком возрасте и кто чаще всего более склеродермией?
Чаще всего диагноз ставится женщинам в возрасте от 20 до 40 лет, но и другие возрастные рамки тоже захватываются, в том числе страдают заболеванием и мужчины, они от него тоже не застрахованы.
Существует ли специфическая профилактика при склеродермии?
Как и в случае с другими аутоиммунными заболеваниями, специфической профилактики склеродермии не существует. Но врачи говорят о том, что здоровый образ жизни, внимание к своему самочувствию и отсутствие сильных стрессов могут снизить риски заболевания.
Заразна ли склеродермия?
Нет. Это заболевание вызывается особенностями работы иммунитета самого пациента. Оно не может передаваться при прикосновениях, половых контактах, через воздух и т.д. Для окружающих пациент с такой патологией безопасен.
Диагностика и лечение системной склеродермии
Системная склеродермия (ССД) – аутоиммунное заболевание, характеризующееся вовлечением в воспалительный процесс соединительной ткани и проявляющееся поражением кожи, внутренних органов, сосудов и суставов. В статье рассматриваются современные подходы к лечению ССД, которые изложены в недавно опубликованных рекомендациях Европейской антиревматической лиги (EULAR).
Системная склеродермия (ССД) – это аутоиммунное заболевание, в основе которого лежат генерализованная микроангиопатия и активация процессов фиброза кожи и внутренних органов. На ранних стадиях заболевание проявляется кожными изменениями в виде плотного отека пальцев и синдромом Рейно, которые могут не сопровождаться ухудшением общего состояния или признаками поражения внутренних органов (дисфагией, одышкой и др.), поэтому пациенты зачастую не сразу обращаются за медицинской помощью. В связи с этим ССД нередко диагностируют поздно, когда патологические изменения в органах необратимы, а лечение менее эффективно. По данным канадского регистра, у 408 пациентов диагноз ССД был установлен в среднем через 6,0 лет после развития феномена Рейно и через 2,7 года после появления первых “внекожных” проявлений [1]. В России ССД диагностировали через 2,0–2,7 года после появления феномена Рейно при диффузной форме заболевания и через 4,8–6,5 года при лимитированной форме, что связано с разной частой поражения внутренних органов, а также скоростью прогрессирования заболевания [2]. При этом результаты крупного исследования (n=5860) показали, что смертность пациентов с ССД достигает 68 на 1000 человек в год [3]. Таким образом, своевременная диагностика ССД представляет собой сложную, но очень важную задачу для врача.
В настоящее время ССД активно изучается в рамках проекта EUSTAR (European League Against Rheumatism Scleroderma Trials and Research Group). В Российской Федерации в нем принимают участие два центра – НИИ ревматологии им. В.А. Насоновой и клиника им. Е.М. Тареева.
Эпидемиология и факторы риска
Системной склеродермией женщины страдают чаще мужчин (3:1); большая часть пациентов находится в возрасте от 25 до 50 лет [4]. Заболеваемость отличается в разных регионах. Так, в Северной Европе и Японии она составляет менее 10 на 1 млн населения в год, а в Южной Европе, Северной Америке и Австралии достигает 14-21 на 1 млн в год [5]. Распространенность заболевания среди афроамериканцев, американских индейцев, австралийцев, японцев выше, чем среди европейцев и белого населения США [6].
Выявлено множество генов, участвующих в регуляции иммунной системы и повышающих риск развития ССД, в том числе BANK1, C8orf13-BLK, IL-23R, IRF5, STAT4, TBX21 и TNFSF4 [7]. Изучаются также потенциальные эпигенетические механизмы и роль факторов окружающей среды, в том числе кремниевой пыли, органических растворителей, лекарственных препаратов (блеомицина, карбидопы и др.), пестицидов, рапсового масла, кокаина [8].
Клиническая картина
Выделяют две основные формы ССД – диффузную и лимитированную. При лимитированной форме уплотнение кожи отмечается дистальнее локтевых и коленных суставов, при диффузной – изменения кожи могут быть выявлены на туловище, бедрах и плечах (поражение кожи лица встречается при обеих формах). Различия между двумя формами заболевания не ограничиваются распространенностью кожного процесса: диффузная форма характеризуется частым поражением внутренних органов и более быстрым прогрессированием заболевания. Если при диффузной форме ССД 10-летняя выживаемость составляет 65%, то при лимитированной она достигает 92% [9].
Феномен Рейно. Феномен Рейно встречается у 95% больных системной склеродермией и, как правило, оказывается первым признаком болезни [10]. Клинически он имеет две или иногда три стадии – побеление, цианоз и покраснение кожи пальцев, которые развиваются под действием холода и могут сопровождаться онемением и болью 14. Для первичного синдрома Рейно, в отличие от феномена Рейно при ССД, характерны отсутствие изменений при видеокапилляроскопии ногтевого ложа, антинуклеарных антител, симптомов ишемического повреждения тканей (гангрена, язвочки, рубчики), нормальное значение СОЭ [16].
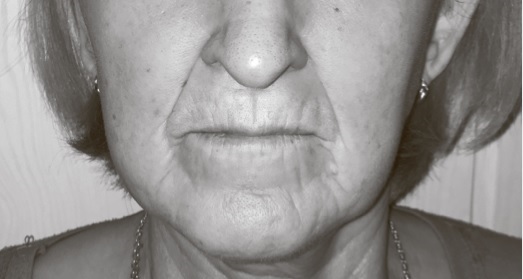
Поражение кожи. Другим признаком ССД является поражение кожи, которое развивается в три стадии: отек (например, плотный отек кистей), уплотнение ( например, склеродактилия), атрофия. На первом этапе отмечаются плотный отек и снижение эластичности кожи и подлежащих тканей, в дальнейшем формируется “склеродерма”, а на стадии атрофии кожа истончается и приобретает цианотично-бурый цвет, появляется специфический блеск, исчезает волосяной покров [17]. Характерны симптом “кисета” (радиальные складки вокруг рта) (рис. 1) и увеличение количества телеангиоэктазий [18]. В результате поражения сосудов микроциркуляторного русла нередко наблюдается ишемическое повреждение кожи – рубчики на дистальных фалангах пальцев по типу “крысиных укусов”, реже – сухие некрозы или гангрена [19]. Существуют и другие специфичные для ССД типы поражения кожи, такие как гипо- и гиперпигментация (“salt and pepper”), кожный кальциноз [20].
Для оценки выраженности кожных изменений применяют модифицированный кожный счет по Rodnan, предполагающий определение толщины кожного покрова в 17 участках тела в баллах от 0 до 3 (нормальная толщина, незначительное, умеренное и выраженное утолщение) с расчетом суммарного балла (максимальное значение 51) [21]. Другим методом, используемым для анализа степени повреждения кожи, является ультразвуковое исследование: гиперэхогенность расценивается как уплотнение кожи вследствие избыточного отложения коллагена, а гипоэхогенность – как признак отека тканей [22]. Реже в клинической практике используют дюрометрию – измерение твердости кожи [23].
Поражение внутренних органов. В России очень большой вклад в изучение висцеральных проявлений ССД внесла проф. Н.Г. Гусева, которая работала в клинике, возглавляемой Е.М. Тареевым, а затем в НИИ ревматологии под руководством акад. В.А. Насоновой [24,25].
У большинства пациентов с ССД (70-98%) развивается поражение желудочно-кишечного тракта, в частности гипотония пищевода, которая проявляется дисфагией и гастро-эзофагеальным рефлюксом. Возможно развитие синдрома мальабсорбции и избыточного роста патогенной флоры на фоне замедления пассажа химуса, а также поражение толстой кишки (диарея, недержание кала) [26]. В отечественном исследовании установлена взаимосвязь между гастроэзофагеальным рефлюксом и тяжестью легочного фиброза [27].
Поражение сердца встречается в 15-35% случаев [28,29] и проявляется сердечной недостаточностью, нарушениями ритма, болевым синдромом [30]. В редких случаях развиваются пороки клапанов, в том числе митральный стеноз [31].
Примерно у 75% больных уже в первые годы заболевания выявляют интерстициальное поражение легких, характеризующееся медленным прогрессирующим течением с исходом в фиброз разной степени тяжести [32]. Л.В. Теплова и соавт. с помощью компьютерной томографии высокого разрешения выявили признаки поражения интерстиция легких у 82% из 138 пациентов с ССД [33].
Для ССД характерно развитие легочной артериальной гипертензии (ЛАГ), иногда тяжелой. По данным недавно опубликованного исследования, в течение в среднем 4 лет умерли 60 из 132 пациентов с ССД, осложнившейся ЛАГ. Выживаемость от момента установления диагноза ЛАГ составила всего 4 (2,2-6,2) года [34]. Легочная гипертензия у пациентов с ССД может быть следствием следующих состояний: ЛАГ (в том числе как исход отложения коллагена в стенке сосудов), легочной веноокклюзионной болезни и/или легочного капиллярного гемангиоматоза, дисфункции левого желудочка, поражения легких с гипоксемией, хронической тромбоэмболической ЛГ [35,36].
Поражение почек встречается у 19% пациентов [29]. Частота развития острого склеродермического криза, проявляющегося быстрым ухудшением функции почек (острое почечное повреждение), составляет 10-15% при диффузной форме ССД и 1-2% при лимитированной форме [37,38]. В настоящее время поражение почек не является основной причиной гибели больных, уступив легочному фиброзу. Склеродермический почечный криз может быть заподозрен при впервые выявленном повышении АД >150/85 мм рт. ст., сохраняющемся в течение последующих 24 ч, а также снижении скорости клубочковой фильтрации на 10% или измеренной СКФ менее 90 мл/мин. Дополнительными признаками склеродермического почечного криза могут быть впервые возникшая гематурия и протеинурия, внезапный отек легких, олигурия или анурия, ретинопатия [39].
Диагностика
ССД следует подозревать у всех пациентов с феноменом Рейно. Важное диагностическое значение имеет поражение кожи (уплотнение кожи, “кисетный” рот, маскообразное лицо, склеродактилия, кальциноз, пигментация), хотя оно может и отсутствовать. При опросе следует также обращать внимание на симптомы поражения внутренних органов, такие как одышку и дисфагию. Для диагностики ССД на практике используют классификационные критерии, разработанные экспертами Американской коллегии ревматологии (ACR) и Европейской антиревматической лиги (EULAR) в 2013 г. (табл. 1) [40]. Необходимо учитывать, что критерии ACR-EULAR мало информативны на ранней и очень ранней стадии ССД, в то время как результаты исследования EUSTAR показали, что срок между развитием синдрома Рейно и других симптомов ССД составляет в среднем 4,8 года при лимитированной форме и 1,9 года при диффузной форме [41]. Полагают, что лечение, начатое в этот период (так называемое “window of opportunity”, или “окно возможностей”), может предотвратить развитие поражения внутренних органов и замедлить прогрессирование заболевания. В связи с этим были разработаны критерии ранней диагностики системной склеродермии (VEDOSS; табл. 2) [42]. На первом этапе диагностики предлагается выявлять ключевые признаки заболевания (так называемые “красные флаги”), такие как синдром Рейно и плотный отек пальцев кистей. На втором этапе проводят видеокапилляроскопию ногтевого ложа и определяют специфические антитела (например, антицентромерные или к топоизомеразе-1) [43]. При очень ранней ССД поражение внутренних органов отсутствует, в то время как при ранней ССД отмечают признаки субклинического их поражения, например, диастолическую дисфункцию левого желудочка по данным эхокардиографии (уменьшение отношения E/A), начальное снижение диффузионной способности легких ТАБЛИЦА 1. Классификационные критерии системной склеродермииACR-EULAR 2013 г
Не стоит забывать о существовании ССД без склеродермы, при которой поражение кожи (уплотнение и фиброз) отсутствует как на ранних, так и поздних стадиях заболевания. В этом случае диагноз устанавливают на основании наличия синдрома Рейно, дигитальных язв, специфических антител, изменений при видеокапилляроскопии, висцеральных поражений [45,46]. Также выделяют CREST-синдром – сочетание кальциноза кожи, синдрома Рейно, нарушения моторики пищевода, склеродактилии и телеангиоэктазий, а также антител к центромере. Для СREST-синдрома характерно достаточно благоприятное течение [47].
| I. Выявление “красных флагов” (феномен Рейно, плотный отек пальцев кистей/склеродактилия) |
| II.а) Проведение видеокапилляроскопии ногтевого ложа (ранние, активные, поздние изменения) |
| б) Серологические исследования: выявление специфических аутоантител (anti-Scl70, ACA, anti-RNA pol III и др.) |
| III. Установление диагноза очень ранней системной склеродермии при выявлении изменений, соответствующих пунктам I и II. |
| IV. Дальнейшее обследование пациентов, соответствующих критериям очень ранней системной склеродермии (компьютерная томография органов грудной клетки, эхокардиография, исследование функции внешнего дыхания, манометрия пищевода). |
| V. Установление диагноза ранней системной склеродермии при выявлении изменений, соответствующих пунктам I, II, IV. |
Важным лабораторным критерием диагностики ССД является наличие аутоантител, например, антител к топоизомеразе I (anti-Scl-70), антицентромерных антител (ACA), антител к рибонуклеопротеазе III (anti-RNA pol III), anti-Th/To, anti-U3RNP/Fibrillarin, anti-Pm/Scl, anti-Ku, антител к белкам сплайсосомы (anti-U1RNP, anti-Sm). В отечественном исследовании (n=300) было показано, что у большинства пациентов с ССД определялись антинуклеарный фактор (83,8%) и anti-Scl-70 (50,0%), реже встречались ACA (14,6%), anti-U1RNP (8,6%) и anti-RNA pol III (5,5%) [48]. Различные типы аутоантител могут ассоциироваться с определенными клиническими проявлениями ССД (табл. 3), поэтому их исследование имеет не только диагностическое, но и прогностическое значение.
Важное диагностическое значение имеют изменения при видеокапилляроскопии. Условно выделяют следующие стадии изменений, выявляемых при видеокапилляроскопии ногтевого ложа у больных с ССД: раннюю, активную и позднюю. При склеродермическом типе изменений на разных стадиях могут быть обнаружены гигантские капилляры, капиллярные кровоизлияния, уменьшение количества капилляров или аваскулярные участки, дезорганизация архитектуры капиллярного русла, “ветвистые” капилляры [49].
Лечение
Международные рекомендации по лечению системной склеродермии были разработаны рабочей группой EULAR/EUSTAR в 2016 году [85]. Они подразделены в зависимости от проявлений заболевания (феномен Рейно, язвы дистальных фаланг пальцев, легочная гипертензия, поражение кожи и легких, склеродермический почечный криз, поражение желудочно-кишечного тракта).
Феномен Рейно. Пациентам с феноменом Рейно следует избегать нахождения на холоде и бросить курить. Препаратами первой линии считают дигидропиридиновые антагонисты кальция, например, пролонгиро ванные формы нифедипина или амлодипин. Благоприятное влияние препаратов этой группы на частоту и тяжесть эпизодов ишемии подтверждается результатами мета-анализа клинических исследований [50]. При недостаточной эффективности антагонистов кальция возможно применение ингибиторов фосфоди эстеразы 5 типа (например, силденафила), эффективность которых также была показана при мета-анализе клинических исследований. Однако они несколько чаще вызывают нежелательные явления, в том числе вазомоторные реакции, миалгии, боль в груди, диспепсию и нарушения зрения [51]. При тяжелом феномене Рейно возможно внутривенное введение синтетического аналога простациклина илопроста (0,5-3 нг/кг/мин в течение 3-5 дней) или ингаляционное его применение в дозе 50-150 мкг два раза в сутки. В Российской Федерации для лечения синдрома Рейно чаще при меняют синтетический аналог простагландина Е1 альпростадил. В неконтролируемых клинических исследованиях альпростадил вызывал уменьшение или купирование боли, ускорял заживление язв и улучшал показатели микроциркуляции [24,52]. В 1985 году было проведено многоцентровое, двойное слепое, плацебоконтролируемое исследование, в которое было включено 55 пациентов с первичным феноменом Рейно и феноменом Рейно в рамках ССД. 72-часовое внутривенное введение альпростадила улучшало кровоток в микроциркуляторном русле по сравнению с плацебо [53].
При непереносимости вазодилататоров в качестве альтернативного препарата в рекомендациях указан флуоксетин 20 мг/сут (селективный ингибитор обратного захвата серотонина), хотя он изучался только в одном небольшом исследованием (n=27) пациентов), в котором по эффективности превосходил нифедипин у пациентов с тяжелым феноменом Рейно [54].
Обсуждается возможность применения топических аналогов нитроглицерина для лечения феномена Рейно. Так, в многоцентровом, двойном слепом, плацебоконтролируемом исследовании MQX-503 (аналог нитроглицерина, быстро абсорбирующийся с поверхности кожи) улучшал микроциркуляцию у пациентов с феноменом Рейно [55]. Длительное время считалось, что блокаторы эндотелиновых рецепторов (бозентан) эффективны только в профилактике новых дигитальных язв, но мало влияют на течение феномена Рейно. Однако недавно было показано, что бозентан может применяться для лечения феномена Рейно у пациентов с ССД, которым противопоказана терапия простаноидами [56,57].
Дигитальные язвы. Пациентам с дигитальными язвами следует избегать нахождения на холоде и бросить курить. Основными препаратами считают простаноиды (например, внутривенное введения илопроста) и ингибиторы фосфодиэстеразы 5 типа, эффективность которых подтверждена результатами мета-анализов клинических исследований [58]. Из ингибиторов фосфодиэстеразы 5 типа у пациентов с дигитальными язвами лучше всего изучен тадалафил, в то время как результаты применения силденафила оказались достаточно противоречивыми. По данным одного из последних исследований SEDUCE, при его применении частота возникновения язвенных дефектов была даже выше, чем в группе плацебо [59]. Тем не менее, авторы рекомендаций отмечают, что доза силденафила в указанном исследовании была ниже (60 мг/сут), чем в других исследованиях (100 мг/сут). При неэффективности ингибиторов фосфодиэстеразы может быть назначен бозентан (неселективный антагонист ЕТА и ЕТВ эндотелиновых рецепторов), эффективность которого была установлена в двух рандомизированных исследованиях (RAPIDS-1, RAPIDS-2). В этих исследованиях лечение бозентаном вызывало уменьшение количества новых язвенных дефектов, но не способствовало заживлению уже имевшихся язв [56,60]. Бозентан может оказывать гепатотоксическое действие, а также обладает тератогенностью. При этом он снижает эффективность пероральных контрацептивов, ингибируя систему цитохрома Р450. Таким образом, ввиду скорее профилактического действия препарата и серьезности нежелательных явлений, бозентан считается препаратом третьей линии [61]. В острую фазу или при подозрении на тромботические осложнения к терапии могут быть присоединены антиагреганты (аспирин, клопидогрел) и антикоагулянты (эноксапарин, варфарин) [58,62,63]. При наличии некротизированной ткани в области ишемического дефекта необходима первичная хирургическая обработка раны, назначение антибактериальной терапии при инфицировании язвы, применение специальных повязок для улучшения заживления язвы 66. Для купирования болевого синдрома применяют нестероидные противовоспалительные препараты, опиоиды, лидокаин [62].
Легочная артериальная гипертензия. Применение антагонистов эндотелиновых рецепторов, таких как бозентан, амбризентан, мацитентан, приводит к повышению толерантности к физическим нагрузкам и замедляет прогрессирование легочной гипертензии [6769]. Зависимость эффекта от дозы была отмечена только при лечении амбризентаном (доза 10 мг по эффективности превосходила дозу 5 мг). К такому же эффекту приводило применение ингибиторов фосфодиэстеразы 5 типа, в том числе силденафила (от 60 до 240 мг/сут) и тадалафила (40 мг/сут), а также риоцигуата – стимулятора растворимой гуанилатциклазы [67,69,70]. При этом эффективность риоцигуата (улучшение пробы с 6-минутной ходьбой) была доказана у пациентов как с ЛАГ, так и с хронической тромбоэмболической легочной гипертензией в исследованиях PATENT и CHEST [71]. Более высокая эффективность комбинированной терапии бозентаном и силденафилом у пациентов с ЛАГ (в том числе идиопатической, наследственной и в рамках диффузных заболеваний соединительной ткани) не была подтверждена в исследовании COMPASS [72]. При тяжелой ЛАГ возможно внутривенное применение эпопростенола (стартовая доза 2 нг/кг/мин), которое в двух исследованиях приводило к улучшению толерантности к физическим нагрузкам и показателей гемодинамики [73,74]. Недостатком препарата является короткий период полувыведения, в связи чем его приходится вводить с помощью центрального венозного катетера, а также синдром отмены, характеризующийся резким повышением давления в легочной артерии при прекращении лечения. Альтернативой может служить ингаляционное применение илопроста, хотя следует учитывать, что его эффективность в лечении ЛАГ у пациентов с ССД недостаточно изучена [67,69]. Ранее пациентам с ЛАГ назначали терапию варфарином, однако в регистре COMPERA не была подтверждена эффективность антикоагулянтов у пациентов с ССД [75,76].
Поражение кожи. Ранние кожные изменения при ССД могут поддаваться лечению метотрексатом. В двух рандомизированных клинических исследованиях препарат изучался в дозах 15 мг/нед в течение 2 лет и 10 мг/нед в течение года. Эти дозы ниже доз препарата, которые применяются при других ревматических заболеваниях, в частности ревматоидном артрите [40,77]. Применение циклофосфамида у пациентов с висцеральными проявлениями ССД в рандомизированных клинических исследованиях также приводило к улучшению состояния кожи [78]. Эффективность микофенолата мофетила и азатиоприна изучена недостаточно.
Интерстициальная болезнь легких. В рандомизированном клиническом исследовании (Scleroderma Lung Study) лечение циклофосфамидом в дозе 1-2 мг/кг/сут внутрь вызывало уменьшение одышки и изменений на компьютерных томограммах, улучшение качества жизни и показателей вентиляционной функции, причем наиболее выраженный эффект был отмечен у пациентов с тяжелым поражением легких [78]. В другом многоцентровом, проспективном, рандомизированном, двойном слепом, плацебо-контролируемом исследовании циклофосфамид применяли внутривенно в дозе 600 мг/м2/мес в течение 6 месяцев, а затем заменяли на азатиоприн (2,5 мг/кг/сут) в течение 6 месяцев. В этом исследовании был выявлен прирост форсированной жизненной емкости (ФЖЕЛ) легких в основной группе на 4,2% по сравнению с контролем [79]. Был сделан вывод, что циклофосфамид замедляет прогресси ро вание заболевания, а его применение оправдано у пациентов с прогрессирующим интерстициальным поражением легких. Режим дозирования и длительность терапии следует подбирать индивидуально, учитывая эффективность и токсичность препарата. Следует отметить, что при анализе отдаленных результатов исследования (через 24 месяца) было выявлено ухудшение показателей функции внешнего дыхания и рентгенологической картины, которые фактически возвращались к исходным значениям [80]. В рандомизированном двойном слепом исследовании была сопоставлена эффективность микофенолата мофетила (3000 мг/сут в течение 24 мес) и циклофосфамида внутрь (2 мг/кг/сут в течение 12 мес с дальнейшим приемом плацебо в течение 12 мес) у пациентов с ССД. Улучшение показателей функции внешнего дыхания было сопоставимым в двух группах, однако переносимость микофенолата мофетила была лучше, чем циклофосфамида [81].
В исследовании случай-контроль лечение ритуксимабом пациентов с ССД и интерстициальным поражением легких предотвращало снижение ФЖЕЛ по сравнению с контролем (p=0,02) [82]. Л.П. Ананьева и соавт. применяли ритуксимаб у 27 пациентов с ССД и поражением легких. У 82% пациентов был достигнут хороший эффект, а у 15% – удовлетворительный. Через 1 год после первого введения ритуксимаба было выявлено достоверное увеличение среднего значения ФЖЕЛ. Эффективность препарата у пациентов с длительностью болезни менее 5 лет была выше, чем у больных с более длительным анамнезом ССД: увеличение ФЖЕЛ на 11,4±12,2% и 3,7±5,7%, соответственно [83]. Мы применяли ритуксимаб у 8 пациентов с ССД и интерстициальным поражением легких. Через 6 мес ФЖЕЛ и диффузионная способность легких увеличились на 6,9±6,9% и 4,7±4,7% соответственно, а через 12 месяцев – на 8,9±6,9% и 6,7±4,6%.
В рандомизированном, двойном-слепом, плацебоконтролируемом исследовании лечение тоцилизумабом, блокирующим рецепторы интерлейкина-6, у 87 пациентов с ССД и интерстициальным поражением легких задерживало прогрессирование фиброза через 24 и 48 недель [84].
Склеродермический почечный криз. Основа лечения – ингибиторы АПФ, в частности каптоприл, который назначают в дозе 6,25-12,5 мг три раза в сутки, а затем постепенно увеличивают дозу до максимальной (50 мг три раза в сутки) [85]. Каптоприл не отменяют, даже если функция почек продолжает ухудшаться. После стабилизации АД можно перейти на прием ингибитора АПФ длительного действия. Постоянный прием ингибитора АПФ увеличил выживаемость пациентов со склеродермическим почечным кризом с 10% в течение года до 60% в течение 5 лет [86,87]. Если на фоне приема каптоприла в максимальной дозе не удается добиться нормализации АД в течение 72 ч, добавляют блокаторы кальциевых каналов, нитраты (особенно при появлении застойных явлений в легких) или другие вазодилатирующие средства. При сохранении олигурии может потребоваться лечение гемодиализом. Медлен ное (в течение 2 лет) восстановление или улучшение функции почек после склеродермического почечного криза происходит у 30% пациентов [88]. Если через 2 года сохраняется потребность в гемодиализе, возможна трансплантация почки [89].
Интересно отметить, что независимым фактором риска почечного склеродермического криза считают применение глюкокортикостероидов в дозе более 15 мг/сут, что недавно было показано в двух крупных исследованиях [90,91]. Возможно также развитие так называемого “нормотензивного” почечного криза, при котором АД не превышает 140/90 мм рт. ст. Выживаемость пациентов с нормотензивным кризом значительно ниже таковой пациентов с гипертензивным кризом – 13% и 35%, соответственно, ввиду поздней диагностики [92]. Рекомендаций по лечению данного состояния нет, в связи с чем терапия аналогична лечению гипертензивного почечного криза.
Поражение желудочно-кишечного тракта. При наличии гастроэзофагеального рефлюкса рекомендуется применение ингибиторов протонной помпы [93]. При необходимости могут быть использованы прокинетики [94]. Лечение антибактериальными препаратами для профилактики избыточного бактериального роста в тонкой кишке представляется спорным, учитывая отсутствие соответствующих рандомизированных клинических исследований [95].
Ранняя ССД. Количество исследований, в которых изучались подходы к лечению пациентов с ранней ССД, ограничено. В достаточно крупном проспективном обсервационном исследовании ESOS (European Scleroderma Observational Study) у 326 пациентов c диффузной формой ССД длительностью не более 3 лет изучалась эффективность различных режимов иммуносупрессивной терапии, в том числе метотрексатом (n=65), микофенолата мофетилом (n=118) и циклофосфамидом (n=87). Пятьдесят шесть пациентов не получали иммуносупрессивную терапию. 276 (84,7%) пациентов завершили 12-месячное наблюдение и 234 (71,7%) – 24-месячное. Во всех группах пациентов, получавших иммуносупрессивные препараты, отмечалось значительное снижение кожного счета по Rodnan. Через 24 месяца выживаемость была ниже в контрольной группе пациентов, хотя разница между группами не достигла статистической значимости [96].
Применение глюкокортикостероидов. Применение глюкокортикостероидов для лечения ССД по возможности следует ограничивать в связи с риском развития отдаленных осложнений, однако при прогрессирующем диффузном поражении кожи и других клинических признаках воспалительной активности (серозит, миозит, прогрессирующее интерстициальное поражение легких, рефрактерный синовит и/или теносиновит) целесообразно назначение глюкокортикостероидов в дозах до 15 мг/сут, так как прием этих препаратов в более высоких дозах увеличивает риск развития склеродермического почечного криза.
Заключение
ССД остается одним из самых неблагоприятных диффузных заболеваний соединительной ткани ввиду частого тяжелого поражения жизненно важных органов и ограниченных возможностей терапии. Многие вопросы лечения ССД остаются нерешенными, а прогнозирование эффективности терапии представляется затруднительным в связи с малым количеством исследований. Концепция ранней и очень ранней ССД, а также “окна возможностей” представляет интерес, однако опыт назначения иммуносупрессивного лечения в столь ранние сроки весьма ограничен. Перспективно дальнейшее изучение эффективности ритуксимаба, тоцилизумаба и, возможно, других ГИБП, однако до сих пор остается неясным, имеют ли препараты данной группы реальное преимущество перед стандартными препаратами.

