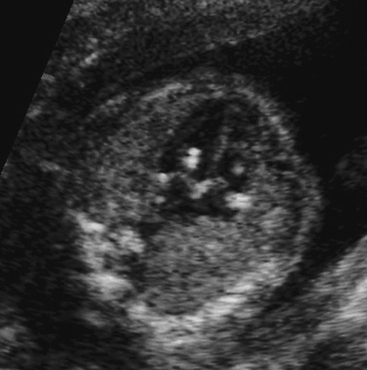
Гэф в сердце плода что это
Гэф в сердце плода что это
а) Лучевая диагностика:
• Небольшая яркая точка ( > справа > с обеих сторон
о Существует риск диагностических ошибок
• Гиперэхогенный внутрисердечный фокус (ГВФ) чаще всего является изолированной находкой у пациентов группы низкого риска:
о Порок развития и нарушение функции сердца отсутствуют
о Изолированный ГВФ слабо связан с Т21:
— Отношение правдоподобия: 1,4-1,8
— Обнаруживают другие маркеры Т21
о Наличие сопутствующих выраженных аномалий связано с Т13
о Наличие множественных ГВФ с большей вероятностью может быть связано с анеуплоидией
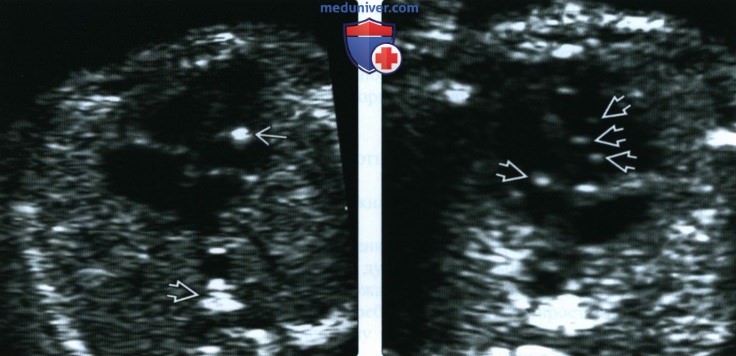
(Справа) Другой случай. В сердце плода с обеих сторон видны многочисленные ГВФ. Многочисленные ГВФ по сравнению с изолированным единственным ГВФ связаны с более высоким риском анеуплоидии. В большинстве случаев ГВФ выявляют у плодов с нормальным кариотипом, относящихся к группе низкого риска. 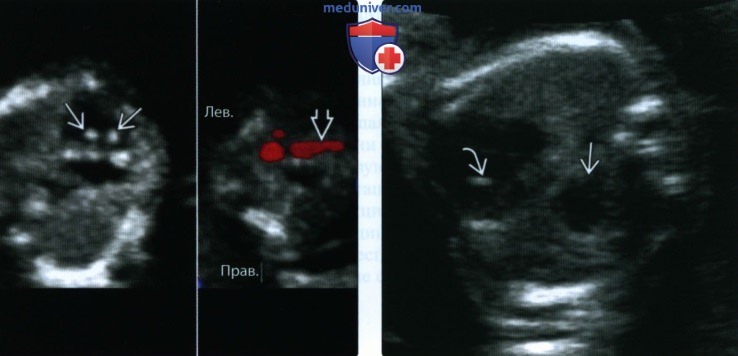
(Справа) УЗИ грудной клетки плода с диафрагмальной грыжей и Т13, поперечная плоскость. Визуализируются ГВФ, а также отклонение оси сердца, обусловленное выпадением желудка в грудную клетку. ГВФ, сочетающийся с той или иной аномалией развития, позволяет заподозрить анеуплоидию.
б) Дифференциальная диагностика гиперэхогенного внутрисердечного фокуса:
• Рабдомиома:
о Гомогенное гиперэхогенное образование в миокарде
• АВСД:
о Остаточная ткань клапана может напоминать ГВФ
в) Патологоанатомические особенности:
• В основе предположительно лежит микрокальцификация в толще сосочковой мышцы
г) Клинические особенности:
• ГВФ присутствует у 4-7% плодов с нормальным кариотипом
• Связь с анеуплоидией:
о ГВФ присутствует у 15-30% плодов с Т21
о ГВФ присутствует у 30—40% плодов с Т13
• Этническая вариабельность противоречива:
о Среди уроженцев Азии ГВФ присутствует у 20% плодов
о Более высокая частота диагностики, вероятно, связана с более низким индексом массы тела женщин в среднем, чем с этнической предрасположенностью
д) Особенности диагностики:
• Изолированный ГВФ у пациента группы низкого риска считается вариантом нормы
• ГВФ диагностируют только в том случае, если эхогенность очага не уступает эхогенности костной ткани
• Наблюдение по поводу ГВФ у пациентов группы низкого риска не требуется
Редактор: Искандер Милевски. Дата обновления публикации: 13.10.2021
ГЭФ в желудочках сердца плода: причины и исходы для ребенка
Doctor Polyakov » Блог » Врачевание » Гинекология » ГЭФ в желудочках сердца плода: причины и исходы для ребенка
УЗИ во время беременности помогает вовремя обнаружить пороки у малыша. ГЭФ в желудочках сердца плода относится к факторам риска по аномалиям развития, но в большинстве случаев не оказывает негативного влияния на ребенка.
На УЗИ ГЭФ виден в виде гиперэхогенных “горошин”
Малые ультразвуковые маркеры врожденной патологии
Ультразвуковое сканирование при беременности проводится трижды в каждом триместре. Наиболее важен первый пренатальный скрининг, на основе которого можно своевременной обнаружить хромосомные аномалии у плода. Грубые анатомические пороки выявить проще всего: гораздо сложнее, когда врач видит незначительные дефекты. К малым ультразвуковым маркерам хромосомных отклонений относятся:
Ни один из этих признаков не может указывать на наличие врожденных аномалий, но при этом врач УЗ диагностики не может гарантировать отсутствие формирования порока развития. ГЭФ в желудочках сердца плода – это фактор риска по возможному развитию патологии и повод для внимательной оценки внутриутробного роста и развития малыша.
ГЭФ в желудочках сердца плода
Частота встречаемости – около 7%. ГЭФ в желудочках сердца плода – это маленькое образование внутри полости сердца, которое при проведении УЗИ по эхоструктуре сравнимо с костной тканью. К основным УЗ критериям патологии относятся:
Альтернативные названия ГЭФ в желудочках сердца плода – «гольфный мяч», «горошина». Не всегда врач ультразвуковой диагностики сможет обнаружить изменения в полостях сердца плода, но в любом случае при обнаружении «горошины» не нужно впадать в панику. К возможным исходам ГЭФ относятся:
В редких случаях при сочетании ГЭФ с другими признаками врожденных аномалий можно ожидать, что дообследование с помощью инвазивных методов диагностики выявит хромосомные аномалии или пороки развития у ребенка.
Возможные причины
Проблемы внутриутробного развития чаще всего возникают на фоне следующих факторов:
ГЭФ в области сердца у малыша – это серьезно: при наличии факторов риска, врач назначит дополнительное обследование для исключения опасной врожденной патологии у малыша.
После выявления гиперэхогенного фокуса в сердце плода надо наблюдаться у врача и делать УЗИ по назначению доктора
ГЭФ в желудочках сердца плода: врачебная тактика
В большинстве случаев при обнаружении «гольфного мяча» в области сердца у ребенка необходимо продолжить наблюдение: контрольное УЗ исследование при беременности должен выполнять сертифицированный врач-диагност на современном 3D-аппарате. При подозрении на хромосомные аномалии у плода надо соглашаться на инвазивные методы исследования.
После рождения ребенка важно в первые дни и в течение первых лет жизни малыша регулярно проходить обследование у педиатра и кардиолога.
Обнаружение любых изменений в сердце у малыша – это существенный повод для внимательной оценки внутриутробного развития ребенка.
Общие вопросы про УЗИ во время беременности
Как часто можно делать УЗИ во время беременности и не вредно ли трехмерное исследование? Чем отличается акушерский и эмбриональный сроки беременности? Диагностика пола будущего ребенка. На вопросы про ультразвуковой скрининг беременных отвечают врачи УЗИ медицинского центра «Арт-Мед».
Теоретически это возможно, но вам крайне показана инвазивная диагностика для пренатального определения хромосомного набора плода.
На сроке 22-24 недели.
Причины маловодия разнообразны – патология плода, плаценты, различные заболевания матери. Для уточнения причины необходимо комплексное обследование. Если вод очень мало, возможно нарушение развития конечностей плода. Повторять УЗИ нужно обязательно, в сочетании с допплерометрией.
Абдоминальным датчиком можно диагностировать беременность через 3 недели после зачатия, то есть при недельной задержке менструации. Пороки развития матки нередко становятся причиной невынашивания или недонашивания беременности.
Есть подозрение на внутриутробное страдание плода (плацентарную недостаточность). Для уточнения диагноза необходимо провести допплерометрию сосудов маточно–плацентарного комплекса и сделать КТГ.
Плодное яйцо чуть меньше, чем должно быть. Но такое бывает. Для уточнения диагноза я бы рекомендовала повторить УЗИ через неделю.
Речь идет о преждевременном старении (созревании) плаценты, которое чревато развитием плацентарной недостаточности. Подробно об этом Вы можете прочитать в разделе «Медицинские публикации».
В третьем триместре беременности размер почечных лоханок плода 5 мм – это норма.
Обычно плодное яйцо можно увидеть на 3-5 день задержки очередной менструации при трансвагинальном УЗИ.
Это одно и тоже. Норма коррелирует со сроком, измеряется в 11-13 недель. Максимальное значение нормы 3 мм.
Как правило, гиперэхогенный фокус в желудочке сердца плода бывает доброкачественной находкой с хорошим прогнозом для плода. Если такая находка сделана до 21-22 недель беременности, то может быть предложено дополнительное генетическое исследование. В 28 недель беременности тактика наблюдения предлагается только консервативная, с последующим обследованием новорожденного. Рекомендую УЗИ экспертного уровня в нашем медицинском центре.
Если гиперэхогенный кишечник плода появился только в третьем триместре беременности, то, чаще всего, это бывает признаком начавшегося внутриутробного пищеварения плода, иногда – признаком гипоксии. В таких случаях надо следить за состоянием плода традиционными методами – КТГ, допплерометрия; следующее УЗИ рационально сделать ближе к родам – в 37-38 недель.
Если функция такой почки не изменена, и вторая почка имеет нормальное строение, то, как правило, никаких значительных проблем ожидать не стоит. О полноценности работы почек плода косвенным образом свидетельствует нормальное количество околоплодных вод. Требуется, прежде всего, наблюдение в динамике, обследование новорожденного у детского уролога.
Диагностическое значение имеет отсутствие носовой кости или ее резкое недоразвитие. Небольшие колебания размеров (как в Вашем случае) в большинстве случаев являются индивидуальной особенностью, могут быть связаны с этнической принадлежностью супругов. Вы можете также получить еще одно независимое мнение по этому поводу, сделав УЗИ фундаментального уровня и обсудив результаты пренатального скрининга с врачом генетиком.
Толщину воротникового пространства (шейную складку) плода в 10-14 недель принято считать нормальной до 3 мм.
Какие еще ВПР были обнаружены? В таких ситуациях желательно срочно произвести определение кариотипа плода путем кордоцентеза.
Это УЗ-исследование входит в стандартную схему пренатальной диагностики, допплерометрия необходима для исследования кровотока, если имеются для этого показания.
Вам предложили стандартную тактику наблюдения за подобными ситуациями. Если будут выявлены отклонения по результатам биохимического скрининга, то надо будет обсудить с генетиком возможности дополнительной диагностики – определения кариотипа плода путем амнио- или кодоцентеза.
Скорее всего, это вариант нормального развития мозга плода. Вы можете получить еще одно независимое мнение, сделав УЗИ экспертного уровня в медицинском центре «АРТ-МЕД».
Если визуализируется только плодное яйцо, то указывается истинный срок беременности, если же есть эмбрион (плод), то акушерский.
Чтобы определить риск для плода по хромосомной патологии и сформулировать показания к инвазивной пренатальной диагностики одного ультразвукового маркера мало. Необходима оценка целого комплекса клинической информации (возраста женщины, состояния здоровья, исхода предыдущих беременностей, данных биохимического скрининга и пр.).
Изолированные небольшие кисты почек – довольно частая ультразвуковая находка. Как правило, никакого существенного влияния на развитие ребенка такая изолирования особенность строения почки не влияет. В подобных ситуациях рекомендуется тщательная оценка строения других органов на УЗ-аппарате экспертного класса и наблюдение в динамике.
Пол ребенка полностью сформирован к 12 неделям. В 13 недель пол можно точно идентифицировать. Однако точность его определения зависит от положения плода, качества ультразвукового прибора и профессионализма врача.
Маркеры патологического течения перинатального периода у детей с гиперэхогенным внутрисердечным фокусом
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Цель исследования: выявить особенности течения перинатального периода у детей с антенатально диагностируемым гиперэхогенным внутрисердечным фокусом (ГВФ).
Материал и методы: группы исследования, которые формировали по методу «случай — контроль», были сопоставимы по возрасту, акушерскому и соматическому анамнезу матерей. Критерием включения в первую группу было наличие гиперэхогенного образования в сердце плода, по данным ультразвукового пренатального скрининга, а также наблюдение и рождение ребенка в ГБУЗ ТО «Перинатальный центр» (Тюмень). Первую группу составили 214 беременных (плодов с ГВФ, впоследствии новорожденных), вторую группу — 107 беременных (плодов без ГВФ, впоследствии новорожденных). Проведен ретроспективный анализ течения антенатального и интранатального периодов развития новорожденных с ГВФ; изучены особенности течения раннего неонатального периода, данные гистологического исследования плацент (n=69), результаты аутопсий перинатальных потерь (n=12).
Результаты исследования: установлено, что ГВФ, впервые визуализируемые после 20-й нед. гестации, сохранялись после рождения значительно чаще (р 0,05). Между тем только у детей с ГВФ диагностированы врожденные пороки развития различных органов (7,94%) и генерализованная цитомегаловирусная инфекция (1,46%). Постгипоксическую кардиопатию как отражение синдрома дезадаптации со стороны сердечно-сосудистой системы в 3,2 раза чаще регистрировали у новорожденных с ГВФ (р=0,005).
Заключение: сочетание ГВФ (размером 2,67±0,9 мм) с локализацией в левом или правом желудочке сердца плода и других мягких ультразвуковых маркеров, наличие структурных изменений центральной нервной системы и/или системы кровообращения диктуют необходимость обследования беременной на внутриутробные инфекции, а также проведения допплерографии маточных и пуповинных артерий для минимизации риска развития перинатальных катастроф.
Ключевые слова: перинатальный период, гиперэхогенный внутрисердечный фокус, новорожденные, перинатальные потери, врожденная аномалия, постгипоксическая кардиопатия, ультразвуковой маркер.
Для цитирования: Малинина Е.И., Рычкова О.А., Чернышева Т.В. Маркеры патологического течения перинатального периода у детей с гиперэхогенным внутрисердечным фокусом. РМЖ. Мать и дитя. 2020;3(2):132-135. DOI: 0.32364/2618-8430-2020-3-2-132-135.
Markers of the pathological course of perinatal period in children with echogenic intracardiac focus
1 Tyumen State Medical University, Tyumen, Russian Federation
2 Tyumen Cardiology Research Center — branch of Tomsk National Research Medical Center
of the Russian Academy of Sciences, Tyumen, Russian Federation
Aim: to describe the course of perinatal period in children with echogenic intracardiac focus (EIF) diagnosed in the antenatal period.
Patients and Methods: in this case-control study, the groups were similar in age, obstetric history, and somatic status of mothers. Group 1 included 214 pregnant women whose fetus (newborn later) was diagnosed with EIF. Inclusion criteria were an echoic focus within the fetal heart (by prenatal ultrasound) as well as pregnancy follow-up and childbirth in the Perinatal Center of Tyumen city. Group 2 included 107 pregnant women whose fetus (newborn later) had no this sonographic sign. Retrospective analysis of the course of antenatal and intranatal periods of newborns with EIF was performed. The course of early neonatal period was described. Placental histology (n = 69) and autopsies of perinatal losses (n=12) were discussed.
Results: it was demonstrated that EIFs identified for the first time after 20 weeks of gestation persist after delivery much more common (p 0.05). Only newborns with EIF were diagnosed with different types of birth defects (7.94%) and generalized cytomegalovirus infection (1.46%). Hypoxic cardiopathy (that illustrates cardiovascular deadaptation) was 3.2 times more common in newborns with EIF (p=0.005).
Conclusion: combination of EIF (2.67±0.9 mm) localized in the left or right ventricle and other sonographic signs, central nervous system defects and/or cardiovascular abnormalities require screening for perinatal infections as well as uterine and umbilical artery Doppler to minimize the risk of perinatal events.
Keywords: perinatal period, echogenic intracardiac focus, newborns, perinatal losses, congenital anomaly, hypoxic cardiopathy, sonographic sign.
For citation: Malinina E.I., Rychkova O.A., Chernysheva T.V. Markers of the pathological course of perinatal period in children with echogenic intracardiac focus. Russian Journal of Woman and Child Health. 2020;3(2):132–135. DOI: 10.32364/2618-8430-2020-3-2-132-135.
Введение
Интерес к изучению перинатального периода появился в конце 1960-х гг., когда в рутинную практику врачей разных специальностей вошло ультразвуковое исследование (УЗИ) высокого разрешения, что способствовало выявлению не только грубых аномалий развития того или иного органа, но и малых структурных изменений [1, 2]. Это послужило толчком к совершенствованию методов профилактики, диагностики и терапии различных заболеваний матери, плода и новорожденного и восприятию системы «мать — плацента — плод» как единого организма [3].
В 1990-х гг. работы патоморфологов D.J. Roberts и D. Genest по изучению участков кальцификации папиллярных мышц, или гиперэхогенных внутрисердечных фокусов (ГВФ), у плодов с аномальным кариотипом стали основанием для того, чтобы рассматривать данную ультразвуковую находку как маркер хромосомных аномалий [4–6]. Эти образования при проведении УЗИ совершали колебательные движения подобно прыжкам мяча и были названы «гольфный мяч» [7, 8]. Гипотезы формирования ГВФ неоднократно менялись (от нормального варианта эмбрионального развития клапанно-хордального аппарата до предиктора внутриутробного инфицирования плода), однако до сих пор не существует единого мнения об этом ультразвуковом феномене [9–13].
Цель работы: выявить особенности течения перинатального периода у детей с антенатально диагностируемым ГВФ.
Материал и методы
Настоящее ретроспективное исследование проведено на базе ГБУЗ ТО «Перинатальный центр» (Тюмень). Критерием включения было наличие гиперэхогенного образования в сердце плода, по данным ультразвукового пренатального скрининга. Группы исследования формировали методом «случай — контроль», при этом статистически значимых межгрупповых различий по возрасту, акушерскому и соматическому анамнезу матерей не было. Первую группу составили 214 беременных (плодов c ГВФ, впоследствии новорожденных), вторую группу — 107 беременных (плодов без ГВФ, впоследствии новорожденных). Анализировали течение перинатального периода новорожденных с ГВФ с использованием медицинской документации (ф111/у и ф096/у), результатов инструментального обследования (электрокардиографии, нейросонографии, эхокардиографии (ЭхоКГ), УЗИ органов брюшной полости), а также патоморфологического исследования 69 плацент (34 из первой группы и 35 — из второй) и перинатальных потерь (n=12). Не все плаценты подвергались патоморфологическому исследованию, но для настоящего исследования с учетом сформированных групп были отобраны заключения с учетом сходного срока гестации и анамнеза.
Результаты и обсуждение
В ходе исследования установлено, что в 11–13 нед. гестации при пренатальном ультразвуковом скрининге диагностируется 6,08% ГВФ, в 20–22 нед. — 84,11%, в 32–34 нед. — 9,81%. Нужно отметить, что все ГВФ, визуализируемые при первом ультразвуковом скрининге, локализовались в левом желудочке и были одиночными, имея средний размер 1,2±0,1 мм. В то же время локализация гиперэхогенных образований, диагностируемых во второй половине беременности, была различной, а также отмечались множественные фокусы, размер которых превышал 2 мм. Динамическое наблюдение показало, что к моменту рождения сохраняются лишь 0,46% ГВФ, регистрируемых до 14-й нед., и 24,3% ГВФ, выявляемых впервые после 20-й нед. гестации.
Антенатальное УЗИ выявило, что 1/3 пациентов с ГВФ начиная с 20-й нед. гестации имеют ультразвуковые признаки изменений в плаценте: аномальное прикрепление, кистозные изменения, увеличение/уменьшение количества околоплодных вод, снижение маточно-плацентарного кровотока в целом.
Таким образом, ГВФ визуализируется при ультразвуковом скрининговом исследовании на любом сроке гестации, чаще (до 90,19%) с 9-й по 22-ю нед. беременности. Его обнаружение было сопряжено с нарушениями маточно-плацентарного кровотока (р=0,033) и другими малыми ультразвуковыми маркерами хромосомных аномалий в 24,76% случаев (р 1 Малинина Елена Игоревна — к.м.н., доцент кафедры детских болезней лечебного факультета с курсом иммунологии и аллергологии, ORCID iD 0000-0001-9987-4899;
1 Рычкова Ольга Александровна — д.м.н., доцент, заведующая кафедрой детских болезней лечебного факультета с курсом иммунологии и аллергологии, ORCID iD 0000-0002-2566-5370;
2 Чернышева Татьяна Викторовна — к.м.н., доцент, заведующая детским отделением, ORCID iD 0000-0003-0137-3282.
1 ФГБОУ ВО Тюменский ГМУ Минздрава России. 625024, Россия, г. Тюмень, ул. Одесская, д. 54.
2 Тюменский кардиологический научный центр — филиал Томского НИМЦ. 625026, Россия, г. Тюмень, ул. Мельникайте, д. 111.
Контактная информация: Малинина Елена Игоревна, e-mail: malininaele@mail.ru. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах и методах. Конфликт интересов отсутствует. Статья поступила 31.07.2019.
1 Elena I. Malinina — MD, PhD, associate professor of the Department of Childhood Diseases the Course of Immunology & Allergy of Medical Faculty, ORCID iD 0000-0001-9987-4899;
1 Olga A. Rychkova — MD, PhD, Associate Professor, Head of the Department of Childhood Diseases the Course of Immunology & Allergy of Medical Faculty, ORCID iD 0000-0002-2566-5370;
2 Tat’yana V. Chernysheva — MD, PhD, Associate Professor, Head of Children Department, ORCID iD 0000-0003-0137-3282.
1 Tyumen State Medical University. 54, Odesskaya str., Tyumen, 625024, Russian Federation.
2 Tyumen Cardiology Research Center— branch of Tomsk National Research Medical Center of the Russian Academy of Sciences. 111, Melnikaite str., Tyumen, 625026, Russian
Federation.
Contact information: Elena I. Malinina, e-mail: malininaele@mail.ru. Financial Disclosure: no authors have a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 31.07.2019.
Только для зарегистрированных пользователей
Патологии сердца плода, которые можно определить на скрининговом УЗИ
» data-image-caption=»» data-medium-file=»https://i0.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2018/05/patologii-serdtsa-ploda.jpg?fit=450%2C300&ssl=1″ data-large-file=»https://i0.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2018/05/patologii-serdtsa-ploda.jpg?fit=807%2C537&ssl=1″ />
Основные пороки сердца у плода формируются в 1 триместре беременности на сроке 12-14 недель. Это может быть реакция на внешние факторы либо генетические проблемы. К этому сроку происходит формирование сердечной мышцы плода, поэтому будущей матери необходимо пройти УЗИ обследование на выявление патологий органа.
патологии сердца плода
» data-image-caption=»» data-medium-file=»https://i0.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2018/05/patologii-serdtsa-ploda.jpg?fit=450%2C300&ssl=1″ data-large-file=»https://i0.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2018/05/patologii-serdtsa-ploda.jpg?fit=807%2C537&ssl=1″ loading=»lazy» src=»https://i0.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2018/05/patologii-serdtsa-ploda.jpg?resize=807%2C537″ alt=»патологии сердца плода» width=»807″ height=»537″ srcset=»https://i0.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2018/05/patologii-serdtsa-ploda.jpg?w=807&ssl=1 807w, https://i0.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2018/05/patologii-serdtsa-ploda.jpg?resize=450%2C300&ssl=1 450w, https://i0.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2018/05/patologii-serdtsa-ploda.jpg?resize=768%2C511&ssl=1 768w» sizes=»(max-width: 807px) 100vw, 807px» data-recalc-dims=»1″ />
Во внутриутробном развитии пороки сердца возникают как реакция организма на нарушение плацентарного кровообращения либо воздействие канцерогенных веществ (формальдегиды, никотин, токсические вещества).
Аномалии положения сердца плода
Среди аномалий расположения сердца выделяют эктопию сердца (размещение вне грудной клетки). К таким патологиям относят декстрокардию (смещение сердца в правую сторону относительно нормального положения) и мезокардию (расположение сердца не с левой стороны грудины, а по срединной линии тела).
Эктопия сердца у плода возникает на сроке 14-18 дней с момента зачатия мезадерма начинает развиваться неправильно, что вызывает неправильное срастание брюшной стенки. У плода либо отсутствует диафрагма вообще, либо нет диафрагмального сегмента перикарда.
Из-за отверстия в стенке между правым и левым желудочком слышны интракардиальные шумы. Также у плода эктопия сердца нередко сопровождается другими аномалиями — гидроцефалией, энцефалоцеле и пр.
Надо сказать, что существует высокая вероятность ошибочного диагноза по установки положения сердца. При тазовом предлежании плода на УЗИ сердца визуализируется справа, хотя на самом деле оно располагается в положенном месте.
В 71% случаев эктопия сердца вызывается плевральным выпотом, кистозным аденоматозным пороком развития лёгкого, диафрагмальной грыжей.
Различают четыре вида эктопии:
Грудная эктопия встречается в 55-60% случаев, торакоабдоминальная — в 38%, шейная — почти в 3%. Выживаемость составляет около 10%. В большинстве случаев при эктопии младенец либо рождается мёртвым, либо умирает сразу после рождения.
Патология сопровождается смещением других внутренних органов, которые не защищены от механических повреждений и подвержены инфекциям и вирусам больше обычного.
Врождённые дефекты сердца
Пять наиболее встречаемых дефектов — это тетрада Фалло, дефект межжелудочковой перегородки, транспозиция магистральных сосудов, коарктация аорты, гипоплазия левых камер.
Оптимальным сроком для проведения ультразвуковой диагностики сердца плода считается период 24-26 недель беременности. Именно в это время анатомические структуры сердца максимально визуализируются, а на более ранних сроках можно увидеть только явные и глобальные пороки сердца.
Наиболее информативен ультразвуковой осмотр 4-камерного среза сердца. После которого при любом отклонении от нормы женщина отправляется на более детальное обследование плода с использованием допплеровской эхокардиографии. Также проводится кариотипирование, потому что в 30% случаев аномалии являются результатом хромосомных нарушений.
Что выявляет УЗИ
В нашей клинике используется современное 4D оборудование, имеющее допплеровский режим. С его помощью можно получить изображение 3-х главных сосудов — верхней полой вены, лёгочного ствола и восходящей аорты. Во время обследования выявляется не только расположение сосудов, но и их диаметр и другие параметры.
На экране монитора будут видны следующие патологии плода:
Какие патологии сердца у плода сложно выявить на скрининговом УЗИ
Трудности в диагностике заболеваний сердца на УЗИ вызывают следующие патологии органа:
При подозрении на их наличие, пациентка должна регулярно наблюдаться и соблюдать все рекомендации гинеколога.