Гомогенный сигнал что это
Расшифровка МРТ головного мозга
Результаты МРТ головного мозга – это серия снимков в нескольких плоскостях, представляющих собой послойные виртуальные срезы толщиной в пару миллиметров, сделанные через исследуемую область. Полная и точная интерпретация снимков магнитно-резонансной томографии – работа врача-рентгенолога, имеющего специализацию в соответствующей области. Задача данного материала – знакомство с основными принципами расшифровки результатов МРТ головного мозга, но не обучение данному процессу.
Как выглядит снимок МРТ головного мозга
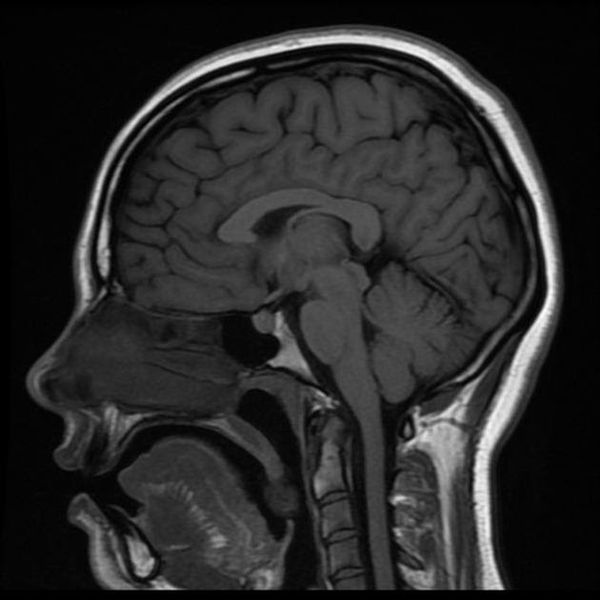
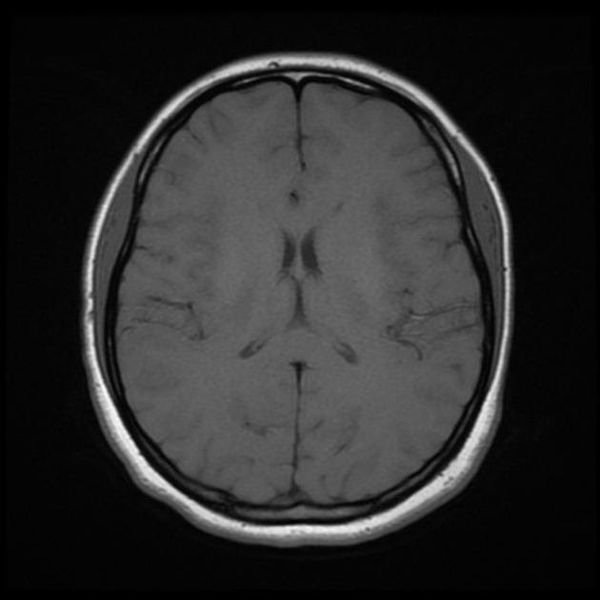
Классический пример МРТ снимков головного мозга показан на рисунках ниже. Магнитно-резонансная томография выполняется в поперечной (или аксиальной – рисунок снизу) и продольной (или сагиттальной — рисунок сверху) плоскостях.
Исследование выполняется в нескольких режимах. Основные из них Т1 и Т2. Изображения, полученные в данных режимах, часто также называют Т1-взвешенными или Т2-взвешенными снимками. Изображения, показанные выше, сделаны в Т1-режиме.
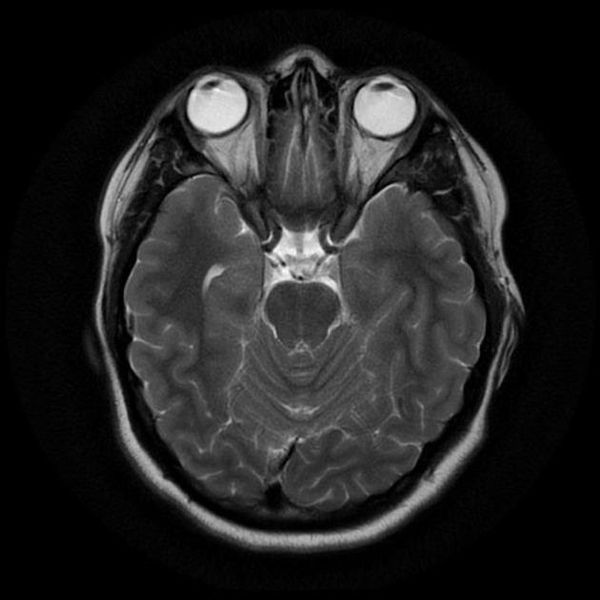
Главное отличие этих режимов – в том, как на снимках отображается жидкость и воздух. В Т1 режиме ткани, содержащие большое количество воды, имеют более темную окраску, в то время как в Т2 режиме они яркие, светлые. Это легко понять, посмотрев на снимки выше – глазные яблоки визуализируются в виде светлых парных округлых образований с одной стороны яркие и светлые, с другой – темные. Следовательно, снимок справа сделан в Т1 режиме, снимок слева – в Т2. Также существует разница в том, как в этих режимах отображается серое вещество головного мозга. В Т2 режиме оно светлее, чем белое вещество.
На самом деле режимов намного больше – FLAIR, DWI, STIR и так далее. Какой-то режим используется для подавления сигнала от богатых жиром тканей, какой-то – для изучения плотности распределения протонов в тканях, третий – для оценки броуновского движения молекул воды. Вот почему полный курс МРТ-диагностики для врачей длится не один месяц.
Норма и отклонения на МРТ головного мозга
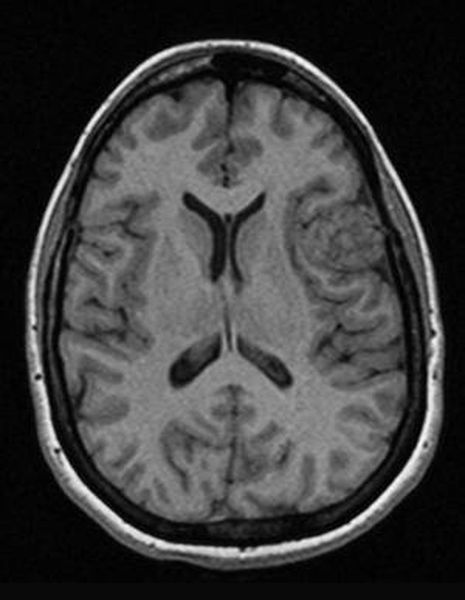
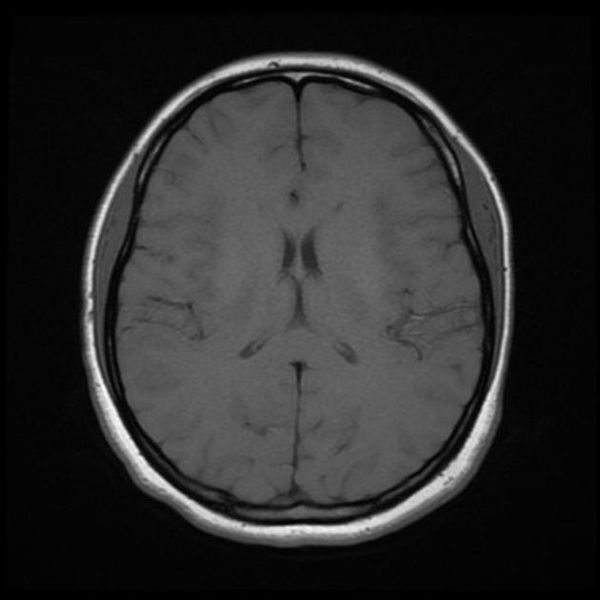
Как же узнать, есть ли на снимках признаки болезни? Самое главное – запомнить, как выглядит головной мозг здорового человека. Врач, изучая снимки пациентов, постоянно сравнивает их с нормальными снимками, хранящимися у него в голове. Чтобы понять, как это происходит – посмотрите на снимки внизу:
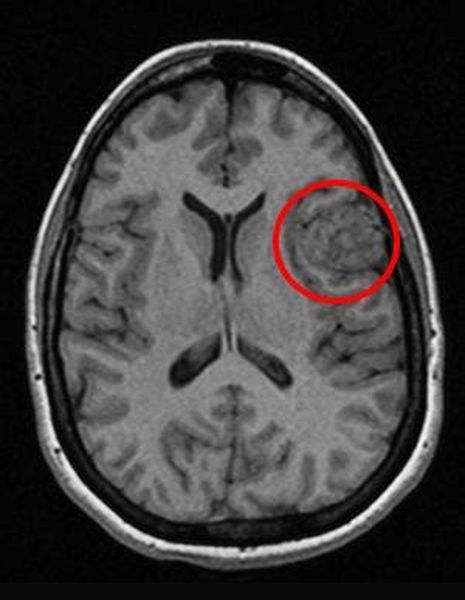
Перед вами – два снимка, сделанных в одном режиме. Снимок снизу – норма. Какое заболевание, в таком случае, есть на верхнем снимке? Чтобы понять это, нужно сравнить эти изображения. Явно видно отличие – на верхнем снимке в правой части головного мозга есть новообразование. Разница еще заметнее, если сравнить левую и правую части того же снимка.
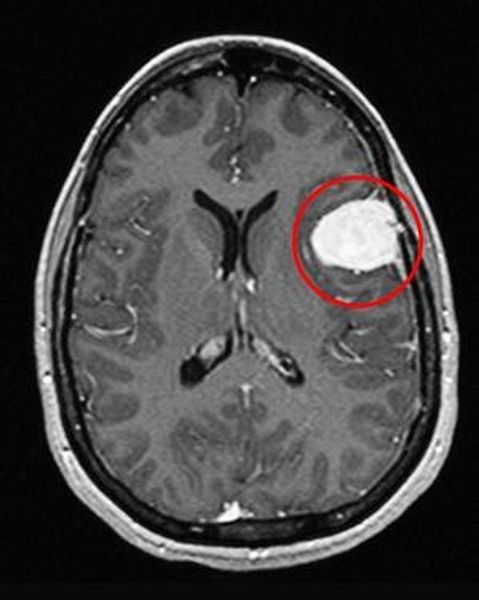
Отметим его красной окружностью. Визуально оно представляет собой узел, неоднородный по окраске и отличающийся от серого и белого вещества головного мозга. В таких случаях, чтобы точно определить границы опухоли и определить её тип исследование повторяют с контрастом. Введение контрастного препарата в кровь через локтевую вену приводит к накоплению контрастного вещества в тканях опухоли – нормальные здоровые ткани его практически не накапливают. И мы получаем следующую картину, показанную на рисунке справа. Яркая окраска опухоли соответствует накопленному контрасту – теперь можно не только сказать, где опухоль, но и примерно определить, что это доброкачественная опухоль, так как она имеет четкие границы (злокачественные опухоли прорастают окружающие ткани, из-за чего границы будут размытыми и не такими четкими).
Таким образом расшифровка результатов МРТ головного мозга проводится путем сравнения полученных снимков с нормой. При отсутствии отличий можно говорить о том, что пациент, чьи снимки исследует врач, скорее всего здоров. Сравнивается все – форма, размеры анатомических структур, локализация, симметричность, количество спинномозговой жидкости в полостях головного мозга, и множество других параметров. Каждое заболевание, будь то инсульт или рассеянный склероз, имеет свои характерные признаки.
Как читать результаты МРТ головного мозга
Теперь попробуем прочитать заключение МРТ головного мозга с расшифровкой снимков на следующем примере:
В заключение выносят только патологические изменения – в данном случае это очаги ишемии, атрофия лобно-височных областей, киста гайморовой пазухи. В целом картина соответствует возрасту пациента – 65 лет. МРТ-признаки сосудистой энцефалопатии – окончательный диагноз будет определен лечащим врачом. Обратите внимание – в норме на снимках отсутствуют изменения, очаговые или диффузные (распространенные равномерно), кисты, опухоли, новообразования, участки патологической гипер или гипоинтенсивности сигнала. Анатомические образования имеют четкие ровные контуры, не смещены, симметричны. Сосуды симметричны, без признаков сужения просвета, с нормальным ходом и калибром, интралюминарный сигнал (фактически кровь в сосуде) гомогенный, что говорит об отсутствии тромбов в просвете артерии или вены.
Подобным путем проводится расшифровка и описание снимков в любой клинике. Однако точность сделанного заключения зависит от квалификации врача МРТ-диагностики.
Магнитно-резонансная томография (МРТ) в Санкт-Петербурге
Запишитесь на МРТ по телефону (812) 493-39-22 или заполните форму
Расписание приема МРТ:
ЦМРТ «Нарвский»
(812) 493-39-22
в четверг прием с 8-00 до 23-00
и воскресенье прием с 8-00 до 23-00
ул. Ивана Черных,29
МРТ аппарат 1,5 Тл
суббота :
ЦМРТ «Старая деревня»
(812) 493-39-22
прием 8-00 до 23-00
ул. Дибуновская,45
МРТ аппарат 1,5 Тл
Прием в “РНХИ им. проф. А.Л. Поленова” прекращен по техническим причинам и
перенесен в ЦМРТ
Опухолевое поражение поясничного отдела позвоночника на МРТ
Как любом отделе позвоночника опухоли могут быть экстрадуральными, интрадуральными экстра- и интрамедуллярными. МРТ СПб позволяет выбирать место выполнения МРТ поясничного отдела позвоночника, мы рекомендуем Вам обследоваться у нас. Поясничный отдел позвоночника имеет некоторую специфику. Именно с ее учетом мы проводим МРТ в СПб в наших центрах.
Среди экстрадуральных опухолей на первом месте стоит метастатическое поражение. Стандартный протокол МРТ исследования позвоночника при подозрении на метастатическое поражение состоит из Т1-зависимых сагиттальных МРТ и Т2-зависимых МРТ с подавлением сигнала от жира. Литические метастазы замещая костный мозг выглядят гипоинтенсивными на Т1-зависимых МРТ позвоночника. На Т2-зависимых МРТ позвоночника они могут быть гипоинтенсивными, изоинтенсивными, если они склеротические, либо яркими, если они литические, особенно при подавлении сигнала от жира. Метастаз может диффузно поражать костный мозг позвонка или быть очаговым. На самой ранней стадии диффузного поражения при МРТ позвоночника заметно исчезновение сигнала от вертебробазилярной вены, процесс захватывает ножки дуг и задние структуры позвонка. Распространение на мягкие ткани вдоль позвоночника лучше видно на Т1-зависимых корональных МРТ, а сдавление спинного мозга на сагиттальных МРТ позвоночника. На последнем этапе желательны контрастированные Т1-зависимые МРТ в сагиттальной и поперечной плоскостях. Чуствительность МРТ позвоночника превышает 90%, что заметно превосходит радионуклидную диагностику. В плане отличия метастазов и доброкачественных заболеваний МРТ позвоночника не абсолютно надежна. Дифференциальная диагностика с гематологической патологией – плазмоцитомой, лимфомой и лейкозами практически невозможна и требует аспирационной биопсии. Реакцией костного мозга на МРТ позвоночника, напоминающей метастатическое поражение, сопровождаются доброкачественные переломы. Однако МРТ сигнал выраженно неоднородный, задние структуры и костный мозг в заднем отделе тела позвонка остаются интактными. Более надёжным в плане дифференциальной диагностики является использование диффузионное-взвешенных МРТ позвоночника. При доброкачественном переломе через 1 – 3 месяца сигнал возвращается к норме.
Метастазы в позвонки. Т2-зависимая МРТ.
Первичные опухоли позвонков встречаются гораздо реже метастатических.
Остеосаркома – злокачественная опухоль, составляет 20% от всех сарком и около половины всех костных опухолей. Позвоночник поражается очень редко. При МРТ образование гипоинтенсивное на Т1- и смешанное на Т2-зависимых томограммах, контрастирование хорошее.
Остеосаркома крестца. Сагиттальная Т1-зависимая МРТ с контрастированием.
Остеохондрома – доброкачественная опухоль, составляет 8-9% от всех костных опухолей и треть от доброкачественных костных опухолей. Позвоночник поражается в 1-4% случаев остеохондромы. Опухоль позвоночника локализуется в остистых и поперечных отростках. При МРТ сигнал смешанный на Т1- и Т2-зависимых МРТ.
Фибросаркома – редкая злокачественная опухоль. Встречается в возрасте от 30 до 60 лет, без половой предрасположенности. Позвоночник поражает исключительно редко. При МРТ отличается обширной костной деструкцией и параспинальным компонентом.
Фибросаркома крестца. Т1-зависимая МРТ.
Хордома – доброкачественная опухоль из остатков нотохорды. Может располагаться по средней линии в любом месте от ската до копчика. При МРТ сигнал от опухоли неоднородный, рост её инвазивный, опухоль чаще контрастируется, но встречаются случаи неконтрастирующейся хордомы.
Хордома крестца. Сагиттальные Т1- и Т2-зависимые МРТ.
Множественная миелома (плазмоцитома, миеломная болезнь) – доброкачественная опухоль из плазматических клеток костного мозга. Критериями диагностики плазмоцитомы служат выявление в аспирате костного мозга не менее 10-15% плазматических клеток плюс очаги, выявляемые лучевыми методами, плюс моноклональные иммуноглобулины в моче (белки Бенс-Джонса и т.п.) и крови. Выживаемость при плазмоцитоме без лечения составляет до одного года, при лечении – 2-3 года. При МРТ признаки неспецифические – очаги высокого сигнала на Т2-зависимых и низкого на Т1-зависимых МРТ, контрастирование очагов хорошее.
Множественная миелома. Сагиттальная Т1-зависимая МРТ после контрастирования.
Эозинофильная гранулёма (гистиоцитоз X) – представляет собой один из доброкачественных вариантов гистиоцитоза из клеток Лангерганса. Встречается в возрасте от 2 до 30 лет, пик частоты приходится на возраст 5-10 лет. Соотношение полов М:Ж как 3:2. Опухоль типично локализуется в черепе, нижней челюсти, рёбрах, длинных трубчатых костях, костях таза, реже в позвонках. Обычно наблюдается самостоятельный регресс заболевания в течение 2 лет. Встречается компрессионный перелом тела позвонка. В стадии заживления вокруг очага может быть склероз. При МРТ признаки неспецифические – очаг гиперинтенсивный на Т2-зависимых МРТ и гипоинтенсивный на Т1-зависимых МРТ, контрастирование хорошее.
Интрадуральные экстрамедуллярные опухоли расположены в дуральном мешке внутри позвоночного канал, но за пределами спинного мозга. Такие опухоли обычно происходят из корешка конского хвоста (невриномы и нейрофибромы) или дурального мешка (менингиомы).
На МРТ Т1-зависимого типа и невриномы, и нейрофибромы изо- или слегка гипоинтенсивны по отношению к спинному мозгу. Однако, встречаются случаи и повышенного сигнала за счет сокращения Т1 мукополисахаридами, связанными с водой. Протонная плотность повышена, а на Т2-зависимых МРТ они чаще неоднородные, могут быть очень яркие участки, где имеется высокое содержание воды, и сравнительно низкого сигнала, особенно в центре. Обе опухоли хорошо контрастируются. По форме невриномы округлые, границы ровные, четкие. При МРТ видно, что нейрофибромы вытянуты вдоль корешка. Размеры могут быть самыми различными.
Нейрофиброма. Сагиттальная Т1-зависимая МРТ с контрастированием.
Менингиомы составляют до экстрадуральных 40% опухолей, но только 3% – в поясничном отделе. Обычно менингиомы диагностируются в возрасте около 40-50 лет. Редко спинальные менингиомы встречаются у детей (3-6% от всех случаев менингиом) как проявление нейрофиброматоза II типа. При этом заболевании менингиомы могут быть множественные, что составляет около 2% от случаев менингиом. Происходят менингиомы из паутинной оболочки. Они инкапсулированы, имеют широкое основание, хорошо васкуляризированы, часто содержат кальцинаты и редко подвергаются кистозной дегенерации. У женщин встречаются в 4 раза чаще, чем у мужчин. Растут они очень медленно.
Менингиома. Т1-зависимая МРТ с контрастированием.
Интрадуральные экстрамедуллярные метастазы (дроп-метастазы, лептоменингеальный карциноматоз) происходят они из злокачественных опухолей ЦНС и распространяются вдоль мягкой мозговой оболочки с током ликвора. Чаще они наблюдаются в детском возрасте. Отдаленные лептоменингеальные метастазы из раковых узлов, меланом и лимфом, занесенные через кровоток или по лимфатическим путям, встречаются исключительно редко. Характерная локализация лептоменингеальных метастазов в поясничном отделе.
Иногда на Т1-зависимых МРТ удается увидеть узлы изоинтенсивные корешкам конского хвоста. На Т2-зависимых МРТ они часто сливаются с ликвором. Поэтому если у больного опухоль, известная частым метастазированием, надо обязательно выполнять МРТ с контрастированием. Вместе с тем, отсутствие метастазов по результатам МРТ должно быть дополнительно подтверждено многократным цитологическим анализом ликвора.
Эпендимомы экстрамедуллярной локализации растут из конуса и конечной нити. По гистологии относятся к миксопапиллярному типу. Составляют около 13% от всех спинальных эпендимом. Диагностируются в возрасте около 40 лет и чуть чаще у мужчин. Хотя относятся к градации 1, встречается диссеминация с током ликвора.
Миксопапиллярная эпендимома. Сагиттальная Т1-зависимаяМРТ после контрастирования.
Ганглионеврома (параганглиома) происходит из клеток автономной нервной системы. Частота составляет 1 случай на 100 тыс. населения. Это особый тип опухолей, который может локализоваться в любом месте, где есть подобные клетки. Спинальная ганглиневрома обычно имеет экстрадуральный тип роста, но изредка встречается и интрадуральный. Проявляется в возрасте 40 – 50 лет. Чуть чаще наблюдается у мужчин.
На Т1-зависимых МРТ опухоль изоинтенсивна спинному мозгу. На Т2-зависимых МРТ она гиперинтенсивна, причем может быть видна фиброзная капсула. Контрастное усиление при МРТ хорошее, но неравномерное. Так как интрадуральная параганглиома локализуется в области конского хвоста и конечной нити отличить ее от эпендимомы по МРТ признакам невозможно.
Ганглионеврома конского хвоста. Сагиттальная Т1-зависимая МРТ после контрастирования.
Интрамедуллярные опухоли располагаются непосредственно в спинном мозге. Поскольку спинной мозг обычно заканчивается на уровне первого поясничного позвонка, опухоли происходят из конского хвоста.
Эпендимома у взрослых локализуется в области конского хвоста и конечной нити, эти эпендимомы относятся к миксопапиллярному подтипу. Эпендимомы растут медленно по длиннику спинного мозга, вызывая со временем эрозию ножек и задних отрезков тел позвонков.
Также как и астроцитома, эпендимома гипоинтенсивна на Т1-зависимых МРТ и гиперинтенсивна на Т2-зависимых МРТ. После контрастирования на МРТ за счет капсулы виден как четко очерченный однородный узел.
МРТ в диагностике болезни Хираяма
Целью исследования было изучение возможности магнитно-резонансной томографии (МРТ) в диагностике болезни Хираяма на высокопольном томографе.
Материалы и методы: Методом магнитно-резонансной томографии с напряженностью поля 3 Тесла были обследованы 6 пациентов с клинической картиной болезни Хираяма. Выполнялось стандартное исследование шейного отдела позвоночника в нейтральной позиции, функциональные пробы со сгибанием, дообследование с внутривенным контрастированием, МР-трактография.
Результаты: Был выявлен набор характерных МР-признаков, коррелирующий с клинической картиной и данными электромиографии: локальная атрофия спинного мозга в шейном отделе на уровне С5-С7, аномальное искривление спинного мозга, его уплощение, нарушение фиксации дорсального дурального мешка и подлежащей пластинки в нейтральной позиции, переднее смещение заднего листка твердой мозговой оболочки при сгибании и расширение заднего эпидурального пространства, контрастное усиление эпидурального компонента. Также МР-исследования были дополнены диффузионно-тензорной последовательностью с определением хода и структуры проводящих путей спинного мозга.
Заключение: Функциональное МР-исследование шейного отдела позвоночника со сгибанием должно быть неотъемлемой частью диагностического протокола при подозрении на болезнь Хираяма.
Введение
Болезнь Хираяма также известна как непрогрессирующая ювенильная спинальная мышечная атрофия дистальных отделов верхних конечностей. Она представляет собой разновидность цервикальной миелопатии, обусловленной срывом механизмов нормальной биомеханики в шейном отделе позвоночника при сгибании. Болезнь Хираяма считается доброкачественной нозологией из группы заболеваний мотонейрона со стабилизацией процесса после периода первичного прогрессирования. В основе ее патогенеза лежат микроциркуляторные изменения в бассейне передней спинальной артерии, причиной которых являются повторяющиеся сгибательные движения или длительный постоянный наклон шеи. Гипоксия приводит к ишемии и некрозу передних рогов спинного мозга нижнешейного отдела позвоночника. Данные изменения являются отличительной чертой данной патологии [1,2].
Обычно заболевание возникает у молодых людей в возрасте 15-25 лет с доминантным поражением мужчин. Заболевание начинается и прогрессирует постепенно с преимущественной односторонней слабостью в верхней конечности и атрофией, периферическими вялыми парезами без вовлечения сенсорных и пирамидных трактов. Болезнь Хираяма также сопровождается мышечной слабостью и атрофией в руке и предплечье с сохранением плечелучевой мышцы. Из-за этого возникает характерная картина атрофии, поражающей миотомы С7, С8, Th1 [1]. Амиотрофия наиболее часто возникает в одной конечности, асимметричное билатеральное поражение возникает реже, еще реже можно наблюдать двустороннее вовлечение верхних конечностей.
В литературе описан спектр основных МР-изменений при болезни Хираяма. Настоящее исследование демонстрирует типичные признаки заболевания в нейтральной позиции и при сгибании шейного отдела позвоночника на томографе с напряженностью поля 3 Тесла, а также изменения в проводящих трактах спинного мозга.
Материалы и методы
Исследование проведено на базе ФГБУ «Центральная клиническая больница с поликлиникой» УДП РФ у 6 пациентов с клинической картиной болезни Хираяма.
Средний возраст обследованных составил 20 лет. Все заболевшие были мужского пола. Продолжительность болезни от начала заболевания до установки диагноза составила 2,5года. Основными клиническими проявлениями патологии в исследованной группе были хроническая слабость и атрофия в дистальных отделах рук разной степени выраженности у всех пациентов, а также непостоянный грубый тремор в пальцах кисти у 2 человек. Отсутствовали патологические рефлексы и неврологические симптомы со стороны сенсорного звена. Также для всех пациентов было характерно отсутствие клинических симптомов поражения черепных нервов, мозжечка, пирамидных трактов нижних конечностей, сфинктеров. Результаты электромиографии при этом свидетельствовали о формировании хронической денервации в мышцах и отсутствие объективного нарушения чувствительности.
Исследование проводилось на МР-томографе SIGNA HDxt (GE, Milwaukee, WI, USA) напряженностью поля 3 Тесла. МРТ в нейтральной позиции включало стандартное исследование шейного отдела позвоночника на 6-канальной спинальной катушке с использованием сагиттальных Т2 и Т1 взвешенных изображений в режиме быстрого спин- эха, в том числе с жироподавлением, фронтальной Т2 взвешенной последовательности и аксиальной Т2 последовательности в режиме градиентного эха (2D MERGE). Протокол функциональной МРТ со сгибанием в шейном отделе позвоночника состоял из Т2 взвешенной спин-эхо последовательности в сагиттальной плоскости и аксиальной Т2 последовательности в режиме градиентного эха (2D MERGE). Для максимального сгибания использовалась подушка для позиционирования, которая укладывалась под голову (рисунок 1). Для исследований с внутривенным контрастированием выбирали стандартную Т1 последовательность в режиме спин-эхо. Толщина среза сагиттальных изображений составляла 3мм, аксиальных – 2мм.
Рисунок 1. Укладка пациента для выполнения МРТ шейного отдела позвоночника в положении гиперфлексии. Для максимального сгибания в шейном отделе под голову уложена подушка для позиционирования треугольной формы.
Результаты
На МР-томограммах у всех пациентов отмечалась атрофия спинного мозга с уменьшением его толщины на уровне С5-С7, выпрямление шейного лордоза, с кифотической деформацией разной степени выраженности. Уплощение спинного мозга на сагиттальных томограммах в нейтральной позиции наблюдалось у всех пациентов, при этом у 4 пациентов обнаруживалась грушевидная форма спинного мозга на аксиальных изображениях за счет преимущественного поражения левой или правой стороны, у 2 пациентов поражение было симметричным. Нарушение прикрепления дурального мешка и подлежащей пластинки к костным элементам выявлено у всех пациентов. Интрамедуллярное изменение МР-сигнала отмечалось у 3 пациентов по данным стандартной МРТ, еще у одного пациента структурные изменения МР-сигнала в спинном мозге удалось верифицировать только по данным МР-трактографии (рисунки 2 и 3).
Рисунок 2. Представлены МР-томограммы в сагиттальной плоскости в нейтральной позиции и в положении максимального сгибания (Т2 взвешенное изображение) пациента А с болезнью Хираяма. Отмечается истончение спинного мозга на уровне С5-С7, изменение анатомического контура и миелопатия (фиолетовая стрелка), нарушение статики в шейном отделе позвоночника. Обращает на себя внимание нормальное положение задней стенки дурального мешка и твердой мозговой оболочки в нейтральной позиции и их передняя миграция при сгибании шеи (красная стрелка). Заднее эпидуральное пространство при сгибании резко увеличено и выглядит в виде гиперинтенсивного «полумесяца», с наличием множественных артефактов потока (синие стрелки).
МРТ со сгибанием шейного отдела (МРТ с функциональными пробами) визуализировало переднюю миграцию дурального мешка у всех пациентов. В задних отделах позвоночного канала на уровне С5-С7 у всех обследованных определялся эпидуральный компонент серповидной формы, изоинтенсивный спинному мозгу на Т1 и гиперинтенсивный на Т2 взвешенных изображениях – расширенное венозное сплетение. У 3 пациентов наблюдалось распространение изменений на грудной отдел позвоночника. После внутривенного контрастирования отмечалось интенсивное гомогенное контрастное усиление заднего эпидурального пространства (рисунки 2 и 3).
Рисунок 3. МР-томограммы в сагиттальной плоскости в нейтральном положении и условиях максимального сгибания пациента Б с болезнью Хираяма. Отмечается истончение и неоднородная структура спинного мозга на уровне С5-С6 (фиолетовая стрелка). При выполнении функциональной пробы со сгибанием шеи отмечается переднее смещение дорсальной твердой мозговой оболочки на уровне С4-Th2 (красная стрелка). При этом визуализируется расширенное заднее эпидуральное венозное сплетение с гетерогенным сигналом на Т2 взвешенных изображениях (синие стрелки).
Магнитно-резонансная трактография была выполнена у всех пациентов. В 5 случаях ее результаты совпадали с данными стандартного МРТ исследования. В 3 случаях отмечалось локальное уменьшение фракционной анизотропии спинного мозга, что соответствовало зоне миелопатии по Т2 взвешенным изображениями. В 1 случае отмечалась нормальная структура проводящих трактов, что совпадало с нормальными сигнальными характеристиками от спинного мозга на Т2 и Т1 импульсных последовательностях. В 1 случае удалось выявить уменьшение фракционной анизотропии в зоне компримированного спинного мозга, без четких признаков миелопатии на Т2 взвешенных изображениях (рисунок 4).
Рисунок 4. МР-трактография спинного мозга шейного отдела позвоночника. Отмечается уменьшение фракционной анизотропии в правых отделах спинного мозга на уровне С5-С6 (красная стрелка), что позволяет сделать вывод о наличии дефицита трактов белого вещества и структурных изменениях проводящих путей на этом уровне. На другом уровне (нижнее левое изображение) показатели фракционной анизотропии в пределах нормы.
Обсуждение
Ювенильная дистальная амиотрофия верхней конечности (болезнь Хираяма) – редкое заболевание, названное в честь K. Hirayama, впервые описавшего в 1959 году 12 пациентов с амиотрофией, отличавшейся от бокового амиотрофического склероза и прогрессирующих спинальных амиотрофий. Распространенность составляет примерно 0,5:100000. Наиболее часто встречается в странах Азии (Япония, Китай, Индия), хотя возможна у людей любой этнической принадлежности. Болезнь Хираяма чаще встречается у мужчин, соотношение мужчины/женщины в среднем составляет 7/1. Дебют заболевания приходится на возраст 15-25 лет. Большинство случаев – спорадические, в литературе имеется лишь несколько описаний семейных прецедентов.
Патогенез болезни Хираяма окончательно не установлен, рассматриваются теории о миелопатии, обусловленной нарушениями микроциркуляции при сгибании шеи, и о редкой форме болезни мотонейрона. Kikuchi et al. считает, что в основе болезни лежит несбалансированный рост, приводящий к диспропорции длины костной части позвоночного столба и содержимого позвоночного канала, и в результате этого происходит формирование «ригидного» дурального мешка [3]. В норме твердая мозговая оболочка спинного мозга прикрепляется к позвоночному каналу только в 2 местах: в области большого затылочного отверстия/позвонков С2-С3 краниально и на уровне нижних крестцовых позвонков/копчика каудально. Таким образом дуральный мешок оказывается свободно подвешен в позвоночном канале почти на всем протяжении. Фиксация также осуществляется по ходу корешков спинномозговых нервов с помощью зубчатых связок (lig.denticulatum). Эти связки (20—21 пара) являются производными паутинной оболочки и представляют собой тонкие коллагенозные тяжи, которые находятся между рядами передних и задних корешков спинномозговых нервов и соединяют спинной мозг с твердой мозговой оболочкой (рисунок 5). Они начинаются от твердой оболочки выше выхода I шейного нерва и заканчиваются на уровне XII грудного или I поясничного нерва, разделяя субарахноидальное пространство на передний и задний отделы. Функциональное значение зубчатых связок заключается в амортизации спинного мозга в позвоночном канале при движениях, также они участвуют в циркуляции спинномозговой жидкости. В них находятся преганглионарные симпатические волокна и чувствительные униполярные клетки.
Рисунок 5. На МРТ шейного отдела позвоночника в аксиальной плоскости в режиме 3D T2 TSE с толщиной среза 1мм на середине боковых поверхностей спинного мозга визуализируется зубчатая связка слева (показана белой стрелкой), расположенная между корешками спинномозговых нервов, а также вентральный и дорсальный корешки спинномозгового нерва С5 справа (красные стрелки).
У здоровых субъектов дуральная оболочка податливая, эластичная, содержит несколько поперечных складок, которые компенсируют возрастающую длину позвоночного канала при сгибании. В отличие от этого, при болезни Хираяма наблюдается более короткая и поэтому ригидная твердая мозговая оболочка. Она не может компенсировать увеличения длины позвоночного канала, особенно выраженного при сгибании, тем самым смещаясь кпереди с компрессией спинного мозга [3]. Toma и Shiozawa предположили, что относительное диспропорциональное укорочение дурального мешка особенно выражено в пубертатном периоде, когда происходит резкое ускорение роста [4].
Повторяющееся сгибание шеи приводит к сдавлению спинного мозга в зоне максимального кифоза (чаще в нижнешейном отделе), с нарушением микроциркуляции в бассейне передней спинальной артерии. В ответ на это происходит атрофия передних рогов спинного мозга, так как они наиболее чувствительны к гипоксии. Белое вещество спинного мозга страдает в меньшей степени [2]. Установлено, что для болезни Хираяма характерно асимметричное истончение спинного мозга. Shinomiya и др. предположил, что вероятным фактором могут быть особенности строения связок заднего эпидурального пространства [5]. Он выделил тонкие и толстые группы связок между твердой мозговой оболочкой и желтыми связками, которые противостоят сепарации дуального мешка от позвоночного канала. Несимметричное распределение этих связок относительно срединной линии может быть одной из причин асимметричного поражения спинного мозга при болезни Хираяма.
Клинически болезнь Хираяма характеризуется постепенным развитием мышечной слабости и атрофией в области кисти и нижней трети предплечья (миотомы С7-Th1). Плечелучевая мышца остается сохранной, что формирует картину «косой» границы амиотрофии. Как правило, наблюдается одностороннее поражение, иногда – асимметричное, редко- симметричное. Отмечается нарастание мышечной слабости при воздействии низких температур (холодовой парез), гипергидроз, полимиоклонус в пальцах пораженной конечности. У некоторых больных описаны фасцикуляции. Типично прогрессирование заболевания в течение 5-6 лет с последующей стабилизацией. Признаки поражения верхнего мотонейрона, а также чувствительные, координаторные, тазовые нарушения отсутствуют. Результаты анализов крови и цереброспинальной жидкости не претерпевают изменений (иногда наблюдается незначительное повышение количества белка) По данным электрофизиологических исследований отмечено снижение амплитуд моторных ответов при стимуляции локтевого и срединного нервов при сохранении скорости распространения возбуждения и сенсорных ответов в пределах референсных значений. Может фиксироваться увеличение процента выпадения F-волн или невозможность их регистрации в связи с атрофией мышц. Характерны денервационные изменения в атрофированных мышцах. Часто наблюдается субклиническое поражение второй руки при клинически одностороннем течении заболевания. Для лечения болезни Хираяма рекомендуется ношение ортопедического воротника для ограничения сгибания шеи. В отдельных быстропрогрессирующих и тяжелых случаях продемонстрированы хорошие результаты хирургического лечения (пластика твердой мозговой оболочки, реконструкция с трансплантацией сухожилий, передняя декомпрессия шейного отдела позвоночника). [6,7] Прогноз при болезни Хираяма благоприятный.
В группу патологий, с которыми необходимо проводить дифференциальный диагноз болезни Хираяма относятся сирингомиелия, боковой амиотрофический склероз, шейный остеохондроз со стенозом позвоночного канала и миелопатией, опухоли и травматические изменения в спинном мозге [4]. Большинство этих заболеваний удается исключить или подтвердить при выполнении рутинной МРТ шейного отдела позвоночника.
Рентгенологическое исследование шейного отдела позвоночника при болезни Хираяма неинформативно, и выявляет только нарушение статики: выпрямление лордоза, кифоз, сколиоз, листезы. На латеральных миелограммах можно увидеть выраженную атрофию спинного мозга, переднее смещение дурального мешка, уменьшение сагиттального размера дуального мешка, и появление рентгенонегативной полоски кзади от дурального мешка при сгибании. КТ-миелография визуализирует несимметричное истончение спинного мозга с наличием гиподенсной полоски кзади от дурального мешка. [1,8]. Однако осложнения и инвазивность миелографических исследований привели к их полной замене на МРТ.
Характерными признаками болезни Хираяма на МРТ являются локальная атрофия спинного мозга на уровне С5-С7, несимметричное истончение спинного мозга, миелопатия с преимущественным поражением передних рогов, нарушение анатомического контура спинного мозга, дефект прикрепления задних отделов дурального мешка к позвоночному каналу. Чувствительность диагностики болезни Хираяма по вышеописанным признакам МРТ в нейтральной позиции достигает 80% [9,10].
При проведении МРТ шейного отдела с максимальным сгибанием наблюдается нарушение прикрепления задней стенки дурального мешка и смещение его вместе со спинным мозгом вперед, расширение заднего эпидурального пространства [1,11,12]. Отмечается гиперинтенсивный сигнал, серповидное расширение заднего эпидурального пространства с наличием артефактов потока от движущейся крови в расширенном эпидуральном венозном сплетении.
Широко обсуждается роль контрастного усиления парамагнетиками при дегенеративно-дистрофических и функциональных изменениях в позвоночнике [13]. В исследовании Sonwalkar et al. показали важную роль динамического контрастирования на МРТ у пациентов с подозрением на болезнь Хираяма. Гомогенное контрастное усиление заднего эпидурального пространства при болезни Хираяма считается типичным признаком [14]. Новые последовательности, такие как 3D-FIESTA могут существенно сократить время МР-обследования шейного отдела позвоночника с функциональными пробами до 6 минут и доказали сопоставимую точность со стандартным протоколом без необходимости внутривенного контрастирования [15].
Исчезновение эпидурального компонента в нейтральной позиции шеи подтверждает сосудистую природу выявляемых в нем изменений, а именно расширение внутреннего заднего эпидрального венозного сплетения (рисунок 6).
Исчезновение эпидурального компонента в нейтральной позиции шеи подтверждает сосудистую природу выявляемых в нем изменений, а именно расширение внутреннего заднего эпидрального венозного сплетения (рисунок 6).
Рисунок 6. Анатомия венозного кровоснабжения позвоночника. Аксиальные и сагиттальные изображения. (Daniel Kim et al. Tumors of the Spine. 1st ed; 2008)
Расширению внутреннего заднего венозного сплетения (его продольной и поперечной частей) при сгибании способствуют 3 патофизиологических фактора. Во-первых, переднее смещение дурального мешка формирует отрицательное давление в задних отделах позвоночного канала и результирующее увеличение потока в заднем внутреннем венозном сплетении [10]. Во-вторых, переднее смещение дурального мешка вызывает компрессию переднего внутреннего венозного сплетения, и как следствие увеличение нагрузки на заднее венозное сплетение с его компенсаторным расширением. [12]. В-третьих, венозный дренах из яремных вен уменьшается при сгибании шеи, что в свою очередь затрудняет венозный возврат из позвоночных венозных сплетений [10].
Метод диффузионно-тензорной визуализации основан на анализе направления диффузии молекул воды вдоль аксонов, входящих в состав различных трактов белого вещества. С его помощью регистрируются данные о направлении и плотности нервных путей, соединяющих различные структуры головного и спинного мозга; математическим выражением полученных данных является фракционная анизотропия – количественная характеристика вектора диффузии. Диффузионно-тензорные изображения у пациентов с болезнью Хираяма потенциально могут указывать на клинически немые участки дезорганизации кортикоспинальных трактов, предвосхищая возникновение морфологических и клинических изменений в будущем. Постулируется, что уменьшение фракционной анизотропии может быть связано с рестрикцией диффузии молекул воды в компримированном спинном мозге [16]. Интрамедуллярный отек также способствует нарушению баланса между внутри- и внеклеточным содержанием жидкости и белка. что как следствие приводит к уменьшению свободной диффузии. В норме отмечается снижение значений фракционной анизотропии спинного мозга от уровня С2-С3 к уровню С5-С6. Как полагают это связано с разным соотношением серого и белого вещества в краниокаудальном направлении, а также отхождением стволов плечевых сплетений от нижнешейного отдела спинного мозга, что вызывает пространственную дезорганизацию белого вещества и уменьшение значений фракционной анизотропии [17]. На цветовых картах проводящих путей спинного мозга могут быть продемонстрированы нарушения, не видимые на стандартных МР-сканах.
Заключение
У пациентов соответствующей возрастной группы с локальными неврологическими нарушениями в верхних конечностях рекомендуется проведение МРТ шейного отдела позвоночника с функциональными пробами для исключения болезни Хираяма. Протокол, дополненный исследованием в положении гиперфлексии позволяет выявить типичный для болезни Хираяма морфологический паттерн при сомнительных результатах рутинного МР-исследования. МР-трактография в отдельных случаях может определить начальные структурные изменения в спинном мозге, не визуализируемые на стандартных импульсных последовательностях.