Гомозиготная мутация что это значит
Что такое синдром Жильбера? Причины возникновения, диагностику и методы лечения разберем в статье доктора Васильева Романа Владимировича, врача общей практики со стажем в 14 лет.
Определение болезни. Причины заболевания
Краткое содержание статьи — в видео:
Синонимы названия болезни: простая семейная холемия, конституциональная или идиопатическая неконъюгированная гипербилирубинемия, негемолитическая семейная желтуха.
По распространённости данное заболевание встречается не менее, чем у 5 % населения, в соотношении мужчин и женщин — 4:1. Впервые заболевание описал французский терапевт Августин Жильбер в 1901 году.
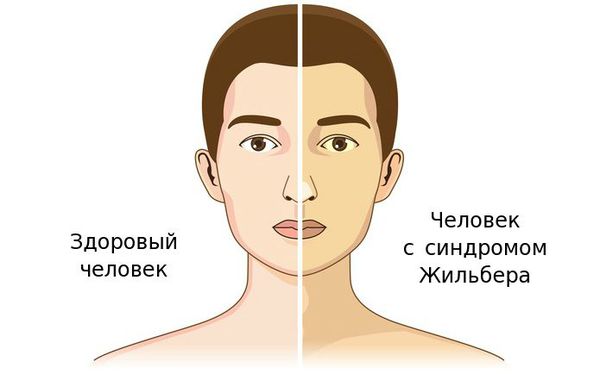
Чаще синдром Жильбера проявляется в период полового созревания и характеризуется доброкачественным течением. Основным проявлением этого синдрома является желтуха.
К провоцирующим факторам проявления синдрома можно отнести:
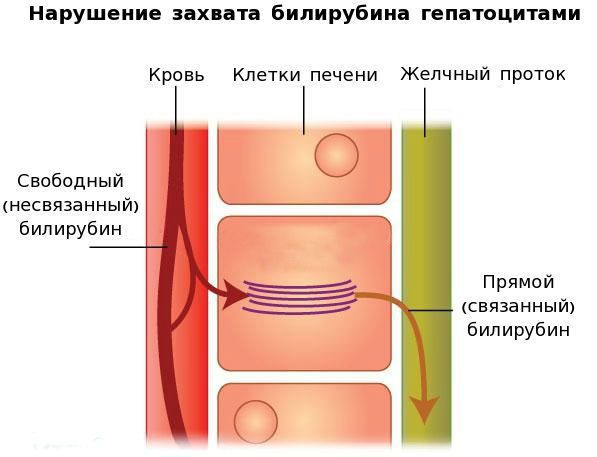
Причина заболевания — генетический дефект фермента УДФГТ1*1, который возникает в результате его мутации. В связи с этим дефектом функциональная активность данного фермента снижается, а внутриклеточный транспорт билирубина в клетках печени к месту соединения свободного (несвязанного) билирубина с глюкуроновой кислотой нарушается. Это и приводит к увеличению свободного билирубина.
Симптомы синдрома Жильбера
Некоторые специалисты трактуют синдром Жильбера не как болезнь, а как физиологическую особенность организма.
До периода полового созревания данный синдром может протекать бессимптомно. Позже (после 11 лет) возникает характерная триада признаков:
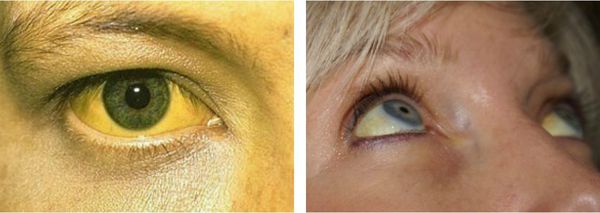
Желтуха чаще всего проявляется иктеричностью (желтушностью) склер, матовой желтушностью кожных покровов (особенно лица), иногда частичным поражением стоп, ладоней, подмышечных впадин и носогубного треугольника.
Заболевание нередко сочетается с генерализованной дисплазией (неправильным развитием) соединительной ткани.
Усиление желтухи может наблюдаться после перенесения инфекций, эмоциональной и физической нагрузки, приёма ряда лекарственных препаратов (в частности, антибиотиков), голодания и рвоты.
Клиническими проявлениями заболевания общего характера могут быть:
В отношении ЖКТ синдром Жильбера проявляется снижением аппетита, изменением привкуса во рту (горечь, металлический привкус), реже возникает отрыжка, тяжесть в области правого подреберья, иногда наблюдается боль ноющего характера и плохая переносимость лекарственных препаратов.
При ухудшении течения синдрома Жильбера и существенном повышении токсичной (свободной) фракции билирубина может появляться скрытый гемолиз, усиливая при этом гипербилирубинемию и добавляя в клиническую картину системный зуд.
Патогенез синдрома Жильбера
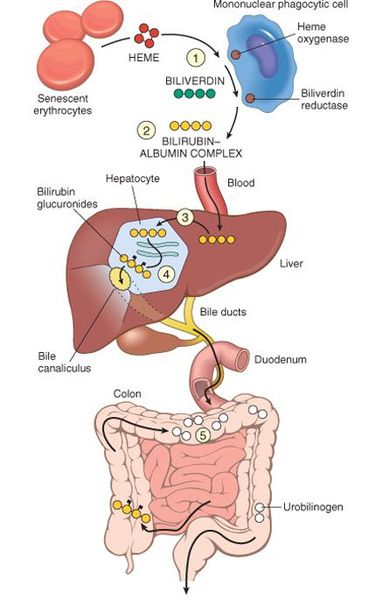
В норме свободный билирубин появляется в крови преимущественно (в 80-85 % случаев) при разрушении эритроцитов, в частности комплекса ГЕМ, входящего в структуру гемоглобина. Это происходит в клетках макрофагической системы, особенно активно в селезёнке и купферовских клетках печени. Остальная часть билирубина образуется из разрушения других гемсодержащих белков (к примеру, цитохрома P-450).
У взрослого человека в сутки образуется приблизительно от 200 мг до 350 мг свободного билирубина. Такой билирубин слаборастворим в воде, но при этом хорошо растворяется в жирах, поэтому он может взаимодействовать с фосфолипидами («жирами») клеточных мембран, особенно головного мозга, чем можно объяснить его высокую токсичность, в частности токсичное влияние на нервную систему.
Первично после разрушения комплекса ГЕМ в плазме билирубин появляется в неконъюгированной (свободной или несвязанной) форме и транспортируется с кровью при помощи белков альбуминов. Свободный билирубин не может проникнуть через почечный барьер за счёт сцепления с белком альбумином, поэтому сохраняется в крови.
В печени несвязанный билирубин переходит на поверхность гепатоцитов. С целью снижения токсичности и выведения в клетках печени свободного билирубина при помощи фермента УДФГТ1*1 он связывается с глюкуроновой кислотой и превращается в конъюгированный (прямой или связанный) билирубин. Конъюгированный билирубин хорошо растворим в воде, он является менее токсичным для организма и в дальнейшем легко выводится через кишечник с желчью.
При синдроме Жильбера связывание свободного билирубина с глюкуроновой кислотой снижается до 30% от нормы, тогда как концентрация прямого билирубина в желчи увеличивается.
В основе синдрома Жильбера лежит генетический дефект — наличие на промонторном участке A(TA)6TAA гена, кодирующего фермент УДФГТ1*1, дополнительного динуклеотида ТА. Это становится причиной образования дефектного участка А(ТА)7ТАА. Удлинение промонторной последовательности нарушает связывание фактора транскрипции IID, в связи с чем уменьшается количество и качество синтезируемого фермента УДФГТ1, который участвует в процессе связывания свободного билирубина с глюкуроновой кислотой, преобразуя токсичный свободный билирубин в нетоксичный связанный.
Вторым механизмом развития синдрома Жильбера является нарушение захвата билирубина микросомами сосудистого полюса клетки печени и его транспорта глутатион-S-трансферазой, которая доставляет свободный билирубин к микросомам клеток печени.
Классификация и стадии развития синдрома Жильбера
Общепринятой классификации синдрома Жильбера не существует, однако условно можно разделить генотипы синдрома по полиморфизму.
Генетика и онкология: главные вопросы
Александр Олегович Иванцов, доктор медицинских наук
— Александр Олегович, что такое мутация? Как возникают «поломки» в молекулах ДНК?
— Организм человека состоит из большого числа специализированных клеток, ядра которых содержат нуклеиновые кислоты: ДНК и РНК. Совокупность этих молекул содержит биологическую информацию, необходимую для построения и поддержания клеток, органов и систем органов в целом. Весь наследственный материал, заключённый в клетке, получил название – геном. У человека он представлен 23 парами хромосом (22 пары аутосом и пара половых хромосом), находящихся в ядре. ДНК является длинной полимерной молекулой, она хранит биологическую информацию в виде генетического кода, состоящего из последовательности повторяющихся блоков — нуклеотидов. Последовательность нуклеотидов позволяет «кодировать» информацию о различных типах РНК, которые необходимы для последующего биосинтеза важнейших белков. Открытие структуры ДНК в 1953 году стало поворотным моментом в развитии биологии, а исследователям Фрэнсису Крику, Джеймсу Уотсону и Морису Уилкинсу была присуждена Нобелевская премия в 1962 году. Стойкое изменение генома получило название – мутация. Эти изменения могут касаться структуры отдельных генов, хромосом и генома в целом. То есть изменение последовательности нуклеотидов приводит к нарушениям в кодировании информации – в итоге к аномалиям на уровне качества или количества соответствующих белков.
— Почему некоторые мутации приводят к развитию рака? Как устроен этот механизм? Как ученые определяют, какие именно «поломки» в ДНК приводят к развитию злокачественных опухолей?
— Чтобы ответить на этот вопрос, стоит разобраться как развивается опухоль. Она имеет автономный характер роста. Что это значит? В норме количество клеток в организме человека регулируется балансировкой двух противоположных процессов – клеточного деления и клеточной гибели. При росте опухоли прибавление клеточной массы опережает клеточную гибель. Это возможно по двум причинам – либо активируются процессы пролиферации, т.е. деления клетки, либо угнетается апоптоз, т.е. запрограммированная клеточная гибель. Автономность опухоли состоит в том, что ее клетки не способны реагировать на внешние сигналы организма, и, как следствие, она продолжает рост.
Если изменения нуклеотидной последовательности ДНК происходят в значащих фрагментах ДНК (прим. – экзонах), то они могут привести к развитию опухоли. К развитию рака приводят в основном мутации, нарушающие баланс деления и гибели клеток, то есть мутации в генах, контролирующих именно эти процессы. Мутации могут возникать случайно, например, в процессе удвоения ДНК в результате деления клетки. А могут возникать под влиянием мутагенов: например, воздействия ультрафиолетового или рентгеновского излучения, высокой температуры, некоторых химических веществ. На последний вопрос, можно ответить, что патогенность мутации можно предположить в первую очередь по функции гена, который она затрагивает, по её структурным характеристикам (насколько сильно она нарушает или изменяет работу этого гена), и подтвердить путем функциональных исследований (например, на клеточных культурах).
— Что такое онкогены?
— Онкогеном называется ген, который в норме не оказывает влияние на процессы деления и гибели клеток, а в опухоли активизируется, вследствие чего раковые клетки приобретают способность к неконтролируемому размножению. Кроме того, в настоящее время известно о роли антионкогенов. В норме они подавляют процесс деления клеток или способствуют их гибели, а в опухоли этот сдерживающий эффект подобных генов отсутствует, тем самым провоцируется рост опухолевых масс. Современная наука полагает, что для возникновения трансформированного клеточного клона необходимо как минимум пять-девять мутаций в разных онкогенах и антионкогенах.
— Эти мутации можно выявить с помощью генетического исследования?
— Да, конечно, можно. Спектр генетических повреждений в опухолях характеризуется удивительным многообразием. Например: амплификации (увеличение копийности генов), делеции, инсерции, транслокации, микромутации (точковые замены, микроделеции, микроинсерции) и так далее. Кроме того, в опухоли изменяются уровни экспрессии генов в результате аномального метилирования их промоторов.
Существует много методов, используемых для выявления мутаций в опухолевой ткани, и достаточно много ситуаций, когда это требуется. Выявление определённых мутаций иногда помогает поставить диагноз, определить лечебную тактику, прогноз и так далее. Наиболее часто для молекулярного тестирования используются технологии полимеразной цепной реакции (ПЦР) и секвенирования нового поколения (NGS, next generation sequencing). Обе технологии универсальны и используются для анализа любой генетической последовательности, а также многократно превосходят все другие технологии по своей чувствительности, специфичности и не сопряжены с риском получения «промежуточных», неинтерпретируемых результатов. Секвенирование экзома позволяет выявить все мутации в кодирующих последовательностях генома в каждой конкретной опухоли. Именно полногеномное секвенирование значительно расширяет возможности персонализированного подбора препаратов, предназначенных для специфического поражения мутированных онкобелков.

— Сфера медицинского применения ДНК- и РНК-тестов в современной онкологии постоянно расширяется. Сейчас это тестирование позволяет диагностировать наследственные опухолевые синдромы, выявить предиктивные мутации, осуществить анализ экспрессионных характеристик опухоли. Также совершенствуются технологии, которые позволяют уточнять диагноз опухолей с невыявленным первичным очагом, эффективно контролировать течение заболевания и изменения свойств опухоли (жидкостная биопсия), выполнять различные биологические тесты с опухолевыми клетками.
Индивидуализация лечения онкологического пациента во многих случаях напрямую зависит от результатов генетического тестирования. Эмпирический подход, сопряжённый со случайным перебором биологически активных химикатов, постепенно замещается научно-обоснованным, молекулярно-направленным поиском специфических противоопухолевых средств, направленных на активацию или инактивацию ключевых биохимических компонентов опухолевой трансформации.
Например, еще недавно клиническое деление всех первичных опухолей легкого на мелкоклеточный и немелкоклеточный рак было достаточным для определения стратегии лечения. Ситуация изменилась с открытием активирующих мутаций в гене, который кодирует рецептор эпидермального фактора роста — EGFR, сделавших этот онкогенный белок избирательной мишенью для воздействия препаратов ингибиторов EGFR. Мутации EGFR, как правило, встречаются у пациентов с аденокарциномой легкого. Тест на мутацию EGFR позволяет практически со 100%-й достоверностью отобрать тех больных, у которых гарантирован положительный результат применения гефитиниба, эрлотиниба или афатиниба.
— Может ли генетическое исследование помочь здоровому человеку предупредить рак или выявить его на ранней стадии?
— Вообще, бывают наследственные и ненаследственные опухоли. Наследственные опухолевые синдромы составляют незначительную долю от общего числа новообразований (около 1%), хотя для определённых локализаций (молочная железа, яичник, толстая кишка) их удельный вклад достигает более высоких показателей (5-20 %). Носительство наследуемой «раковой» мутации является причиной подобного заболевания. В этих случаях, в каждой клетке организма человека есть повреждение, которое передалось ему по наследству. Лица, имеющие такой генетический дефект, остаются практически здоровыми до определенного момента. В то же время они обладают фатально высоким риском возникновения опухолей (85-100%).
Генетическое исследование при подозрении на наследственный раковый синдром носит комплексный характер. Оно начинается со сбора онкологического анамнеза ‒ уделяется внимание случаям злокачественных заболеваний у кровных родственников. В результате составляются родословные, позволяющие заподозрить наследственную патологию. На заключительном этапе проводится анализ ДНК, что позволяет установить наличие в генотипе больного, а также членов его семьи, подозреваемые мутации.
— Какие виды мутаций ученые уже выявили? Существует ли для каждого вида таргетный препарат? Как именно работает таргетный препарат?
— Много разных видов мутаций при разных опухолях известны, но наибольший интерес представляют мутации в онкогенах, в частности, в рецепторных протеинкиназах, для блокировки которых разрабатываются специфические препараты. Мутации в протеинкиназах изменяют конформацию белковых молекул и, таким образом, формируют идеальное терапевтическое окно. Таргетный препарат избирательно воздействует на клетки опухоли, содержащие молекулярную мишень, и этим выгодно отличается от химиотерапии. Известно об успешном использовании ингибитора тирозинкиназы ALK – кризотиниба – у больных с ALK-транслоцированными карциномами легкого. Успешным оказалось и применение специфических ингибиторов мутированного белка BRAF – вемурафениба и дабрафениба для лечения больных меланомой. Другой пример: ген BRCA1 кодирует фермент репарации ДНК. BRCA1-дефицитные клетки демонстрируют неспособность эффективно удалять сшивки ДНК, индуцированные препаратами платины. В наследственных BRCA1-ассоциированных раках отмечается наибольшая эффективность цисплатина, т.к. в опухолевых клетках наблюдается соматическая утрата оставшегося BRCA1-аллеля, в то время как нормальные клетки носительниц мутаций BRCA1 сохраняют интактную копию данного гена. Этим обусловлено уникальное терапевтическое окно и это объясняет высокую эффективность цисплатина при лечении BRCA1-ассоциировнного рака молочной железы, яичника. Конечно, по разным причинам, не для всех мутаций есть такие препараты, но их спектр и количество неуклонно возрастает.
— Какие исследования, связанные с мутациями ДНК, сейчас проводятся в научной лаборатории молекулярной онкологии ФГБУ «НМИЦ онкологии им. Н.Н. Петрова»?
— В настоящее время проводятся исследования в двух направлениях: диагностика наследственных раковых синдромов и индивидуализация подбора лекарственных препаратов на основе молекулярных характеристик опухоли. Тем самым повышается клиническая эффективность применения дорогостоящих лекарственных препаратов, снижается частота и тяжесть побочных эффектов, и в некоторых случаях предотвращается неблагоприятный исход заболевания.
Генетическая диагностика синдрома Жильбера, UGT 1A1
Генетическая диагностика синдрома Жильбера заключается в анализе количества повторов динуклеотидной последовательности тимидин-аденин (ТА)- гена, кодирующего фермент УДФГТ или уридиндифосфатглюкуронидазу, который отвечает за превращение молекулы билирубина в водорастворимую форму. Место расположения гена – хромосома 2. Мутировавший участок гена приводит не только к формированию синдрома Жильбера, но и провоцирует синдром Криглера-Найяра (описано ниже), преходящую желтуху новорожденных, повышенный сывороточный билирубин.
Описание
Характерен астенический синдром с вегетативными расстройствами – утомляемость, слабость, нарушения засыпания, потливость, дискомфорт в сердце. Если повышенный уровень билирубина держится долго, развивается депрессия.
Уровень билирубина повышается изолированно, чаще до 100 ммоль/л, преобладает прямая (несвязанная) фракция, остальные печеночные пробы не изменяются.?
Механизм развития желтухи следующий. В результате распада эритроцитов образуется прямой билирубин, он циркулирует в крови. В норме в клетках печени прямой билирубин захватывается глюкуроновой кислотой и становится непрямым. «Командует» связыванием прямого билирубина фермент УДФГТ, активность которого при синдроме Жильбера снижена на 25-30%. Билирубин, оставшийся несвязанным, накапливается в тканях, вызывая их повреждение. Лечение симптоматическое – диета №5 (ограничение жирного, жареного, содержащего холестерин, много овощей и фруктов), покой, по назначению врача гепатопротекторы.
Фермент УДФГТ синтезируется по коду, который задает ген UGT 1A1. Синдром Жильбера – это мутация промоторной области (участок нуклеотидов, с которого начинается кодирующая часть), вместо 6 ТА-повторов обнаруживается 7 или реже 8.
Мутация – это изменение генотипа, которое передается потомкам. Генотип – это набор генов, который уникален и неповторим у каждого человека. Мутация гена UGT 1A1 передается по аутосомно-доминантному типу. Это значит, что дефектный ген не содержится в половых хромосомах, мог быть передан как от отца, так и от матери. Дети обоих полов могут болеть с одинаковой частотой.
Имеет значение тип мутации – гомо- или гетерозиготная. Нужно вспомнить, что каждый организм имеет два набора хромосом – от отца и от матери. Гомозиготная мутация (в переводе с греческого «равная, одинаковая яйцеклетка») – такая, при которой пара хромосом имеет одинаковую форму гена. Гетерозиготная мутация отличается тем, что форма генов в паре разная.
При гомозиготной мутации или одинаковой паре генов клиническая картина выражена тяжелее, уровень билирубина максимально высокий. При гетерозиготной форме повышение билирубина обнаруживается случайно, клинических проявлений нет. Бессимптомное течение отмечается в более чем половине случаев синдрома Жильбера.
В группе риска находятся все люди, у которых есть родственники с синдромом Жильбера. Вылечить его невозможно, нужно ограничивать нагрузки на печень, избегать провоцирующих факторов. Продолжительности жизни синдром Жильбера не уменьшает, влияние на качество жизни минимальное. Это особенность организма, с которой нужно считаться, чтобы не навредить себе.
Определять наличие мутантного гена нужно перед началом лечения препаратами, оказывающими токсическое действие. У людей с синдромом Жильбера могут быть тяжелые интоксикационные реакции при приеме многих групп лекарств: глюкокортикоидных и половых гормонов, кофеина, некоторых антибиотиков, аспирина, парацетамола. Особенно это касается приема нового цитостатика Иринотекана, чрезвычайно эффективного при раке толстой кишки.
Специалисты ЦЭЛТ предпочитают полностью обследовать пациента перед сложным лечением во избежание неприятных неожиданностей.
Невынашивание беременности и женское бесплодие – генетические аспекты
Патологии женской репродуктивной системы в целом, и невынашивание беременности, как важная часть этой проблемы тесно связаны с генетикой человека. Так, наиболее значимые звенья сложного и многосоставного патогенеза акушерских патологий имеют своей причиной мутации генов, обеспечивающих самые разнообразные процессы, участвующие в возникновении и нормальном протекании беременности. Рассмотрим несколько основных акушерских патологий с генетической точки зрения.
Тромбофилия
Тромбофилия – термин, обозначающий предрасположенность к венозному и случайному артериальному тромбоэмболизму. Патологическая способность к тромбообразованию может быть результатом врожденного или приобретенного нарушения свертывания крови. Наиболее распространена активация резистентности протеина С, которая вызвана мутацией фактора 5 Лейден (5)
Тромбофилия играет важную роль в патогенезе развития:
Тромбофилия является ключевой проблемой в процессе развития акушерских осложнений во время беременности:
Венозные тромбозы занимают третье место по распространённости среди сердечно-сосудистых заболеваний. Частота венозных тромбозов в общей популяции, согласно мировым данным, составляет 1-2 случая на 1000 населения ежегодно.
Риск тромбозов значительно увеличивается при наличии таких провоцирующих факторов, как хирургические операции, приём гормональных контрацептивов, различные заболевания (диабет, онкология, ожирение), а также беременность и роды.
Планирование беременности.
Своевременно выявленная тромбофилия – не приговор, а прямая инструкция к действию, ведь своевременно, еще до наступления беременности, терапия позволяет минимизировать, а часто и полностью исключить патологии беременности, вызванные тромбофилией.
Выбор способа контрацепции.
При приеме эстрогенсодержащих контрацептивов свертываемость крови повышается, что в случае тромбофилии становится просто опасным для здоровья и жизни.
Показания к назначению исследования на наследственную тромбофилию:
Факторы риска тромбофилий:
Основные блоки генов, участвующих в развитии тромбофилии:
К первичным (генетически обусловленным) тромбофилиям относят (10):
Частота различных тромбофилий (10):
Основные мутации, приводящие к наследственной тромбофилии:
Коагуляционный фактор 5
Лейденская мутация; G1691A; Arg506Gln
Замедление деградации фактора 5 активированным протеином
Коагуляционный фактор 2 (протромбин)
Усиление синтеза протромбина аллеля А, смещение равновесия в системе гемостаза в сторону усиления свертывания крови
Коагуляционный фактор 2 (протромбин)
Повышение экспрессии гена фибриногена, увеличение выработки фибрина, повышенное тромбообразование
Снижение интенсивности синтеза фибриногена
Образование термолабильной формы фермента со сниженной активностью приводит к нарушению метилирования гомоцистеина и повышению его уровня в крови. Гипергомоцистеинемия приводит к поврежению эндотелия сосудов.
Мутация приводит к термолабильности MTHFR ТОЛЬКО при СОВМEСТНОМ носительстве с мутацией 677T
Усиление плотности рецепторов к коллагену на поверхности тромбоцитов, усиление адгезии тромбоцитов к эндотелию
Мутация влияет на агрегационный свойства тромбоцитов
Ингибитор активатора плазминогена 1-го типа
Аутосомно-доминантная тромбофилия вследствие дефицита протеина С
Аутосомно-доминантная тромбофилия вследствие дефицита протеина С
Аутосомно-доминантная тромбофилия вследствие дефицита протеина S
Аутосомно-доминантная тромбофилия вследствие дефицита протеина S
Тромбофилии в акушерской практике
В настоящее время тромбофилии являются причиной более чем 45 % случаев невынашивания беременности, 80 % преэклампсий, нередко приводя к преждевременной отслойке нормально расположенной плаценты (ПОНРП), синдрому задержки роста плода (СЗРП) с его антенатальной гибелью, а также к последовым и послеродовым кровотечениям (2, 4)
Связь тромбофилии с патологиями беременности:
F5 Лейденская мутация (G1691A)
F2 Коагуляционный фактор 2 / Протромбин (G20210A)
Риск развития тромбозов у носителей аллеля А возрастает в 2-5 раз. У беременных при наличии этой мутации значительно возрастает риск не только венозных, но и артериальных тромбозов, что может приводить к развитию инсультов и ИБС.
FGB Фириноген (G-455A)
Мутация является фактором риска периферического и коронарного тромбоза, ассоциирована со степенью атеросклеротического поражения сосудов. При беременности возрастает риск тромбозов, невынашивания беременности, тромбоэмболических осложнений в родах и послеродовом периоде.
F7 Коагуляционный фактор 7 (G10976A)
SERPINE 1 Ингибитор активатора плазминогена 1-го типа (5G>4G)
Мутации в генах тромбоцитарных факторов
MTHFR 5,10-метилентетрагидрофолатредуктаза (C677T)
Дефекты генов фолатного цикла и беременность
Определённую роль в невынашивании беременности могут играть гены, принимающие участие в метаболизме фолиевой кислоты и витамина В12.
Фолиевая кислота (витамин В9) отвечает за перенос метильных групп (СН3-) при химических реакциях в организме – это реакции, в ходе которых синтезируются ДНК, РНК и ряд аминокислот (глицин, метионин). Поэтому для беременных и для плода так важно не иметь дефицита как самой фолиевой кислоты, так и ферментов, участвующих в ее метаболизме.
Высокие концентрации активной формы фолиевой кислоты необходимы для превращения гомоцистеина в метионин. Основными генами, продукты которых контролируют превращение фолиевой кислоты в метаболически активные формы и регулируют обмен гомоцистеина, являют ся MTHFR (метилентетрагидрофолатредуктаза), MTR (метионинредуктаза) и MTRR (метионинсинтетазредуктаза). Снижение активности этих ферментов – одна из важных причин накопления гомоцистеина в организме.
Схема метаболизма фолиевой кислоты
Причины токсического действия избытка гомоцистеина на организм женщины и плода следующие (6):
Полиморфизм: названия и [синонимы]
C677T; Ala222Val; A222V
Мутантный вариант этого полиморфизма 677Т приводит к образованию термолабильного фермента и повышению уровня гомоцистеина в крови
A1298C; Glu429Ala; E429A
Повышенная частота генотипов А/С и С/С для этого полиморфизма была зарегистрирована у женщин с повторными выкидышами раннего срока.
Показано увеличение частоты встречаемости аллеля 66А гена MTRR и аллеля 2756G гена MTR у женщин с преждевременными родами в анамнезе (после 22-й недели беременности).
Полиморфизм гена MTRR A66C связан с синдромом Дауна и дефектами спинного мозга.
Нарушение имплантации эмбриона (гены TP53, LIF и другие)
На настоящий момент доказано, что экспрессия белка LIF является круциальным фактором для формирования так называемого «окна имплантации».
В эндометрии женщин с бесплодием снижена экспрессия LIF, а также было показано, что при бесплодии неясного генеза значительно снижается экспрессия LIF в среднюю секреторную фазу эндометрия.
Уровень LIF регулируется белком р53, соответственно, мутации генов сигнального пути гена TH53 опосредованно влияют и на экспрессию LIF в эндометрии. Это мутации генов TP53, MDM2, MDM4, USP7 и некоторых других (D.d’Avila Paskulin et al., 2012)
Нарушения имплантации эмбриона (генная сеть генов LIF и TP53)
Эстрогеновый рецептор 1
XbaI Polymorphism; A-351G; IVS1-351A>G
Совместное регулирование как р53 так и эстрогенами требуется для обеспечения экспрессии LIF на уровне, достаточном для имплантации бластоцисты. Учитывая, что функция эстрогенового рецептора при варианте гена rs9340799-G в гомозиготном состоянии (генотип G/G) значительно снижена, следует ожидать уменьшения количества LIF и, как следствие, нарушения имплантации бластоцисты.
Эстрогеновый рецептор 1
Совместное регулирование как р53 так и эстрогенами требуется для обеспечения экспрессии LIF на уровне, достаточном для имплантации бластоцисты. Учитывая, что функция эстрогенового рецептора при варианте гена rs2234693-C в гомозиготном состоянии (генотип C/C) значительно снижена, следует ожидать уменьшения количества LIF и, как следствие, нарушения имплантации бластоцисты.
5-гидрокситриптаминовый (серотониновый) рецептор 1A
У гомозиготных носителей варианта rs6295-C гена 5-HT1A (генотип C/C) обнаруживаются значительно более низкие показатели имплантации. Для них также свойственны значительно более высокие биохимические показатели потери беременности. PMID: 23499153
Фактор, ингибирующий лейкемию
Val64Met; Val86Met; 3400 G/A; G3400A; Arg26His
Фактор, ингибирующий лейкемию
Выявлена ассоциация варианта C полиморфизма rs929271 в 3 ‘UTR гена LIF с нарушением имплантации бластоцисты. Встречаемость C аллеля много выше у женщин с идиопатическим бесплодием в возрасте до 35 лет, но не старше.
MDM2 протоонкоген, E3 убиквитин-протеин-лигаза
Вариант rs2279744-G резко увеличивает экспрессию кодируемого MDM2 белка. Повышенное количество MDM2, в свою очередь, ингибирует p53, что снижает уровень LIF и вероятность имплантации.
MDM4, регулятор p53
Присутствие аллеля Т в полиморфизме rs1563828 гена MDM4 увеличивает экспрессию кодируемого этим геном белка-супрессора р53. Ингибирование р53, в свою очередь, приводит к снижению количества LIF и вероятности имплантации.
Простагландин-эндопероксид синтаза (простагландин G/H синтаза и циклооксигеназа)
Нейротрансмиттерный переносчик серотонина
L/S; Long/Short; 44-bp Ins/Del
У гомозиготных носителей (генотип L/L) обнаруживаются значительно более низкие показатели имплантации, более низкие клинические показатели беременности (PR) и более высокие биохимические показатели потери беременности (BPL).
Опухолевый протеин р53
Arg72Pro; Ex4+119C>G; 12139G>C; R72P
Процент женщин-носительниц аллеля Pro72 был существенно выше в выборке перенесших ЭКО в связи с повышенным числом случаев нарушений имплантации. Аллель Pro72 служит фактором риска развития недостаточности имплантации.
Убиквитин-специфическая пептидаза 7, ассоциированная с вирусом герпеса
У пациентов, несущих аллель Hausp A (генотип A/A), наблюдается значительное нарушение функции гена USP7, снижающее в итоге активность p53. Потеря активности p53 влечёт за собой снижение экспрессии гена LIF, что уменьшает количество соответствующего белка, играющего ключевую роль в процессе имплантации бластоцисты
Преэклампсия
Преэклампсия – возникающий при беременности синдром полиорганной недостаточности, в основе которого лежит увеличение проницаемости сосудстой стенки и других мембран исвязанные с этим волемические и гемодинамические нарушения.
На генетическую предрасположенность к преэклампсии влияет целый ряд генетических полиморфизмов. В настоящее время исследованы свыше 20 генов предрасположенности к гестозу, однако данные постоянно перепроверяются и пополняются.
Четко показана связь с гестозом для следующих групп генов:
Генетическая предрасположенность преэклампсии (эндотелиальной дисфункции, гестозу)
Полиморфизм: названия и [синонимы]
Эстрогеновый рецептор 1
XbaI Polymorphism; A-351G; [IVS1-351A>G]
При одновременном наличии Т/Т генотипа полиморфизма Pvull, риск преэклампсии возрастает в 3,26 раза даже при отсуствии таких факторов риска, как повышенный индекс массы тела, курение, беременность.
Эстрогеновый рецептор 1
PvuII Polymorphism; T-397C; [-397T>C]
При одновременном наличии A/A генотипа полиморфизма Xball, риск преэклампсии возрастает в 3,26 раза даже при отсуствии таких факторов риска, как повышенный индекс массы тела, курение, беременность.
Met235Thr; M235T; Met268Thr; M268T
У носительниц аллеля 235Thr повышена концентрация ангитензиногена в крови; риск развития преэклампсии в 2 раза выше, чем у носительниц «дикого» аллеля Met235.
Ins/Del, Intron 16; 289bp Alu-Ins/Del
У носительниц аллеля D упровень АФП повышен; риск развития преэклампсии в 2 раза выше, чем у носительниц «дикого» аллеля I.
Ангиотензин-превращающий фермент (Дипептидилкарбоксипептидаза 1)
Ins/Del, Intron 16; 289bp Alu-Ins/Del
Мутации гена АСЕ являются одной из причин эндотелиальной дисфункции. У носительниц генотипа D/D уровень АПФ повышен; риск развития преэклампсии и тромбоэмболий в 2 раза выше, чем у носительниц «дикого» генотипа I/I.
Синтаза оксида азота 3
Glu298Asp; E298D; [G894T; 894G>T]
Показано, что у гомозигот по минорному аллелю Asp/Asp риск развития преэклампсии выше по сравнению со среднепопуляционным в 2,45 раза. Носительницы аллеля Asp (генотипы Asp/Asp и Glu/Asp) встречаются чаще в группах беременных, страдающих гипертонией и отслойкой плаценты, по сравнению с группой женщин без данных осложнений беременности. Наличие аллеля Asp является фактором риска развития гипертензии при беременности.
T-786C; [-786 T/C; IVS1-762C>T]
Замена С на Т в регуляторной области гена ведет к снижению экспрессии гена, которая ведет к повышению тонуса артерий. Это является фактором риска спазма коронарных сосудов, в сочетании с присутствием аллеля 298Asp значительно повышает риск развития преэклампсии.
Активатор ингибитора плазминогена, тип 1 (PAI1)
4G/5G; PAI1: 4G/5G; Ins/Del G; [-675 4G/5G; Ins/Del(G)]
Полиморфизм 4G/5G является полиморфизмом инсерции/делеции нуклеотида G в промоторной области гена SERPINE1. Отсутствие одного нуклеотида в области полиморфизма получило название 4G варианта, который связан с высокой транскрипционной активностью данного гена и увеличением концентрации его продукта, что, в свою очередь, негативно воздействует на фибринолиз, повышает риск сосудистых осложнений и тромбозов. Наличие варианта 4G в гомозиготном состоянии (генотип 4G/4G) связано со значительным риском развития поликистоза яичников, а также со значительным риском возникновения осложений беременности, таких как ранние эмбриональные и преэмбриональные потери, гестозы и неудачи ЭКО. Указанные риски увеличиваются при сочетании с носительством варианта 34Leu гена полипептида A1 фактора коагуляции XIII (F13A1).
Фактор коагуляции XIII, полипептид A1
Val34Leu; Val35Leu; 9G>T
Данная мутация приводит к дефициту фактора свертывания 13, вызванной отсутствием субъединица А белка. Этот дефект приводит к склонности к кровотечениям, плохому заживлению ран и привычным выкидышам.
Интерлейкин 6 (интерферон, бета 2)
Гиперандрогения и синдром поликистозных яичников (СПКЯ)
Согласно консенсусу специального Международного симпозиума объединенной рабочей группы ESHRE/ASRM (Европейского общества репродукции и эмбриологии человека и Американского общества репродуктивной медицины). Симпозиум состоялся 1–3 мая 2003 г. в Роттердаме (Нидерланды), на нем были приняты следующие диагностические критерии постановки диагноза наличие хотя бы двух из трех утвержденных критериев позволяет после исключения иных состояний верифицировать диагноз СПКЯ. Таким образом, с одной стороны, в плане обследования СПКЯ остается синдромом (комплексом симптомов), идентификация которого невозможна и недопустима на основании изолированного наличия любого единственного диагностического критерия (одиночно от остальных двух). С другой стороны, простой анализ попарного сочетания современных критериев позволяет сделать принципиальный вывод о необходимости расширенного толкования термина СПКЯ. Это связано с дополнительным включением в его дефиницию новых клинических форм, а именно: в отсутствие другой гиперандрогенной патологии диагноз СПКЯ допустимо выставлять не только при классическим течении (полной триаде признаков), но и при наличии одного из трех неполных (неклассических) клинико-инструментальных дуэтов.
Диагностические критерии СПКЯ (по консенсусу Симпозиума рабочей группы ESHRE/ASRM):
Основные мутации, приводящие к развитию СПКЯ
(CAG)n repeat; (3bp)n, Short/Long (S/L)
При уменьшенном количестве (CAG)-повторов у женщин возрастает риск развития рака груди, эндометрия, синдрома поликистозных яичников и гиперандрогении (является фактором риска развития инсулинорезистетности, но лишь при наличии других факторов риска).
Мутации в гене SRD5A1 повышают уровень активности фермента, что приводит к увеличению синтеза дигидротестостерона. Дигидротестостерон обладает более выраженным андрогенным эффектом, чем тестостерон.
Фермент преобразует прегненолон и прогестерон в дегидроэпиандростерон (DHEA) и андростендион. Мутации в этом гене связаны с псевдогермафродитизмом и гиперплазией коры надпочечников.
Цитохром P450, семейство 11, подсемейство А, полипептид 1 (Фермент, расщепляющий боковую цепь холестерина)
При увеличении числа (TTTTA)n повторов (вариант L, где n>16) в гене CYP11A1 повышается продукция андрогенов, что является фактором риска развития СПКЯ.
Цитохром P450, семейство 21, подсемейство A, полипептид 2
Мутация ведет к развитию неклассической (постпубертатной) формы врожденной дисфункции коры надпочечников. При этой форме заболевания первые признаки появляются только во время полового созревания. Высок риск бесплодия и невынашивания беременности.
Показано, что риск развития ановуляции у носительниц аллеля III гена INS повышен по сравнению с носительницами генотипа I/I. Это связано с тем, что гиперинсулинемия/резистентность к инсулину опосредует снижение чувствительности гипофиза к гонадотропин-релизинг гормону, что способствует ановуляции.
Рецептор гамма, активируемый пролифератором пероксисом
Pro12Ala; P12A (протективный)
У носителей мутантного аллеля 12Ala повышена чувствительность к инсулину. Это является протективным фактором в отношении риска развития диабета 2 типа и СПКЯ. Однако, протективный эффект нивелируется при ожирении и повышении индекса массы тела.
Показания к назначению исследования на СПКЯ (8):