Гормон соматотропин за что отвечает у женщин
Гормон соматотропин за что отвечает у женщин
Эндокринологический научный центр Минздрава РФ, Москва
Кафедра акушерства и гинекологии №1 лечебного факультета
Эндокринологический научный центр Минздрава РФ, Москва
ФГБУ «Национальный медицинский исследовательский центр эндокринологии» Минздрава России,, Москва, Россия
Влияние соматотропного гормона (гормона роста) и инсулиноподобного фактора роста 1-го типа на регуляцию женской репродуктивной системы
Журнал: Российский вестник акушера-гинеколога. 2018;18(2): 45-51
Воротникова С. Ю., Станоевич И. В., Дзеранова Л. К., Луценко А. С. Влияние соматотропного гормона (гормона роста) и инсулиноподобного фактора роста 1-го типа на регуляцию женской репродуктивной системы. Российский вестник акушера-гинеколога. 2018;18(2):45-51.
Vorotnikova S Iu, Stanoevich I V, Dzeranova L K, Lutsenko A S. Effect of somatotropin (growth hormone) and insulin-like factor 1 on the regulation of the female reproductive system. Russian Bulletin of Obstetrician-Gynecologist. 2018;18(2):45-51.
https://doi.org/10.17116/rosakush201818245-51
Эндокринологический научный центр Минздрава РФ, Москва
В статье обобщены и проанализированы результаты опубликованных научных работ за последние 20 лет о роли соматотропного гормона (гормона роста) и инсулиноподобного фактора роста 1-го типа в регуляции женской репродуктивной системы. Отображены механизмы взаиморегуляции системы гормона роста, инсулиноподобного фактора роста 1-го типа и секреторной активности гонадотрофов и гипоталамических структур. Показано, что соматотропный гормон является одним из неотъемлемых факторов инициации пубертата. Установлено влияние соматотропного гормона и инсулиноподобного фактора роста 1-го типа на процессы развития матки, фолликулогенеза и яичникового стероидогенеза. В совокупности с системным влиянием соматотропного гормона и инсулиноподобного фактора роста 1-го типа важным аспектом является их локальная овариальная и маточная секреция, определяющая спектр физиологических влияний на органном и клеточном уровнях.
Эндокринологический научный центр Минздрава РФ, Москва
Кафедра акушерства и гинекологии №1 лечебного факультета
Эндокринологический научный центр Минздрава РФ, Москва
ФГБУ «Национальный медицинский исследовательский центр эндокринологии» Минздрава России,, Москва, Россия
На протяжении длительного времени нейроэндокринная регуляция репродуктивной функции представлялась в виде упорядоченной иерархической системы, включающей нейроны гипоталамуса, секретирующие гонадотропин-рилизинг-гормон (ГнРГ), гонадотрофы, ответственные за синтез и циклический выброс лютеинизирующего (ЛГ) и фолликулостимулирующего (ФСГ) гормонов в системный кровоток, и органов-мишеней — яичников, реализующих процессы стероидогенеза. Научные и клинические исследования последнего десятилетия привнесли значительные изменения в понимание сложнейшей системы регуляции инициации пубертата, цикличности овуляторной и менструальной функции, поддержания гестации. Достижения современной физиологии позволили определить факторы и механизмы, ответственные за взаимосвязь репродуктивной функции с системами, ответственными за развитие и рост организма, энергетический обмен, поддержание гомеостаза.
Ключевым компонентом гармоничного развития человеческого организма еще до момента рождения является нормальное функционирование соматотрофов гипофиза как основного источника соматотропного гормона (СТГ), гормона роста, определяющего корректное морфологическое и функциональное становление большинства органов и тканей. Филогенетически репродуктивная система неразрывно связана с системой СТГ [1], что обусловливает их дальнейшую функциональную целостность в контроле становления и поддержания репродуктивной функции.
СТГ и высшие центры регуляции репродукции
Вовлечение СТГ в регуляцию репродуктивной системы отмечается как в непосредственном биологическом влиянии на органы-мишени, так и на уровне высших регуляторных механизмов. В настоящее время ключевыми центрами, ответственными за интеграцию систем размножения и роста организма, признаны аркуатное и переднее паравентрикулярные ядра гипоталамуса, содержащие кисснейроны. В течение последнего десятилетия на фоне открытия новых свойств белка кисспептина (KISS) в физиологии произошла смена парадигмы гормональной регуляции репродуктивной функции и инициации пубертата. Согласно данным многочисленных исследований и экспериментов, кисспептину отведена ведущая роль в координации работы нейронов, секретирующих ГнРГ. В то же время влияние данного нейропептида на количественные и временны́е характеристики секреции СТГ остается спорным во многом из-за несоответствия между экспериментами in vivo и in vitro. В большинстве исследований in vivo у человека и животных не удалось отметить значимого влияния нейропептида на частоту или амплитуду импульсов СТГ [2, 3]. У мышей с дефектом рецептора кисспептина (KISS1R) наблюдалось снижение массы тела, что однако не является абсолютным показателем нарушения секреции СТГ [4]. В то же время в исследованиях in vitro сообщалось о значительной дозозависимой стимуляции экспрессии гена или секреции СТГ при введении кисспептина некоторым видам крыс, рыб, нечеловекообразных обезьян [5, 6]. Кроме того, авторами отмечалось усиление влияния средств, повышающих секрецию СТГ, в присутствии кисспептина [7]. Экспрессия рецептора кисспептина в соматотрофах гипофиза визуализирована у некоторых видов животных и рыб [5, 8]. Достоверных сведений о наличии рецепторов СТГ на кисснейронах не получено.
Согласно данным литературы, прямое модулирующее влияние СТГ на активность нейронов, секретирующих ГнРГ, маловероятно, однако не исключается взаиморегуляция функций соматотрофов и гонадотрофов в гипофизе. Возможность взаиморегуляции этих функций определяется наличием рецепторов СТГ и СТГ-связывающих белков в цитоплазме и ядре гонадотрофов [1]. В ряде исследований указывается, что соматотрофы являются необходимым компонентом для нормального развития гонадотрофных питуицитов, вероятно, вследствие облигатности паракринного взаимодействия [1, 9]. Сведения о влиянии СТГ на секрецию ЛГ и ФСГ противоречивы. У некоторых видов животных показано достоверное снижение базальных и стимулированных уровней гонадотропинов при врожденном дефиците СТГ или резистентности к нему [10]. В то же время у женщин с аменореей введение СТГ сопровождалось снижением амплитуды выброса и концентрации ЛГ без изменения характеристик секреции ФСГ [11].
Многие авторы высказывают предположение о вовлечении СТГ в механизмы инициации пубертата, однако точный триггер периода полового созревания и роль в нем ростовых сигналов окончательно не выяснены. Более вероятно, что гормон роста обладает модулирующей ролью в запуске процессов полового созревания. Данная теория подкрепляется фактом задержки пубертата у детей с резистентностью к гормону роста вне зависимости от массы тела [12], более поздним наступлением первой беременности у грызунов с мутацией гормона роста [13].
Влияние СТГ на структуры яичников
Безусловно, СТГ выполняет значимую роль в регуляции фертильного статуса не только на уровне гипоталамических и гипофизарных структур, но и непосредственно на уровне органов-мишеней — яичников и матки. Гормон роста стимулирует выработку прогестерона и эстрадиола клетками гранулезы у животных и человека, при этом его действие модифицируется в зависимости от фазы менструального цикла [14—17]. Так, у крыс СТГ потенцирует эффекты ФСГ, способствуя активации ранних реакций стероидогенеза посредством повышения локальной секреции инсулиноподобного фактора роста 1-го типа (ИФР-1), и, как следствие, секреции прогестерона. В то же время СТГ ингибирует индуцированную ФСГ активацию ароматазы и соответственно синтез эстрадиола [17]. С большей вероятностью механизм, обеспечивающий возможность реализации антагонистического действия СТГ на стероидогенез, обусловлен увеличением концентрации ИФР-1 на поздних этапах стероидогенеза с последующей блокадой негативного влияния СТГ на синтез эстрадиола. Временнóе разнонаправленное действие СТГ также подтверждается рядом экспериментов на животных моделях, демонстрирующих модификацию эффектов гормона роста до и после периода полового созревания, в ранние утренние часы и в вечернее время [17, 18].
Результаты исследований [19, 20], посвященных влиянию СТГ на фолликулогенез, также противоречивы ввиду расхождений результатов экспериментов in vivo и in vitro. Предположительно СТГ выполняет важную роль в росте и созревании фолликулов. Так, у животных с мутациями рецептора гормона роста наблюдалось увеличение числа примордиальных фолликулов наряду с уменьшением вторичных, преантральных и антральных, повышение частоты фолликулярной атрезии. Восполнение дефицита СТГ в таких случаях улучшало фолликулогенез только у молодых особей и не влияло у взрослых животных. У трансгенных мышей повышенная экспрессия СТГ сочеталась с усилением фолликулогенеза, увеличением массы яичников, частоты овуляции, что, однако, не приводило к усилению репродуктивного потенциала ввиду выраженных нарушений углеводного обмена [21]. При проведении экспериментов in vitro показано, что у грызунов гормон роста усиливает пролиферацию текаклеток и клеток гранулезы в преантральных фолликулах [22]. Аналогичное влияние СТГ продемонстрировано в отношении улучшения качества ооцитов человека при проведении протоколов экстракорпорального оплодотворения (ЭКО) [23], в которых при дополнительном назначении СТГ удавалось достичь большего числа эмбрионов, что, однако, не отразилось на показателе достигнутых беременностей. Полагают, что позитивные эффекты гормона роста реализуется за счет кумулюсных клеток. В эксперименте у крыс положительное влияние СТГ регистрировалось только в ооцит-кумулюсных комплексах, но не в случае ооцитов, освобожденных от яйценосного холмика [24].
Рецепторы СТГ визуализированы в клетках желтого тела — основного эндокринного органа, поддерживающего беременность в ранние сроки. Как и в случае фолликулогенеза, основное действие гормона роста заключается в активации пролиферации и антиапоптотическом влиянии. У человека СТГ стимулирует пролиферацию лютеинизированных клеток гранулезы [25]. У мышей с дефектами рецептора гормона роста установлено меньшее количество желтых тел, впрочем, как и антральных фолликулов [26].
Локальная овариальная продукция СТГ
В настоящее время все большее внимание уделяется вопросам локальной овариальной секреции СТГ. У человека иммунореактивность к гормону роста отмечена в клетках гранулезы, ооцитах и практически отсутствует в текаклетках и клетках кумулюса [27]. Выделение мРНК СТГ только в цитоплазме ооцита и редко в гранулезных клетках примордиальных фолликулов свидетельствует об инициации экспрессии гена СТГ в период раннего развития фолликулов. В пользу наличия аутокринной овариальной системы СТГ выступает также факт сочетанной коэкспрессии гена рецептора СТГ [28]. Физиологическое значение яичниковой секреции гормона роста и факторов, ответственных за регуляцию локальной секреции, является дискуссионным. Некоторыми авторами высказывается предположение о влиянии классических факторов, усиливающих секрецию СТГ, на основании изучения иммунореактивности фолликулярной ткани человека по отношению к рилизинг-гормону и его рецептору, что тем не менее не подтвердилось в экспериментах на животных [29, 30]. Под влиянием грелина продемонстрировано стимулирование секреции ГР, но отсутствуют данные об усилении его синтеза [31].
Гормон роста и матка
Матка, как и яичники, является органом реализации физиологического действия и местом секреции СТГ, маточная иммуноэкспрессия СТГ подтверждена в период беременности и вне ее, а рецепторный паттерн изменчив в течение менструального цикла, достигая максимального уровня в эндометрии и децидуальной оболочке в среднюю и позднюю лютеиновую фазу и минимального — в пролиферативную и раннюю лютеиновую фазы [32, 33]. Пролиферативный эффект является ведущим компонентом многофакторного действия СТГ на детородный орган. Женщины с дефицитом гормона роста характеризуются меньшими размерами матки в сравнении с пациентками, у которых проводилась гормональная заместительная терапия [34].
Учитывая прямую корреляцию экспрессии мРНК СТГ с эстроген-индуцированной гипертрофией матки [35], логично предположить, что СТГ выполняет значимую функцию в подготовке матки к имплантации. У мышей, нокаутированных по гену рецептора гормона роста, наблюдалось меньшее количество сайтов имплантации [26]. Большое внимание уделяется роли СТГ в процессах канцерогенеза матки и шейки матки. Показано, что митогенные эффекты в первую очередь ассоциированы с локальной продукцией СТГ [36]. Экспрессия СТГ резко повышена при эндометриозе и ассоциирована со степенью агрессивности эндометриальной карциномы [37]. Как и в случае с яичниковой тканью, основными регуляторами секреции СТГ представляются ГнРГ и СТГ-ингибирующий фактор [38].
Инсулиноподобный фактор роста-1 и гипоталамо-гипофизарный уровень регуляции репродуктивной функции
Вклад главного медиатора эффектов СТГ — ИФР-1 в реализацию и нейроэндокринный контроль репродуктивной функции в экспериментах in vivo оценить достаточно сложно. Большинство исследователей придерживаются мнения, что регуляторная роль ИФР-1 реализуется на уровне гонад, при этом отсутствуют значимые исследования, посвященные изучению влияния гормона на секрецию гонадотропинов и гонадолиберина. Проведение экспериментов затрудняется тем, что особи с дефектом рецептора ИФР-1 погибают в ранние сроки после рождения ввиду развития острой дыхательной недостаточности [39].
Общеизвестно, что биодоступность ИФР-1 определяется количественными характеристиками 6 ИФР-связывающих белков (ИФРСБ) [40]. В случае гиперэкспресии ИФРСБ-6 у трансгенных мышей наблюдалось 50% снижение уровня ЛГ [41], в то же время при избытке ИФРСБ-1 визуализировалась гонадотрофная гиперплазия [42]. У мышей с делециями в генах ИФРСБ наряду с множественными метаболическими дефектами и низкорослостью не отмечено нарушений фертильности [43]. Несмотря на скудные данные in vivo, более 20 лет назад ряд исследователей in vitro убедительно продемонстрировали влияние ИФР-1 на секрецию ГнРГ. Показано, что ИФР-1 обладает способностью активировать промотор гена ГнРГ [44] и стимулирует выработку рилизинг-гормона при добавлении к нейрональным клеткам линии GT1−7 [45]. Рецепторы ИФР-1 локализованы в различных регионах головного мозга, в том числе на мембранах нейронов, секретирующих ГнРГ [46]. При введении ИФР-1 самкам крыс и мышей отмечались повышение секреции ГнРГ и преждевременная инициация пубертата. В то же время у грызунов с дефектами рецепторов ИФР-1 на ГнРГ-нейронах наблюдалась задержка пубертата без нарушения фертильности во взрослом возрасте, что, предположительно, объясняется поздним морфологическим созреванием данных нейронов [47]. По всей вероятности, система ИФР-1 рецепторного сигналинга необходима для пролиферации клеток—предшественников ГнРГ-нейронов, адекватного роста аксонов и формирования синапсов, позволяющих клеткам осуществлять нейрональную коммуникацию. Другие исследователи полагают, что снижение ИФР-1 в гипоталамусе лежит в основе нейроэндокринных изменений, происходящих в период угасания репродуктивной функции, что было продемонстрировано на крысах [48]. Как и в случае с СТГ, ряд эффектов ИФР-1 на ГнРГ-нейроны реализуются опосредованно через систему KISS/KISS1R. Так, ИФР-1 стимулирует экспресиию гена кисспептина в гипоталамусе, а интракраниальное и периферическое введение ИФР-1 приводило к активации кисснейронов [49].
Наряду с прямыми эффектами ИФР-1 на ГнРГ-нейроны отмечено влияние гормона на гипофиз. Клеточные линии-модели гонадотрофов — LβT2 и αТ3−1 — широко экспрессировали ИФР-1-рецепторы [50], активация которых приводила к усилению митотической активности. Ряд исследователей [51, 52] продемонстрировали повышение выработки и секреции ЛГ под влиянием ИФР-1, однако для реализации эффекта требовалось длительное введение гормона.
Овариальные эффекты ИФР-1
В литературе активно обсуждается влияние ИФР-1 на функционирование яичников в норме и патологии. Аналогично Г.Р. большую роль на этом уровне репродуктивной оси играет локальная продукция гормона. Показано, что клетки гранулезы синтезируют ИФР-1, клетки теки — ИФР-2, в то время как рецептор ИФР-1 представлен в обеих частях фолликула и реализует эффекты обоих гормонов [53]. Основное физиологическое влияние ИФР-1 заключается в содействии пролиферации, дифференциации и повышении жизнеспособности фолликулярных клеток [54]. По мнению многих исследователей [55], влияние ИФР-1 реализуется в раннюю фазу фолликулогенеза и выражается в стимуляции рецепторов ЛГ и ФСГ с последующим повышением активности вторичных мессенджеров. Степень выраженности эффектов локального ИФР-1 принципиально зависима от количества ИФРСБ. Показано, что концентрация ИФР-1 в фолликулярной жидкости не изменяется в течение роста фолликула, в то время как содержание ИФРСБ меняется пропорционально его эстрогеновой активности. В атрезированных фолликулах наблюдается максимальная концентрация ИФРСБ [56]. Таким образом, ИФРСБ обладает способностью тормозить реализацию эффектов ИФР-1 путем блокировки связи гормона со специфическим рецептором на клетках гранулезы и текаклетках, что приводит к задержке роста и дифференциации фолликулов. Регуляция секреции ИФРСБ достигается двумя путями — транскрипционный контроль мРНК, экспрессия которой снижается в период роста фолликула, и контроль деградации под действием специфической протеазы в активных эстрогенпродуцирующих фолликулах [56].
Согласно данным литературы [26, 56, 57], регуляция секреции ИФР-1 в яичниках независима или в незначительной степени связана с изменением концентрации СТГ в системном кровотоке. В экспериментах на животных введение рекомбинантного гормона роста или его антагониста не приводило к закономерной модуляции секреции овариального ИФР-1. Не отмечалось и изменения экспрессии гена ИРФ-1 или рецептора ИФР-1 в доминантном фолликуле, в отличие от других органов СТГ-зависимого синтеза ИФР-1 — печени, матки [58].
Наряду с фактором роста эндотелия сосудов (ФРЭС) ИФР-1 выполняет значимую роль в регуляции ангиогенеза и апоптоза желтого тела [59, 60]. У животных ИФР-1 способствует усилению синтеза прогестерона [60].
ИФР-1 как фактор развития матки и циклических изменений эндометрия
Рецепторы ИФР-1 широко представлены в тканях матки, включая эпителиальные, стромальные клетки [61, 62]. В экспериментах на животных локальная маточная экспрессия этого фактора возрастала в течение пролиферативной фазы менструального цикла, а также в ответ на воздействие эстрогенов [63]. Последний факт, вероятно, определяет взаимозависимые с эстрогенами механизмы реализации влияния ИФР-1 на структуры матки. Мыши с дефектами ИФР-1 характеризуются наличием гипоплазированной матки и бесплодны. Лечение эстрадиолом таких животных индуцировало минимальную и отсроченную пролиферацию эпителиальных клеток, в то время как после пересадки детородного органа особям с интактным ИРФ-1 матка развивалась до нормальных размеров [64]. В то же время у овариэктомированных мышей маточная мРНК ИФР-1 была резко снижена и нормализовалась при системном введении эстрадиола. Стимулирующий эффект эстрогенов в матке при этом превосходил по значимости влияние СТГ, в отличие от печени, где эстрогены давали минимальный эффект на секрецию ИФР-1 [65]. Учитывая аналогичное изменение маточной экспрессии ИФР-1 в течение менструального цикла, данный регуляторный механизм, по всей вероятности, характерен и для человека. Показано, что значимая роль в этом процессе отводится ИФРСБ. По аналогии со зреющими фолликулами ИФРСБ-1 модулирует концентрацию ИФР-1 в эндометрии в течение менструального цикла. У женщин с внутриматочными рилизинг-системами с левоноргестрелом наблюдалось повышение количества ИФРСБ, что соответственно приводило к снижению ИФР-1 и, как следствие, к подавлению пролиферации и усилению дифференцировки эндометрия [66].
В последнее время все чаще обсуждается роль инсулиноподобных факторов роста в осуществлении успешной эмбриональной имплантации, однако механизм влияния ИФР-1 окончательно не выяснен. Полагают, что ИФР-1 и ИФР-2 ответственны за контроль погружения бластоцисты в эндометрий [67].
Заключение
Функционирование всех звеньев женской репродуктивной оси тесно интегрировано с системой регуляции роста и развития организма. СТГ является одним из неотъемлемых факторов инициации пубертата, контроля созревания фолликулов, овуляции и яичникового стероидогенеза. В период полового созревания гормон роста, обладая возможностями тонкой настройки функционирования высших отделов репродуктивной функции, является неким источником информации для гипоталамических нейронов о состоянии готовности систем и органов к запуску дополнительной гормональной оси, ответственной за реализацию передачи наследственного материала. СТГ в определенной степени ответственен за гармоничное развитие предымплантационнных эмбрионов, а эволюционная схожесть с пролактином определяет позитивное влияние на гестационный процесс. Наряду с СТГ гипофизарного происхождения огромное значение в физиологическом функционировании женских половых органов имеет локальная продукция данного гормона. Основное влияние маточного и овариального СТГ заключается в поддержании пролиферативных процессов и контроле апоптоза, соотношение которых определяет ключевую роль в канцерогенезе и является краеугольным камнем многочисленных исследований, посвященных оценке факторов риска развития злокачественных процессов.
В экспериментах на клеточных линиях и животных моделях продемонстрировано влияние ИФР-1 на физиологическое развитие и морфологическое созревание клеток гипоталамуса и гипофиза, секретирующих ГнРГ и гонадотропины, что подтверждает вовлечение гормона в систему репродукции на высших уровнях регуляции. По аналогии с СТГ локальная овариальная секреция ИФР-1 определяет процессы фолликулогенеза и функционирования желтого тела. Реализация влияния ИФР-1 на функцию яичников взаимозависима от секреции СТГ и эстрогенов и контролируется вариативной экспрессией основных ИФРСБ. Неоспорима роль ИФР-1 в регуляции развития матки и поддержании циклической пролиферации эндометрия.
Таким образом, в последние 20 лет проведено огромное количество исследований, раскрывающих тонкие механизмы взаиморегуляции важнейших систем организма — систем размножения и роста, что послужило отправной точкой для разработки новых методик вспомогательных репродуктивных технологий и приблизило понимание начальных процессов онкогенеза внутренних половых органов.
Работа выполнена при поддержке гранта Президента Российской Федерации для молодых докторов наук №МД-3061.2017.7
Авторы заявляют об отсутствии конфликта интересов.
Возможности медикаментозной коррекции недостатка гормона роста у взрослых
Каковы основные причины соматотропной недостаточности у взрослых? Каковы ее клинические проявления? Какие методы лабораторно подтверждают диагноз? Как известно, гормон роста (ГР) был последним из классических гормонов, который начали применять с
Каковы основные причины соматотропной недостаточности у взрослых?
Каковы ее клинические проявления?
Какие методы лабораторно подтверждают диагноз?
Как известно, гормон роста (ГР) был последним из классических гормонов, который начали применять с целью заместительной гормональной терапии у взрослых. У детей история медикаментозной коррекции низкорослости насчитывает около тридцати лет, ко взрослым же лечение с использованием биосинтетических препаратов ГР впервые было применено около десяти лет назад. В течение многих лет с целью терапии использовался ГР, получаемый из гипофизарных экстрактов, однако в 1985 году, когда были описаны четыре случая болезни Крейтцфельдта — Якоба у реципиентов гипофизарного ГР, использование последнего было запрещено. Это послужило отправной точкой для начала работ по производству биосинтетического ГР [2].
Использование ГР у детей и произошедший параллельно научный прорыв в отношении диагностирования дефицита гормона роста у взрослых привели к появлению в клинической эндокринологии новой нозологии и, соответственно, новых методов обследования и лечения. Ни один конгресс или симпозиум, проходящий в настоящее время, не обходится без докладов, посвященных проблемам диагностики дефицита ГР (ДГР) у взрослых, выявлению нарушений, сопровождающих заболевание, и принципам подбора терапии.
Для того чтобы создать более точное представление о спектре нарушений, развивающихся на фоне соматотропной недостаточности, необходимо кратко напомнить о структуре ГР, механизмах его секреции и влиянии на органы и системы. ГР, синтезируемый соматотрофами передней доли гипофиза, относится к особому семейству пептидных гормонов, в состав которого кроме ГР входят пролактин (ПРЛ) и плацентарный соматомаммотропин человека (СМЧ). Секреция ГР находится под контролем двух гипоталамических гормонов: соматостатина или соматотропин-ингибирующего фактора (СИФ), который оказывает блокирующее действие на синтез и секрецию соматотрофами ГР. Соматотропин — рилизинг гормон (СРГ) — оказывает стимулирующее действие на соматотрофы, что проявляется увеличением продукции ГР.
Как многие гормоны, ГР синтезируется в определенном импульсном режиме, пики секреции приходятся на 22.00 и 4.00 часа.
Несмотря на существование специфических рецепторов ГР, его действие осуществляется посредством специфических факторов, аналогичных по своей структуре инсулину: инсулиноподобного ростового фактора I (ИФР-I) и инсулиноподобного ростового фактора II (ИФР-II). ИФР-I, действуя через собственные рецепторы, оказывает ростовые эффекты преимущественно в постэмбриональном онтогенезе организма. Действие ИФР-II проявляется преимущественно в процессе эмбриогенеза.
Многочисленные исследования, результаты которых публикуются в современных медицинских изданиях, красноречиво свидетельствуют о наличии серьезных нарушений в соматическом и психологическом статусе пациентов с декомпенсированной недостаточностью гормона роста. Эти нарушения характеризуются изменением соотношения жировая/мышечная ткань в сторону снижения удельного веса последней, увеличения удельного веса жировой ткани и сопровождаются висцеральным отложением последней. При проведении денситометрии обнаруживается снижение плотности костной ткани (МПК). Scacchi at al отметили обратно пропорциональную зависимость между индексом массы тела (ИМТ) и периодом полужизни ГР, а также амплитудой секреции ГР. Процент содержания жировой ткани находился в обратной зависимости от интегрального показателя концентрации ГР, определяемого в течение 24 часов.
Со стороны метаболических нарушений необходимо выделить снижение толерантности к углеводам при проведении инсулинтолерантного теста, увеличение продукции инсулина, проинсулина, повышение содержания триглицеридов плазмы крови, липопротеидов низкой и очень низкой плотности [3].
Не до конца изучено влияние недостаточности ГР на увеличение риска развития сердечно-сосудистых заболеваний, однако при ретроспективном исследовании 333 пациентов с гипопитуитаризмом выявлено, что в течение 22 лет случаи кардиоваскулярной смерти встречались в два раза чаще по сравнению с группой контроля. При проведении эхокардиографии исследователи обнаруживали снижение массы левого желудочка, уменьшение толщины перегородки и задней стенки желудочков, а также снижение фракции выброса левого желудочка.
Еще сравнительно недавно проблема дефицита ГР у взрослых не находила отражения в исследованиях эндокринологов, хотя вопросы, связанные с недостаточностью секреторной функции гипофиза, возникали с того времени, когда были впервые описаны пациентки с синдромом Шиена (Шихана). Данная патология обусловлена развитием инфарктов и кровоизлияний в раннем послеродовом периоде и характеризуется развитием пангипопитуитаризма. Долгие годы пациентки получали заместительную гормональную терапию глюкокортикоидами, тиреоидными гормонами, половыми стероидами, однако при этом продолжали предъявлять неспецифические жалобы на повышенную утомляемость, слабость, немотивированное увеличение массы тела. При попытке исследовать уровень гормонов сыворотки крови с целью выяснения степени компенсации имеющихся нарушений патологических отклонений обнаружено не было, а сниженному уровню ГР не придавали значения. В дальнейшем многочисленные клинические и лабораторные исследования продемонстрировали, что снижение секреции ГР в организме взрослого человека приводит к целому ряду нарушений, которые остаются незамеченными и не имеют такой яркой клинической окраски, как, например, гиперсекреция ГР и развивающаяся вследствие этого акромегалия.
Перечислим причины развития соматотропной недостаточности у взрослых
Количество пациентов, подвергшихся тем или иным вмешательствам на селлярной области, растет год от года, и связано это с повышением разрешающей способности диагностических методов, используемых при обследовании больных, и расширением лечебных возможностей современной медицины. Исходя из этого можно прогнозировать, что количество пациентов, нуждающихся в проведении скринингового обследования ДГР, будет увеличиваться год от года. Современная фармакология, в свою очередь, располагает целым спектром препаратов, призванных компенсировать соматотропную недостаточность; ниже приводится перечень средств, имеющихся на сегодняшний день в отечественной аптечной сети.
«Золотым стандартом» в диагностике ДГР у взрослых справедливо считается инсулинотолерантный тест. Необходимо оговориться, что его проведение возможно только после компенсации вторичного гипотиреоза и вторичного гипокортицизма, в противном случае результаты теста могут быть недостоверными.
В рамках исследования, проведенного в клинике эндокринологии ММА им. И. М. Сеченова и посвященного изучению целесообразности назначения препарата генноинженерного гормона роста взрослым, была обследована группа больных с подозрением на наличие соматотропной недостаточности.
В группу вошли 15 человек в возрасте от 15 до 45 лет: 12 женщин (80%) и трое мужчин (20%). Девять женщин (60%) были прооперированы по поводу макропролактином гипофиза, трое мужчин (20%) и трое женщин (20%) подверглись оперативному вмешательству по поводу краниофарингиомы гипофиза, у одного мужчины (6,7%) при проведении МРТ выявлена агенезия гипофиза. Среди всех обследованных пациентов задержка роста зафиксирована у троих мужчин (20%) в возрасте 16, 21 и 27 лет, оценка роста у них проводилась с использованием таблицы «Перцентильный график роста для мальчиков». У первого пациента рост был равен 148 см, при оценке перцентильных значений величина стандартного отклонения (SDS) составила –3,5. Рост второго и третьего пациентов был равен 145 и 152 см соответственно, но в связи с невозможностью оценить величину SDS исходя из паспортного возраста последняя была рассчитана исходя из костного. В первом случае паспортный возраст ровнялся 13-14 годам и SDS –2, во втором случае костный возраст соответствовал 16 годам и SDS –3. Структура эндокринных заболеваний, выявленных у пациентов с подозрением на соматотропную недостаточность, отражена в табл. 2.
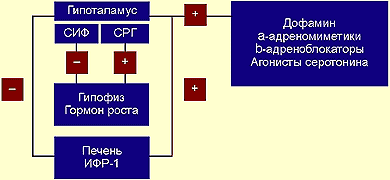 |
| Регуляция секреции гормона роста |
Перед проведением провокационных тестов, направленных на диагностику соматотропной недостаточности, всем пациентам был проведен комплекс лабораторно-диагностических мероприятий для уточнения соматического и гормонального статуса пациентов.
Большинство пациентов получали заместительную гормональную терапию по поводу вторичного гипотиреоза, вторичной надпочечниковой недостаточности, несахарного диабета; у всех было проведено скрининговое исследование концентрации свободного Т4, пролактина, ЛГ, ФСГ, эстрадиола с целью коррекции доз получаемых препаратов.
Исследование соматического статуса предусматривало определение следующих показателей: расчет индекса массы тела (ИМТ), вычисление отношения объем талии/объем бедер (ОТ/ОБ), определение уровня глюкозы, холестерина, триглицеридов, ЛПНП, ЛНВП, АЛТ, АСТ. Проводилось ЭКГ и измерение артериального давления с целью исключения патологии со стороны сердечно-сосудистой системы.
Для оценки качества жизни пациентов с рассматриваемой патологией использовался опросник, разработанный специально для пациентов с дефицитом ГР — QoL-AGHDA (Quality of Life — Assessment of Growth Hormone — Deficiency in Adults) и содержащий 25 вопросов, на которые необходимо было ответить «да» или «нет». Каждый положительный ответ оценивался в один балл; чем больше оказывалась полученная в результате сумма, тем ниже показатель качества жизни.
В ходе обследования были получены следующие результаты.
Нормальные показатели ИМТ (18 30) диагностировано у четырех человек (26,7%). У одного пациента наряду с задержкой роста был выявлен дефицит массы тела, ИМТ составил 15,9 (6,7%). У одной пациентки (6,7%) обнаружен сахарный диабет II типа. Признаки висцерального ожирения выявлены у четырех пациенток (26,7%).
При обследовании у шести пациенток обнаружено повышение гликемии натощак, которое составило 7,025 ± 0,12 ммоль/л; показатели гликемии у 11 пациентов были в пределах нормы и варьировали от 3,6 до 5,5 ммоль/л. Для исключения возможных нарушений углеводного обмена: тощаковой гипергликемии, нарушения толерантности к углеводам, сахарного диабета, гиперинсулинемии всем пациентам был проведен оральный глюкозотолерантный тест с 75 г глюкозы. При определении гликемии через 2 часа после приема 75 г глюкозы последняя составила 6,6 ± 0,14 ммоль/л. Сахарный диабет был выявлен у одной пациентки (гликемия 11,9 ммоль/л), еще у двоих пациентов определено нарушение толерантности к углеводам (гликемия 8,3 и 9,0 ммоль/л). При исследовании уровня С-пептида сыворотки крови были получены следующие результаты: базальная гиперинсулинемия (>2,5 нг/мл) обнаружена у пяти пациентов (3,33%) и составила 3,89 ± 0,1 нг/мл. Более чем двукратное увеличение концентрации С-пептида через 120 минут после стимуляции отмечено у девяти пациентов (60%) и составило 10,5 ± 0,4 нг/мл. При оценке липидного обмена гиперхолестеринемия выявлена у десяти пациентов (66,6%), гипертриглицеридемия обнаружена у семи пациентов (46,6%).
Всем пациентам был проведен инсулинотолерантный тест с целью подтверждения дефицита гормона роста. В условиях стационара пациентам внутривенно вводился инсулин короткого действия: Humulin R или Actrapid HM, из расчета 0,1 ЕД/кг [1]. Исходно через каждые 15 минут в дальнейшем пациентам проводилось определение гликемии в капиллярной крови и забор крови для последующего выявления уровня гормона роста в сыворотке крови.
В ответ на инсулин-индуцированную гипогликемию у 12 обследованных (80%) концентрация ГР не превысила 5 нг/мл, а составила в среднем 0,76 ± 0,013 нг/мл. У троих на фоне гипогликемии было зарегистрировано повышение уровня ГР до 30,78 ± 0,45 нг/мл.
По результатам проведенного теста девяти пациентам была назначена терапия генотропином (Pharmacia&Upjohn). Двое пациентов с задержкой роста получают препарат в настоящее время, у семи человек завершился шестимесячный курс терапии. При расчете дозы препарата использовались рекомендации Janssen и соавт., дозировка генотропина определялась из расчета 0,018 МЕ/кг для шести пациентов, а для трех пациентов с задержкой роста доза была вычислена из расчета 0,1 МЕ/кг [2].
Спустя 6 месяцев после начала терапии все пациенты прошли повторное обследование. Сколько-нибудь значимых изменений ИМТ отмечено не было, показатель ОТ/ОБ снизился у пяти человек, у двоих он остался на прежнем уровне. У троих пациентов выявлено некоторое снижение концентрации холестерина, составившее 8,4, 9,7 и 26,6% от первоначального уровня. У троих пациентов не определено каких-либо изменений, у одного пациента выявлено повышение концентрации холестерина на 17% от исходного. По показателям содержания триглицеридов выявлены следующие данные: у четверых пациентов снижение ТГ составило 56,4, 47,2, 3,7 и 6,3% от исходного. В одном случае динамики отмечено не было, а у двоих человек зафиксировано повышение концентрации ТГ, составившее 68 и 92% от исходного уровня. Снижение уровня ТГ и холестерина на фоне терапии генотропином подтверждается данными зарубежных исследователей, демонстрирующих нормализацию показателей липидного обмена на фоне заместительной терапии.
Перед началом терапии средний показатель качества жизни составил 12,5 балла, а на последней неделе терапии он снизился до 8,9 балла (необходимо отметить, что, по данным Holmes и соавт., у здоровых пациентов, обследованных в Швеции, он составляет 3,7).
Пациент с задержкой роста за 6 месяцев лечения вырос на 5 см, и его рост на момент окончания терапии составил 157 см.
Среди зафиксированных пациентами побочных эффектов чаще всего встречались: отеки, артралгии и миалгии, которые развивались на 3-6-й неделе терапии; о них сообщили четверо пациентов. Аналогичные данные демонстрируют и зарубежные исследователи, проводившие наблюдения за более многочисленными группами пациентов, получавших ГР.
По результатам проведенного исследования можно сделать следующие выводы.
Литература
1. Алгоритмы диагностики и лечения болезней эндокринной системы/ Под ред. И. И. Дедова, 1997.
2. Дедов И. И., Тюльпаков А. Н., Петеркова В. А. Соматотропная недостаточность, 1998.
3. Monson J. P. Growth Hormone Therapy. Oxf, 1999. Р. 93-103.
