Гранулоцитарный росток расширен что это значит
Диагностика и лечение хронической аутоиммунной гемолитической анемии
Больная Ш., 80 лет, пенсионерка. Из анамнеза известно, что в течение последних двух лет неоднократно проходила амбулаторное и стационарное лечение по поводу хронической B12–фолиеводефицитной анемии, диагностированной на основании анемического синдрома в сочетании с гиперхромией и макроцитозом эритроцитов. Стернальная пункция, определение уровня витамина B12 и фолиевой кислоты не проводились. Отмечался временный незначительный положительный эффект лечения витамином B12. С конца 2011 года, несмотря на ежемесячное введение витамина B12 в дозе 500γ в сочетании с фолиевой кислотой, стала нарастать анемия (14.02.2012 г. гемоглобин – 54 г/л). Для обследования и лечения госпитализирована в больницу № 40 с диагнозом: B12–фолиеводефицитная анемия тяжелой степени. ИБС. Стенокардия напряжения II ф. к. Гипертоническая болезнь II ст. Желчнокаменная болезнь. Хронический калькулезный холецистит. Мочекаменная болезнь. Конкремент правой почки, простые кисты обеих почек. Полипы желудка.
При поступлении жалобы на выраженную общую слабость, головокружения, головную боль, учащенное сердцебиение, перебои в работе сердца.
При объективном осмотре отмечены субиктеричность кожи и слизистых оболочек, умеренная гепатомегалия (+2 см) и спленомегалия (+ 2 см).
Результаты клинического анализа в динамике представлены в таблице 1.
Таблица 1. Клинические анализы крови пациентки Ш. в динамике
 | 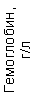 | 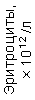 | 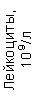 | 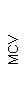 | 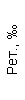 |  | 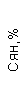 | 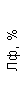 | 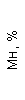 | 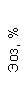 | 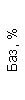 | 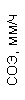 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 15.02.12 | 54 | 1.39 | 10.5 | 133 | 80 | 2 | 66 | 21 | 9 | 2 | — | 75 |
| 11.03.12 | 50 | 1.41 | 11.8 | 114 | 98 | 4 | 75 | 11 | 4 | 3 | 1 | 78 |
| 15.03.12 | 49 | 1.31 | 17.8 | 121 | 288 | 4* | 60 | 23 | 5 | 1 | — | 78 |
| 20.03.12 | 72 | 1.93 | 11.4 | 116 | 297 | 2 | 73 | 14 | 7 | 2 | 0 | 46 |
| 27.03.12 | 66 | 1.9 | 11 | 108 | 202 | 2 | 60 | 26 | 7 | 3 | 0 | 40 |
| 12.04.12 | 70 | 1.75 | 1.9 | 112 | 104 | 3 | 62 | 24 | 11 | 0 | 0 | 27 |
| 26.04.12 | 93 | 2.56 | 5.7 | 109 | 148 | 3 | 74 | 13 | 9 | 0 | 0 | 11 |
| 24.06.12 | 111 | 3.42 | 4.7 | 97 | 7 | 2 | 69 | 21 | 10 | 0 | 1 | 15 |
| 16.08.12 | 120 | 3.97 | 5.8 | 93 | 12 | — | 71 | 19 | 9 | 1 | 0 | 40 |
Примечание: * в лейкоцитарной формуле 15.03.12 выявлялись также миелоциты (2%) и метамиелоциты (5%).
В биохимическом анализе крови – повышение уровня креатинина (189 ммоль/л), билирубина (58 ммоль/л) за счет непрямого билирубина.
УЗИ органов брюшной полости: гепатоспленомегалия; камни желчного пузыря; диффузные изменения поджелудочной железы; простые кисты обеих почек, конкремент правой почки.
ФГДС: два полипа желудка размером до 0,5 см.
Учитывая высокий риск сердечно-сосудистых осложнений у пожилой пациентки с анемией тяжелой степени, проведены трансфузии эритроцитарной взвеси. На основании клинико-лабораторных данных (спленомегалия, гипербилирубинемия, гиперхромная анемия с ретикулоцитозом) и неэффективности лечения витамином B12 и фолиевой кислотой заподозрена гемолитическая анемия.
При исследовании крови на антиэритроцитарные антитела выявлены аутоантитела класса IgG ++++.
Результаты стернальной пункции представлены в таблице 2.
Таблица 2.Миелограмма пациентки Ш. от 17.02.12 г.
Заключение
Клеточный костномозговой пунктат. Эритропоэз – нормобластический. Гиперплазия эритроидного ростка – 74,8%. Со стороны эритрокариоцитов отмечаются клетки с цитоплазматическими мостиками, скопления в виде «эритроидных островков».
Мегакариоциты различной степени зрелости с умеренным тромбоцитообразованием.
На основании данных миелограммы (гиперплазия эритроидного ростка при нормобластическом типе кроветворения) и выявления антиэритроцитарных антител диагностирована аутоимунная гемолитическая анемия с тепловыми антителами. При дополнительном обследовании признаков вторичного характера анемии не выявлено.
С 11.03.12 г. начата пульс-терапия метипреднизолоном в дозе 500 мг 1 раз в день внутривенно в сочетании с пероральным приемом преднизолона в дозе 45 мг в сутки под прикрытием гастропротекторов. После 5 дней лечения анемический синдром продолжал нарастать, появился выраженный сдвиг лейкоцитарной формулы влево, увеличение количества ретикулоцитов (табл.1). Доза преднизолона перорально увеличена до 75 мг в сутки, к лечению добавлен азатиоприн по 100 мг/сутки per os, проведена трансфузия1 дозы эритроцитарной взвеси.
С 20.03.12 г. с учетом сохраняющегося гемолиза (ретикулоциты 297‰) проведен второй курс пульс-терапии метилпреднизолоном в дозе 500 мг в сутки № 4, однократно введен внутривенно циклофосфан в дозе 600 мг.
Лечение больная переносила хорошо. С 27.03.12 г. отмечена тенденция к увеличению уровня гемоглобина без поддерживающих гемотрансфузий. Решено продолжить введение циклофосфана по 200 мг в сутки, отменить азатиоприн. Анемический синдром продолжал уменьшаться: к 12.04.12 г. уровень гемоглобина достиг 70 г/л, снизился гемолиз (ретикулоцитов 104‰), однако развилась лейкопения (1,9×10 9 /л), в связи с чем циклофосфан был временно отменен. После восстановления количества лейкоцитов лечение циклофосфаном по 200 мг дважды в неделю было возобновлено на фоне постепенного снижения дозы преднизолона.
Больная в удовлетворительном состоянии 28.04.12 г. выписана из стационара. На амбулаторном этапе продолжено введение циклофосфана по 200 мг в сутки 2 раза в неделю, преднизолон в течение месяца полностью отменен.
В течение нескольких месяцев получала поддерживающую терапию циклофосфаном по 200 мг в сутки 2 раза в неделю (суммарная доза составила 7200 мг). На этом фоне уровень гемоглобина стабилен в пределах 100–120 г/л, количество ретикулоцитов не превышает 20%.
Комментарий к клиническому случаю
Аутоиммунная гемолитическая анемия (АИГА) – гетерогенная группа заболеваний и синдромов, обусловленных повышенным разрушением эритроцитов вследствие образования аутоантител. Частота АИГА во всех возрастных группах составляет 1:40000 – 1:80000, причем женщины болеют в 2 раза чаще мужчин. Выделяют первичные (идиопатические) и вторичные АИГА, которые чаще всего развиваются при лимфомах, солидных опухолях и заболеваниях соединительной ткани. По серологическим свойствам различают АИГА с тепловыми (85%) и холодовыми (15%) антителами; по месту разрушения эритроцитов выделяют АИГА с внутриклеточным (наиболее частым), внутрисосудистым и смешанным гемолизом.
Клинические проявления АИГА:
При внутрисосудистом гемолизе моча приобретает темно-бурую или черную окраску.
Лабораторные критерии:
Стандарт первой линии терапии АИГА – пероральные глюкокортикостероиды в начальной дозе 1 мг/кг в сутки, возможно проведение пульс-терапии метилпреднизолоном в дозе 0,5–1,0 г/сутки внутривенно в течение 3-5 дней. Второй линией терапии является спленэктомия, которая используется при отсутствии эффекта глюкокортикостероидов в течение 4–6 месяцев. У пожилых пациентов показано назначение иммунодепрессивных и цитостатических препаратов (азатипоприн, циклофосфон, циклоспорин). Значительно реже используют моноклональные антитела (ритуксимаб) и иммуноглобулин. Выживаемость больных АИГА в течение 5 лет составляет 75%.
При анализе данного случая обращает внимание длительное латентное течение заболевания у больной преклонного возраста с гиперхромной анемией, что послужило причиной ошибочного диагноза B12–дефицитной анемии (для АИГА характерен нормохромный характер анемии). С учетом возраста пациентки и наличия сопутствующих заболеваний было принято решение о подключении к лечению цитостатической терапии, позволившее получить ремиссию заболевания, отменить глюкокортикостероиды и отказаться от проведения спленэктомии.
Гранулоцитарный росток расширен что это значит
Острый лимфобластный лейкоз является самой распостраненной формой и составляет 80% от всех лейкозов у детей. А если говорить о всей детской онкологии, то количество острых лимфобластных лейкозов – составляет практически одну третью часть среди всех форм онкологических заболеваний у детей и подростков.
По статистике в Германии в Детском Раковом Регистре ежегодно регистрируется около 500 детей и подростков в возрасте от 0 до 14 лет с диагнозом острый лимфобластный лейкоз. А общее количество заболевших в возрасте до полных 18 лет ежегодно составляет примерно от 550 до 600 человек.
Согласно мировой статистике, 3,3-4,7 детей из 100 тысяч заболевают лейкемией в возрасте до 15 лет. Около 40-46 % случаев приходится на детей 2-6 лет.
Именно поэтому не смотря на недостаток знаний о данном заболевании крайне важно его изучение.
Изучить патогенез острого лимфобластного лейкоза на примере статистических данных и клинического случая на базе онко-гематологического центра им. Ф.П.Гааза ГБУЗ ПК «Краевая Детская Клиническая Больница».
Материалы и методы:
Для исследования была отобрана группа из 40 пациентов с диагнозом острый лимфобластный лейкоз.
Не установлено ни одной безусловно вызывающей лейкоз причины. Существует 3 теории происхождения заболевания: инфекционная, опухолевая и теория системно-пролиферативной природы лейкозов.
Сторонники инфекционной теории разделяются на 3 группы: одни считают, что возбудителем лейкоза могут быть различные микробы, вызывающие однотипную реакцию со стороны крови; другие стоят на точке зрения туберкулезной этиологии лейкоза; наконец, третьи придерживаются вирусной теории лейкоза.
Наиболее обоснованной является опухолевая теория, которая поддерживается большинством современных авторов. Доказательства сторонников этой теории основываются на общих закономерностях развития злокачественных опухолей и лейкозов, нередко их сочетаний, аналогичных нарушениях обменных процессов, клеточной анаплазии, однотипности наследственных влияний и гормональных нарушений — все это свидетельствует о патогенетической общности лейкозов и злокачественных новообразований.
Третья теория происхождения лейкоза — системно-пролиферативная — несколько сходна с опухолевой теорией и рассматривает патологический процесс как следствие нарушения патогенетических механизмов, регулирующих пролиферацию и созревание элементов крови. Причиной этих нарушений считают различные экзогенные и эндогенные факторы. К первой группе относят патогенное влияние вирусов (специфический вирус пролиферации), канцерогенные вещества и ионизирующую радиацию. Ко второй группе можно отнести влияние эндокринных нарушений в организме.
В происхождении лейкоза большое значение придается также конституциональным особенностям организма, в частности «врожденной генетической предрасположенности» (И. А. Кассирский, 1967). Это мнение основывается на случаях «семейного» лейкоза, особенно возникающего у однояйцевых близнецов.
Основным звеном в развитии острого лимфобластного лейкоза является то, что различные неблагоприятные факторы приводят к мутациям в клетках кроветворения. При этом клетки реагируют неудержимым ростом, невозможностью дифференцировки и изменением скорости нормального созревания. Поэтому все клетки, которые составляют лейкемическую опухоль, являются потомком одной стволовой клетки или клетки-предшественницы любого направления кроветворения. Клеточный субстрат при этом представлен бластами.
Такие опухоли обладают способностью расти вне органов гемопоэза, они неравноценны и представляют разные этапы прогрессии. Происходит нарастание процесса в виде выхода бластных элементов в периферическую кровь, перехода от лейкопении к лейкоцитозу.
Говоря об остром лимфолейкозе, патогенез до настоящего времени до конца не выяснен. Существует только ряд теорий.
Теория «опухолевой прогрессии» (клональная теория). Условно в патогенезе можно выделить следующие этапы:
1.этап повышенной мутабельности нормальных клеток;
4.этап независимой прогрессии.
3. Второй этап – поликлональной трансформации (злокачественный). Клоны клеток, прилежащие к стволовой клетке более дифференцированы и менее злокачественны, а клоны клеток, все дальше отстоящие от стволовой, менее дифференцированы и более злокачественны. С каждым последующим клоном растет нестабильность генетического аппарата клеток (клеточный полиморфизм, нарушается созревание, возникают атипичные элементы).
4. Пролиферация патологических клеток, идет в режиме геометрической прогрессии, подчиняясь закону митотического деления клеток. Мутантный клон автономен от каких-либо регулирующих воздействий организма и достаточно быстро вытесняет нормальные гемопоэтические клетки, замещая собой весь гемопоэз с последующим развитием синдромов: анемический, геморрагический и вторичного иммунодефицита.
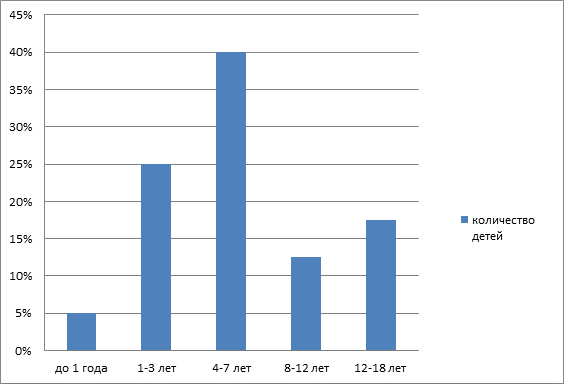
Процентное соотношение возраста пациентов.
Детей от 4-7 лет (16 человек), 1-3 лет (10 человек), 12-18 лет (7 человек), 8-12 лет (5 человек), до 1 года (2 человека).
Вывод: из 40 детей в отделении онкогематологии, наиболее подвержены заболеванию дети от 1 года до 7 лет.
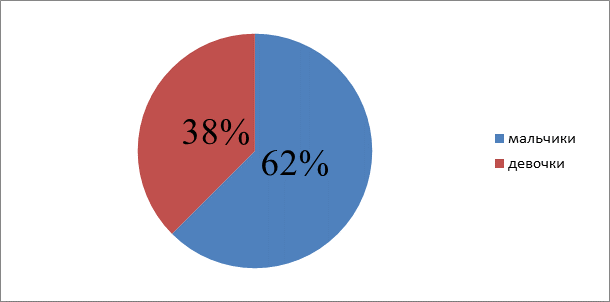
Процентное соотношение мальчиков и девочек.
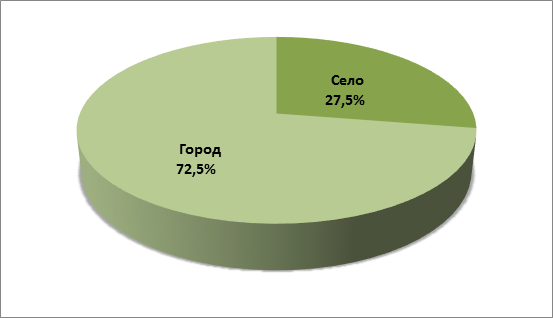
Соотношение сельских и городских детей.
Пациентка Х, 3,5 лет. Диагноз: острый лимфобластный лейкоз.
Пациентка часто болела ОРЗ и ОРВИ в период с 1 года до 2х лет. За 2 месяца до постановки диагноза родители отмечали обострение ситуации, часто беспокоила высокая температура (38.6), кашель, насморк. Лечение проходила в стационаре Ординской ЦРБ, назначались курсы антибактериальной и противовирусной терапии с периодичностью раз в 2 недели. К началу мая появились быстрая утомляемость, вялость, бледность кожи, по анализам крови была диагностирована анемия и пациентку направили на консультацию к гематологу. К 22.05.19 состояние стало ухудшаться, появилась геморрагическая сыпь на ногах и теле, печень и селезенка увеличены, с 23.05.19 больная госпитализирована в Ординскую ЦРБ, затем переведена в ОРИТ Кунгурской больницы. ОАК от 23.05.19 Hb- 52 г/л; Эр- 2,0; Тр-19; Л-0,5; лимфоциты- 92. После чего пациентка переведена в онкологическое отделение ПКДКБ с 24.05.19.
Для подтверждения диагноза оценивались показатели ОАК, миелограммы, проводились иммунофенотипирование клеток костного мозга, определение транслокаций методом ПЦР, кариологическое исследование, исследование ликвора.
На 8-й день госпитализации в ПКДКБ значительно улучшились показатели крови: ОАК от 06.06.19 Hb- 116 г/л; Эр- 4,12; Ht-33,5; MCV- 79,6; Тр-105;Л-3,58; лимфоциты-31; СОЭ-19.
Миелограмма от 13.05.19 Пунктат малоклеточный. Все ростки костного мозга угнетены. Гипопластическое состояние костного мозга.
Миелограмма: от 27.05.19 Костный мозг малоклеточный. Бластные клетки выше нормы. Заключение: бластная гиперплазия костного мозга.
Миелограмма от 02.10.19 Костный мозг многоклеточный. Бласты в пределах нормы. Гранулоцитарный росток незначительно сужен, эритроцитарный- расширен.
Кариологическое исследование от 30.05.19 (результат от 11.06.19). Обнаружен гиперплоидный клон с модальным числом хромосом- 52, что характерно для ОЛЛ из клеток-предшественников В-лимфоцитов.
Также была выявлена отягощенная наследственность ребенка в сфере онкологических заболеваний.
Числовые изменения кариотипа имеют большое значение для прогнозирования острого лимфобластного лейкоза. Вариант острого лимфобластного лейкоза со значительным увеличением числа хромосом (более 50) имеет относительно благоприятный прогноз: 80—90 % больных переживает пятилетний срок с момента постановки диагноза, однако выявление некоторых структурных перестроек в клетках лейкозного клона с такими числовыми нарушениями может ухудшить прогноз.
Проанализировав полученные результаты, можно сделать вывод, что острый лимфобластный лейкоз в онкологии у детей занимает одно из первых мест. Особенно подвержены дети в возрасте от 1 года до 7 лет. Самый маленький процент заболеваемости у детей до года.
Мальчики более подвержены данному заболеванию, чем девочки, то есть у мальчиков острый лимфобластный лейкоз встречается в 1,63 раза чаще, чем у девочек.
Большое значение в возникновении острого лимфобластного лейкоза имеют различные канцерогенные вещества. Именно это может объяснять более частое возникновение заболевания у городских жителей.
Рассмотренный ранее клинический случай доказывает волнообразность течения данного заболевания. Также прослеживается характерная длительность заболевания. В данном случае довольно ярко видна клиническая картина острого лимфобластного лейкоза, подкрепляемая типичными данными лабораторных исследований.
Учитывая высокий процент встречаемости острого лимфобластного лейкоза среди онкологических заболеваний у детей, вопрос изучения этого вида патологии остается актуальным и требует дальнейших исследований.
Гранулоцитарный росток расширен что это значит
Московский научно-исследовательский онкологический институт им. П.А. Герцена — филиал ФГБУ «Национальный медицинский исследовательский радиологический центр» Минздрава России, Москва, Россия
Научно-клиническое отделение гематологической хирургии Гематологического научного центра Минздрава РФ, Москва
Алгоритм исследования трепанобиоптатов костного мозга при миелодиспластических синдромах
Журнал: Архив патологии. 2014;76(1): 50-56
Капланская И. Б., Гласко Е. Н. Алгоритм исследования трепанобиоптатов костного мозга при миелодиспластических синдромах. Архив патологии. 2014;76(1):50-56.
Kaplanskaya I B, Glasko E N. Algorithm for examination of bone marrow trephine biopsy specimens in myelodysplastic syndromes. Arkhiv Patologii. 2014;76(1):50-56.
Московский научно-исследовательский онкологический институт им. П.А. Герцена — филиал ФГБУ «Национальный медицинский исследовательский радиологический центр» Минздрава России, Москва, Россия
На основании анализа более 1000 трепанобиоптатов костного мозга у больных с миелодиспластическими синдромами до начала какой-либо специфической терапии предложены гистологические критерии их оценки (алгоритм исследования), оптимальная панель иммуногистохимического исследования, гистологические критерии прогноза течения заболевания.
Московский научно-исследовательский онкологический институт им. П.А. Герцена — филиал ФГБУ «Национальный медицинский исследовательский радиологический центр» Минздрава России, Москва, Россия
Научно-клиническое отделение гематологической хирургии Гематологического научного центра Минздрава РФ, Москва
Патофизиологические механизмы МДС сложны и недостаточно изучены. В основе лежат выраженный апоптоз кроветворных элементов на ранних стадиях и усиленная пролиферация с утерей способности к дифференцировке клеток-предшественников на поздних стадиях заболевания. В качестве основного механизма МДС рассматривается нарастание степени апоптоза активно пролиферирующими ГСК, что ассоциируется с изменениями экспрессии в кроветворных клетках про- и антиапоптотических белков. В популяции CD34-положительных бластных клеток костного мозга больных МДС по сравнению с нормой увеличено соотношение продуктов экспрессии онкогенов c-MYC и BCL2 (соответственно способствующих увеличению апоптоза и повышающих выживаемость клеток). Важную роль в индукции апоптоза в клетках костного мозга играет система, включающая антиген Fas/Apo (CD95) и его лиганд Fas-L, которые при иммуноцитохимическом исследовании обнаруживаются на поверхностных мембранах клеток при МДС и не определяются на CD34+CD14+-клетках в норме. Имеется также корреляция между интенсивностью программированной гибели клеток эритроидного, гранулоцитарного, мегакариоцитарного ростка и стромальных клеток при МДС и экспрессией фактора некроза опухоли α (TNFα) и трансформирующего фактора роста β (TGFβ). С увеличением интенсивности апоптоза при МДС ассоциируется повышенная экспрессия белка р53 [1, 2].
Характерными клиническими симптомами МДС являются одно-, двух- и чаще трехростковая цитопении, существенно реже имеет место органомегалия и/или лимфаденопатия 5. Эта группа заболеваний привлекает к себе внимание еще с середины прошлого века. В последние годы классификация МДС постоянно совершенствуется, что обусловлено появлением новых данных о биологическом поведении входящих в него форм и совершенствованием диагностических возможностей. Последняя классификация, разработанная группой экспертов ВОЗ, была предложена в 2008 г. [6, 7]. В ней в отличие от предыдущих, базировавшихся в основном на данных гемо- и миелограммы, учитываются результаты цитогенетических исследований и в соответствии с этим выделено уже 8 вариантов МДС.
Классификация МДС (ВОЗ, 2008):
— рефрактерная анемия (РА);
— РА с ринг-сидеробластами;
— РА с мультилинейной дисплазией;
— РА с мультилинейной дисплазией и ринг-сидеробластами;
— РА с мультилинейной дисплазией и избытком бластов;
— РА с изолированной делецией 5q;
— МДС у детей (РА в детском возрасте).
В отличие от предыдущих классификаций в последней снижен уровень бластных клеток в костном мозге с 30 до 20%, при котором уже диагностируется трансформация МДС в острый лейкоз.
В соответствии с этой классификацией диагностика МДС до сих пор основывается на данных цитологического исследования периферической крови и/или костного мозга и наличии цитогенетических поломок.
По мере изучения МДС стали появляться работы о гистологической диагностике этого заболевания на основании исследования трепанобиоптатов костного мозга (ТБКМ). Однако и до последнего времени их гистологическая верификация вызывает большие трудности [8, 9].
В отличие от цитологического исследования периферической крови или костного мозга гистологическое исследование ТБКМ более точно позволяет оценить клеточность костного мозга, соотношение и локализацию клеток различных ростков гемопоэза, состояние стромы, васкуляризацию костного мозга, наличие реактивных изменений в виде лимфоидной гиперплазии, в том числе с формированием реактивных лимфоидных узелков, наличия плазматических клеток, гистиоцитов, макрофагов, тучных клеток, нарушения обмена железа.
В связи с этим на основании анализа более 1000 ТБКМ у больных с МДС, обследованных до начала терапии, и данных литературы мы сочли возможным предложить разработанный нами алгоритм гистологического исследования ТБКМ при МДС.
Алгоритм исследования трепанобиоптатов костного мозга при МДС (гистологические параметры оценки ТБКМ):— клеточность костного мозга;
— соотношение клеток гранулоцитарного и эритроидного ростков;
— локализация клеток различных ростков гемопоэза;
— отсутствие или наличие ALIP;
— наличие или отсутствие клеток-предшественников CD34-позитивных;
— наличие или отсутствие фиброза;
— наличие лимфоидной гиперплазии;
— наличие моноцитарно-гистиоцитарной пролиферации;
— наличие тучных клеток;
При МДС в ТБКМ чаще выявляется гиперплазия костного мозга (гиперпластический вариант) (рис. 1).МДС. 




Гипопластический вариант представляет большие трудности в диагностике, при этом надо проводить дифференциальную диагностику в первую очередь с апластической анемией и гипопластическим вариантом острого лейкоза [10]. Нередко для их дифференциации необходимо динамическое исследование ТБКМ в сопоставлении с клиническими и цитогенетическими данными. В отличие от МДС при апластической анемии мегакариоциты полностью отсутствуют или их количество минимальное, в них отсутствуют признаки дисплазии. Дифференциация с гипопластическим вариантом острого лейкоза возможна в основном только с привлечением иммуногистохимического (ИГХ) исследования.
В отличие от цитологических препаратов только ТБКМ позволяют охарактеризовать локализацию клеток гемопоэза. Это особенно важно для атипичной локализации клеток-предшественников миелопоэза, так называемый ALIP (рис. 6). 

В гистологических препаратах ТБКМ в отличие от цитологических препаратов костного мозга можно охарактеризовать состояние стромы, что в первую очередь касается фиброзных изменений, степени их выраженности (рис. 8). 
Гистологическое исследование костного мозга, особенно с использованием ИГХ-исследования, позволяет оценить выраженность ангиогенеза (рис. 9). 
По нашим данным, примерно в 50% случаев МДС в ТБКМ имеет место лимфоидная гиперплазия разной степени выраженности. В ряде случаев она бывает выражена столь значительно, что возникает необходимость проведения дифференциальной диагностики с лимфопролиферативными заболеваниями, в частности Т-клеточной природы, которые нередко протекают с цитопеническим синдромом и картиной гипоплазии костного мозга, часто сопровождаемой вторичным МДС. В таких случаях дифференциальная диагностика возможна только с привлечением иммуногистохимических методов исследования.
В ряде работ, в том числе и наших исследованиях, показано, что в костном мозге при МДС имеет место увеличение CD8-положительных цитотоксических Т-лимфоцитов, которые наряду с нарушениями в генах, определяющих клеточный цикл, транскрипционными и супрессивными факторами, нарушениями в соотношении апоптоз/пролиферация играют роль в патогенезе заболевания, подавляя дифференцировку эритроидных и гранулоцитарных предшественников 18.
В развитии цитопении при МДС также может играть определенную роль наличие в клетках костного мозга различных вирусов. По нашим данным, при ИГХ-исследовании ТБКМ в мегакариоцитах, лимфоидных клетках, клетках эритроидного и гранулоцитарного ростка выявляются вирус Эпштейна-Барр, цитомегаловирус, вирусы простого герпеса I и II типа (рис. 10). 
На основании изложенных данных мы предлагаем не только алгоритм исследования ТБКМ при МДС, но и оптимальную, на наш взгляд, панель ИГХ-исследования.
Следует отметить, что на основании ТБКМ не всегда можно верифицировать вариант МДС в соответствии с классификацией ВОЗ. Это возможно только при сочетании с клинико-лабораторными, в том числе цитогенетическими, данными. Однако на основании исследования ТБКМ можно диагностировать такой вариант, как 5q-синдром, для которого характерны гиперплазия и выраженная дисплазия в клетках мегакариоцитарного ростка, отсутствие изменений или минимально выраженные изменения в эритроидном и гранулоцитарном ростке. При таких вариантах МДС, как 7q, нарушениях в 8-й, 20-й и других хромосомах характерных гистологических изменений не найдено. Также имеются довольно характерные гистологические изменения при рефрактерной анемии с мультилинейной дисплазией, проявляющиеся снижением количества клеток гранулоцитарного ростка, задержкой их созревания вплоть до появления бластных клеток, которые могут располагаться не только эндостально. Для этого варианта также характерен выраженный неоангиогенез. При этом варианте в ТБКМ отмечается увеличение по сравнению с нормой количества эндотелиальных клеток, аналогичное выявляемому при остром миелобластном лейкозе.
На основании собственных и литературных данных мы выделили ряд гистологических параметров, влияющих на прогноз заболевания. В международной прогностической счетной системе при прогнозировании течения заболевания, в том числе трансформации в острый лейкоз, придается значение гистологическому исследованию костного мозга, в частности такому гистологическому показателю, как ALIP. Наличие последнего указывает на возможную эволюцию процесса в сторону острого лейкоза [19, 20]. Ряд исследователей считают, что ALIP и процент идентифицированных иммуногистохимически CD34-положительных клеток является важнейшим прогностически значимым признаком в разных группах риска при МДС. Помимо этих параметров, прогностическое значение придается фиброзу, который рассматривается как неблагоприятный фактор. Ниже приведены наиболее значимые прогностически неблагоприятные гистологические признаки, которые можно выявить в ТБКМ при МДС.
Гистологические прогностические критерии при МДС по данным трепанобиоптатов костного мозга:
— фиброз костного мозга;
— увеличение количества CD8-позитивных Т-клеток.
Как уже отмечалось, при МДС, особенно его гипопластическом варианте, необходимо проводить дифференциальную диагностику с такими заболеваниями, как апластическая анемия, гипопластический вариант острого лейкоза, а также с постмедикаментозными цитопениями. Нередко приходится проводить дифференциальную диагностику с такой группой заболеваний, как МДС/МПЗ (миелопролиферативные заболевания) [21, 22], а также вторичными МДС, которые могут сопровождать другие заболевания системы крови, в том числе специфическое поражение костного мозга при лимфомах, или быть обусловлены предшествующей полихимиотерапией.
В последние годы рядом исследователей выявлена группа больных, у которых изменения в крови и костном мозге не укладываются в диагностические критерии МДС, разработанные классификацией ВОЗ. Гематологические нарушения у них проявлялись длительной одно-, би- или панцитопенией периферической крови или умеренным цитопеническим синдромом с наличием 10% и более диспластически измененных клеток в разных линиях гемопоэза в костном мозге при отсутствии интеркуррентных заболеваний или циторедуктивной терапии. Для обозначения этих состояний предложены термины: «идиопатическая цитопения неопределенного значения (ИЦНЗ)» и «идиопатическая дисплазия неопределенного значения (ИДНЗ)».
ИДНЗ свойственна пациентам молодого возраста.
В периферической крови отсутствует или умеренно выражен цитопенический синдром с макроцитозом эритроцитов и псевдопельгеровской аномалией в лейкоцитах. Клеточность кроветворной ткани варьирует, среди клеток разных линий гемопоэза определяется не менее 10% диспластически измененных клеток. Кариологические нарушения минимальные, не строго специфичны для МДС и в части наблюдений совсем не выявляются.
ИЦНЗ и ИДНЗ рассматриваются как предфаза МДС. Дифференциация этих нарушений невозможна на гистологическом уровне без учета данных клинико-лабораторных исследований. В то же время сочетания морфологических особенностей ИЦНЗ и ИДНЗ в сопоставлении с данными клиники и кариологии являются основанием для диагноза одного из вариантов МДС. Каждый из вышеперечисленных вариантов может эволюционировать в типичный МДС. Латентный период трансформации в МДС, а также в МДС/МПЗ или острый миелобластный лейкоз может быть продолжительным, в частности, потому что патологический клон при ИЦНЗ в течение ряда лет может продуцировать лишь минимальную популяцию патологических клеток, и может ускоряться с появлением новых генетических поломок. В связи с этим исследование костномозгового кроветворения у больных с подозрением на МДС должны проводиться в динамике с одновременным исследованием кариотипа 23.
Основываясь на вышеизложенном хочется подчеркнуть крайнюю трудность диагностики МДС как клиницистами, так и врачами-патоморфологами. В связи с этим мы сочли возможным предложить алгоритм исследования ТБКМ больных с предполагаемым диагнозом МДС, в котором предусмотрены не только характерные гистологические особенности, включающие оценку клеточности костного мозга, изменения в соотношении и в каждом ростке гемопоэза, выраженность диспластических изменений, топографию клеток разных ростков гемопоэза, а также стромальные реакции. Несмотря на это, формирование окончательного диагноза МДС невозможно без учета данных клинических и цитогенетических исследований.