Грануляционное созревание ткани это что
ГРАНУЛЯЦИОННАЯ ТКАНЬ
Грануляционная ткань (лат. granulum зернышко; син.: грануляция, «дикое мясо», зернистая ткань) — соединительная ткань, образующаяся при заживлении тканевых дефектов путем вторичного натяжения.
Первоначально этот термин использовали только для характеристики раневых процессов, протекающих в тканях, обладающих свободной поверхностью (кожа, слизистая оболочка) и потому видимых глазом. Но он правомерен и по отношению к молодой соединительной ткани (см.), формирующейся при организации тромбов, инфарктов, воспалительных экссудатов и инкапсуляции инородных тел. Формирование Грануляционной ткани — проявление одного из трех последовательно сменяющих друг друга этапов раневого процесса — воспаления (см.), образования грануляций, рубцевания. Непосредственно за повреждением развивается травматический отек, в процессе к-рого происходит избыточное накопление жидкости в поврежденных тканях. В отечной жидкости содержится большое количество белков: альбуминов, глобулинов, фибриногена. Воспалительная реакция, сменяющая травматический отек, ведет к расплавлению мертвых тканей и очищению раны. Еще до завершения этого процесса в дне и по краям раны начинает развиваться Г. т. (цветн. рис. 12,а), постепенно заполняющая возникший дефект. Развитие Г. т. представляет собой проявление регенерации (см.). Сложное строение Г. т. подробно описано H. Н. Аничковым, К. Г. Волковой, В. Г. Гаршиным (1951). Поверхность ее покрыта некротическими массами (цветн. рис. 12,б), содержащими мелкозернистый детрит, фибрин, большое количество лейкоцитов и эритроцитов. Под этим лейкоцитарно-некротическим слоем располагается слой сосудистых петель, содержащий тонкостенные сосуды, полиморфно-ядерные лейкоциты и фибробласты. Интенсивная пролиферация эндотелиоцитов обеспечивает быстрый рост капилляров, достигающих раневой поверхности и затем, образуя петли, вновь уходящих в глубь ткани. Вершины петель с поверхности имеют вид красноватых зерен, вследствие чего молодая соединительная ткань и получила название грануляционной, зернистой. Под слоем сосудистых петель лежит слой собственно Г. т., или слой вертикальных сосудов, составляющий главную ее массу. Между вертикально расположенными сосудами этого слоя находится аморфное межуточное (основное) вещество, представляющее собой студнеобразную массу. Еще глубже лежит слой горизонтально расположенных фибробластов — созревающий слой. Этот слой, постепенно утолщаясь, играет основную роль при заживлении раны. Морфологической особенностью его является разнообразный клеточный состав: здесь находятся фибробласты, эозинофильные лейкоциты, макрофаги, тучные клетки. Глубокие участки этого слоя постепенно приобретаю* вид фиброзной ткани, составляющей дно, а часто и края раны.
На ранних этапах развития Г. т. состоит преимущественно из аморфного межуточного вещества, содержащего кислые мукополисахариды (гиалуроновая к-та, хондроитин-серная к-та, глюкозамин, галактоза-мин, гепарин); в нем рассеяны немногочисленные соединительнотканные клетки и фибробласты, гистиоциты, тучные клетки, нейтрофильные и эозинофильные лейкоциты, клетки лимфоидного ряда, или полибласты. Кислые мукополисахариды, синтезирующиеся фибробластами и тучными клетками, входят в состав коллагеновых пучков как материал, цементирующий коллагеновые фибриллы. Общая динамика развития Г. т. заключается в постепенном уменьшении количества аморфного вещества, интенсивной пролиферации клеточных элементов и сосудов, число которых в дальнейшем, по мере нарастания массы коллагеновых волокон и формирования рубца, снижается. Ведущую роль в образовании основного вещества Г. т. и особенно ее волокнистых структур играют фибробласты. Эти клетки, в обычных условиях тонкие, вытянутые, с небольшим узким ядром и цитоплазмой, бедной ультраструктурами, при активации биосинтетических процессов становятся крупными, с большим овоидным ядром и резко возросшим объемом цитоплазмы. При электронной микроскопии в таких фибробластах наблюдают увеличение числа митохондрий, гипертрофию пластинчатого комплекса (см. Гольджи комплекс) и расширение его цистерн, значительную гиперплазию шероховатого эндоплазматического ретикулума, ответственного за синтез коллагеновых белков (рис. 1). Фибробласты обладают высокой активностью гидролитических (кислые и щелочные фосфатазы) и протеолитических (аминопептидаза, катепсины) ферментов. Менее выражена в фибробластах активность окислительно-восстановительных ферментов (сукцинатдегидрогеназы, цитохромоксидазы и др.). В их цитоплазме содержится большое количество гликогена и рибонуклеопротеидов. Авторадиографическое исследование свидетельствует об интенсивном синтезе РНК в фибробластах Г. т. (рис. 2). В отношении происхождения фибробластов Г. т. существуют различные точки зрения. Одни исследователи считают более вероятным местное их происхождение из адвентициальных клеток, другие полагают, что фибробласты попадают в Г. т. гематогенным путем; существует также мнение, допускающее наличие обоих этих источников. Отмеченные у фибробластов признаки высокой биосинтетической активности в равной мере наблюдаются и в других клетках Г. т.— тучных, макрофагах, эндотелиоцитах. Тучные клетки принимают участие в образовании межуточного вещества соединительной ткани. Полагают, что, с другой стороны, они регулируют состав межклеточного вещества, поглощая избыток мукополисахаридов, откладывающихся в их цитоплазме в виде гранул. Появление и активизация тучных клеток почти исключительно в созревающем слое грануляций, в к-ром происходит постоянная убыль кислых мукополисахаридов, делают это предположение вполне обоснованным. Уменьшение массы аморфного вещества в созревающей Г. т. происходит синхронно с увеличением в ней количества волокнистых структур. Около фибробластов, лежащих вдоль вертикально расположенных сосудов, появляются нежные коллагеновые волокна. В это же время в Г. т. обнаруживают в большом количестве и аргирофильные волокна. Высокая активность фермента коллагеназы в цитоплазме фибробластов свидетельствует о том, что эти клетки, по-видимому, обеспечивают не только синтез коллагеновых волокон, но и частичный лизис их, благодаря чему достигается регуляция количества новообразований фиброзной ткани. На ранних этапах новообразования Г. т. процессы рассасывания выражены слабо. Интенсивными они становятся в период созревания грануляций, когда происходит нарастание массы коллагеновых волокон, часть которых подвергается рассасыванию. При закрытии раневого дефекта и образовании рубца стихает процесс рассасывания коллагеновых волокон. По мере созревания Г. т. количество межуточного аморфного вещества, тучных клеток, гистиоцитов, лейкоцитов и других ее клеточных элементов снижается, а количество грубеющих коллагеновых волокон увеличивается. В процессе развития рубца постепенно стихает и биосинтетическая активность фибробластов, которые превращаются в «покоящиеся» фиброциты. В этот период снижается энзиматическая активность фибробластов, в их цитоплазме уменьшается содержание гликогена и РНК (рис. 3), уменьшается количество цитоплазматических структур. В финале раневого процесса формируется рубцовая ткань, представляющая собой пучки грубых коллагеновых волокон с расположенными между ними немногочисленными фиброцитами и сосудами. Способность фиброцитов рубцовой ткани к повторному активному синтезу коллагена, т. е. превращению в фибробласты, не изучена. Позже в рубце могут появляться эластические волокна.
Развитие Грануляционной ткани характеризует процесс заживления раны путем вторичного натяжения. Если же рана невелика и ее края максимально сближены, срастание их происходит быстро, без развития значительных грануляций, и в этих случаях говорят о заживлении путем первичного натяжения. В обоих случаях клеточная реакция и динамика коллагеноза принципиально идентичны, и речь идет только о количественных различиях.
Весь цикл развития и созревания Г. т. занимает ок. 2—3 нед., однако различные этапы этого процесса могут затягиваться или протекать интенсивнее в зависимости от размеров раны, индивидуальных особенностей организма и различных условий окружающей среды. При нарушениях кровообращения, иннервации, авитаминозе С наблюдаются различные отклонения от описанного хода развития Г. т. в виде вяло текущих грануляций, появления избыточных грануляций (напр., «дикое мясо» на деснах при кариесе зубов и парадентитах, при длительном нагноении раны, хроническом остеомиелите) или быстрого и чрезмерного огрубения соединительной ткани с гиалинозом фиброзных пучков и формированием так наз. келоидных рубцов. Эти отклонения обусловлены качественными и количественными нарушениями коллагенообразования в фибробластах и окружающем их межуточном вещество.
У детей процесс развития Грануляционной ткани протекает интенсивнее, чем у взрослых. Сокращению сроков заживления ран способствуют и некоторые фармакологические препараты, напр, пентаксил, метилурацил, оротат калия.
Библиография Аничков H. Н., Волкова К. Г. и Гаршин В. Г. Морфология заживления ран, М., 1951; Давыдовский И. В. Огнестрельная рана человека, т. 1, М., 1950; Хрущов Н. Г. Проблема происхождения фибробластов в постнатальном онтогенезе млекопитающих, Онтогенез, т. 5, № 1,с. 3, 1974, библиогр.; Rae k. allio J. Enzyme histochemistry of wound healing, Progr. histochem. cyto-chem., v. 1, p. 51, 1970, bibliogr.; Repair and regeneration, ed. by J. E. Dunphy a. W. V. Winkle, p. 151, N. Y. a. o., 1969; Whitting H. The tissue mast cell and wound healing, Int. Rev. Gen. Exp. Zool., v. 4, p. 131, 1969, bibliogr.
Что такое хорошие грануляции донорского ложа, и как они влияют на приживление аутокожи в условиях гнойной раны
Авторы: Фомин А. А., Новиков Ю. В., Першаков Д. Р., Фомин М. А.
Введение
Лечение гнойно-некротических поражений нижних конечностей является одной из актуальных проблем хирургии, диабетологии и флебологии. Если нарушение обменных процессов можно нормализовать проведением соответствующей консервативной терапии, то анатомические изменения можно исправить только оперативным путем. Довольно долго методом выбора лечения длительно незаживающих ран и язв считалось ранняя, свободная аутодермопластика. Однако нередко подобная тактика не приносила успеха из-за отторжения или некроза кожного лоскута. Неудачи кожно-пластических вмешательств могут быть обусловлены многочисленными причинами, главными из которых считают недостаточную подготовку воспринимающего ложа, снижение репаративных возможностей организма, в том числе и из-за диабета и пожилого возраста больных. Весьма существенную роль играет и состояние микроциркуляции в пораженной конечности, без улучшения которой невозможно рассчитывать на положительный результат. В научных хирургических публикациях последних лет большое внимание уделяется проблеме лечению гнойно-некротических осложнений синдрома диабетической стопы. В связи с этим рассматриваются вопросы восстановления региональной гемодинамики, сроки и объем оперативных вмешательств. Одним из методов ликвидации раневых дефектов нижних конечностей у больных является аутодермопластика расщепленным кожным лоскутом.
Остаются до конца нерешенными вопросы о сроках проведения аутодермопластики, обоснованности и длительности проведения предоперационной подготовки, улучшение региональной гемодинамики, подготовки к аутодермопластике воспринимающего ложа и донорского участка кожи.
С 2006 года накоплен большой материал по данной проблеме, который обобщен в статье.
Цель исследования
Улучшить результаты лечения гнойных ран при трофических нарушениях нижних конечностей (сахарный диабет, хроническая венозная недостаточность, хроническая артериальная недостаточность) путем совершенствования приемов аутодермопластики и оценке уровня микорциркуляции раневого ложа.
Материал и методы
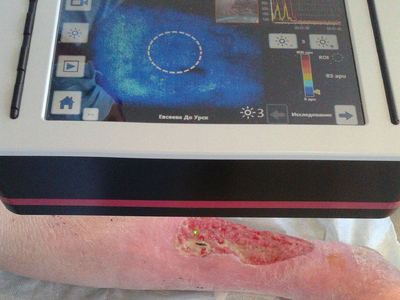
В основу работы положен анализ лечения гигантских (более 50 см²) трофических язв нижних конечностей при сахарном диабете (27 пациентов), хронической венозной (32 больных) и артериальной (24 человека) недостаточности период с 2009 по 2013 год. Группу сравнения составили 60 больных сопоставимые по возрасту, виду патологии и сопутствующей патологии лечившихся традиционными способами. Средний возраст оставил 69±3,7 лет. Микроциркуляцию язвенной поверхности измеряли с помощью аппарата Easy-LDI (Швейцария). Предоперационною подготовку раневого ложа производили с помощью вакуум-терапии, ультразвуковой кавитации и адресной лимфотропной антибиотикотерапии. Забор аутокожи осуществляли дисковымдерматомом с последующей перфорацией лоскутов. Изучение микроциркуляции раневоговоспринимаюшего ложа у наших пациентов осуществляли с помощью метода лазерной допплеровской визуализации на аппарате LDI фирмы AIMAGO (Швейцария). Технология LDI (LaserDopplerImaging), в русскоязычной литературе — лазерная допплеровская визуализация, позволяет проводить бесконтактное наблюдение за микрокровотоком на площади 100 см², с глубиной зондируемого слоя до 2 мм, одномоментной видеозаписью исследования и возможностью измерений сразу в нескольких близлежащих точках. При этом технически исследование настолько просто, что может быть выполнено средним медперсоналом, поскольку воспроизводимость практически не зависит от квалификации исследователя. Анализ полученного изображения производился в режиме реального времени.
Полученные данные заносились в память прибора, что позволяло при необходимости повторно просмотреть видеозапись измерения. Учитывали число относительных перфузионных единиц (apu), отражающих количество крови протекающей в единицу времени в одной кубической единице объема ткани. Вакуумировнаие язвенного дефекта осуществляли по предложенной методике. Суть ее заключается в том, что вместо традиционной губки используются обычные подгузники. Их прекрасная гигроскопичность не уступает таковым у поролона, и втоже время они более привлекательны по цене, бесплатны для больных в стационарах, выпускаются в достаточном количестве нашей промышленностью. Форма подгузника позволяет накладывать его так, что абсорбционная поверхность полностью закрывает кожные покровы и не мацерирует их.
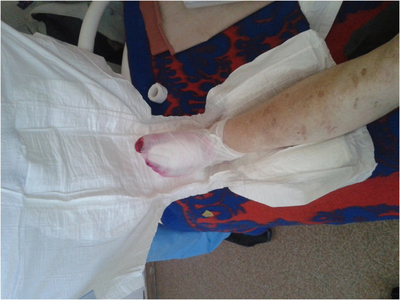
Методика применения подгузника для вакуум-терапии заключается в следующем. На раневую поверхность накладывается стерильная марлевая повязка. Поверх ее укладывается подгузник (рис. 2). Причем последний накладывается целиком, гигроскопичной поверхностью к коже, предупреждая опрелость и ее мацерацию.
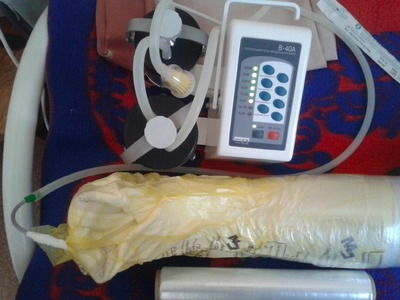
Между подгузником и стерильной повязкой помещается силиконовый катетер Нелатона № 14 по подошвенной части стопы с переходом на заднюю часть нижней трети голени. Такая укладка улучшает отток раневого отделяемого в горизонтальном положении больного. Поверх подгузника одевается мешок для сбора медицинских отходов. В верхней трети голени он фиксируется к кожным покровам клеящейся медицинской пленкой. Свободный конец катетера Нелатона выводится через прокол в нижнем углу пакета, герметизируется и подсоединяется к отсосу (рис. 3).
Перфорационное отверстие в пакете герметизируется лейкопластырем. Сравнительный анализ использования поролона и подгузника проведен в группах больных с гнойными ранами в фазу выраженной экссудации у больных сахарным диабетом. По всем параметрам предпочтительнее оказалось применение подгузника. Обладая одинаковой всасывательной способностью, под ним не преют и не мацерируются кожные покровы, себестоимость подгузника в 2 раза дешевле, чем поролона. Эти обстоятельства побудили нас в методике использования вакуум-терапии применять подгузники. Эффективность вакуум-терапии гнойной раны оценивали с помощью показателей микроциркуляции (лазерная допплеровская визуализация — LDI) и регистрации отека тканей измерением диаметра голени в средней трети. Результаты исследования представлены в табл. 1.
Таблица 1. Изменение показателей микроциркуляции и уменьшение отека гнойной раны под влиянием вакуум-терапии
| Параметры измерения | До вакуум-терапии | После вакуум-терапии | р |
|---|---|---|---|
| Показатели микроциркуляции | 4,7±2,5 apu | 10,3±1,7 apu | р ≤ 0,05 |
| Окружность голени в средней трети | 32,4±2,7 см | 27,1±1,4 см | р ≤ 0,05 |
Из таблицы следует, что вакуум-терапия улучшает микроциркуляцию пораженных тканей на 54,4 % и уменьшает на 25,7 % отек тканей за счет удаления межклеточной жидкости. Это помогает раннему очищению и развитию грануляционной ткани, что в конечном итоге ускоряет заживление раны.
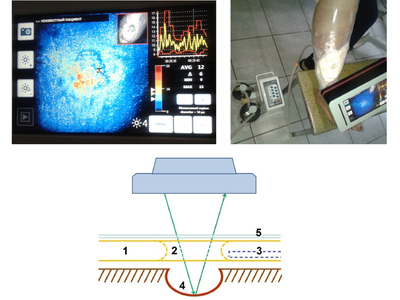
Пониженное атмосферное давление усиливает приток крови к зоне вакуума, тем самым усиливается фагоцитоз, рана быстрее очищается и заживает. Однако, при микроангиопатиях как атеросклеротического так и диабетического генеза проницаемость капиллярного русла страдает. Поэтому очень важно оценить степень разрежения для улучшения микроциркуляции и регулировать ее в динамике в режиме реального времени. При выполнении стандартного метода оценить это не представляется возможным, так как раневая поверхность закрыта повязкой. Предлагаем способ «управляемой микроциркуляции» (рис. 4) в ране при вакуум–терапии в режиме реального времени. Для этого в подгузнике (1) выкраиваем окно (2), между подгузником и повязкой (4) вставляем дренажную трубку (3), отводящую воздух, всю конструкцию изолируем пленочным материалом (5). Через сформированное окно допплеровским дистанционным флоуметром LDI (Швейцария) выполняем функционально-метаболическую визуализацию (сочетая визуализацию микроциркуляторного русла со стимуляцией пациента — изменение температурного режима, применения вазоактивных проб, лекарственные нагрузки, кислородные пробы и т. д.)
Исследование проведено на 30 пациентах (мужчин — 16, женщин — 14 ). Средний возраст — 64±12,5 лет. Микроангиопатия атеросклеротического генеза — у 10 больных, диабетическая — у 10 пациентов, флебологическая — у 10.
Динамическое наблюдение за параметрами микроциркуляции позволяет своевременно выполнить ее коррекцию путем подбора режима отрицательного давления, применения медикаментозной терапии и т. д. Проведенное исследование показало, что пленочное покрытие при прохождении лазерного пучка не искажает результаты исследования микроциркуляции.
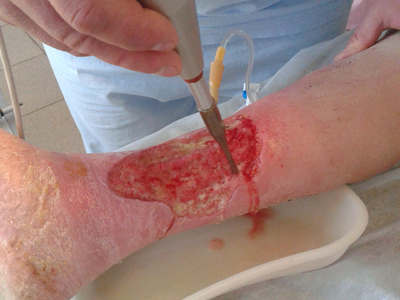
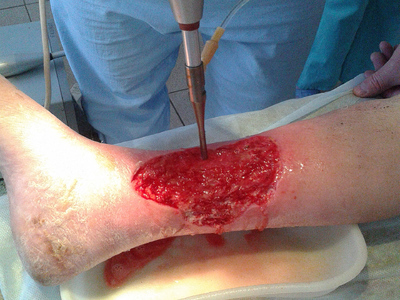
Непосредственно перед наложением перфорированного аутодермального лоскута воспринимающее ложе обрабатывали антисептиком с учетом чувствительности флоры раневой поверхности с помощью ультразвуковой кавитации (рис. 5, 6).
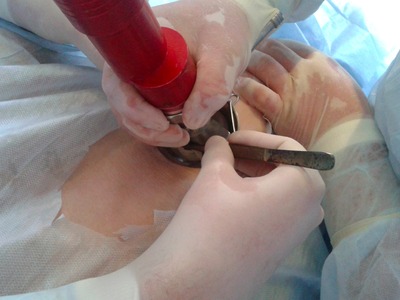
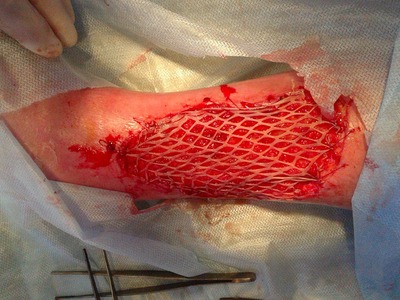
Затем дисковым дерматомом под местной анестезией раствором новокаина 0,5 % (80,0) выполняли забор аутокожи (рис. 7), перфорировали его (рис. 8) и пересаживали на гранулирующую ткань язвенной поверхности (рис. 9)
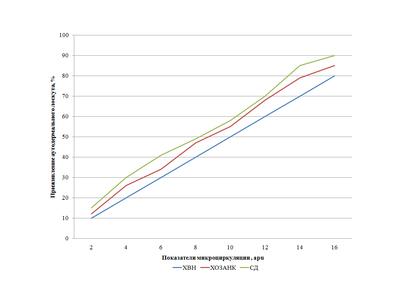
В доступной нам литературе мы не нашли показаний к дермопластике с учетом микроциркуляции грануляций. Поэтому изучили влияние микроциркуляции грануляционной ткани в язвенной поверхности у больных с сахарным диабетом, хронической венозной недостаточностью и хронической ишемией конечности на приживаемость кожного аутотранстплантата. Полученные данные представлены на рис. 10 (по вертикали — показатели приживления аутодермального лоскута, выраженный в %, по горизонтали — показатели микроциркуляции, представленные в apu).
Из рисунка видно, что с увеличением показателей микроциркуляции возрастает доля приживляемости аутотрансплантата, причем у больных сахарным диабетом она несколько замедлена, по-видимому, это связано с более выраженным поражением микроциркуляторного русла при данной патологии. Оптимальными показателями микроциркуляции грануляционной ткани гарантирующими прижевление аутокожи явились значения от 14,3±1,17 apu до 16,5±1,5 apu.
Самостоятельное закрытие гигантских трофических дефектов нижних конечностей весьма проблематично и обычно заканчивается грубым келлоидом, уродующим ногу и нарушающим функцию нижних конечностей. Применение аутодермопластики значительно облегчает эту задачу. Применение нашей методики данного оперативного пособия в лечении грубых дефектов нижних конечностей показало значительное преимущество перед традиционными методами (табл. 2).
Таблица 2. Показатели приживления аутокожи при закрытии язвенных дефектов при гигантских трофических язвах в основной и контрольной группах, %
| Заболевание | Основная группа | Контрольная группа |
|---|---|---|
| Сахарный диабет n-20 | 93±3,7* | 54±8,3* |
| ХОЗАНКn-10 | 87±4,1* | 67±4,8* |
| ХВНn-10 | 80,1±2,8* | 71±3,2* |
* — p ≤ 0,005
Список литературы
Похожие статьи
Статья, описывающая метод ультразвуковой кавитации ран.
В статье описан принцип лимфотропной терапии и ее клиническое применение при рожистом воспалении.
В данной статье даётся описание вакуум-терапии, как современного эффективного метода лечения трофических язв
Классификация ран. Раневой процесс
Раны являются одним из самых частых травматических повреждений. Пострадавшие получают ранения в бытовых, производственных, боевых и криминальных условиях. Характерно, что большая часть пострадавших находится в молодом трудоспособном возрасте. Кроме того, раны наносятся при выполнении оперативных вмешательств. В последнем случае главной особенностью является возможность создания условий, сводящих к минимуму риск раневых осложнений. Общим для всех ран за исключением послеоперационных является то, что они всегда контаминированы микроорганизмами, и зачастую осложняются развитием инфекции.
Раневой процесс
Основными клиническими признаками ран сразу после их нанесения являются наличие дефекта кожи или слизистых, кровотечение и боль. В дальнейшем клиническая картина соответствует фазам течения раневого процесса.
Местные реакции организма направлены на восстановление целостности поврежденных тканей. Заживление ран различных органов и тканей имеет свои особенности, зависящие от их морфологического строения. Раневой процесс может существенно различаться по длительности, но всегда сопровождается образованием соединительно-тканного рубца. Без образования рубца заживают только поверхностные раны без повреждения росткового слоя кожи. Выделяют 3 фазы течения раневого процесса (рис. 11. 1).
Фаза регенерации или пролиферации в среднем продолжается 2-4 недели. Процессы регенерации начинаются уже с 1 суток после ранения, и их продолжительность зависит от величины раневого дефекта и морфологии поврежденных тканей. Происходит миграция фибробластов, образование коллагена и основного вещества, новообразование кровеносных сосудов с развитием грануляционной ткани в месте тканевого дефекта. Постепенно уменьшаются экссудация и отек, грануляционная ткань со дна раны заполняет весь дефект. Грануляционная ткань содержит много новообразованных сосудов и практически не иннервирована. При нормальном течении раневого процесса поверхность гранулирующих ран яркая, «сочная», при перевязках характерна высокая контактная кровоточивость и незначительная болезненность.
Фаза эпителизации и реорганизации рубца в зависимости от морфологии тканей продолжается от нескольких недель до года. Эпителизация начинается от краев раны одновременно с образованием грануляционной ткани. Данный процесс регулируется действием эпидермального хейлона, являющегося контактным ингибитором пролиферации. Сразу после формирования рубца начинается его перестройка: происходит образование эластических волокон и развитие новой фиброзной сети, а содержание воды в рубцовой ткани снижается.
На течение раневого процесса влияют различные общие и местные факторы. К общим факторам относятся: возраст, состояние питания и иммунный статус пациента, различные нарушения гомеостаза, сопутствующие заболевания, в том числе сахарный диабет, прием противовоспалительных средств, цитостатиков, массивная антибиотикотерапия. К местным факторам, влияющим на течение раневого процесса, относится состояние кровоснабжения и степень травматизации тканей в зоне повреждения, уровень микробной контаминации раны и качество ухода за раной.
По степени обсемененности и наличию признаков инфекции все раны делятся на 3 вида: асептические, контаминированные и инфицированные.
· Асептическими являются только операционные раны при «чистых» оперативных пособиях.
· Контаминированные – это раны, обсемененные микрофлорой, но без признаков нагноения. К ним относятся все случайные раны после их нанесения и часть операционных ран.
· Инфицированные – это гнойные раны, то есть раны с признаками наличия инфекционно-воспалительного процесса. Они подразделяются на первично инфицированные – образовавшиеся после операций по поводу острых гнойных процессов, и вторично инфицированные – раны, нагноившиеся в процессе заживления.
Раневой процесс заканчивается заживлением раны. Выделяют следующие типы заживления ран:
· Заживление первичным натяжением – заживление без нагноения. Оно происходит с развитием линейного рубца без образования видимой межуточной ткани. Такое заживление свойственно для ран с ровными жизнеспособными краями, отстающими друг от друга не более чем на 1 см, и при микробной контаминации тканей ниже критического уровня. Операционные раны при наложении первичных швов обычно заживают первичным натяжением.
· Заживление вторичным натяжением – заживление через нагноение и гранулирование с развитием грубого рубца и образованием видимой межуточной ткани. Имеет место при обширных дефектах тканей, не допускающих первичного сопоставления стенок раны и при развитии раневой инфекции.
· Заживление под струпом – заживление без рубца. Имеет место при поверхностных ранах без повреждения росткового слоя кожи. Под струпом, состоящим из фибрина и форменных элементов крови, происходит быстрая регенерация эпидермиса.
Описанное выше течение раневого процесса характерно для ран, явившихся результатом одномоментного воздействия повреждающего фактора. При длительном или постоянном неблагоприятном воздействии, приводящем к нарушению функционирования покровов тела и затрудняющем заживление, имеющем место в случае образования хронических ран, характерно наличие признаков сразу всех трех его фаз. Дно хронической раны одновременно покрыто фибрином и грануляциями, возможно наличие участков некроза и гнойного отделяемого. Грануляции вялые, бледные. Края раны и ткани вокруг уплотнены. Часто имеет место краевая эпителизация. Обычно пальпация зоны повреждения малоболезненна.
Окружающие ткани имеют изменения, характерные для заболевания, вызвавшего образование хронической раны. Если повреждающие факторы не устранены, хронические раны даже при интенсивном лечении длительно не заживают, а после заживления рецидивируют – в той же или в соседней области. При длительно существующих хронических ранах имеется риск их малигнизации.