Иммунореактивный трипсин повышен у новорожденного что это
Иммунореактивный трипсин повышен у новорожденного что это
Муковисцидоз — наиболее широко распространённое ухудшающее качество жизни врождённое состояние у представителей европеоидной расы. В настоящее время средняя продолжительность жизни увеличилась от нескольких лет до 30-35 лет с планируемой продолжительностью жизни для современных новорождённых до 40 лет.
Муковисцидоз — аутосомно-рецессивное заболевание. У лиц европеоидной расы показатель носительства составляет 1:25 с рождением 1 больного ребёнка на 2500 родов. Заболевание менее распространено в других этнических группах.
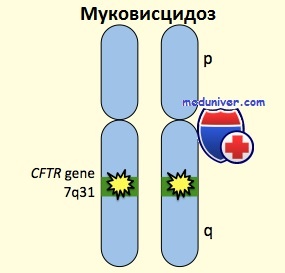
Ген, локализованный в хромосоме 7, кодирует белок, названный муковисцидозным трансмембранным регулятором, — он бывает неполноценным при муковисцидозе. Этот белок — циклический АТФ-зависимый блокатор хлоридного канала.
При муковисцидозе было выявлено более 1000 различных мутаций генов, но мутация AF508 была обнаружена в 75% случаев в Великобритании. Мутация гена влияет на тяжесть заболевания и продолжительность жизни. Распознавание мутации гена, вовлечённого в процесс в конкретной семье, позволяет проводить пренаталь-ную диагностику и определять носителей у дальних родственников.
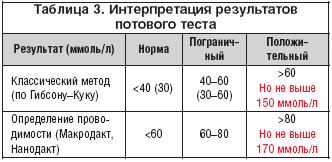
При муковисцидозе нарушенный транспорт ионов через эпителиальные клетки экзокринных желёз респираторного тракта и поджелудочной железы вызывает повышенную вязкость секретов. Нарушение функций потовых желёз приводит к повышенной концентрации натрия и хлоридов в поте (60-125 ммоль/л — при муковисцидозе, 10-30 ммоль/л — у здоровых детей).
Это составляет основу важнейшей диагностической процедуры — потового теста, при котором потоотделение стимулируют путём ионофореза пилокарпина. Пот собирают в специальную капиллярную трубочку или абсорбируют на взвешенном куске фильтровальной бумаги. Если собрано недостаточное количество пота, часто возникают диагностические ошибки, поэтому тест должен проводить опытный персонал. Густая и вязкая слизь — не единственная основа патогенеза.
• Новорождённые.
— Диагностируют путём скрининга новорождённых.
• Дети грудного возраста.
— Мекониальный илеус в период новорождённости.
— Затянувшаяся неонатальная желтуха.
— Нарушение развития.
— Рецидивирующие инфекции дыхательных путей.
— Мальабсорбция, стеаторея.
В нашей стране проводят скрининг новорождённых на муковисцидоз. Клинически большинство детей с муковисцидозом поступают с мальабсорбцией или нарушением развития с рождения, это сопровождается рецидивирующими или длительно существующими инфекциями дыхательных путей.
В лёгких (в мелких дыхательных путях) вязкая мокрота предрасполагает к хроническим инфекциям, первоначально вызванных Staph. aureus и Н. Influenzae, а впоследствии — Pseudomonas aeruginosa. Это приводит к повреждению стенки бронхов, образованию бронхоэктазов и абсцессов. У ребёнка отмечают постоянный неукротимый продуктивный кашель с гнойной мокротой. При объективном обследовании выявляют вздутие грудной клетки вследствие механизма «воздушной ловушки», грубую инспираторную крепитацию и/или свистящий выдох.
При длительно существующем заболевании у ребёнка возникает деформация пальцев в виде «барабанных палочек». В итоге 95% пациентов с муковисцидозом умирают от дыхательной недостаточности.
Более 90% детей с муковисцидозом имеют недостаточность экзокринной функции поджелудочной железы (недостаточная секреция липазы, амилазы и протеаз), вызывающую нарушение пищеварения и мальабсорбцию. Это приводит к нарушению развития, частому жирному стулу (стеаторея) с бледной окраской, очень неприятным запахом и большим объёмом. Недостаточность поджелудочной железы можно диагностировать путём подтверждения низкого содержания эластазы в стуле.
Около 10-20% детей с муковисцидозом поступают в периоде новорождённости с обратимой кишечной непроходимостью. Уплотнённый меконий вызывает обструкцию кишечника с рвотой, вздутием живота и неспособностью выделить меконий в течение первых нескольких дней жизни. Первоначальная терапия — введение гастрографина в клизмах, но в большинстве случаев показано хирургическое вмешательство.
Оценка подростка с муковисцидозом
— Если были больны братья и сестры — заболевание аутосомно-рецессивное
— Солёный пот в жаркую погоду может приводить к обезвоживанию
— Для внутривенного введения антибиотиков при активном лечении инфекции устанавливают центральные венозные катетеры, например Portachat
— Пальцы в виде «барабанных палочек»
— Шрам после операции по поводу мекониального илеуса в периоде новорождённости (10-20%)
— Следует контролировать возможные осложнения:
• полипы носа, синусит, выпадение прямой кишки;
• аллергический бронхолёгочный аспергиллёз;
• сахарный диабет (часто инсулиннезависимый);
• цирроз печени и портальная гипертензия;
• синдром дистальной обструкции кишечника (аналог мекониального илеуса)
• пневмоторакс или рецидивирующее кровохарканье;
• возможно бесплодие у мужчин
— Мокрота — доказательство инфекции, острой или хронической, вызванной видом Pseudomonas или Burkholderia cepacia
— Рост:
Целью является нормальный рост
— Питание:
• Гастростома для питания в течение ночи для дополнительного обеспечения калориями Недостаточность экзокринной функции поджелудочной железы:
• получает ли достаточную заместительную терапию панкреатическими ферментами;
• получает ли жирорастворимые витамины
— Оценка респираторных проблем:
• Спирометрия — при ухудшении
• Постоянная дыхательная гимнастика?
• Физиотерапия или гимнастика?
• Оптимальна ли терапия бронходилататорами?
• Инфекции дыхательных путей — острые или хронические — и их лечение?
• Антибиотики против Pseudomonas через небулайзер и ДНКаза?
• Нужно ли избегать прямого контакта с другими пациентами, кроме членов семьи?
— Общая оценка:
• посещаемость и успеваемость в школе;
• особые проблемы лечения заболевания;
• психологические потребности
Скрининг новорожденных на муковисцидоз
Скрининг новорождённых на муковисцидоз ведёт к улучшению функции лёгких в детском возрасте, снижает нарушения питания и улучшает нервно-психическое развитие. Скрининг всех новорождённых на муковисцидоз проводят в нашей стране в плановом порядке повсеместно. У пациентов с муковисцидозом повышается содержание иммунореактивного трипсина, которое можно измерить при стандартном заборе крови из пятки, проводимом для биохимического скрининга всем младенцам (тест Гатри). Пробы с повышенным содержанием иммунореактивного трипсина затем проверяют на обычные при муковисцидозе мутации генов, и детям с двумя мутациями для подтверждения диагноза проводят потовый тест. Установление диагноза в периоде новорождённости позволяет рано начать регулярное лечение. Это позволяет также рано провести генетическое консультирование родителей и сообщить им о риске повторного рождения такого ребёнка 1:4 и возможности пренатальной диагностики при следующей беременности.
Диагноз муковисцидоза следует исключить у любого ребёнка с рецидивирующими инфекциями, жидким стулом или нарушением развития.
Видео этиология, патогенез муковисцидоза
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Актуальные вопросы диагностики муковисцидоза
Опубликовано в журнале:
«ПРАКТИКА ПЕДИАТРА»; март-аперль; 2015; стр. 20-27.
Е.И. Кондратьева, д. м. н., профессор, В.Д. Шерман, к. м. н., Н.И. Капранов, д. м. н., профессор, Н.Ю. Каширская, д. м. н., профессор, НКО муковисцидоза ФГБНУ «МГНЦ», ГБУЗ «ДГКБ № 13 им. Н.Ф. Филатова ДЗМ», г. Москва
Болезнь прежде всего характеризуется повышенной продукцией вязкого бронхиального секрета, частыми легочными инфекциями и обструкцией дыхательных путей. По мере прогрессирования легочной болезни образуются участки ателектазов, развивается эмфизема, постепенно разрушается паренхима легких с развитием бронхоэктазов и участков пневмосклероза, а больной имеет высокий риск погибнуть от легочно-сердечной недостаточности. В финальной стадии заболевания пересадка комплекса «сердце-легкие» остается для больного единственной надеждой. Помимо бронхолегочной системы у большинства больных муковисцидозом поражается поджелудочная железа, при этом это происходит внутриутробно. Недостаточность панкреатических ферментов обусловливает нарушение всасывания жиров и белков, развитие нутритивной недостаточности. В результате больные отстают в росте и страдают гипотрофией. Продукция инсулина также может быть нарушена, что ведет к развитию диабета. К частым осложнениям течения муковисцидоза относят остеопороз, а также жировой гепатоз с переходом в цирроз. При наличии «мягкой» мутации клинические проявления развиваются постепенно, преобладают моносимптомы, диагноз «муковисцидоз» устанавливается поздно или случайно.
Своевременная диагностика муковисцидоза, обеспечивающая в большинстве случаев раннее начало терапии, в том числе на доклиническом этапе, улучшает прогноз заболевания, повышает эффективность лечения, позволяет предупредить развитие тяжелых осложнений, значительного отставания в физическом развитии, а в ряде случаев и необратимых изменений в легких. Ранняя диагностика позволяет семье вовремя решить необходимые вопросы, связанные с рождением здорового ребенка (генетическое консультирование, пренатальная диагностика МВ в последующие беременности).
Диагностика делится на:
1) пренатальную диагностику;
2) диагностику по неонатальному скринингу (до клинических проявлений или при их дебюте);
3) диагностику при клинических проявлениях:
4) диагностику среди родственников больных.
Клинические признаки
1. Диагностика классической формы МВ обычно не представляет сложностей. Классический фенотип больного является результатом наличия двух мутантных копий гена муковисцидозного трансмембранного регулятора (CFTR) и характеризуется хронической бактериальной инфекцией дыхательных путей и придаточных пазух носа, стеатореей из-за внешнесекреторной недостаточности поджелудочной железы, мужским бесплодием из-за обструктивной азооспермии, а также повышенной концентрацией хлоридов потовой жидкости.
2. Проблемы диагностики МВ, как правило, связаны с фенотипическим разнообразием его форм, обусловленным генетическим полимор-
В ряде случаев атипичного течения МВ возможна его диагностика во взрослом возрасте. Как правило, в этой группе больных отмечается более мягкое течение болезни в связи с сохранностью функции поджелудочной железы и нетяжелым поражением органов дыхания.
Диагностика МВ у носителей «мягких» генотипов (актуально для детей, рожденных до 2006-2007 гг., и взрослых):
В настоящее время выделяют несколько групп риска по МВ.
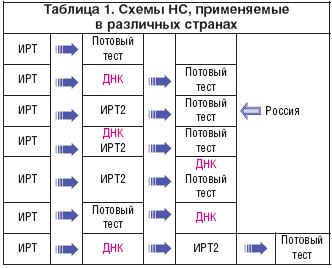
Основной группой риска по заболеванию в РФ в настоящее время являются новорожденные с неонатальной гипертрипсиногенемией. Учитывая возможность получения ложноотрицательных результатов неонатального скрининга, а также то обстоятельство, что в РФ неонатальный скрининг на МВ проводится с 2006-2007 гг., не теряет своей актуальности анализ групп риска, включающих пациентов с патологией желудочно-кишечного тракта, бронхолегочными нарушениями, патологией других органов и родственников больных МВ (табл. 1).
Таблица 1.
Группы риска для дифференциальной диагностики муковисцидоза
| I. Бронхолегочные нарушения |
| 1. Повторные и рецидивирующие пневмонии с затяжным течением, особенно двусторонние 2. Бронхиальная астма, рефрактерная к традиционной терапии 3. Рецидивирующие бронхиты, бронхиолиты, особенно с высевом Ps. aeruginosa 4. Двусторонние бронхоэктазы |
| II. Изменения со стороны желудочно-кишечного тракта |
| 1. Синдром нарушенного кишечного всасывания неясного генеза 2. Мекониальный илеус и его эквиваленты 3. Гиперэхогенность кишечника плода 4. Желтуха обструктивного типа у новорожденных с затяжным течением 5. Цирроз печени 6. Сахарный диабет 7. Гастроэзофагеальный рефлюкс 8. Выпадение прямой кишки |
| III. Патология со стороны других органов |
| 1. Нарушение роста и развития 2. Задержка полового развития 3. Мужское бесплодие 4. Хронический синусит 5. Полипы носа 6. Электролитные нарушения |
| IV. Члены семей больных муковисцидозом |
Среди клинических проявлений, характерных для МВ, можно выделить высоко-и менее специфичные (табл. 2). Состояния, представленные в левой колонке таблицы, в абсолютном большинстве случаев встречаются у больных МВ. Причиной состояний из правой колонки могут быть другие заболевания, например первичная цилиарная дискинезия, гуморальный иммунодефицит и т. д.
Таблица 2.
Клинические проявления, характерные для МВ
Генетическое исследование
Генетическое исследование проводится после потовой пробы. Однако в связи с ограниченными возможностями ДНК-диагностики в России данный метод не является обязательным, однако применяется с исследовательской целью и для окончательного подтверждения диагноза.
На первом этапе ДНК-обследования наиболее часто используется панель, включающая 28 мутаций, как наиболее частых в мире, так и специфичных для России: F508del, CFTRdele2,3(21kb), 3849+10kbC>T, W1282X, 2143delT, 2184insA, 1677delTA, N1303K, G542X, R334W, E92K, L138ins, 394delTT, 3821delT, S1196X, 2789+5G>A, G85E, 2183AA>G, 604insA, 621+1G>T, R117H, R347P, R553X, 3667insTCAA, G551D, I507del, 1717-1G>A, 2184delA. По данным лаборатории генетической эпидемиологии ФГБУ «Медико-генетический научный центр» (МГНЦ) РАМН, при использовании данной панели удается обнаружить лишь около 82,5% мутантных аллелей у больных МВ. В случае когда при положительной потовой пробе не будет найдено ни одной мутации гена (что само по себе маловероятно), может потребоваться секвенирование гена МВ, позволяющее идентифицировать примерно 98% мутаций в гене CFTR.
Рекомендации:
Для диагностики МВ или его исключения при пограничных результатах пробы необходимо:
В европейских странах для подтверждения дефекта ионного транспорта применяется метод определения разности назальных потенциалов или измерение электрического тока в биоптате кишки, отражающие нарушение функции хлорного канала. Оба метода основаны на электрическом характере транспорта ионов и являются высокоинформативными для диагностики МВ.
Диагностика панкреатической недостаточности включает:
У больных МВ показатель эластазы может снижаться в течение первых лет жизни, поэтому определяется в динамике. Низкий уровень панкреатической эластазы расценивается как один из признаков МВ. Приблизительно 1% пациентов с МВ имеет пограничный результат потового теста в комплексе с сохранной функцией поджелудочной железы и хроническим бронхитом.
Диагностика хронического бронхолегочного процесса:
В качестве дополнительных диагностических маркеров могут быть использованы азооспермия в постпубертатном возрасте, идентификация МВ-ассоциированных патогенов из респираторного тракта, рентгенологические признаки синусита.
Знание основных симптомов МВ и особенностей его течения в разные возрастные периоды позволяет своевременно заподозрить наличие заболевания и направить пациента для дальнейшего обследования. Нередкие случаи поздней диагностики МВ связаны как с отсутствием у врачей достаточных знаний о заболевании, так и с фенотипическим разнообразием его форм. Ограниченные возможности ДНК-диагностики МВ в России и ее низкая доступность затрудняют и затягивают окончательную верификацию заболевания.
Иммунореактивный трипсин
Общая характеристика
Поджелудочная железа является единственным источником трипсина, поэтому определение его содержания может быть более важным для суждения о поражении поджелудочной железы, чем других ферментов. Все панкреатические протеазы, особенно трипсин и химотрипсин, очень быстро связываются с сывороточными ингибиторами немедленного и замедленного действия. Наиболее точным методом определения суммарной фракции трипсина и трипсиногена в крови является радиоиммунологический, основанный на принципе конкурентного белковосвязывающего анализа с двойными антителами. К преимуществам радиоиммунного анализа относятся: высокая чувствительность, специфичность, надежность, точность. Уровень трипсинемии зависит от формы и стадии заболевания. При острых атаках панкреатита характерно увеличение содержания трипсина, которое наблюдается чаще, чем повышение активности амилазы и липазы. Прогрессирующее безрецидивное течение хронического панкреатита или длительно текущий панкреатит сопровождаются постепенным снижением уровня сывороточного трипсина.
Повышение концентрации трипсина в сыворотке крови детей в первые несколько недель после рождения свидетельствует о наличии муковисцидоза, в связи с чем определение этого показателя считают эффективным методом скрининга. По мере прогрессирования болезни и развития истинной недостаточности поджелудочной железы концентрация трипсина в сыворотке крови снижается.
Показания для назначения
1. Диагностика муковисцидоза.
2. Заболевания поджелудочной железы.
Маркер
Маркер ранней постнатальной диагностики муковисцидоза и нарушений функции поджелудочной железы.
Иммунореактивный трипсин повышен у новорожденного что это
Сейчас во многих странах всем новорожденным проводится обследование на наличие у них муковисцидоза. При выявлении в крови у ребенка повышенного уровня иммунореактивного трипсина его относят к группе риска, а окончательный диагноз устанавливается (или исключается) на основании исследования солей (хлоридов) в потовой жидкости. У многих родителей может возникать закономерный вопрос: зачем же проходить генетический тест, если диагноз ребенку уже подтвержден? Давайте разберемся.
Муковисцидоз – заболевание наследственное. И связано с нарушением работы гена CFTR на 7 хромосоме. Этот ген у всех здоровых людей вырабатывает особый белок, необходимый для поддержания малой вязкости слизи, вырабатываемой различными полыми органами (в основном, в системе дыхания и пищеварения). Если данный ген несет мутацию (поломку/дефект) на обеих 7-х хромосомах (полученных и от матери, и от отца), его белок не вырабатывается или вырабатывается в очень малом количестве. Если мутация присутствует только на одной из 7-х хромосом, это никак не проявляется и называется «носительством». Таким образом, если вашему ребенку поставлен диагноз муковисцидоз, вы и ваш супруг(а) являетесь носителями мутаций в гене CFTR.
Значит, при каждой последующей беременности вы имеете высокий риск того, что родившийся ребенок также будет болен муковисцидозом. Такой риск составляет 25%.
Если же вы хотите обезопасить себя от повторного рождения у вас ребенка с муковисцидозом, необходимо сначала выяснить, какими именно мутациями (дефектами) гена CFTR вызвана болезнь у вашего ребенка. Самое простое и недорогостоящее исследование – тест на мутации, встречающиеся наиболее часто. Их около 30, и все можно протестировать одновременно. Если же при этом мутации не будут выявлены, или выявится только одна, для поиска более редких придется протестировать всю последовательность гена. Этот тест называется секвенированием. Он позволит выявить все мутации, возможно ранее не описанные ни у одного больного муковисцидозом в мире.
Когда вы будете знать, носителями каких именно мутаций вы с мужем являетесь, можно проводить их исследование плоду (при наличии беременности) или эмбриону (при зачатии с помощью ЭКО).
Сейчас наиболее распространена пренатальная диагностика – это когда во время беременности в сроке 10-12 недель делают забор плодного материала (плаценты) через прокол передней брюшной стенки. Полученный материал исследуют на носительство уже известных мутаций. Если мутаций не выявлено или выявлена только одна мутация, ребенок будет здоровым. Если же обнаружены 2 мутации, то диагноз муковисцидоза можно считать установленным и семья оказывается перед тяжелым решением сохранить беременность с тем, чтобы родить ребенка с наследственным заболеванием, или же прервать.
Более оптимальным вариантом дородовой диагностики является преимплантационная генетическая диагностика (ПГД). ПГД позволяет исследовать генетический статус эмбриона, полученного при экстракорпоральном оплодотворении (ЭКО), до его попадания в полость матки и наступления беременности. При этом вы не будете стоять перед моральной проблемой прерывания беременности и в то же время будете точно знать, что ваш будущий ребенок не будет страдать муковисцидозом.
Кроме того, в ближайшем будущем станут доступны лекарственные генные препараты, действие которых будет зависеть от типа мутации. Тогда знание о том, какая именно мутация у Вашего ребенка,будет определяющим в назначении конкретного препарата.
В лаборатории Genetico Вы можете пройти генетическое тестирование для определения как частых, так и более редких мутаций гена муковисцидоза, а при уже известных мутациях провести преимплантационную генетическую диагностику эмбрионам, для того чтобы родить здорового ребенка. О необходимости, возможностях и ограничениях каждого теста Вас может проконсультировать врач-генетик центра.
Особенности массового скрининга новорожденных на муковисцидоз
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Первые попытки проведения неонатального скрининга (НС) на муковисцидоз (МВ) в Европе предпринимались еще в начале 1970–х годов и сводились к определению содержания альбумина в меконии. И лишь обнаруженное в 1979 г. повышение уровня иммунореактивного трипсина (ИРТ) в плазме крови новорожденных с МВ послужило толчком к началу массового скрининга новорожденных на данное заболевание [1]. Дальнейшее усовершенствование программы НС стало возможным после клонирования в 1989 г. гена CFTR и последующей идентификации специфических CFTR–мутаций в общей популяции, что позволило включить анализ ДНК в скрининговые протоколы [2]. Ежегодно по программе НС в Европе обследовалось более 1,6 млн новорожденных и выявлялось более 400 больных детей. По данным за 2008 г., количество детей, прошедших скрининг, превысило 3 млн в год в связи с внедрением НС на МВ в Великобритании и России. Программа НС оправданна как с медицинской, так и с экономической точки зрения. Ранняя диагностика МВ дает возможность своевременно начать адекватную терапию, что ведет к значительному улучшению качества и продолжительности жизни больных. Кроме того, проведение НС и установка CFTR–генотипа новорожденных с МВ предполагает возможность более раннего генетического консультирования, что может повлиять на репродуктивное поведение супругов и их родственников [3].

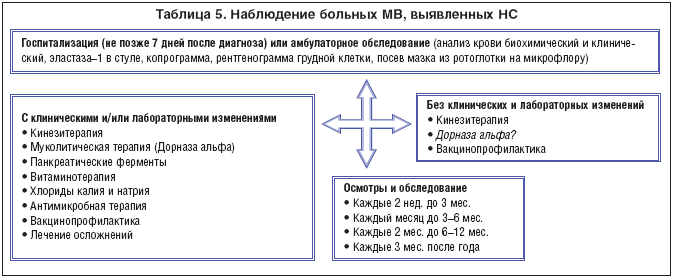
Литература
1. Crossley JR, Elliott RB, Smith PA. Dried–blood spot screening for cystic fibrosis in the newborn. Lancet 1979;1(8114):472–4.
2. Southern KW, Munck A, Pollit R, Castellani C et al. A survey of newborn screening for cystic fibrosis in Europe. J of Cystic Fibrosis 2007; 6:57–65.
3. Castellani C, Southern KW, Brownlee K. et al. European best practice guidelines for cystic fibrosis neonatal screening. Journal of Cystic Fibrosis Volume 8 (2009) 153–173.
4. Priest FJ, Nevin NC. False positive results with immunoreactive trypsinogen screening for cystic fibrosis owing to trisomy 13. J Med Genet 1991;28:575–6.
5. Heeley AF, Fagan DG. Trisomy 18, cystic fibrosis, and blood immunoreactive trypsin. Lancet 1984;1:169–70.
6. Cheillan D, Vercherat M, Chevalier–Porst F, Charcosset M, Rolland MO, Dorche C. False–positive results in neonatal screening for cystic fibrosis based on a three–stage protocol (IRT/DNA/IRT): should we adjust IRT cut–off to ethnic origin? J Inherit Metab Disease 2005;28:813–8.
7. Giusti R. New York State Cystic Fibrosis Newborn Screening Consortium. Elevated IRT levels in African–American infants: implications for newborn screening in an ethnically diverse population. Pediatr Pulmonol 2008;43: 638–41.
8. Lakeman P, Gille JJP, Dankert–Roelse JE, et al. CFTR mutations in Turkish and North African cystic fibrosis patients in Europe: implications for screening. Genetic Testing 2008;12:25–35.
9. Kharrazi M, Kharrazi LD. Delayed diagnosis of cystic fibrosis and the family perspective. J Pediatr 2005;147:S21–5.
10. Толстова В.Д., Каширская Н.Ю., Капранов Н.И. Массовый скрининг новорожденных на муковисцидоз в России. Фарматека. – 2008. – №1. – С.1–5.
11. Comeau AM, Parad RB, Dorkin HL et al. Population–based newborn screening for genetic disorders when multiple mutation DNA testing is incorporated: a CF newborn screening model demonstrating increased sensitivity but more carrier detections. Pediatrics 2004;113(6):1573–81.
12. Муковисцидоз. Современные достижения и актуальные проблемы. Методические рекомендации. Издание третье (первое 2001) переработанное и дополненное. Под редакцией Капранова Н.И., Каширской Н.Ю. М.: ООО «4ТЕ Арт». 2008. – с.124.
13. Brice P, Jarrett J, Mugford M. Genetic screening for cystic fibrosis: An overview of the science and the economics. J of Cystic Fibrosis 2007; 6:255–261.

