Иммуносупрессивные препараты что это такое список
Иммуносупрессивные препараты что это такое список
Как уже известно к настоящему времени, COVID-19-ассоциированные заболеваемость и смертность объясняются патологическими изменениями иммунного ответа пациента. Выдвигаются две противоречивые гипотезы: поражение, опосредованное гипервоспалительным «цитокиновым штормом», и нарушение иммунологического защитного механизма хозяина, приводящее к неконтролируемому распространению вируса и поражению органов. Ключевой причиной неспособности объяснить такое противоречие является отсутствие диагностических инструментов для оценки иммунной функции при заражении COVID-19.
Один из наиболее примечательных фактов о текущей эпидемии SARS-CoV-2 (COVID-19) заключается в том, что, несмотря на активно проводимые по всему миру исследования, патофизиологические процессы, играющие решающую роль в заболеваемости и смертности среди пациентов, по-прежнему остаются неизвестными. Господствующая в настоящее время парадигма патологического процесса подразумевает, что слишком сильный иммунный ответ, медиаторами которого выступают чрезмерно продуцируемые провоспалительные цитокины, вызывает обширное поражение легких и состояние склонности к тромбозам. Соответственно, предполагается, что летальный исход наступает в первую очередь по причине воспалительного заболевания легких, нарушения микро- и макроциркуляции и наступающих в конечном итоге дыхательной недостаточности или васкулярной коагулопатии. Это понятие опосредованного «цитокиновым штормом» летального исхода среди пациентов с COVID-19 популяризовано как в неспециализированных печатных изданиях, так и во многих ведущих научных публикациях.
На основании вышеизложенной теории проводятся испытания ряда антицитокиновых и противовоспалительных терапий для лечения COVID-19, включая антитела к интерлейкину-6, антагонисты рецептора интерлейкина-1 и ингибиторы сигнального пути JAK-STAT, но в ходе более ранних клинических исследований существенную эффективность таких подходов доказать не удалось.
В то же время, как это ни парадоксально, вторая, диаметрально противоположная теория COVID-19-индуцированной заболеваемости и смертности заключается в коллапсе системы иммунитета пациента. Такой коллапс иммунитета проявляется в неспособности его сдерживать неконтролируемые репликацию и распространение вируса наряду с прямой цитотоксичностью продуктов иммунного ответа пациента. В качестве обоснования этой прямо противоположной теории приводится наблюдаемая у пациентов прогрессивная и глубокая лимфопения, уровни которой порой достигают таких же значений, как при СПИДе. Результаты многих недавно выполненных исследований свидетельствуют о том, что, в отличие от «цитокинового шторма», который часто считается эпизодическим, лимфопения сохраняется у критически больных пациентов с COVID-19 и коррелирует с повышенной тяжестью вторичных заболеваний и летальным исходом.
Персонализированный подход к оказанию медицинской помощи требует более полного понимания, какой из этих типов реакции системы иммунитета преобладает, поскольку подходящие вмешательства будут различаться кардинальным образом в зависимости от постановки диагноза — наличия у пациента гиперреактивности или же глубокой иммуносупрессии. Например, в настоящее время выполняется клиническое исследование антител против интерлейкина-6, антагонистов рецептора IL-1 и ингибиторов JAK-STAT в качестве терапевтических средств для лечения пациентов с COVID-19 и существует вероятность, что они могут еще больше нарушить способность организма пациента побороть вирус. С другой стороны, методы терапии с использованием иммуностимуляторов, например, ингибиторов иммунных контрольных точек интерлейкина-7, интерферона-γ или GM-CSF, могут усугубить нарушенный и устойчивый воспалительный ответ и привести к усилению степени поражения органов.
Суммируя вышесказанное, становится ясным, что при ведении критически больных пациентов с COVID-19 необходимо ответить на два конкретных и являющихся ключевыми вопроса:
1) каков их первичный иммунный эндотип, т.е. является ли он гиперреактивным или иммуносупрессивным;
2) каким образом это состояние изменяется с течением времени в связи с прогрессированием заболевания или нормализацией состояния.
Более полное понимание иммунного статуса пациента с COVID-19 поможет провести правильную иммунотерапию. Задачей последующих исследований в этой области будет определение, развивается ли при COVID-19 усиленный провоспалительный «цитокиновый шторм» или же состояние, развивающееся при указанной патологии, представляет собой иммуносупрессивный тип иммунного ответа, а также изучение, как изменяется функция иммунной системы по мере прогрессирования заболевания.
Иммуносупрессивные препараты
Содержание
Ингибирование иммунных реакций [ править | править код ]
Ингибирование иммунных реакций целесообразно при пересадке органов для предотвращения отторжения трансплантата и при аутоиммунных заболеваниях. Иммуносупрессия в свою очередь подразумевает ослабление защиты от инфекций, а также риск возникновения злокачественных новообразований.
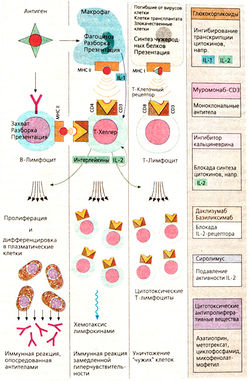
Специфическая иммунная реакция начинается с присоединения антигена к лимфоциту. В-Лимфоциты «узнают» поверхностную структуру с помощью мембранных рецепторов, которые похожи на образующиеся затем антитела. Т-Лимфоциты узнают антигены, представленные на поверхности макрофагов, с помощью молекул главного комплекса гистосовместимости (МНС, от англ, major histocompatibility complex). T-Клетки имеют на поверхности молекулы CD3 и CD4 (Т-хелперы) или CD8 (цитотоксические Т-лимфоциты), которые взаимодействуют с МНС. Помимо узнавания антигена для активации лимфоцита необходима стимуляция с помощью медиаторов типа цитокинов. Интерлейкин 1 образуется макрофагами, другие интерлейкины, в том числе интелейкин 2, — Т-хелперами. Антигенспецифичные лимфоциты пролиферируют, и возникает иммунный ответ.
I. Воздействие на механизм узнавания антигена. Муромонаб-СРЗ является мышиным моноклональным антителом против CD3, который участвует в узнавании антигена и взаимодействует с Т-лимфоцитами (применяют при реакции отторжения трансплантата) при лечении рассеянного склероза. Этому заболеванию приписывают аутоагрессию, обусловленную действием Т-лимфоцитов против олигодендроцитов, которые образуют миелиновую оболочку нейронов в ЦНр. Миелиновый белок действует, очевидно, как антиген. Ему подобен глатирамер; он ингибирует антигенные рецепторы, что усиливает узнавание антигена лимфоцитами.
II. Ингибирование образования цитокинов и их активности. Глюкокортикоиды модулируют экспрессию множества генов. Так, например, они блокируют образование интерлейкинов 1 и 2, что в свою очередь тормозит иммунный ответ Т-хелперов. Глюкокортикоиды взаимодействуют с другими цитокинами и медиаторами воспаления. Их назначают при реакции отторжения трансплантата, аутоиммунных заболеваниях и аллергических реакциях. Системное применение опасно развитием синдрома Кушинга.
Анакинра — генно-инженерный препарат, антагонист рецепторов интерлейкина 1. Анакинра применяется при лечении ревматоидного артрита (с. 340).
Даклизумаб и базиликсимаб представляют собой моноклональные антитела против рецептора интерлейкина 2. Они состоят из мышиных РаЬ-фрагментов и человеческого Fc-фрагмента. Применяют при реакции отторжения трансплантата.
Глатирамерацетат состоит из синтетических пептидов с различной длиной цепи, составленной из аминокислот в случайной последовательности: глутаминовой кислоты, лизина, аланина и тирозина (название глатирамер возникло из первых букв аминокислот — они выделены). Этот препарат может применяться наряду с р-интерфероном
III. Нарушение метаболизма клетки ингибированием пролиферации. Некоторые цитостатики также применяются в качестве иммунодепрессантов, но в более низких дозах, чем для лечения опухолей. К ним относятся азатоприн, метотрексат и циклофосфамцц. Они оказывают неспецифическое антипролифератив-ное действие как на В-, так и на Т-клетки. Мофетилмикофенолат действует специфически на пролиферацию лимфоцитов, блокирует инозинмонофосфатдегидрогена-зу, которая необходима лимфоцитам для синтеза пуринов. Препарат применяют при острых реакциях отторжения трансплантата.
IV. Иммунная сыворотка против Т-клеток получается при иммунизации лабораторных животных человеческими Т-лим-фоцитами. Препарат повреждает Т-лим-фоциты и применяется для ослабления реакции отторжения трансплантата.
Ингибиторы кальциневрина, сиролимус [ править | править код ]
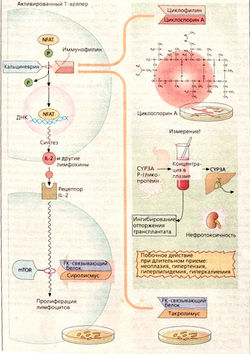
Циклоспорин А получают из грибов. Это циклический полипептид, состоящий из 11 аминокислот, в том числе атипичных. Поэтому при пероральном приеме он не разрушается протеазами желудочно-кишечного тракта. В Т-хелперах циклоспорин А ингибирует образование интерлейкина 2, участвуя в регуляции транскрипции этого белка.
В норме «ядерный фактор активации Т-клеток» (NFAT) может вызвать экспрессию интерлейкина 2. Для этого необходима стадия дефосфорилирования NFAT при катализе фосфатазой кальциневрином, что д елает возможным поступление NFAT из цитозоля в клеточное ядро. Циклоспорин А внутри клетки связывается с белком циклофилином. Этот комплекс ингибирует кальциневрин и тем самым останавливает образование интерлейкина 2.
Успехи современной трансплантационной медицины в значительной мере обязаны внедрению в практику циклоспорина А. В настоящее время его применяют и при определенных аутоиммунных заболеваниях, атопическом дерматите и других болезнях.
В качестве нежелательного эффекта можно назвать нефротоксичность препарата. Дозы должны выбираться с учетом того, чтобы концентрация в крови была не слишком высокой (возрастание риска нарушения работы почек) и не слишком низкой (риск реакции отторжения трансплантатов). К тому же терапия циклоспорином А трудно управляема. При пероральном приеме биодоступность неполная. Р-Гликопротеин в стенках кишечника транспортирует вещество обратно в просвет кишечника, или оно разрушается цитохромоксидазой типа ЗА. Ферменты печени CYP-3A метаболизируют циклоспорин и отвечают за его пресистемную элиминацию. Лекарства, действующие на CYP-3A и Р-гликопротеины, могут взаимодействовать между собой. Для оптимального назначения лекарства необходимо провести полный анализ крови пациента.
Медикаментозное ингибирование отторжения трансплантатов должно проводиться продолжительное время. Повышенный риск развития злокачественных опухолей является ответом на подавление иммунной системы организма. Для долгосрочных прогнозов существенно то, что повышается риск возникновения сердечно-сосудистых заболеваний.
Такролимус — макролидный антибиотик; вырабатывается стрептомицетами. Действует аналогично циклоспорину А. На молекулярном уровне также может рассматриваться как рецептор, но не циклофилина, а так называемого FK-связывающего белка. Такролимус используется для предотвращения отторжения трансплантатов. Лучше проникает через эпителий, чем циклоспорин А, и может применяться локально при атопическом дерматите.
Иммуносупрессивные препараты [ править | править код ]
Иммуносупрессивные препараты — это лекарственные препараты разных фармакологических химических групп, которые подавляют реакции иммунитета через опосредованное угнетение функции клеток иммунокомпетентной системы. Такие средства применяют для лечения тяжелых гипериммунных заболеваний и угнетения реакции отторжения трансплантата, а также для ослабления воспалительных процессов неопределенной этиологии.
Известные сегодня иммуносупрессивные препараты характеризуются разной активностью: мягкое иммуносупрессивное действие оказывают НПВС, гепарин, препараты золота, пенициллин, производные 4-аминохинолина и др., в связи с чем их называют «малыми» иммуносупрессантами, умеренный иммуносупрессивный эффект проявляют средние дозы глюкокортикостероидов.
Наиболее мощными иммуносупрессивными препаратами являются цитостатики — препараты, применяемые как противоопухолевые, в частности, антиметаболиты и алкилирующие соединения, антилимфоцитарные и моноклональные антитела (AT), антибиотики и др., которые называют «большими» иммуносупрессантами.
Классификация иммуносупрессивных лекарственных средств
а) алкилирующие — миелосан, циклофосфан;
б) антиметаболиты — азатиоприн, меркантопурин;
в) некоторые антибиотики — например актиномицин;
г) препараты ферментов — L-аспарагиназа.
4. Производные 4-аминохинолина — хингамин, гидроксихлорохин.
5. Препараты золота — кризанол, солганал, ауротиоглюкоза, ауронофин.
6. Производные кислоты микофолевой — целсепт и др.
Глюкокортикостероиды, как уже отмечалось, это уникальная группа препаратов, которая сочетает мощное противовоспалительное и иммунное воздействие, их иммуносупрессивное действие связано с влиянием на клетки лимфоидного ряда.
Глюкортикоиды подавляют реакцию клеток на лимфокины (фактор, активирующий макрофаги, фактор переноса и пр.), ограничивая этим клон сенсибилизированных клеток. Они нарушают инфильтрирование тканей клетками крови, в том числе моноцитами, предупреждая превращение их в макрофаги тканей. Имеет значение их способность стабилизировать мембраны лизосом, снижать в крови число циркулирующих в крови Т-лимфоцитов, особенно Т-хелперов, препятствуя этим их активности, кооперации с В-лимфоцитами и образованию иммуноглобулинов, угнетать активность макрофлагов, в частности продукцию ими ИЛ-1, увеличивать синтез белков, тормозящих латентные протеазы и фосфолипазу А,. Применяют их при лечении диффузных заболеваний соединительной ткани (ревматоидный артрит), обычно в сочетании с другими препаратами, и при других заболеваниях, в основе патогенеза которых лежит гиперчувствительность замедленного типа: красная волчанка, склеродермия, аутоиммунная гемолитическая анемия, неспецифический язвенный колит, аутоиммунный гломерулонефрит и др.
(Правила, согласно которым осуществляется лечение этими препаратами, их побочные эффекты освещены ранее.)
Цитостатические лекарственные препараты для достижения цитостатического или иммуносупрессивного эффекта применяют в соответствии с определенными клинико-фармакологическими принципами, а именно:
Алкилирующие иммуносупрессивные препараты — одна из наиболее распространенных групп цитостатиков, в основе механизма их действия лежит способность замещать атомы водорода в важных биологических структурах клеток на алкильную группу. При этом происходит необратимое угнетение жизнедеятельности клеток. Наиболее чувствительны к алкилирующим соединениям нуклеиновые кислоты. Препараты — миелосан, хлорбутин, циклофосфан действуют в любой фазе клеточного цикла и на клетку в состоянии покоя, проявляют преимущественное влияние на В-клетки, угнетают продукцию IgM.
Циклофосфан назначают в начальной дозе 200—400 мг, в случаях длительного применения — 75—100 мг в сутки. Иммуносупрессивный эффект развивается на 10-е сутки лечения. Хлорбутин применяют по 0,2 мг-кг»1 в сутки, в случае длительного лечения дозу уменьшают; иммуносупрессивный эффект развивается на 10—14-е сутки лечения.
Миелосан — цитотоксическое средство, действие которого проявляется преимущественно относительно клеток миелинового ряда, применяется при хроническом миелоцитарном лейкозе, настоящей полицитемии; в случае значительной тромбоцитемии при миелофиброзе. Относительная избирательность действия обусловливает беспечность его назначения в течение длительного времени. Препарат не следует применять при остром и подостром лейкозах, при обострении хронического лейкоза, при значительной тромбоцитопении.
Антиметаболиты. Меркаптопурин — антиметаболит пуринов, по химическому строению близок к этим соединениям, в связи с чем нарушает синтез нуклеотидов, нуклеиновых кислот, оказывает цитотоксическое действие, угнетает рост пролиферирующих тканей. По структуре и свойствам к меркаптопурину близок азатиоприн (имуран), у него больше проявляется иммуносупрессивное действие и меньше — цитоксичность. Применяют при аутоиммунных заболеваниях (ревматоидный полиартрит, системная красная волчанка), изредка — для предупреждения отторжения трансплантата при пересадке органов.
Меркаптопурин и азатиоприн проявляют наибольшую активность в индуктивной фазе иммунной реакции, их иммуносупрессивное действие приблизительно одинаково относительно как клеточного, так и гуморального иммунитета. Оба препарата вызывают лейкотромбоцитопению, диспепсические расстройства (тошноту, рвоту, анорексию), токсический гепатит. Азатиоприн больные переносят лучше, он реже, чем меркаптопурин, вызывает эрозии слизистой пищеварительного тракта и гипоплазию головного мозга. Обычная начальная суточная доза меркаптопурина — 2 мг/кг/1, в случае длительного лечения — 0,5—1 мг/кг/1, эффект повышается применением дозы 4 мг/кг в сутки, иммунодепрессивное действие обоих препаратов развивается через 20—60 сут от начала лечения.
Метотрексат, антагонист кислоты фолиевой, угнетает активность дигидрофолатредуктазы (РН,-редуктаза), образование кислоты тетрагидрофолиевой, необходимой для ресинтеза тиминметиловых групп и кислоты дезоксиуридиловой в пределах синтеза тимидилата. При этом нарушается удвоение ДНК. Применяют внутрь 2,5—5 мг в сутки; общая доза в неделю — от 10 до 20 мг. Иммуносупрессивный эффект развивается после введения 10—20 мл на 10—40-й день после начала лечения.
Важнейший представитель иммуносупрессивных препаратов среди противоопухолевых антибиотиков — актиномицин, угнетающий деление клеток, а также синтез РНК. Препарату свойственно значительное побочное действие, поэтому его не применяют для длительного лечения, однако он довольно эффективен для предупреждения отторжения почек или других органов после трансплантации. Вводят парентерально, суточная доза — 0,01— 0,02 мл/кг/1.
Циклоспорин (сандимун) — продукт обмена грибов группы Trichocterma polysporum, обладает значительным иммуносупрессивным эффектом, замедляет раннюю стадию диффенцирования Т-лимфоцитов, вызываемую антигеном, особенно сильно влияет на Т-хелперы, в результате чего угнетаются преимущественно реакции отторжения. Уменьшает образование интерлейкинов и интерферона. Применяют внутрь и внутривенно при реакциях гиперчувствительности замедленного типа: отторжения трансплантата при пересадке органов (почек, печени, сердца, легких, костного мозга), при некоторых аутоиммунных заболеваниях. В отличие от цитостатических средств, сандимун не оказывает отрицательного влияния на кроветворение. Проявляет нефро- и гепатотоксическое действие. Больные, получающие циклоспорин А, менее чувствительны к инфекционным агентам, чем те, которые применяют другие иммуносупрессоры. Иммуносупрессивные препараты оказывают на клетки иммунокомпетентной системы неспецифическое действие. Их влияние направлено на фундаментальные механизмы клеточного деления и ключевые этапы биосинтеза белка в разных клетках, в т. ч. иммунокомпетентных. Несмотря на универсальные цитостатистические свойства, иммунодепрессанты отличаются по направленности действия на определенные этапы иммуногенеза, что важно учитывать при выборе препарата, адекватного конкретной клинической ситуации. Практическое значение имеет деление иммуносупрессантов на три группы в зависимости от того, в какие сроки их необходимо вводить (относительно действия антигена) для иммуносупрессивного ответа.
Первая группа объединяет соединения, которые проявляют иммуносупрессивный эффект при введении перед антигенной стимуляцией или одновременно с ней. Они влияют на механизмы узнавания, переработки антигена и информации. К этой группе принадлежат глюкокортикостероиды, актиномицин С, некоторые алкилирующие соединения.
Вторая группа препаратов осуществляет иммуносупрессивное воздействие при введении через 1—2 дня после действия антигена, угнетая пролиферативную фазу иммунного ответа. При их введении в организм до антигена или больше чем через неделю после него иммуносупрессивный эффект не развивается. В эту группу входят антиметаболиты, алкалоиды барвинка (винкристин, винбластин), актинолицин, большинство алкилирующих соединений.
Третья группа содержит соединения, эффективные как до, так и после антигенного влияния, они имеют несколько точек приложения в цепи иммунного ответа. К этой группе относятся антилимфоцитарный глобулин (АЛГ), антитимоцитарный глобулин (АТГ), ионизирующее излучение, L-аспарагиназа и др.
Исходя из изложенного препараты первой группы следует применять в случае трансплантации органов, когда иммуносупрессия необходима для предупреждения реакции отторжения трансплантата. При аутоиммунных заболеваниях для угнетения процессов пролиферации, при длительном действии антигенов по типу цепной реакции лучше назначать препараты второй или третьей группы.
Учитывая большое количество осложнений, «большие» имуносупрессивные препараты не применяют в начале лечения аутоиммунной патологии. Как правило, при этом используют «малые» иммуносупрессанты. Поскольку большинство «больших» иммуносупрессантов незначительно влияет на эффекторные механизмы иммунного ответа, их часто комбинируют с НПВС или с глюкортикостероидами.
Определенное значение имеют производные 4-аминохинолина (хингамин, гидроксихлорохин), которые блокируют синтез нуклеиновых кислот. Препараты золота (кризанол, солганал, ауротиоглюкоза, ауронофин) стимулируют клеточные иммунные реакции и угнетают гуморальный иммунитет, их применяют для лечения ревматоидного артрита. Производные кислоты микофолевой (селлсепт) оказывают большее цитостатическое влияние на лимфоциты, чем на другие клетки, их назначают для профилактики отторжения тканей при пересадке почек.
Практически все препараты, проявляющие иммуносупрессивную активность, имеют широкий спектр действия, угнетая не только иммунокомпетентные клетки, но и другие пролиферирующие клетки, системы и отдельные органы (почки, печень). При их применении ослабляется противомикробный и противоопухолевый иммунитет, возрастает риск развития инфекционных осложнений и онкологических заболеваний. За последние годы проводят исследования по созданию с помощью генноинженерной технологии человеческих антител, которые имели бы узкий спектр действия на строго определенные клеточные популяции, на молекулы главного комплекса гистосовместимости, на антигенные рецепторы Т-клеток, на интерлейкины и их рецепторы и др. Применение подобных препаратов поможет целенаправленно влиять на необходимое звено иммунной системы.
Поскольку на данном этапе селективную иммунотерапию проводить невозможно, наилучшего терапевтического эффекта можно достичь при комбинированном использовании иммуносупрессивных средств. Применять иммуносупрессивные препараты следует только тогда, когда возможности другой терапии исчерпаны, а шансы на успех превышают риск иммуносупрессии.
Учитывая, что иммунные заболевания очень часто имеют неблагоприятный прогноз, противопоказания для проведения иммуносупрессивной терапии относительны. Особую осторожность следует проявлять при таких ситуациях: наличие инфекции, недостаточная функция костного мозга, снижение функции почек (угроза кумуляции), беременность, нарушение функций печени, глубокие нарушения иммунной системы, онкозаболевания.
Иммунотерапия: механизм действия и клиническое применение иммунокорригирующих препаратов
Неуклонно увеличивается число хронических воспалительных, аллергических, аутоиммунных, эндокринных, онкологических и др. заболеваний. Данные эпидемиологических и статистических исследований последних лет свидетельствуют о значительном ухудшении здоровья н
Неуклонно увеличивается число хронических воспалительных, аллергических, аутоиммунных, эндокринных, онкологических и др. заболеваний. Данные эпидемиологических и статистических исследований последних лет свидетельствуют о значительном ухудшении здоровья нации. Опыт мировой практики по иммунопрофилактике показывает, что эта категория лиц в первую очередь нуждается в вакцинации против инфекционных заболеваний. Есть данные, что с клинической точки зрения вакцинация лиц с различными нарушениями в состоянии здоровья безопасна, однако напряженность иммунного ответа у них ниже, чем у практически здоровых лиц. Для стимулирования формирования поствакцинального иммунитета у таких пациентов назначают различные иммуномодулирующие препараты.
Следует отметить, что наибольший опыт в этой области имеют российские исследователи, которые показали, что при правильном подборе иммуномодулирующего препарата и схемы его введения можно получить быстрый и полноценный иммунный ответ на вакцинацию у лиц, страдающих различной патологией.
Одной из главных целей при назначении иммуномодулирующего препарата при проведении профилактической вакцинации у лиц с различными нарушениями в состоянии здоровья является не только профилактика инфекционного заболевания, но и достижение положительной динамики в течении основного заболевания. При этом врачу необходимо сделать правильный выбор иммунокорригирующего препарата с учетом не только нозологической формы заболевания, но и исходных показателей иммунного статуса.
Иммунная система человека выполняет важную функцию по сохранению постоянства внутренней среды организма, осуществляемую путем распознавания и элиминации из организма чужеродных веществ антигенной природы, как эндогенно возникающих (клетки, измененные вирусами, ксенобиотиками, злокачественные клетки и т. д.), так и экзогенно проникающих (прежде всего микробы). Эта функция иммунной системы осуществляется с помощью факторов врожденного и приобретенного (или адаптивного) иммуннитета. К первым относятся нейтрофилы, моноциты, макрофаги, дендритные клетки, NK- и NKТ-лимфоциты; ко вторым — Т- и В-клетки, которые ответственны за клеточный и гуморальный ответ соответственно. При нарушении количества и функциональной активности клеток иммунной системы развиваются иммунологические нарушения: иммунодефициты, аллергические, аутоиммунные и пролиферативные процессы.
Современная патология характеризуется наличием двух взаимосвязанных и взаимообусловленных процессов, а именно: ростом числа хронических инфекционных заболеваний, вызываемых условно-патогенными или оппортунистическими микробами и снижением иммунологической реактивности населения, наблюдаемым практически во всех развитых странах.
Очевидно, что справиться с ростом инфекционной заболеваемости с помощью одних только антибиотиков практически невозможно. Антибиотик подавляет размножение возбудителя заболевания, но конечная его элиминация из организма является результатом деятельности факторов иммунитета. Более того, длительное неконтролируемое применение антибиотиков снижает иммунологическую реактивность организма. Поэтому на фоне подавленной иммунореактивности эффективность действия антибиотиков, а также противогрибковых, противовирусных и других химиотерапевтических средств снижается.
В связи с этим в настоящее время резко возрос интерес врачей к препаратам, действующим на иммунную систему организма. Рынок предлагает большое количество лекарственных средств, пищевых добавок и просто пищевых продуктов, действующих на иммунитет. Практикующему врачу зачастую трудно разобраться в этом громадном потоке информации и предложений и выбрать нужное средство. Кроме того, в настоящее время имеется большая путаница в определениях, что такое иммунокорректор, иммуномодулятор, иммуностимулятор.
Назначение с лечебной или профилактической целью при заболеваниях, связанных с нарушениями иммунитета, препаратов химической или биологической природы, обладающих иммунотропной активностью (лечебный эффект связан с их преимущественным или селективным действием на иммунную систему человека), называется иммунотерапией, а сами препараты могут быть разделены на четыре большие группы:
Иммуномодуляторы — лекарственные средства, обладающие иммунотропной активностью, которые в терапевтических дозах восстанавливают функции иммунной системы (эффективную иммунную защиту).
Иммунокорректоры — средства и воздействия (в том числе и лекарственные), обладающие иммунотропностью, которые нормализуют конкретное нарушенное то или иное звено иммунной системы (компоненты или субкомпоненты Т-клеточного иммунитета, В-клеточного иммунитета, фагоцитоза, комплемента). Таким образом, иммунокорректоры — это иммуномодуляторы «точечного» действия.
Иммуностимуляторы — средства, усиливающие иммунный ответ (лекарственные препараты, пищевые добавки, адъюванты и другие агенты биологической или химической природы, стимулирующие иммунные процессы).
Иммунодепрессанты — средства, подавляющие иммунный ответ (лекарственные препараты, обладающие иммунотропностью или неспецифическим действием, и другие различные агенты биологической или химической природы, угнетающие иммунные процессы).
Для того чтобы тот или иной лекарственный препарат мог быть отнесен к группе иммуномодуляторов, должна быть доказана его способность изменять иммунологическую реактивность организма в зависимости от ее исходного состояния, т. е. способность повышать или понижать соответственно пониженные или повышенные показатели иммунитета. Для этого исследуемый препарат должен пройти доклинические испытания, проведенные в соответствии с Методическими рекомендациями, утвержденными Фармакологическим государственным комитетом при Минздраве РФ от 10.12.1998. В результате этих испытаний должно быть доказано его иммуномодулирующее влияние на компоненты иммунной системы: фагоцитоз, систему комплемента, гуморальный иммунитет, клеточный иммунитет, систему цитокинов. Далее исследуемый препарат должен пройти клинические испытания в соответствии с правилами GCP, в результате которых на основании двойного слепого рандомизированного исследования будет доказана его клиническая и иммунологическая эффективность. В конечном итоге препарат регистрируется ФГК Минздрава России как иммуномодулятор и выдается разрешение на его широкое медицинское применение и промышленное производство.
Только тот препарат, который прошел доклинические и клинические испытания по описанным выше правилам, отвечает требованиям, предъявляемым к иммуномодулирующим препаратам.
При анализе фармакологического действия иммуномодуляторов необходимо учитывать удивительную особенность функционирования иммунной системы, которая «работает» по типу сообщающихся сосудов, т. е. наличие груза на одной «чаше» приводит в движение всю систему. В связи с этим, вне зависимости от исходной направленности, под влиянием иммуномодулятора в конечном счете в той или иной степени изменяется функциональная активность всей иммунной системы в целом. Иммуномодулятор может оказывать избирательное влияние на соответствующий компонент иммунитета, но конечный эффект его воздействия на иммунную систему всегда будет многогранным. Например, вещество X индуцирует образование только одного интерлейкина-2 (ИЛ-2). Но этот цитокин усиливает пролиферацию Т-, В- и NK-клеток, повышает функциональную активность макрофагов, NK-клеток, цитотоксических лимфоцитов (ЦТЛ) и т. д. ИЛ-2 не является исключением в этом плане. Все цитокины — главные регуляторы иммунитета, опосредующие действие на иммунную систему как специфических, так и неспецифических стимулов, оказывают множественное и разнообразное действие на иммунную систему. В настоящее время не выявлено цитокинов со строго специфической активностью. Такие особенности функционирования иммунной системы делают практически невозможным существование иммуномодулятора с абсолютно селективным конечным влиянием на иммунитет. Это положение позволяет нам сформулировать следующий принцип.
Любой иммуномодулятор, избирательно действующий на соответствующий компонент иммунитета (фагоцитоз, клеточный или гуморальный иммунитет), будет в той или иной степени оказывать воздействие и на все другие компоненты иммунной системы.
Существуют три основные группы заболеваний иммунной системы: иммунодефициты, аллергические и аутоиммунные процессы. Рассмотрим, при каких заболеваниях целесообразно применение иммуномодуляторов.
Аллергические заболевания. При аллергических заболеваниях использование иммуномодуляторов целесообразно в тех случаях, когда эти заболевания осложнены какими-либо проявлениями вторичной иммунной недостаточности: например, атопический дерматит с пиодермией, бронхиальная астма с явлениями хронического гнойно-обструктивного бронхита, рецидивирующей герпетической или цитомегаловирусной инфекции и т. д. В этих случаях эффект иммуномодуляторов направлен на ликвидацию у больного с аллергическим процессом инфекционного очага. В ряде случаев это может существенно улучшить клиническую картину основного заболевания. Например, применение иммуномодулируюшей терапии у больных бронхиальной астмой может удлинять продолжительность ремиссии до одного года. Однако во всех этих случаях иммуномодулируюшая терапия не направлена на основную причину заболевания, т. е. не является этиотропной. Как известно, при аллергических заболеваниях происходит активация Тh2-клеток и повышена продукция цитокинов ИЛ-4, ИЛ-5, ИЛ-13. ИЛ-5 способствует созреванию эозинофилов и их активации. ИЛ-4 и ИЛ-13 индуцируют В-клетки к синтезу иммуноглобулина IgE. Следовательно, с иммунологических позиций, повышенная активность Тh2-клеток является основным звеном в патогенезе аллергических реакций. Отсюда становится очевидным, что одним из направлений в иммуномодулирующей терапии этих процессов является применение препаратов, снижающих активность Тh2-клеток и повышающих активность Тh1-клеток, т. е. иммуномодуляторов.
Аутоиммунные заболевания. При аутоиммунных заболеваниях в настоящее время довольно широко применяются иммунотропные препараты, относящиеся к группе иммунодепрессантов, действие которых направлено на подавление аутоиммунного воспалительного процесса. Их применение, как правило, дает быстрый и хороший клинический эффект. Тем не менее, такое лечение, вероятно, нельзя считать этиотропным, так как оно направлено на патогенез, а не на причину заболевания. Так, применение гормональных препаратов при рассеянном склерозе, являющемся Thl-опосредованным заболеванием, дает хороший клинический эффект, но не удлиняет продолжительность ремиссии — важного показателя эффективности терапии. В основе этиопатогенеза многих аутоиммунных заболеваний, как и при аллергических процессах, лежит дисбаланс Th1/Th2. При рассеянном склерозе, ревматоидном артрите, аутоиммунных тиреоидитах наблюдается повышенная активность Тh1-клеток, при системной красной волчанке, аутоиммунных васкулитах, некоторых видах анемий — Th2-клеток. Основанием для применения иммуномодуляторов при аутоиммунных процессах, как и при аллергии, являются инфекционные процессы, осложняющие течение основного заболевания.
Иммунодефициты. Повышенная инфекционная заболеваемость служит главным проявлением как первичных, так и вторичных иммунодефицитов. Возникает вопрос: целесообразно ли применение иммуномодулирующих препаратов при первичных иммунодефицитах, в основе которых лежит генетический дефект. Естественно, с помощью этих препаратов исправить генетический дефект невозможно. Но антиинфекционная защита является многокомпонентной, и можно ожидать, что при некотором повышении с помощью иммуномодуляторов функциональной активности нормально работающего компонента иммунной системы будет скомпенсирована, хотя бы частично, «плохая работа» дефектного компонента. Существенное улучшение клинического состояния и показателей иммунного статуса наблюдается у больных с пониженным уровнем всех классов иммуноглобулинов (общая вариабельная иммунологическая недостаточность) при их лечении иммуномодулирующими препаратами, активирующими фагоцитоз, в частности, Полиоксидонием. Хорошо продуманное применение иммуномодулирующей терапии у больных с некоторыми формами первичных иммунодефицитов может дать хороший клинический результат.
Главной мишенью применения иммуномодулирующих препаратов являются вторичные иммунодефициты, которые характеризуются частыми, рецидивирующими, трудно поддающимися лечению инфекционно-воспалительными процессами всех локализаций и любой этиологии. В основе любого хронического инфекционно-воспалительного процесса лежат те или иные изменения в иммунной системе, которые и служат одной из причин существования этого процесса. Исследование параметров иммунной системы может не всегда выявить эти изменения, поэтому при наличии в организме хронического инфекционно-воспалительного процесса можно назначать больному иммуномодулирующие препараты даже в том случае, если иммунодиагностическое исследование не выявит существенных отклонений в иммунном статусе. Как правило, при этих процессах в зависимости от вида возбудителя врач назначает антибиотики, противогрибковые, противовирусные средства или другие химиотерапевтические препараты. Мы считаем, что во всех случаях, когда врач назначает противомикробные средства при явлениях вторичной иммунологической недостаточности, следует назначать и иммуномодулирующую терапию. При лечении процессов иммуномодуляторы применяют в основном в комплексном лечении совместно с этиотропными химиотерапевтическими средствами.
Таким образом, основным критерием для назначения иммуномодулятора служит клиническая картина заболевания, проявляющаяся наличием хронического инфекционно-воспалительного процесса, трудно поддающегося адекватному антиинфекционному лечению.
Возникает вопрос: как применять иммуномодуляторы в комплексном лечении хронических инфекций. Мы считаем, что иммуномодуляторы следует назначать не после и не перед приемом антибиотиков или противовирусных препаратов, а одновременно с ними. В этом случае по возбудителю будет нанесен двойной удар: антибиотик или другое химиотерапевтическое средство снижает функциональную активность микроба, а иммуномодулятор повышает функциональную активность клеток иммунной системы, за счет чего достигается более эффективная элиминация возбудителя из организма. Следует избегать «модного» утверждения о негативном влиянии антибиотиков на иммунную систему. В настоящее время на вооружении у врачей имеется ряд антибиотиков, не оказывающих ингибирующего действия на иммунитет. При прочих равных условиях врач должен отдавать предпочтение последним. Отдельным является вопрос о применении иммуномодуляторов при острых бактериальных и вирусных инфекциях.
Как правило, их назначение не рекомендуется при острых процессах, поскольку это может утяжелить их течение. Например, при вирусной инфекции активация ЦТЛ может вызвать фатальный исход за счет массивного разрушения тканей, инфицированных вирусом. Это, вероятно, нужно иметь в виду при назначении химических препаратов, а также препаратов бактериального происхождения, являющихся мощными индукторами провоспалительных цитокинов. Применение иммуномодуляторов при острых инфекционных процессах, особенно бронхолегочного аппарата, может быть оправдано у иммунологически компрометированных людей, например у лиц, относящихся к группе часто и длительно болеющих. Иммуномодуляторы в этих случаях применяются с целью предупреждения развития постинфекционных осложнений. Наличие у Полиоксидония детоксицирующих и антиоксидантных свойств делает возможным его применение при острых инфекционных заболеваниях. Клиническая практика показывает эффективность и безопасность его применения при острых инфекциях. Мы полагаем, что не только Полиоксидоний, но и другие иммуномодуляторы с антиоксидантными и детоксицируюшими свойствами могут применяться при острых инфекционных процессах у иммунологически компрометированных лиц.
Нередко возникает вопрос, можно ли проводить иммуномодуляцию в виде монотерапии. Р.?В.?Петровым было впервые сформулировано понятие «иммунореабилитация», под которым понимается комплекс медикаментозных и немедикаментозных лечебных мероприятий, направленных на восстановление функциональной активности иммунной системы и здоровья человека. Мы полагаем, что при иммунореабилитационных мероприятиях иммуномодуляторы могут применяться в виде монотерапии и в комплексе с различными общеукрепляющими средствами. Это оправдано:
В заключение можно сформулировать некоторые общие принципы применения иммуномодуляторов у больных с недостаточностью антиинфекционной защиты: