Иммуносупрессия что это такое
Иммуносупрессия: диагностика и лечение
Подавление врожденной способности организма отражать болезни и инфекции известно как иммуносупрессия. Это подавление может быть результатом заболевания, которое нацелено на иммунную систему, такого как вирус иммунодефицита человека (ВИЧ) или являться следствием фармацевтических агентов, используемых для борьбы с определенными состояниями, такими как рак.
В некоторых случаях иммуносупрессия также может быть вызвана намеренно. Эта индукция может быть необходима для терапевтических вмешательств, таких как трансплантация тканей и органов, чтобы снизить риск отторжения органа.
Каковы причины иммуносупрессии?
Иммуносупрессия может быть вызвана рядом системных заболеваний. Они включают, но не ограничиваются:
В дополнение к системным болезням определенные фармацевтические препараты и терапевтические вмешательства могут также вызвать иммуносупрессию. Они включают, но не ограничиваются:
Каковы признаки и симптомы иммуносупрессии?
В целом пациенты с ослабленным иммунитетом, как правило, очень больны и подвержены инфекции обычными микроорганизмами, которые в противном случае не представляли бы угрозы для здоровых людей. Они называются оппортунистическими инфекциями и часто встречаются у людей с ослабленной иммунной системой.
Оппортунистические инфекции могут быть вызваны:
Эти микробы легко распространяются через жидкости организма, воздух или загрязненную пищу, воду, животных и предметы. Помимо того, что они физически больны, эти пациенты обычно имеют широкий диапазон нарушений в показателях общего анализа крови, которые используются для указания на инфекционную этиологию.
Инфекции у людей с ослабленным иммунитетом, как правило, длятся дольше и являются более частыми и трудными для лечения, чем инфекции у людей с нормальной иммунной системой. Эти пациенты могут иметь регулярные инфекции дыхательных путей и желудочно-кишечного тракта, а также воспаления и инфекции других внутренних органов и систем. Кроме того, у детей, страдающих иммуносупрессией, наблюдаются признаки ненормального развития и роста.
Как диагностируется и лечится иммуносупрессия?
Иммуносупрессию можно легко увидеть по отклонениям в анализе крови, особенно по количеству лейкоцитов и уровням иммуноглобулинов, которые являются белками, в первую очередь участвующими в борьбе с инфекциями.
Функциональность иммунной системы может быть установлена с помощью дальнейших тестов, которые проверяют клеточный и гуморальный иммунитет. Клеточный иммунитет может быть протестирован с помощью фагоцитарной функции и тестов активации Т-клеток.
Цель лечения иммуносупрессии заключается в том, чтобы по возможности выявить этиологию. Тогда важно агрессивно лечить и предотвращать инфекции, в то же время стимулируя иммунную систему фармакологической терапией.
Антимикробные препараты имеют первостепенное значение против инфекционных агентов. Если виновниками являются бактерии, для предотвращения дальнейшей инфекции необходим длительный курс антибиотиков, пока сила иммунной системы пациента все еще находится ниже оптимальной.
Существует несколько методов лечения, которые могут быть использованы при попытке поддержать организм человека с ослабленным иммунитетом. Такой терапией является использование иммуноглобулинов, которые вводятся внутривенно или подкожно.
Отказ от ответственности: этот контент, включая советы, предоставляет только общую информацию. Это никоим образом не заменяет квалифицированное медицинское заключение. Для получения дополнительной информации всегда консультируйтесь со специалистом или вашим лечащим врачом.
Добавьте «Правду.Ру» в свои источники в Яндекс.Новости или News.Google, либо Яндекс.Дзен
Быстрые новости в Telegram-канале Правды.Ру. Не забудьте подписаться, чтоб быть в курсе событий.
Иммуносупрессия что это такое
Как уже известно к настоящему времени, COVID-19-ассоциированные заболеваемость и смертность объясняются патологическими изменениями иммунного ответа пациента. Выдвигаются две противоречивые гипотезы: поражение, опосредованное гипервоспалительным «цитокиновым штормом», и нарушение иммунологического защитного механизма хозяина, приводящее к неконтролируемому распространению вируса и поражению органов. Ключевой причиной неспособности объяснить такое противоречие является отсутствие диагностических инструментов для оценки иммунной функции при заражении COVID-19.
Один из наиболее примечательных фактов о текущей эпидемии SARS-CoV-2 (COVID-19) заключается в том, что, несмотря на активно проводимые по всему миру исследования, патофизиологические процессы, играющие решающую роль в заболеваемости и смертности среди пациентов, по-прежнему остаются неизвестными. Господствующая в настоящее время парадигма патологического процесса подразумевает, что слишком сильный иммунный ответ, медиаторами которого выступают чрезмерно продуцируемые провоспалительные цитокины, вызывает обширное поражение легких и состояние склонности к тромбозам. Соответственно, предполагается, что летальный исход наступает в первую очередь по причине воспалительного заболевания легких, нарушения микро- и макроциркуляции и наступающих в конечном итоге дыхательной недостаточности или васкулярной коагулопатии. Это понятие опосредованного «цитокиновым штормом» летального исхода среди пациентов с COVID-19 популяризовано как в неспециализированных печатных изданиях, так и во многих ведущих научных публикациях.
На основании вышеизложенной теории проводятся испытания ряда антицитокиновых и противовоспалительных терапий для лечения COVID-19, включая антитела к интерлейкину-6, антагонисты рецептора интерлейкина-1 и ингибиторы сигнального пути JAK-STAT, но в ходе более ранних клинических исследований существенную эффективность таких подходов доказать не удалось.
В то же время, как это ни парадоксально, вторая, диаметрально противоположная теория COVID-19-индуцированной заболеваемости и смертности заключается в коллапсе системы иммунитета пациента. Такой коллапс иммунитета проявляется в неспособности его сдерживать неконтролируемые репликацию и распространение вируса наряду с прямой цитотоксичностью продуктов иммунного ответа пациента. В качестве обоснования этой прямо противоположной теории приводится наблюдаемая у пациентов прогрессивная и глубокая лимфопения, уровни которой порой достигают таких же значений, как при СПИДе. Результаты многих недавно выполненных исследований свидетельствуют о том, что, в отличие от «цитокинового шторма», который часто считается эпизодическим, лимфопения сохраняется у критически больных пациентов с COVID-19 и коррелирует с повышенной тяжестью вторичных заболеваний и летальным исходом.
Персонализированный подход к оказанию медицинской помощи требует более полного понимания, какой из этих типов реакции системы иммунитета преобладает, поскольку подходящие вмешательства будут различаться кардинальным образом в зависимости от постановки диагноза — наличия у пациента гиперреактивности или же глубокой иммуносупрессии. Например, в настоящее время выполняется клиническое исследование антител против интерлейкина-6, антагонистов рецептора IL-1 и ингибиторов JAK-STAT в качестве терапевтических средств для лечения пациентов с COVID-19 и существует вероятность, что они могут еще больше нарушить способность организма пациента побороть вирус. С другой стороны, методы терапии с использованием иммуностимуляторов, например, ингибиторов иммунных контрольных точек интерлейкина-7, интерферона-γ или GM-CSF, могут усугубить нарушенный и устойчивый воспалительный ответ и привести к усилению степени поражения органов.
Суммируя вышесказанное, становится ясным, что при ведении критически больных пациентов с COVID-19 необходимо ответить на два конкретных и являющихся ключевыми вопроса:
1) каков их первичный иммунный эндотип, т.е. является ли он гиперреактивным или иммуносупрессивным;
2) каким образом это состояние изменяется с течением времени в связи с прогрессированием заболевания или нормализацией состояния.
Более полное понимание иммунного статуса пациента с COVID-19 поможет провести правильную иммунотерапию. Задачей последующих исследований в этой области будет определение, развивается ли при COVID-19 усиленный провоспалительный «цитокиновый шторм» или же состояние, развивающееся при указанной патологии, представляет собой иммуносупрессивный тип иммунного ответа, а также изучение, как изменяется функция иммунной системы по мере прогрессирования заболевания.
Иммуносупрессия
Снижение иммунной защиты организма- это не навсегда, с этим можно и нужно бороться.
Иммуносупрессия, иммунодепрессия, или иммунодефицит — все это иммунодефицитные состояния — угнетение иммунитета обусловленные выпадением одного или нескольких компонентов иммунного ответа или тесно взаимодействующих с ним неспецифических факторов. Это приводит к ослаблению сопротивляемости организма по отношению к различным инфекционным и неинфекционным заболеваниям.
Иммуносупрессия бывает физиологической (необходимой в определённых ситуациях для организма), патологической (при различных заболеваниях и болезненных состояниях) и искусственной, вызываемой приёмом ряда иммуносупрессивных препаратов или ионизирующими излучениями.
Физиологическая иммуносупрессия отмечается при беременности. Она необходима для предотвращения иммунологического отторжения эмбриона, который является, по существу, генетически и иммунологически наполовину чужеродным трансплантатом в матке беременной женщины.
Патологическая иммуносупрессия отмечается, прежде всего, при различных состояниях врождённого или приобретённого иммунодефицита, в частности, при инфицировании ВИЧ, при лучевой болезни и др.
Искусственная иммуносупрессия применяется при лечении аутоиммунных заболеваний, при трансплантации органов и тканей и др.
Иммунодефициты можно разделить на первичные и вторичные.
Причины развития вторичного иммунодефицита
Факторы, способные вызвать вторичный иммунодефицит, весьма разнообразны. Вторичный иммунодефицит может быть вызван как факторами внешней среды, так и внутренними факторами организма.
В целом, все неблагоприятные факторы окружающей среды, способные нарушить обмен веществ организма, могут стать причиной развития вторичного иммунодефицита. К наиболее распространенным факторам окружающей среды, вызывающим иммунодефицит относятся загрязнение окружающей среды, ионизирующее и СВЧ излучение, отравления, длительный прием некоторых лекарственных препаратов, хронический стресс и переутомление.
Все эти факторы оказывают комплексное негативное воздействие на иммунную систему, которая охраняет наш организм от всего «вредного», поступающего извне или образующегося внутри. Кроме того, такие факторы как ионизирующее излучение вызывают избирательную депрессию иммунной защиты, связанную с угнетением всех ее продуцирующих функций и системы кроветворения. Люди, проживающие или работающие в условиях загрязненной окружающей среды, чаще болеют различными инфекционными заболеваниями и чаще страдают онкологическими болезнями. Это напрямую связано со снижением активности иммунной системы.
К внутренним факторам, способным спровоцировать вторичный иммунодефицит относятся:
Клиническая картина Иммунодефицитных состояний
Диагностика иммунодефицита
Первичный иммунодефицит обычно проявляется сразу после рождения ребенка или спустя некоторое время после него. Для точного установления типа патологии проводят ряд сложных иммунологических и генетических анализов – это помогает определить место нарушения иммунной защиты (клеточное или гуморальное звено), а также определить тип мутации, которая вызвала заболевание.
Вторичные иммунодефициты могут развиться в любой период жизни. Заподозрить иммунодефицит можно в случае часто рецидивирующих инфекций, перехода инфекционного заболевания в хроническую форму, неэффективности обычного лечения, небольшого, но длительного повышения температуры тела. Установить точный диагноз иммунодефицита помогают различные анализы и тесты: общий анализ крови, определение фракций белков крови, специфические иммунологические тесты.
В настоящее время существует только один метод, позволяющий достоверно оценить в целом состояние гуморального звена иммунной системы — это «ЭЛИ – Висцеро – Тест 24», заключающийся в количестренном определении уровня антител к антигенам основных органов и систем человеческого организма.
Лечение иммунодефицита
Лечить первичные иммунодефициты не просто. Прежде всего, необходим точный диагноз для определения нарушенного звена иммунной защиты и назначения комплексного лечения.
При недостатке иммуноглобулинов проводят пожизненную заместительную терапию сыворотками, содержащими антитела или обычной донорской плазмой. Также применяют иммуностимулирующую терапию препаратами типа Бронхомунал, Рибомунил, Тактивин.
При возникновении инфекционных осложнений назначают лечение антибиотиками, противовирусными или противогрибковыми препаратами.
При вторичных иммунодефицитах, нарушения иммунной системы выражены в меньшей степени, чем при первичных. Как правило, вторичные иммунодефициты носят приходящий характер. В связи с этим лечение вторичных иммунодефицитов гораздо проще и эффективнее по сравнению с лечением первичных нарушений функции иммунной системы.
Обычно лечение вторичного иммунодефицита начинают с определения и устранения причины его возникновения. Например, лечение иммунодефицита на фоне хронических инфекций начинают с санации очагов хронического воспаления.
Иммунодефицит на фоне витаминно-минеральной недостаточности начинают лечить при помощи комплексов витаминов и минералов и различных пищевых добавок, содержащих эти элементы. Восстановительные способности иммунной системы велики, поэтому устранение причины иммунодефицита, как правило, приводит к восстановлению иммунной системы.
Для ускорения выздоровления и специфической стимуляции иммунитета проводят курс лечения иммуностимулирующими препаратами. На данный момент известно большое количество различных иммуностимулирующих препаратов, с различными механизмами действия. Препараты Рибомунил, Кристин и Биостим содержат антигены различных бактерий и будучи введенными в организм, стимулируют выработку антител и дифференциацию активных клонов лимфоцитов. Тималин, Тактивин – содержат биологически активные вещества, экстрагированные из вилочковой железы животных. Кордицепс — является наиболее эффективным иммуномодулятором, нормализующим иммунитет в целом как систему.
Эти препараты оказывают выборочное стимулирующее действие на субпопуляцию Т-лимфоцитов. Нуклеинат натрия стимулирует синтез нуклеиновых кислот (ДНК и РНК), деление и дифференциацию клеток. Различные виды интерферонов повышают общую сопротивляемость организма и с успехомиспользуются в лечении различных вирусных заболеваний.
Заслуживают особого внимания иммуномодулирующие вещества растительного происхождения: Иммунал, экстракт Эхинацеи розовой, и особенно Кордицепс.
Особенности диагностики и лечения в Клинико-диагностической лаборатории БИОМАРКЕР:
Сначала мы проводим уникальное обследование по технологии «Иммункулус», заключающееся в комплексной оценке состояния аутоиммунитета. Всего на основании одного анализа крови мы определяем содержание аутоантител к различным органам и системам нашего организма. Результат покажет уровень общей иммунореактивности, выявит дополнительные звенья патогенеза, «скрытые» патологии. Специалисты Клинико-диагностической лаборатории БИОМАРКЕР проводят строго-индивидуальное лечение, которое состоит из следующих этапов:
В результате такого подхода к лечению иммунодефицитное состояние достоверно проходит. Мы имеем возможность отслеживать его регрессию по результатам контрольных анализов.
Иммуносупрессивная терапия
Для того, чтобы не произошло отторжение пересаженного органа необходимо проведение иммуносупрессивной терапии. Неверно думать, будто она полностью выключает или подавляет иммунитет, вызывает выключение защитных механизмов. Современная медикаментозная иммуносупрессия меняет иммунитет, блокируя на разных уровнях механизмы агрессии иммунитета против пересаженного органа. Действительно, состояние иммуносупрессии несколько повышает восприимчивость организма к инфекциям, в первую очередь вирусным. Кроме того, иммуносупрессивные препараты имеют некоторые особенности, которые необходимо знать как врачу, так и пациенту, который их принимает.
Важно помнить следующее. Несоблюдение рекомендаций врача пациентами после трансплантации печени создаёт угрозу жизни. Назначенная иммуносупрессивная терапия должна приниматься неукоснительно и точно до минуты и до таблетки. Человек, лукавящий, обманывающий врачей, родственников в приёме препаратов, обманывает только самого себя. Хорошее самочувствие, большой срок после трансплантации, хорошие показатели не означают, что можно самостоятельно отменить или снизить дозировку иммуносупрессивной терапии. Зная, что эксперименты на людях запрещены, мы не должны ставить экспериментов на самих себе. Перечислим основные препараты, с которыми Вы сможете столкнуться после трансплантации. Эти препараты применяются во всех странах мира. Вы можете быть уверены, что получаете такую же современную иммуносупрессию, как и пациенты в Токио, Ганновере, Нью-Йорке, Москве. Приведённые данные носят ориентирующий характер. За более подробной информацией обращайтесь, пожалуйста, к инструкции по медицинскому применению препарата, вложенной в упаковку.
Если Вы забыли своевременно принять дозу препарата или после приема таблетки Вас вырвало, примите пропущенную дозу. Однако, если уже почти наступило время для приёма следующей дозы, пропустите пропущенную дозу и продолжайте регулярный режим дозирования. Не принимайте двойную дозу, чтобы наверстать пропущенный прием. Один пропущенный прием препарата как правило не опасен, но таких пропусков должно быть как можно меньше.
Такролимус (програф, прилуксид, рединесп)
Иммуносупрессивный препарат такролимус был открыт в 1984 году как продукт жизнедеятельности грибков из почвы в Японии. Являясь макролидным антибиотиком, он обладает слабым противомикробным и противогрибковым действием, но наиболее мощным является его иммуносупрессивное действие. Широко внедрён в клиническую практику благодаря трудам отца современной трансплантологии Томаса Старзла. Химически является 23-членным макролидом. Угнетает кальциневрин, приводя к снижению выделения лимфоцитами интерлейкина-2. В настоящее время такролимус является золотым стандартом и препаратом №1 в проведении иммуносупрессивной терапии после трансплантации печени.
Этот препарат обладает рядом специфических особенностей, которые надо понимать.
Такролимус пролонгированного действия (адваграф)
Форма пролонгированного действия такролимуса полностью идентична такролимусу, однако суточная доза принимается в один прием — как правило, утром. Все предосторожности в отношении такролимуса распространяются и на данную форму.
Циклоспорин А (сандиммун неорал, экорал, панимун беорал)
Циклоспорин был открыт в 1969 году в Норвегии как продукт жизнедеятельности почвенных грибков. В 1972 году в Швейцарии открыто его действие на иммунитет. Как и такролимус, является ингибитором кальциневрина. Имеет меньшую по сравнению с такролимусом эффективность и более выраженную нефротоксичность. Так как концентрация препарата после его приёма меняется, как правило берут кровь для её определения до приёма таблеток (обычно, за 30 минут до очередного приёма) — это называется «нулевой» концентрацией или С0. Также иногда определяют концентрацию препарата на 2 часу после приёма очередной дозы — концентрацию С2. В сложных случаях концентрацию определяют несколько раз в разные сроки после приема препарата, строят кривую препарата и определяют интегральный показатель — площадь под кривой концентрации (AUC). В редких случаях прием циклоспорина повышает артериальное давление. Редким осложнением также является гиперплазия дёсен. При появлении разрастания тканей дёсен необходимо сообщить своему врачу и обратиться к стоматологу. Если у Вас имеется склонность к повышению уровня холестерина в крови, прием циклоспорина может способствовать его повышению.
Мы назначаем циклоспорин довольно редко, например, при непереносимости препаратов такролимуса
Микофенолаты: микофеноловая кислота (майфортик), микофенолата мофетил (селлсепт, майсепт, микофенолат тл)
Препараты микофеноловой кислоты имеют выраженное иммуносупрессивное действие при небольшом количествепобочных эффектов. Они подавляют фермент, синтезирующий основания для образования ДНК, за счёт чего тормозят деление Т и В лимфоцитов. У некоторых пациентов прием препаратов микофеноловой кислоты достаточно редко приводит к прокинетическому эффекту: увеличивается активность кишечника вплоть до развития диареи. При приёме этих препаратов необходимо контролировать уровень лейкоцитов, при тенденции к снижению необходимо корригировать дозировку во избежание развития инфекционных осложнений (вирусных, в первую очередь). Применение цитостатических иммуносупрессивных препаратов несколько замедляет заживление ран
Ингибиторы mTOR рецепторов: сиролимус (рапамун), эверолимус (сертикан)
Азатиоприн
Азатиоприн является классическим иммуносупрессивным препаратом, введенным в клиническую практику в 1978 году основоположником мировой трансплантации Роем Калном. Данный препарат обладает лимфостатическим действием. Превращаясь в активную форму 6-меркаптопурин, азатиоприн подавляет синтез ДНК в быстро делящихся клетках, в том числе, в Т и В лимфоцитах. Контроль концентрации этого препарата не нужен. Нужен контроль количества лейкоцитов в крови, так как азатиоприн может понижать его. Как и у других лимфостатических иммуносупрессивных препаратов, длительный приём азатиоприна может повышать риск развития некоторых опухолей, о чём нужно помнить. На фоне приёма азатиоприна редко может разиваться острый панкреатит. Несмотря на то, что в клинической практике встречаются более эффективные препараты со сходным действием, недорогой азатиоприн до сих пор имеет место в клинической практике лечения пациентов после трасплантации. Принимается два раза в день в одно и то же время.
Преднизолон, метилпреднизолон (метипред)
Глюкокортикоидные гормоны являются классическим компонентом иммуносупрессивной терапии. С их применением связаны частые страхи и домыслы. Действительно, в прошлом, когда после трансплантации глюкокортикоиды длительно применялись в больших дозировках, на этом фоне возникали такие побочные эффекты, как увеличение веса, покраснение лица, чувство «приливов» после приёма таблеток, увеличение аппетита и другие. Однако сейчас схемы снижения глюкокортикоидов претерпели значительные изменения и дозировки и сроки применения препаратов минимизированы, такие побочные эффекты выражены крайне редко. Под действием глюкокортикоидов уменьшаесмя количество лимфоцитов и уменьшается их активность. Наш центр назначает глюкокортикостероиды крайне редко. Через некоторое время мы снижаем дозировку стероидов или отменяем их приём.
Лечение псориаза: иммуносупрессоры, антитела и ультрафиолет
Лечение псориаза: иммуносупрессоры, антитела и ультрафиолет
И по времени князь Петр иде в баню мытися и повелением девици помазанием помазая язвы и струпы своя и един струп остави непомазан по повелению девицы. Изыде же из бани, ничто же болезни чюяше. На утрии же узрев си все тело здраво и гладко, развие единого струпа, еже бе непомазан по повелению девичю. И дивляшеся скорому исцелению. (Ермолай-Еразм, «Повесть о Петре и Февронии Муромских»)
Автор
Редакторы
Рецензент
Эта статья завершает наш спецпроект по псориазу. Теперь, когда мы уже знакомы с особенностями развития этой патологии, пришло время разобраться с ее лечением. Поиски лекарства для полной и безоговорочной победы над этой болезнью пока не увенчались успехом, но привели к появлению множества терапевтических подходов, позволяющих держать ее в узде. Познакомимся с преимуществами и недостатками основных способов лечения псориаза и попытаемся разобраться, как они работают.
Псориаз
Спецпроект посвящен генетическому кожному заболеванию, от которого страдает около 1% россиян. В статьях спецпроекта мы стараемся подробно, достоверно и интересно осветить это заболевание со всех возможных сторон. В этом нам помогают наши рецензенты: специалист по псориазу, кандидат биологических наук Алёна Золотаренко и врач-дерматовенеролог, кандидат медицинских наук Михаил Бетехтин.
Предыдущие статьи нашего цикла о псориазе («Псориаз: на войне с собственной кожей» [1], «Псориаз: Т-хелперы, цитокины и молекулярные шрамы» [2], «Генетика псориаза: иммунитет, барьерная функция кожи и GWAS» [3], «Эпигенетика псориаза: молекулярные отметины судьбы» [4]) очень подробно объяснили, насколько сложна этиология этого заболевания: она связана и с особенностями генома, и с эпигенетическими модификациями, и с провоцирующими факторами внешней среды. Вычленить из этого коктейля конкретные причины заболевания еще не удалось, поэтому и его лечение до сих пор не этиотропное (позволяющее повлиять на причину болезни), а патогенетическое — направленное на то или иное звено патогенеза псориаза. К сожалению, о полном излечении пока речи нет, но современные терапевтические подходы позволяют приостановить развитие заболевания и достичь ремиссии.
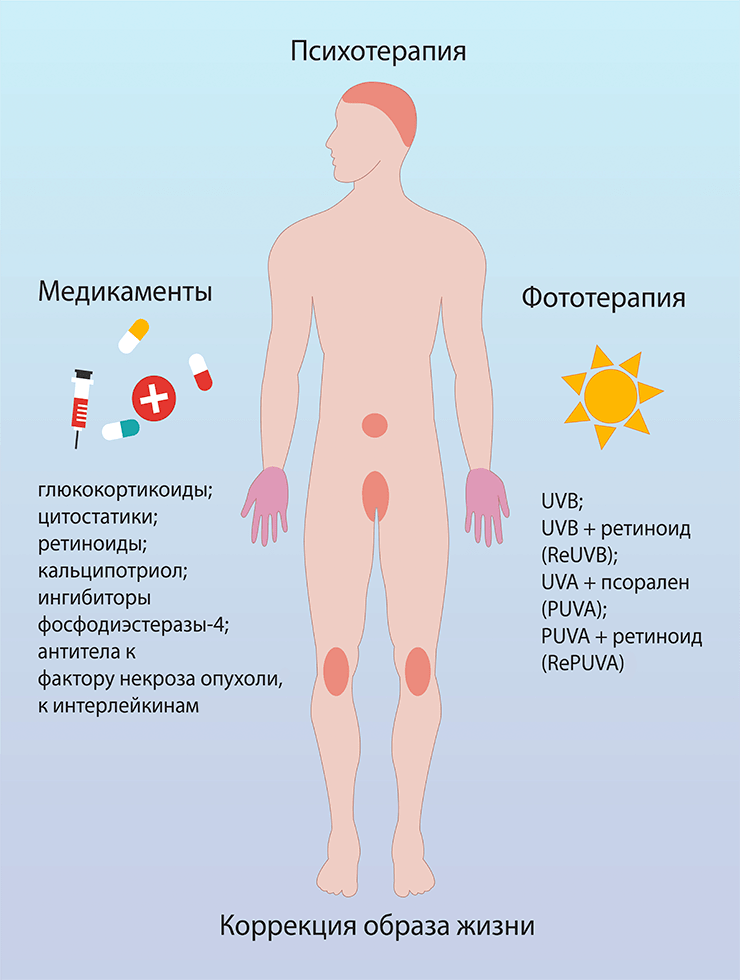
Чаще всего псориаз контролируют с помощью следующих подходов (рис. 1):
Рисунок 1. Лечение псориаза
Глюкокортикоиды
Гормоны из группы глюкокортикостероидов входят в число антипсориатических препаратов первой линии, то есть тех, с которых лечение начинают. Эти гормоны сокращенно называют глюкокортикоидами, кортикостероидами или даже просто стероидами, хотя последнее не совсем корректно. Название этой группы гормонов отражает их принадлежность к стероидам — веществам, главной и системообразующей молекулой которых является циклопентанопергидрофенантрен. Знаменитые «стероиды» бодибилдеров тоже содержат эту молекулу. К глюкокортикоидам относят лишь те стероиды, что способны повышать уровень глюкозы в крови. Термин же «кортикостероиды» очерчивает круг стероидов, происходящих исключительно из коркового слоя, или кортекса, надпочечников.
Природные гормоны из надпочечников животных — кортизон и гидрокортизон (кортизол) — были выделены еще в первой половине XX века. Благодаря широкому спектру действия на разные процессы в организме (общий обмен веществ, водно-электролитный обмен и др.) их применяли для лечения различных заболеваний. Затем появилась возможность усовершенствовать их путем химического синтеза — чтобы они действовали сильнее и прицельнее. Так появились:
Глюкокортикоиды — мощные иммуносупрессоры и регуляторы воспаления. На иммунную систему они действуют неизбирательно, вмешиваясь в работу чуть ли не всех ее звеньев. В частности, они влияют на дифференцировку и/или функции макрофагов, нейтрофилов, моноцитов, Т- и В-лимфоцитов. При псориазе глюкокортикоиды оказывают противовоспалительное действие за счет угнетения синтеза простагландинов, лейкотриенов и цитокинов, уменьшения проницаемости кровеносных сосудов для клеток и жидкости, снижения хемотаксиса иммунокомпетентных клеток и их активности, а также подавления активности фибробластов.
Для лечения псориаза кортикостероиды назначают как наружно (мази, кремы, лосьоны, крело — что-то среднее между кремом и лосьоном), так и внутрь (таблетки, растворы и суспензии для инъекций); выбор препарата и его лекарственной формы зависит от стадии и степени тяжести заболевания. Из-за побочных действий этих препаратов их назначение внутрь стараются отложить настолько, насколько это возможно.
Однако перечисленные нежелательные эффекты проявляются при применении глюкокортикоидов внутрь. Их нанесение на небольшие участки кожи позволяет избежать системных реакций, хотя и не делает местное применение абсолютно безопасным. Чаще всего при длительном наружном использовании сильных глюкокортикоидов могут наблюдаться телеангиэктазии (расширенные мелкие сосуды), атрофия (истончение) кожи, стероидное акне (прыщи на лице и теле), стрии (растяжки кожи) и кожные инфекции. Если переусердствовать с нанесением сильных гормональных мазей на большие участки кожи, то можно получить и системные побочные эффекты [6].
При всех несомненных преимуществах глюкокортикоидов перед другими лекарствами по части эффективности и доступности, их можно сравнить с дубиной, которой мы лупим по иммунной системе и обмену веществ. Ниже мы обсудим лекарства, более тонко регулирующие иммунные механизмы.
Производные витаминов
Витамины А и D, включая их синтетические варианты, способны подавлять проявления псориаза. Эти вещества связываются с ядерными рецепторами (и по совместительству транскрипционными факторами) RARγ/RXR и VDR/RXR, активируя экспрессию ряда генов, ответственных за дифференцировку и пролиферацию клеток. Один из таких генов кодирует особый цитокин — тимический стромальный лимфопоэтин (TSLP, thymic stromal lymphopoietin), который заставляет антигенпредставляющие дендритные клетки воспитывать Th2- и регуляторные (Treg) клетки в ущерб Th1-клеткам. Мы помним из статьи [2], что для псориаза характерна повышенная активность Th1 и Th17 при сниженной активности Th2 и Treg. Соответственно, предполагалось, что А/D-витаминные средства, активируя синтез TSLP в кератиноцитах и других клетках, могут корректировать этот дисбаланс и уменьшать Th1/Th17-опосредованное аутоиммунное воспаление. Но всё оказалось сложнее: TSLP модулирует иммунные реакции по-разному в зависимости от условий. Гомеостатическую и, вероятно, терапевтическую роли играет короткая изоформа TSLP, в то время как длинная образуется в патологических условиях, включая псориатические бляшки. Активный синтез TSLP с последующим «иммунным перекосом» в сторону Th2-звена провоцирует аллергическое воспаление, характерное для атопического дерматита и астмы. А в воспалительной среде, характерной для псориаза, TSLP (по косвенным данным, длинная форма) с помощью CD40L запускает патологическую IL-23/IL-17-сигнализацию [7], [8]. Поэтому в лечении можно было бы использовать ингибиторы длинной формы TSLP и стимуляторы синтеза короткой (либо ее саму).
Роль TSLP в патогенезе и терапии псориаза еще предстоит уточнить, но в то же время очевидно, что антипсориатические эффекты витаминов A и D обусловлены изменением транскрипции многих других генов — регуляторов дифференцировки и пролиферации клеток [1]. (Здесь я должен принести извинения читателю за весьма скудное понимание исследователями как причин, так и механизмов действия лекарств от некоторых кожных болезней.)
Ретиноиды
К ретиноидам в широком смысле слова причисляют витамин А (ретинол) и его биологически активные производные. Но в медицине так принято называть группу синтетических производных витамина А, служащих для лечения определенных болезней, а не восполнения витаминодефицита. Кожные заболевания с их помощью успешно лечат уже более 40 лет.
Чаще других для лечения псориаза используют ацитретин — ретиноид второго поколения. Как и любой другой препарат этой группы, он подавляет избыточный клеточный рост и кератинизацию — главные характеристики псориатической кожи.
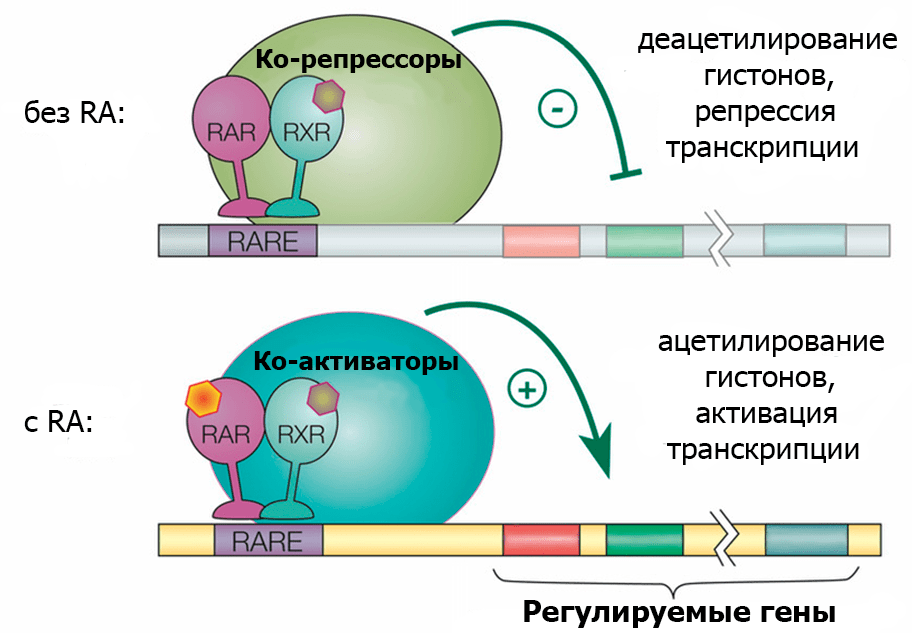
Точный механизм действия ацитретина неизвестен. Судя по всему, ацитретин связывается с рецепторами ретиноевой кислоты — активного метаболита витамина А, образующегося в кератиноцитах, — и запускает характерную для нее сигнализацию [9]. Как это происходит, и почему влияет на течение псориаза, показано на рисунке 2.
Рисунок 2. Принцип работы ретиноидных рецепторов (на примере связывания ретиноевой кислоты). За восприятие ретиноидных сигналов в клетке отвечают ядерные рецепторы семейства RAR (retinoic acid receptors, RARα–γ). RAR образует пару с другой рецепторной молекулой, RXR (retinoid X receptors, RXRα–γ), и этот комплекс взаимодействует с особыми нуклеотидными последовательностями — RARE (RA response elements) — в регуляторных областях ряда генов. Это взаимодействие модулирует активность многих генов, контролирующих рост, деление и дифференцировку клеток. Несвязанная с ретиноевой кислотой (RA) или другим лигандом пара RAR—RXR, взаимодействуя с RARE, чаще всего подавляет экспрессию близлежащих генов, потому что привлекает ко-репрессоры: они конденсируют хроматин так, что считывание наследственной информации в этом участке становится невозможным. Если же с RAR связана RA, то к такому RARE устремляются активаторы экспрессии генов, «расслабляющие» хроматин для посадки компонентов транскрипционной машины. Ретиноидная сигнализация нормализует структуру эпидермиса путем стимуляции клеточной дифференцировки и эксфолиации.
Хотя ацитретин демонстрирует высокую эффективность при псориазе, заранее сложно сказать, как долго пациенту нужно будет принимать препарат и насколько стойкую ремиссию он даст. Прием ацитретина может сопровождаться нежелательными реакциями, порой непереносимыми: фоточувствительностью, истончением и шелушением кожи по всему телу, хрупкостью ногтей, болями в костях и мышцах, тошнотой и др. Препарат противопоказан при нарушениях работы почек и печени, а из-за тератогенного эффекта — и при беременности. Более того, планировать беременность или становиться донором крови можно не менее чем через три года после завершения терапии. Из-за всех этих ограничений вопрос о назначении системных ретиноидов и их преимуществах перед другими лечебными подходами решается строго индивидуально [10].
Кальципотриол (кальципотриен)
Под таким мудреным названием скрывается синтетический аналог витамина D, а именно — его активной формы, кальцитриола. Эффективность кальципотриола была случайно обнаружена при лечении больных остеопорозом, которые также страдали и от псориаза [11]. Точный механизм действия препарата при псориазе не установлен. Известно, что благодаря своему химическому строению кальципотриол взаимодействует с рецепторами витамина D (VDR), но, в отличие от последнего, на обмен кальция влияет незначительно. Рецептор витамина D представлен в различных клетках, включая лимфоциты и кератиноциты; он относится к семейству стероидных рецепторов и работает чаще в виде гетеродимера с уже знакомым нам RXR. Одна часть VDR взаимодействует с лигандом, другая — с участками VDRE (vitamin D response elements) в промоторах регулируемых генов [12]. Далее события развиваются по аналогичному с ретиноидной регуляцией сценарию. Некоторые мутации VDR связаны с предрасположенностью к псориазу, да и дефицит VDR-сигнализации любой природы может иметь патогенетическое значение при этом заболевании.
При местном использовании кальципотриола у мышей и людей выявили дозозависимое повышение секреции кератиноцитами иммуномодулятора TSLP, причем у людей — его короткой формы (у мышей она не синтезируется) [8], [13].
Вообще, эффекты витамина D множественны, связаны не только с TSLP-сигнализацией и не до конца объяснены. При псориазе же важнее всего то, что в терапевтических дозах он:
При использовании мази, крема или раствора кальципотриола лечебный эффект появляется в течение двух недель. Существуют препараты, содержащие и кальципотриол, и глюкокортикоид: такая комбинация действует сильнее. Несмотря на все положительные стороны кальципотриола, его не стόит наносить на обширные участки пораженной кожи (более 30%), так как через нее в кровь может проникнуть избыточное количество лекарства, а это грозит повышением содержания кальция в крови и отложением его солей в почках [17].
Цитостатические препараты
Или просто цитостатики. Это противоопухолевые препараты, нарушающие процессы роста и размножения клеток, особенно быстро делящихся. Очевидно, что чаще всего их применяют для уничтожения злокачественных опухолей. Но поскольку при псориазе кератиноциты, подстегиваемые большим количеством иммунных клеток и цитокинов, делятся как угорелые, для его лечения тоже предложили использовать цитостатики, а точнее — метотрексат, циклоспорин и такролимус. Последние два препарата к этой группе относят не всегда, так как они всё же больше влияют на функции, чем на деление чувствительных клеток. Зато все три препарата можно назвать иммуносупрессорами.
Метотрексат относится к группе антиметаболитов — молекул, которые похожи по химической структуре на вещества, родные для нашего организма, и потому могут занять их место в биохимических процессах и привести к нарушению клеточных функций. Это всё равно что заменить одно из автомобильных колес колесом того же диаметра, но от велосипеда: вроде, всё то же, но далеко не уедешь.
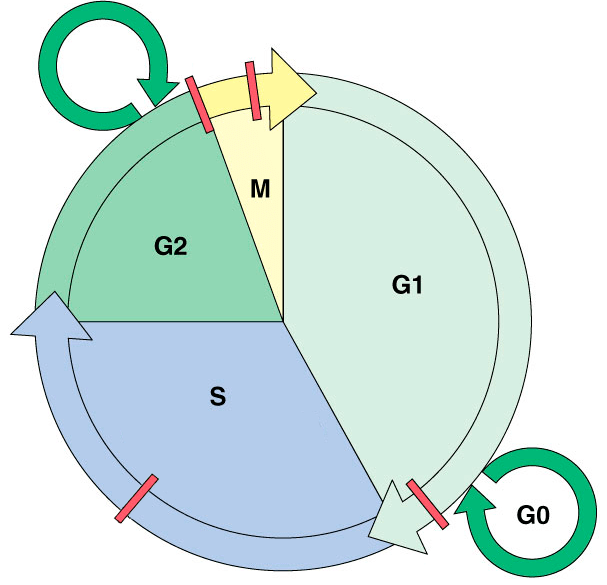
Метотрексат активен в отношении быстро пролиферирующих клеток (в том числе клеток кожи), находящихся в S-фазе клеточного цикла (рис. 3). Но с этим связано и его губительное действие на костный мозг, слизистые оболочки желудочно-кишечного тракта и мочевыводящих путей [6], [18]. Универсальный механизм его работы таков. Для синтеза ДНК организму необходима тетрагидрофолиевая кислота, которая образуется с помощью фермента дигидрофолатредуктазы. Метотрексат блокирует работу этого фермента, притворяясь его субстратом, дигидрофолатом. Кроме того, он ингибирует и другие ферменты, необходимые для синтеза нуклеотидов. В результате подавляются синтез и репарация ДНК, нарушается митоз. Описаны и более специфические механизмы влияния метотрексата на активность лимфоцитов [19].
Деликатнее работает иммуносупрессор циклоспорин. Более 40 лет назад его выделили из почвенных грибков и чуть позже дали на вооружение врачам, которые начали его применять для лечения псориаза. Циклоспорин избирательно блокирует фосфатазную активность кальциневрина в фазах G0 или G1 клеточного цикла T-лимфоцитов. Этот фермент активирует (дефосфорилирует) транскрипционные факторы NFAT, необходимые для синтеза IL-2, IFN-γ и других цитокинов — факторов роста и созревания Т-лимфоцитов [20]. Циклоспорин также мешает экспрессии генов IL-3, IL-4, IL-5, гранулоцитарно-макрофагального колониестимулирующего фактора и TNF. Говоря проще, этот препарат борется с воспалением, обусловленным активацией Т-клеток. Но важно отметить, что он не блокирует синтез цитокинов лимфоцитами раз и навсегда. При снижении его концентрации всё возвращается на круги своя. Более того, в отличие от метотрексата, циклоспорин не подавляет гемопоэз, а в отличие от глюкокортикоидов, не парализует сразу большинство иммунных процессов. Тем не менее его иммуносупрессивного действия хватает для повышения у пациентов риска развития инфекций, паразитарных инвазий и опухолей (особенно лимфом и злокачественных новообразований кожи).
Рисунок 3. Клеточный цикл. M — митоз (деление клетки); S — синтетическая фаза (репликация ДНК); G1 и G2 (Gap 1/2) — пре- и постсинтетическая фазы; G0 — выход из клеточного цикла (временный/постоянный). Красные прямоугольники — контрольные точки (checkpoints) клеточного цикла.
Другой ингибитор кальциневрина — такролимус — можно применять местно. Этот макролид, производимый стрептомицетами, подавляет активность Т-лимфоцитов так же, как и циклоспорин. Помимо этого такролимус тормозит высвобождение медиаторов воспаления из эозинофилов, базофилов и тучных клеток (тканевых базофилов). Клетки Лангерганса под его влиянием меньше экспрессируют FcεRI (высокоаффинный поверхностный рецептор иммуноглобулина Е), что подавляет их активность и презентацию антигенов Т-лимфоцитам. Такролимус — хорошая альтернатива местным глюкокортикоидам, поскольку он не нарушает синтез коллагена и не вызывает атрофии кожи. К побочным эффектам препарата можно отнести повышение вероятности возникновения кожных инфекций, зуд, отеки и фоточувствительность. Однозначных данных о повышении риска злокачественных новообразований кожи на фоне применения такролимуса пока нет [21], [22].
Ингибиторы фактора некроза опухоли
Фактор некроза опухоли альфа (TNF-α, или просто TNF) считают главным инициатором воспаления. В пораженной псориазом коже TNF секретируют Т-клетки и дендритные клетки. Он стимулирует синтез провоспалительных цитокинов IL-1, IL-2, IL-6, IL-8 и IFN-γ, вызывает экспрессию молекул адгезии на стенках кровеносных сосудов, способствуя привлечению иммуноцитов из кровяного русла в кожу, стимулирует производство кератиноцитами других медиаторов воспаления, активирует макрофаги, дендритные и Т-клетки.
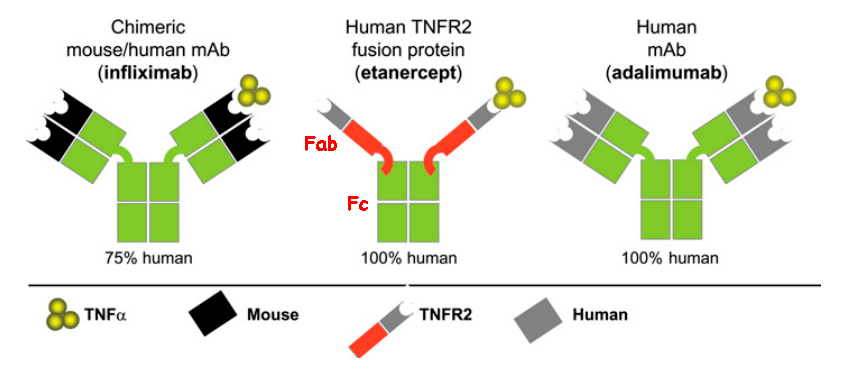
Для ингибирования TNF применяют моноклональные антитела (инфликсимаб, адалимумаб) и гибридные белки (этанерцепт) [5], [23].
Для препаратов, зарегистрированных после июня 2017 года, этот принцип упразднили, потому что с развитием биотехнологии появилось много комбинированных вариантов антител и возникла проблема выбора более подходящего названия [45]. — Ред.
Среди новых (применительно к обыкновенному псориазу) молекул можно выделить цертолизумаб пэгол. Это гуманизированный ПЭГилированный Fab-фрагмент антитела к TNF. Связывание с ПЭГ снижает иммуногенность, улучшает распределение в пораженных тканях и продляет жизнь молекулы в кровяном русле, а отсутствие Fc-фрагмента человеческого IgG1 меняет ее профиль цитотоксичности и затрудняет проникновение через плаценту, что может дать цертолизумабу преимущество перед одногруппниками в лечении беременных [24]. В фазе III клинических исследований препарат в дозировке 200 мг не уступил по эффективности этанерцепту, а в дозировке 400 мг — превзошел его, причем без ухудшения переносимости [25].
Гибридный белок этанерцепт действует немного иначе — как ловушка для TNF. Дело в том, что существуют два типа рецепторов TNF: рецепторы на лейкоцитах, соединение TNF с которыми запускает иммунный ответ, и растворимые рецепторы, циркулирующие в кровяном русле, которые оттягивают на себя TNF и тем самым уменьшают иммунный ответ. Как раз под последние и «подделывается» этанерцепт (рис. 4), но, благодаря Fc-фрагменту человеческого IgG1, он может дольше находиться в кровяном русле и дольше оставаться эффективным.
Рисунок 4. Примеры блокаторов TNF. Инфликсимаб — химерное (мышино-человеческое) моноклональное антитело к TNF. Адалимумаб — полностью человеческое моноклональное антитело. Этанерцепт — гибрид, состоящий из двух растворимых рецепторов TNF (p75) и Fc-фрагмента человеческого IgG1. Fab — антигенсвязывающий фрагмент антитела.
Одним из молекулярных механизмов терапевтического действия TNF-ингибиторов может быть перестройка эпигенетических процессов. Например, в ходе лечения этанерцептом или адалимумабом в крови частично корректируются метильные профили ДНК, меняется продукция десятков типов микроРНК [4].
Поскольку TNF участвует во множестве биологических процессов, подавление его сигнализации не может быть безобидным. Ингибиторы TNF иммуногенны (их эффективность со временем падает из-за выработки антител к ним), противопоказаны в случае тяжелых инфекций (например, туберкулеза) и могут провоцировать частые инфекции кожи и слизистых, хотя по этому пункту ученые ведут споры, ежегодно публикуя обширные статистические работы как в поддержку [26], так и в опровержение этого [27].
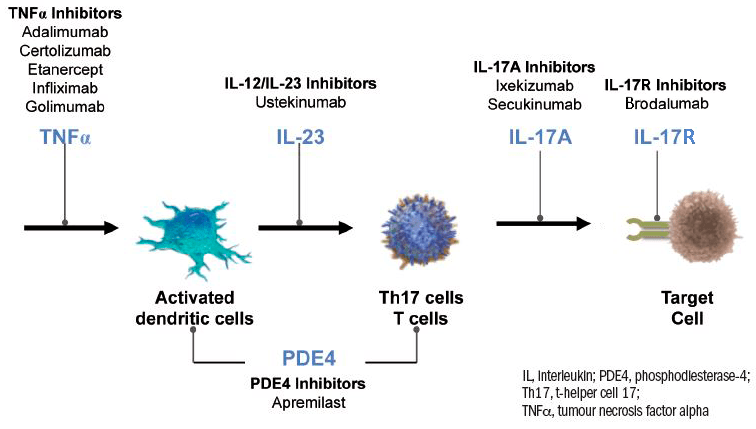
Ингибиторы интерлейкинов
Ингибиторы интерлейкинов фактически действуют так же, как и ингибиторы TNF, и тоже представляют собой моноклональные антитела, но связываются они уже с интерлейкинами. Поскольку популяция клеток Тh17 играет ключевую роль в возникновении псориаза, а цитокин IL-17 специфичен для иммуноопосредованных воспалительных заболеваний (псориаза, болезни Крона, ревматоидного артрита и др.), моноклональные антитела к IL-17 бьют по цели точнее, чем ингибиторы TNF. С IL-17А взаимодействуют секукинумаб и иксекизумаб, а с рецептором IL-17 — бродалумаб.
Моноклональные антитела к субъединицам IL-12 и/или IL-23 тоже эффективно подавляют деятельность Тh17 и Тh1. В эту группу препаратов входят широко известный устекинумаб и относительно недавно одобренная к применению в США и Евросоюзе молекула гуселькумаб [28].
Поскольку ингибиторов интерлейкинов появляется всё больше, приходится регулярно сравнивать их эффективность. Так, одно из исследований 2018 года выстроило препараты по мере снижения эффективности в таком порядке: иксекизумаб и бродалумаб → секукинумаб → устекинумаб [29]. Однако препараты могут проявлять разную эффективность при разных исходных данных, таких как возраст, форма и тяжесть псориаза, сопутствующие болезни и др. А эти исследования им только предстоит пройти.
Моноклональные антитела к интерлейкинам произвели революцию в лечении псориаза, но, к сожалению, эти лекарства отличает очень высокая цена. Поэтому, несмотря на высокую эффективность в клинических исследованиях, они пока остаются малодоступными для широкого круга больных. Нежелательные реакции при применении этой группы препаратов и ингибиторов TNF схожи [27], [30].
Исследователи не ограничились существующим набором молекул и продолжают поиск более эффективных и при этом не менее безопасных. Или не менее эффективных, но более безопасных и/или экономически выгодных. Недавно завершилась фаза 2b клинических исследований новой гуманизированной молекулы — бимекизумаба [31]. Она блокирует сразу две разновидности интерлейкина-17 — IL-17A и IL-17F. Если сравнивать с традиционной блокировкой IL-17A, такая двойная нейтрализация сильнее подавляет экспрессию провоспалительных генов и миграцию иммунных клеток. К 2020 году должна завершиться III фаза клинических исследований бимекизумаба, с бóльшим числом участников, продленным сроком лечения и секукинумабом в качестве контрольного препарата.
Ингибиторы фосфодиэстеразы-4
Фосфодиэстераза-4 (PDE4) — это основная фосфодиэстераза, регулирующая обмен циклического аденозинмонофосфата (цАМФ) в иммунных клетках. Высокая концентрация цАМФ в клетках приводит к депонированию кальция, направлению активности ферментов и цитокиновой сигнализации в сторону подавления воспаления: выработка TNF, IL-23, IL-17 снижается, а IL-10 — повышается. PDE4 разрушает цАМФ, чем стимулирует воспаление, а потому служит одной из терапевтических мишеней при псориазе.
Показано, что апремиласт ингибирует PDE4, что в конечном счете ведет к ослаблению воспалительной реакции. Преимуществом апремиласта считают то, что он подавляет воспаление на более раннем этапе, чем моноклональные антитела к TNF (инфликсимаб, адалимумаб), IL-12/23 (устекинумаб) или IL-17A (секукинумаб, иксекизумаб) [32].
Из нежелательных реакций при приеме апремиласта чаще всего фиксируют расстройства пищеварения и инфекции дыхательных путей [33]. Эффективность апремиласта оценивают лишь к концу первого полугодия лечения, что в сочетании с его высокой стоимостью и доступностью более дешевых противопсориатических препаратов говорит не в пользу его назначения.
Сводная схема таргетированных терапевтических воздействий на основные звенья патогенеза псориаза приведена на рисунке 5. Если говорить о сравнительной эффективности ингибиторов TNF, интерлейкинов и PDE4, то крупное исследование 2018 года показало, что с помощью ингибиторов интерлейкинов или инфликсимаба можно избавиться от псориатических бляшек быстрее, чем с помощью этанерцепта, адалимумаба или апремиласта. Инфликсимаб проигрывает ингибиторам интерлейкинов по двум параметрам: его нужно вводить внутривенно, и на фоне его применения чаще развиваются инфекционные заболевания [29].
Рисунок 5. Патогенетическая терапия псориаза. Объяснения даны в тексте.
сайт keyopinions.info, рисунок с изменениями
Фототерапия
В борьбе с псориазом часто задействуют и физические факторы, а именно — ультрафиолетовое (УФ) излучение. Облучение пораженных участков кожи УФ определенной длины волны (UVА, UVB) называют фототерапией. UVB-терапия может быть широкополосной (280–320 нм) и узкополосной средневолновой (NB-UVB, 311 нм). Второму варианту практически идентична UVB-терапия, проводимая эксимерным лазером (308 нм). Эта группа методов не требует применения каких-либо специальных медикаментов и не противопоказана даже детям.
UVА-терапию чаще используют в виде модификации PUVA — облучения длинноволновым УФ (320–400 нм) с применением фотосенсибилизаторов из группы псораленов. Фотосенсибилизаторы — это вещества, повышающие чувствительность клеток к воздействию УФ. Они могут применяться перорально или наружно, в том числе в виде псораленовых ванн. Из-за повышенной (относительно UVB-терапии) канцерогенности к PUVA прибегают при тяжелых формах псориаза, его прогрессии и в случае неэффективности других средств.
Фототерапия может действовать на течение псориаза несколькими способами, которые обычно делят на четыре категории: индукция апоптоза, изменение цитокиновой сигнализации, иммуносупрессия, прочие механизмы (см. врезку) [34]. Однако эти эффекты во многом взаимосвязаны и взаимообусловлены.
Возможные терапевтические механизмы УФ-облучения при псориазе
Индукция апоптоза
Апоптоз — запрограммированная и строго контролируемая гибель клеток, которую могут индуцировать разные внутренние и внешние стимулы (гипоксия, инфекция, жара, гамма- и УФ-лучи, активация онкогенов). В отличие от некроза, апоптоз обычно не провоцирует воспаление: его конечные продукты с помощью поверхностных маркеров «съешь меня» привлекают фагоциты, и те быстро очищают территорию от останков самоубийц. Видимо, это ключевой механизм УФ-контроля избыточного размножения кератиноцитов в псориатических бляшках.
Каким же образом УФ запускает апоптоз клеток кожи? Лучи типа А преимущественно индуцируют образование мощных окислителей — активных форм кислорода (АФК) и азота, которые окисляют белки, липиды мембран и ДНК, заставляют антиоксиданты трудиться на износ, изменяют воспалительную сигнализацию и структуру внеклеточного матрикса, влияют на выживание и деление клеток. Если говорить о повреждениях ДНК, то чаще всего АФК окисляют гуанин, и продукт реакции — 8-OH-dG — служит отличной платформой для мутаций.
Лучи типа В меньше провоцируют образование АФК, зато напрямую повреждают ДНК, изменяют цитокиновую сигнализацию и синтез адгезивных молекул. Они чаще всего сшивают тимины двух соседних нуклеотидов или разрезают нити ДНК, склеивают их с разными белками, перекрещивают и т.п., то есть тоже запускают череду мутагенных событий.
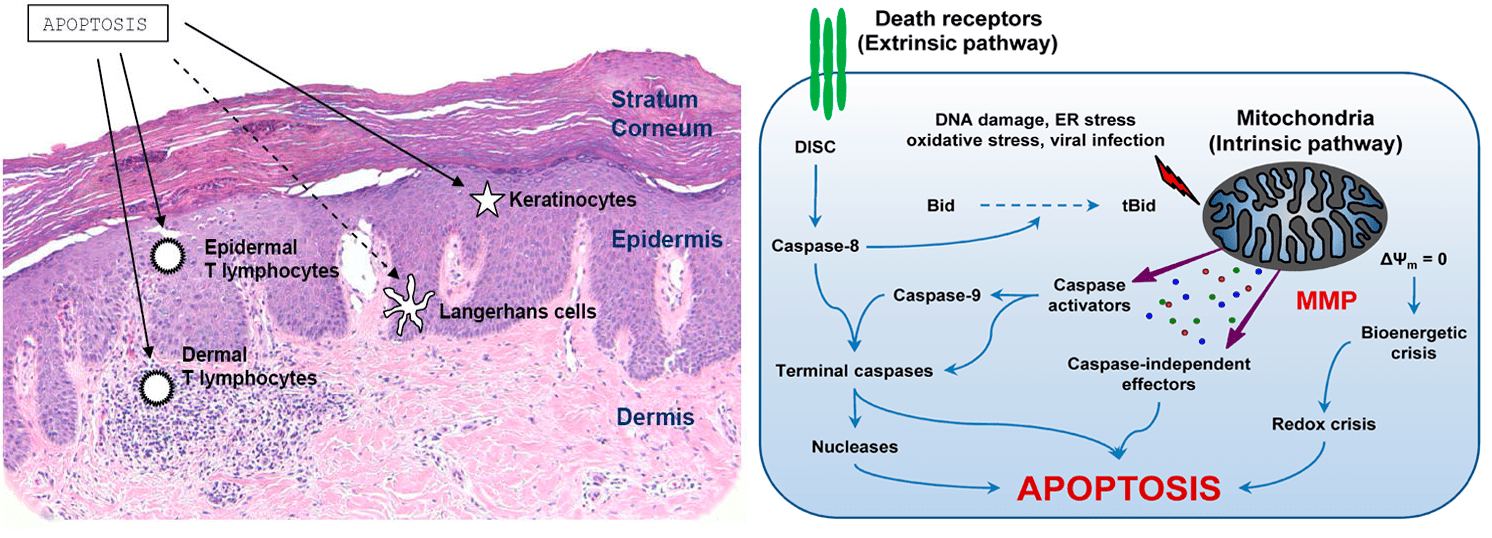
На повреждения ДНК клетка реагирует активацией опухолевого супрессора р53, который арестовывает клеточный цикл в контрольной точке G1/S (рис. 3) до выяснения обстоятельств, то есть не разрешает неблагонадежной, потенциально раковой клетке делиться и активирует ремонтные бригады — репарационные системы. Если они проблему не решают, р53 в зависимости от условий обрекает свою клетку на «пожизненное заключение» (сенесценцию, неспособность к делению) или выносит ей смертный приговор, запуская апоптоз. Вся эта система работает до тех пор, пока высокие дозы облучения не повредят ген самогó р53. Однако случается и р53-независимый апоптоз. Описаны два пересекающихся пути проапоптотической сигнализации — внутренний и внешний (рис. 6), — причем р53 может активировать оба [35].
Рисунок 6. УФ-индуцированный апоптоз. Слева — Восприимчивые клетки кожи. Клетки Лангерганса гибнут в меньшей степени, чем кератиноциты и Т-лимфоциты. Справа — Пути апоптоза. Внешний (extrinsic) путь обусловлен кластерным накоплением и активацией рецепторов смерти, расположенных на поверхности клеток. Так называют белки из суперсемейства TNF-рецепторов, содержащие «домен смерти»; благодаря им клетка узнает, о чём болтают вокруг и не пора ли ей. Активация рецепторов запускает каспазный каскад, ответственный за характерный для апоптоза фенотип. Транскрипцию генов рецепторов смерти может активировать р53. Внутренний (intrinsic) путь обусловлен действием факторов, вызывающих «протечку» мембран митохондрий (MMP), основных «энергетических станций» клетки. Среди них — Bid и другие белки, синтез которых индуцирует р53. Каспазо-зависимая активация Bid — первый перекресток двух апоптозных магистралей. Обнуление мембранного потенциала (Δψ) митохондрий ведет к биоэнергетическому и окислительному кризисам. Вышедшие из митохондрий белки индуцируют апоптоз разными путями. Окисление цитохрома С, например, активирует каспазы (второй перекресток).
Исследования показали, что индукция апоптоза при фототерапии происходит по-разному в разных типах клеток. Например, UVB вызывает выраженный апоптоз Т-лимфоцитов в эпидермисе и минимальный — в дерме, и применяется при распространенном псориазе. NB-UVB-терапия ведет к гибели Т-лимфоцитов как в эпидермисе, так и в дерме, и используется в отношении отдельных бляшек. PUVA и NB-UVB вызывают гибель кератиноцитов с выраженной стимуляцией синтеза белка p53 [36].
С одной стороны, облучение УФ вызывает гибель клеток кожи, а с другой — запускает синтез такого иммуномодулятора, как витамин D. Он контролирует гомеостаз кальция и способствует репарации ДНК. Тем не менее в случае облучения до «неремонтопригодности» этот же витамин способствует апоптозу [37].
Изменение цитокинового профиля
В ответ на фототерапию цитокиновый и Т-клеточный профили меняются в сторону преобладания Th2-звена. Например, облучение кератиноцитов UVB повышает уровень IL-10, ключевого стимулятора Th2-сигнализации. В итоге растет количество Th2-цитокина IL-4, который подавляет дифференцировку лимфоцитов Th1/Th17-звена и синтез их цитокинов (IL-12, IL-22, TNF, IFN-γ). Подобную картину наблюдали и при NB-UVB-, и при PUVA-терапии. Более того, в некоторых исследованиях отмечали не только местное (в коже), но и системное (в крови) подавление Th1/Th17-звена фототерапией [34].
Иммуносупрессия
УФ-индуцированная иммуносупрессия — типичный эффект фототерапии. Посредником в этом процессе мог бы выступать витамин D: как мы уже выяснили, он способствует подавлению разбушевавшегося аутоиммунитета. Однако нет подтверждения тому, что фототерапия изменяет количество этого витамина настолько, чтобы он проявил терапевтическое действие. Очевидно, УФ запускает иные механизмы иммуносупрессии.
Улавливание UVB-фотонов кожной транс-урокановой кислотой ведет к ее превращению в цис-урокановую. Эта изомеризация может запускать каскад реакций, ведущих к иммуносупрессии, частично обусловленной истощением пула эпидермальных клеток Лангерганса. В зависимости от дозы УФ эти антигенпредставляющие клетки либо устремляются из кожи в лимфоузлы, либо подвергаются апоптозу. Поскольку они не в полной мере исполняют свои педагогические обязанности, лимфоциты Th1 теряют способность реагировать на некоторые антигены, снижается контактная гиперчувствительность [38].
Так или иначе, фототерапия может устранять дисбаланс провоспалительных и регуляторных цитокинов, характерный для воспалительных заболеваний кожи, и индуцировать иммунотолерантность [39]. Кроме того, в экспериментах с животными моделями было замечено, что под влиянием фототерапии (UVB и PUVA) в коже ослабляется дегрануляции тучных клеток, а значит, и связанная с выбросом гистамина симптоматика.
Другие механизмы
Под другими механизмами подразумевают:
Выбор лечебного подхода
Любой лечебный подход преследует три главных цели: уменьшение баллов PASI (индекса охвата и тяжести псориаза), повышение качества жизни и максимальная продолжительность ремиссии. Достичь этих целей можно только под руководством грамотного врача, который обязан учитывать многообразие эффектов лечебного агента, особенности его метаболизма [3] и возможное взаимодействие с другими лекарственными средствами.
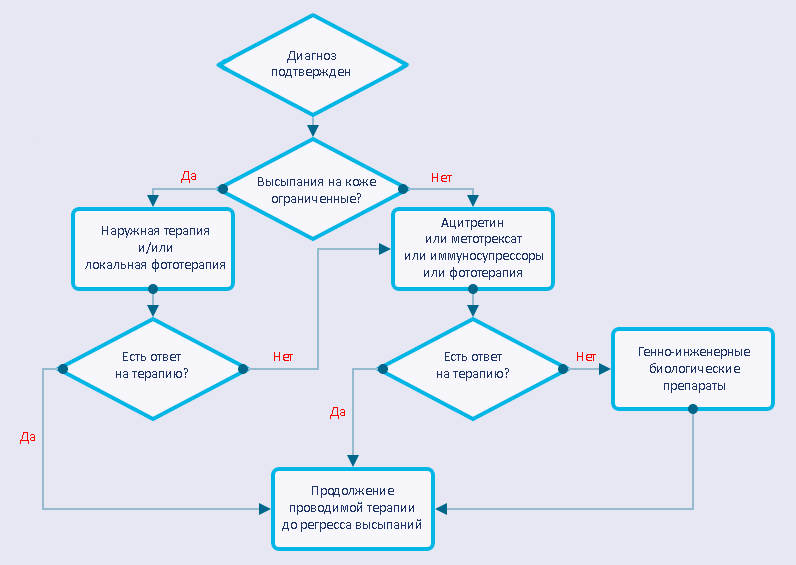
В лечении псориаза, как и большинства заболеваний, всё очень и очень индивидуально. То, что работает у одного, другому может абсолютно не подойти. Тем не менее врачи разработали общую стратегию ведения пациентов с псориазом (рис. 7).
Рисунок 7. Стандартный алгоритм ведения пациента с подтвержденным диагнозом «псориаз»
Выбор того или иного лечебного подхода определяется степенью тяжести псориаза. А объективным критерием тяжести псориаза, принятым в большинстве стран мира, служит PASI. При значении индекса до 10 псориаз считается легким, от 10 до 20 — средней тяжести, более 20 — тяжелым. У большинства пациентов PASI не превышает 10, и в таких случаях ограничиваются наружным лечением. Превышение 10 баллов служит показанием для назначения метотрексата, циклоспорина и ацитретина [40]. В некоторых случаях целесообразно комбинировать метотрексат или ацитретин с фототерапией (UVВ, PUVA), что позволяет одновременно снизить дозировку препаратов, частоту побочных эффектов и канцерогенный потенциал фототерапии [41], [42]. В случае неэффективности, непереносимости побочных эффектов или при противопоказаниях к применению перечисленных подходов прибегают к биологическим препаратам (моноклональным антителам).
Вносить свою лепту в тяжесть болезни и длительность ремиссии могут и вспомогательные, немедикаментозные подходы. Обычно врачи рекомендуют снижение уровня стресса, соблюдение диеты, климатотерапию (курорты с сероводородными, кремнистыми и радоновыми водами) и применение увлажняющих средств.
Заключение
Даже если просто просмотреть заголовки в этой статье, станет ясно: разнообразие видов терапии псориаза настолько велико, что позволяет более-менее индивидуализировать лечение. Но ни один из существующих подходов не лишен недостатков, порой весьма серьезных.
Псориаз — одна из самых распространенных кожных болезней, которая до сих пор окружена множеством загадок и сильно влияет на жизнь больных. Поэтому пациенты с этим диагнозом больше, чем многие другие страдающие хроническими воспалительными заболеваниями, могут рассчитывать на изобретение той самой «волшебной таблетки» (а скорее, нескольких), которая наконец заставит забыть о недуге навсегда. В последние годы новая информация о патогенезе, генетике и эпигенетике псориаза появляется особенно быстро. Это позволяет постепенно переходить от неизбирательной «тяжелой артиллерии» к специфичным средствам, бьющим по конкретным звеньям патогенеза. Каждый год в мире синтезируются новые молекулы, но лишь единицы из них, пройдя длинный путь проверок безопасности и эффективности, достигают организма больного. При этом каждый новый одобренный препарат хоть в чём-то превосходит старые, приближая нас к моменту, когда псориаз станет очередной побежденной болезнью в истории медицины.