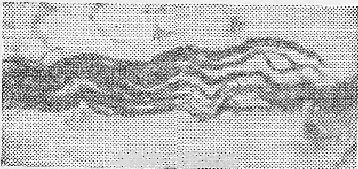Импрегнация солями серебра что окрашивает
ИМПРЕГНАЦИЯ
Полезное
Смотреть что такое «ИМПРЕГНАЦИЯ» в других словарях:
ИМПРЕГНАЦИЯ — ИМПРЕГНАЦИЯ, ИМПРЕГНИРОВАНИЕ [ Словарь иностранных слов русского языка
импрегнация — проникновение, пропитка, импрегирование, импрегнирование Словарь русских синонимов. импрегнация сущ., кол во синонимов: 4 • импрегирование (2) • … Словарь синонимов
ИМПРЕГНАЦИЯ — [impregnatio пропитывание] проникновение вещества в жидком или газообразном состоянии в первичную п. или м л. Геологический словарь: в 2 х томах. М.: Недра. Под редакцией К. Н. Паффенгольца и др.. 1978 … Геологическая энциклопедия
импрегнация — (франц. impregnation, от лат. impraegno, impraegnatum наполнять) в гистологии метод выявления некоторых тканевых структур путем пропитывания объектов гистологического исследования растворами солей металлов; участки ткани, в которых происходит… … Большой медицинский словарь
Импрегнация — (от позднелат. impraegnatio наполнение) пропитывание фиксированной животной ткани некоторыми солями или окислами металлов (например, азотнокислыми солями серебра, кобальта, хлористой солью золота, кадмия, осмиевым ангидридом и др.). Один… … Большая советская энциклопедия
импрегнация — импрегнация, импрегнации, импрегнации, импрегнаций, импрегнации, импрегнациям, импрегнацию, импрегнации, импрегнацией, импрегнациею, импрегнациями, импрегнации, импрегнациях (Источник: «Полная акцентуированная парадигма по А. А. Зализняку») … Формы слов
Импрегнация — ж., геол. Проникновение вещества в жидком или газообразном состоянии в первичную породу, дающее вкрапленность сульфитов и других минералов. Лежачим боком является сильно оруденелый роговик, но оруднелость эта должна быть отнесена к так называемым … Словарь золотого промысла Российской Империи
импрегнация — импрегн ация, и … Русский орфографический словарь
импрегнация золотом — см. Метод золочения … Большой медицинский словарь
импрегнация серебром — см. Метод серебрения … Большой медицинский словарь
О значении импрегнации серебром нервных волокон кожи для диагностики прижизненности повреждений
Кафедра судебной медицины (зав. — доцент И.В. Скопин) Саратовского государственного медицинского института
Поступила в редакцию 9/V 1958 г.
библиографическое описание:
О значении импрегнации серебром нервных волокон кожи для диагностики прижизненности повреждений / Козлов В.В. // Судебно-медицинская экспертиза. — М., 1960. — №1. — С. 18-21.
код для вставки на форум:
За последние годы в судебномедицинской литературе появились высказывания о возможности использования импрегнации серебром нервных волокон кожи с целью дифференциальной диагностики между прижизненными и посмертными повреждениями. Импрегнируя серебром нервные волокна кожи, Б.И. Зорин (1954), М.А. Файн (1955-1956), В.Г. Науменко (1955), И.А. Концевич (1958), Л. Л. Сотникова и Л. А. Семененко (1958) находили в области прижизненных повреждений изменения, качественно отличные от посмертных. По мнению этих авторов, варикозность, вакуолизация, фрагментация и распад нервных волокон являются результатом прижизненных повреждений и: не встречаются в области пореждений посмертного характера.
Задача настоящей работы сводилась к тому, чтобы, применяя импрегнацию серебром, выяснить принципиальную возможность использования полученных указанными авторами данных в практических судебномедицинских целях.
Исследованию подвергались ссадины, странгуляционные борозды, электрометки, отморожения первой степени (ознобления) и ожоги.
Прижизненные повреждения, причиненные в ближайшие сроки до наступления смерти или в агональном периоде, изучались на текущем секционном материале, посмертные — на экспериментальных животных (поросята).
Животных убивали путем обескровливания; повреждения наносили спустя 5—15 минут после наступления клинической смерти.
Кусочки кожи с повреждениями фиксировали в 12% нейтральном формалине и резали на замораживающем микротоме; срезы импрегнировали серебром по методу Бильшовского-Грос в модификации Лаврентьева. Всего было изучено 320 препаратов (плоскостных и отвесных срезов) от 47 повреждений (30 прижизненных и 17 посмертных).
При исследовании прижизненных повреждений наиболее резкие изменения нервных волокон кожи были выявлены в области электрометок.
В прижизненных электрометках многие нервные стволики имели вид сплошных грубых тяжей, диффузно импрегнированных серебром. Осевые цилиндры и ядра шванновской оболочки, как правило, были неразличимы или выявлялись лишь на концах пучка. В более мелких пучках мякотные волокна оказывались резко аргентофильными; наряду с этим часто отмечалась неравномерная импрегнация оболочки. Контуры мякотных волокон были неровными, как правило, отмечалась варикозность осевого цилиндра в виде часто расположенных округлых четкообразных вздутий или неравномерно чередующихся овальных и лентовидных утолщений. Мякотная оболочка волокон содержала большое количество вакуолей, иногда же — на отдельных участках — почти сплошь состояла из них. Очень часто наблюдалось резкое истончение осевого цилиндра, местами с исчезновением оболочки, в этом участке отмечалась фрагментация и распад волокон в пучке. По ходу безмякотных волокон иногда встречались четкообразные утолщения тонких волоконец и изредка их распад (рис. 1).
Рис. 1. Четкообразная варикозность, чередующаяся с резким истончением осевого цилиндра, фрагментация и распад нервных волокон в области прижизненной электрометки.
Не менее резко выраженные изменения нервных волокон кожи наблюдались в области прижизненных ожогов. Не отличаясь от описанных выше в качественном отношении, эти изменения характеризовались преобладанием неравномерной импрегнации оболочек мякотных нервных волокон — в виде чередования слабо окрашенных участков с отложением глыбок серебра, а также наличием варикозности, вакуолизации, фрагментации и распада нервов в пучках. Очень часто отмечалась резкая аргентофилия и грубая импрегнация отдельных волокон и целых пучков.
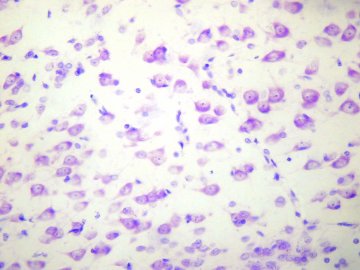
В области прижизненных ссадин изменения нервных волокон кожи по сравнению с предыдущими повреждениями оказались значительно менее выраженными как в качественном, так и в количественном отношении. В большинстве препаратов наблюдались неравномерные утолщения волокон, изредка — истончение осевого цилиндра, грубая импрегнация, аргентофилия и неравномерная окрашнваемостъ оболочек мякотных волокон. Значительно реже наблюдалось образование вакуолей, очень редко явления распада и фрагментации волокон (рис. 2).
Такого же характера, но еще более слабо выраженными, были изменения нервных волокон кожи в области прижизненных странгуляционных борозд, и в ссадинах, и в странгуляционных бороздах большое количество неизмененных нервных волокон и целых пучков.
В области участков ознобления изменения нервных волокон были наиболее слабо выраженными и сводились в основной к неравномерной их импрегнации, утолщению осевых цилиндров и изредка к распаду отдельных волокон в пучке. В препаратах превалировали совершенно не измененные нервные волокна.
При исследовании посмертных повреждений в большинстве случаев удалось обнаружить почти все те качественные изменения нервных волокон кожи, которые наблюдались нами в случаях прижизненной травмы. При этом особенно выраженными оказались изменения нервных волокон кожи в области электрометок. Однако степень выраженности и главным образом частота этих изменений оказались отличными от прижизненных.
В области повреждений посмертного характера наблюдалось наибольшее количество морфологически не измененных нервных волокон, в’ то время ка» в области прижизненных повреждений изменения являлись постоянными, ярко выраженными и распространялись на большую массу нервных волокон. Однако следует отметить, что почти в каждом препарате из области прижизненного повреждения встречалось довольно большое количество внешне не измененных волокон и даже целых пучков.
Рис. 2. Неравномерные утолщения по ходу осевого цилиндра, вакуолизация и аргентофилия волокон в области прижизненной ссадины.
Иногда неизмененные волокна настолько превалировали, что было, крайне затруднительно сделать какие-либо выводы. Следует подчеркнуть, что речь идет о повреждениях, причиненных в ближайшее время (первые минуты) до или после наступления смерти. Увеличение сроков, прошедших между травмой и смертью, влечет за собой значительно большую количественную разницу в изменениях нервных волокон, а при длительных сроках эта разница очень резко выражена.
Изучая в качестве контроля нервные волокна здоровой кожи, мы обратили внимание на то, что волокна имели вид интактных только в случаях взятия свежего материала, когда с момента наступления смерти до изъятия кусочков кожи проходило от нескольких минут (в эксперименте на животном) до нескольких часов.
В случаях взятия материала через 12, 24, 48 часов и более после наступления смерти некоторые нервные волокна заведомо неповрежденной кожи претерпевали почти те же изменения, которые наблюдались в области описанных выше различных повреждений прижизненного характера.
Приведенные наблюдения свидетельствуют о ряде посмертных превращений в периферических нервах кожи, морфологически имитирующих прижизненные дистрофические и некробиотические процессы. Эти превращения, на наш взгляд, требуют детального изучения в разрезе дифференциальной диагностики прижизненных и посмертных изменений нервных волокон.
похожие статьи
Редкий случай травмы шеи при извлечении тела из воды / Виндгассен М., Ресслер Л., Тсокос М., Эстерхельвег Л. // Судебная медицина. — 2019. — №4. — С. 32-33.
Морфологическая характеристика коры мозжечка при ожоговой травме / Морозов Ю.Е., Дорошева Ж.В., Горностаев Д.В., Колударова Е.М., Пиголкин Ю.И. // Судебно-медицинская экспертиза. — М., 2018. — №4. — С. 24-27.
Установление прижизненности механической травмы по биохимическим показателям / Асташкина О.Г., Столярова Е.П., Полтарев С.В., Терешина Н.А. // Медицинская экспертиза и право. — 2010. — №3. — С. 43-45.
Медицинские интернет-конференции
Языки
Импрегнация твердых тканей зуба препаратами серебра
ФГБОУ ВО «Саратовский ГМУ им. В.И.Разумовского» Минздрава России Кафедра стоматологии детского возраста и ортодонтии
Резюме
В данной статье изложена методика серебрения молочных зубов, положительные и отрицательные стороны данной методики, препараты используемые для серебрения.
In this paper, the technique of silvering milk teeth, the positive and negative aspects of this method, the drugs used for silvering.
В данной статье изложена методика серебрения молочных зубов, положительные и отрицательные стороны данной методики, препараты используемые для серебрения.
In this paper, the technique of silvering milk teeth, the positive and negative aspects of this method, the drugs used for silvering.
Ключевые слова
Введение
Методика серебрения очага поражения препаратами, содержащими соединения серебра, до настоящего времени остается методом выбора при лечении начальных форм кариеса временных зубов у детей. Данный метод является актуальным в отношении детей, не готовых к полноценному лечению кариеса, так как ионы серебра обладают антисептическими свойствами, что позволяет уничтожить патогенные микроорганизмы и приостановить процесс развития кариеса в молочных зубах.
изучить методику серебрения зубов у детей.
Материал и методы
Проанализированы различные статьи, периодические издания, а также учебные пособия по стоматологии.
Результаты
Мы изучили ряд научных статей на тему методики серебрения зубов.
Обсуждение
“Аргенат” аналогичен препарату “Saforide” [3,10]. Однокомпонентный стоматологический материал “Аргенат” выпускается в виде бесцветной прозрачной жидкости, содержащей комплексную соль фторид диамминсеребра. “Аргенат” однокомпонентный: применяется при начальных формах кариеса молочных зубов; снижении чувствительности зубов; для серебрения корневых каналов зубов. Препарат не раздражает пульпу зуба, так как на поверхности дентина образуется фторид кальция, суживающий дентинные канальца, затрудняя проникновение ионов серебра; сохранение на длительное время бактерицидного действия [3].
Методика серебрения. Чтобы уменьшить очаг кариозного поражения и площадь окрашивания поврежденного зуба препаратами серебра следует провести реминерализующую терапию. Для этого необходимо наносить на очищенные от зубных отложений поверхности зубов препараты, содержащие кальций, фосфор и фтор (Tooth Mouse, R.O.C.S Medical Minerals, Tiefenfluorid, Amazing White Minerals) [7,8,9]. После проведения реминерализации твердых тканей зуба можно приступить к самой методике серебрения:
Обработанные зубы постепенно начинают темнеть. Темнеют только те участки зуба, где эмаль уже была поражена кариозным процессом, даже если визуально эти участки с начальным кариесом не были видны. Цвет здоровой эмали не изменяется [1,2].
Положительные стороны серебрения зубов:
Заключение
1) Серебро обладает бактерицидными, бактериостатическими, иммуномодулирующими, противовирусными свойствами.
2) Препараты, содержащие ионы серебра, взаимодействуют с кристаллами гидроксиапатита и образуют химическую реакцию, в результате которой продукты образования внедряются в протеины структуры зуба.
3) Методика серебрения проводится с предварительной реминерализующей терапией. На очищенные поверхности зуба наносится препарат на основе серебра. Процедуру проводит врач-стоматолог в стоматологическом кабинете.
4) Положительные стороны серебрения молочных зубов: безболезненность, дешевизна, минимальная затрата времени, сохранение молочных зубов до смены их постоянными. Минусы данной методики: паллиативность, нарушение эстетики молочных зубов, возможность развития осложнений в виде пульпитов.
Литература
1) Арутюнов С.Д., Свердлова М.Г., Кузьмичевская М.В. Новые возможности профилактики и лечения начальных форм кариеса у детей младшего возраста // Стоматология сегодня. 2007. №11. С. 9-12.
2) Сапронова О.Н. Применение серебра в стоматологии: Ученые записки СПбГМУ им. Акад. И.П.Павлова. 2010. Том XVII, № 4. С. 5-7.
3) Колесова О.В., Косюга С.Ю., Балабина Т.С., Володяшкина М.А., Веселов Д.В. Применение препарата “Аргенат” для лечения кариеса временных зубов у детей в возрасте двух-шести лет // Саратовский научно-медицинский журнал. 2011. Т.7(N1). С. 301-303.
4) Бутвиловский А.В. Изучение изменения химического состава твердых тканей пораженных кариесом временных зубов // Оригинальные научные публикации. 2015. № 7. С. 55-57.
5) Бутвиловский А.В., Бурак Ж.М., Петрович Н.И., Кармалькова И.С. Сравнительный анализ химического состава твердых тканей пораженного кариесом временных зубов после обработки фторидом диамминсеребра // Оригинальные научные публикации. Новые технологии в медицине. 2013. С. 89-92.
6) Трезубов В.Н., Семенов С.С., Афиногенов Г.Е., Афиногенова А.Г., Сапронова О.Н. Создание антибактериального материала, содержащего наносеребро, для базисов съемных зубных протезов // Стоматология. №2 (47). 2010. С. 22-23.
7) Детская терапевтическая стоматология / Национальное руководство под редакцией акад. РАН В.К. Леонтьева, проф. Л.П. Кисельниковой. М.: ГЭОТАР-Медиа. 2017. 952 с.
10) Суетенков Д.Е., Усачев В.В. Сравнительная эффективность препаратов на основе диамина фтористого серебра Saforide и «Аргенат» // Стоматология детского возраста и профилактика. 2005. Т. 4. № 3-4. С. 58-61.
Окрашивание нервной ткани
 |  | |
 | Микроскопическая техника Гистологическая техника Гематоксилин Обзорные окрашивания Методы окраски тканей Окрашивание нервной ткани Окрашивание костной ткани Кровь: методы окраски Окрашивание азаном по методу Гейденгайна Микротом для парафиновых срезов МПС-2 |  |
 |  |