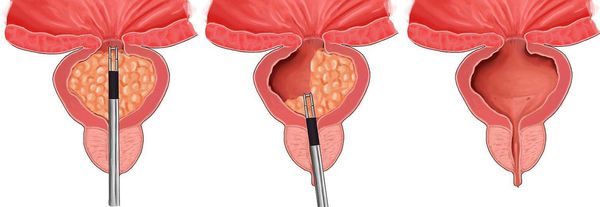
Инфаркт простаты что это
Что такое аденома простаты (ДГПЖ)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Скатова Бориса Васильевича, уролога со стажем в 27 лет.
Определение болезни. Причины заболевания
Физиология
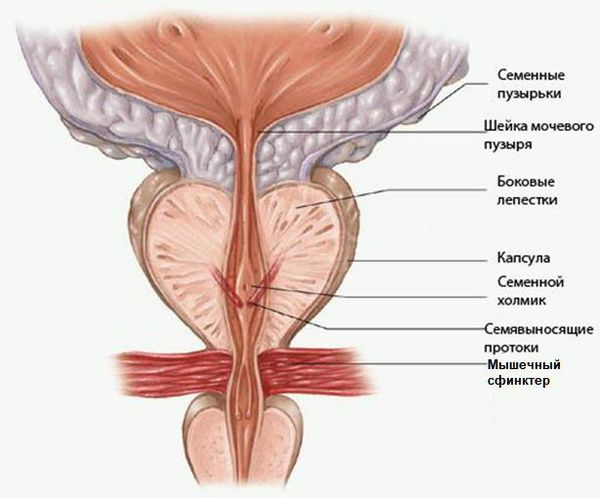
Предстательная железа — это железа, выделяющая комплексный секрет, который состоит из кислой фосфатазы, лимонной кислоты, фибринолизина, простатспецифического антигена и различных белков. Этот секрет выделяется в уретру во время эякуляции и улучшает подвижность сперматозоидов. После полового акта он изменяет pH во влагалище женщины для поддержания жизнеспособности сперматозоидов.
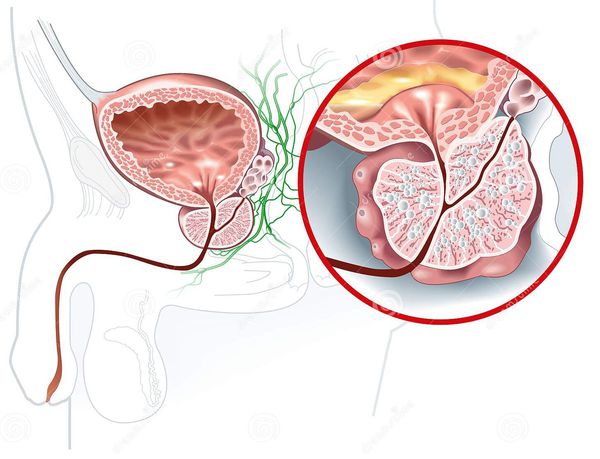
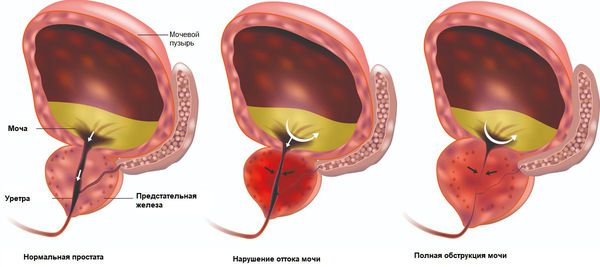
Простата — это единственный внутренний орган человека, продолжающий расти в течение всей жизни человека. Снаружи она покрыта тонкой васкуляризованной капсулой. При увеличении предстательной железы капсула, окружающая её, начинает давить на уретру.
В основе развития ДГПЖ лежат два основных механизма:
В развитии узловой гиперплазии предстательной железы могут принимать участие все клеточные элементы простаты.
Эпидемиология
Факторы риска
Отличия от рака. Бывает ли злокачественная аденома простаты
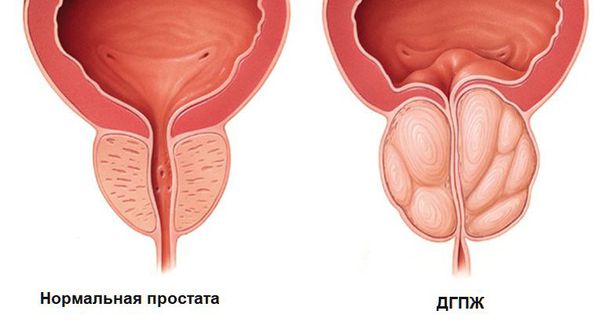
Аденома предстательной железы — это доброкачественное увеличение простаты. В отличии от рака предстательной железы, она не содержит раковых клеток и не прорастает в прямую кишку и просвет мочевого пузыря. Мнения о том, что не вылеченная вовремя гиперплазия простаты ведёт к раку, не получили научного подтверждения.
Отличие от простатита
Простатит — это воспалительный процесс ткани предстательной железы, а в развитии гиперплазии предстательной железы ведущая роль принадлежит половым гормонам. Однако при отсутствии адекватного лечения простатит может развиться как осложнение ДГПЖ. Доброкачественная гиперплазия чаще выявляются у пожилых пациентов, простатит отличается тем, что ему подвержены мужчины всех возрастов, однако наиболее часто заболевание возникает у пациентов репродуктивного возраста.
Симптомы аденомы предстательной железы
В то же время увеличение предстательной железы не всегда приводит к развитию клинических проявлений.
К расстройствам мочеиспускания у мужчин с ДГПЖ относят:
Все перечисленные симптомы аденомы простаты могут длительное время прогрессировать, сохраняться или уменьшаться.
Патогенез аденомы предстательной железы
На развитие доброкачественной гиперплазии предстательной железы влияет сочетание множества факторов:
В развитии гиперплазии предстательной железы ведущая роль принадлежит половым гормонам. У мужчин в возрасте 40 – 50 лет происходит глубокая перестройка организма: изменяется гормональная регуляция, снижается уровень тестостерона в крови, повышается концентрация эстрадиола. В результате этих процессов повышается общий уровень эстрогенов, что ведёт к активации фибробластов (клеток соединительной ткани), выработке фибропластического фактора роста и разрастанию соединительной ткани в предстательной железе.
Патогенез развития доброкачественной гиперплазии предстательной железы зависит от множества факторов и состоит из следующих этапов:
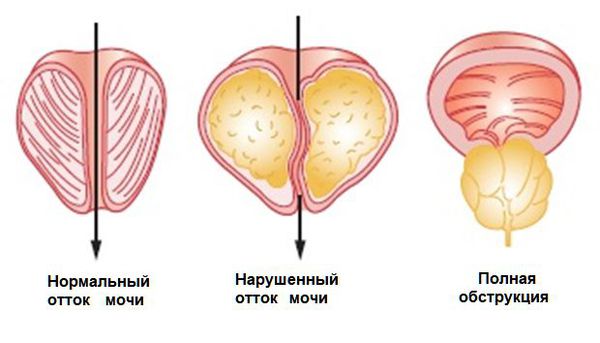
Помимо всего перечисленного, при заболевании ухудшается кровообращение в предстательной железе, нарастает воспаление и отёк — дополнительный механический фактор, который ухудшает мочеиспускание.
Рост узлов в просвет мочевого пузыря приводит к мучительным симптомам, даже при небольших размерах узлов.
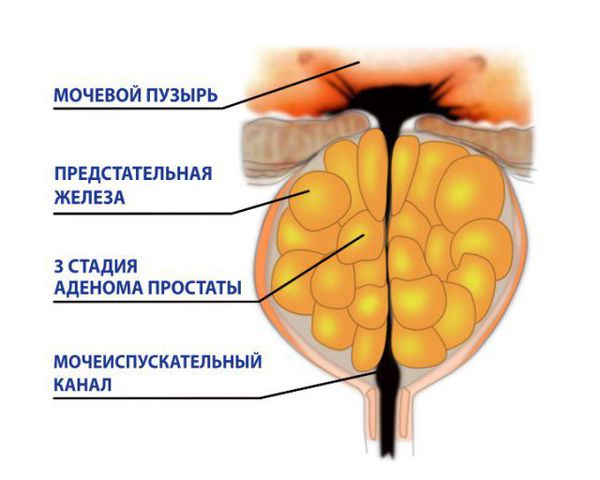
Классификация и стадии развития аденомы предстательной железы
В России иногда используется устаревшая классификация Гюйона, согласно которой выделяют три стадии:
Осложнения аденомы предстательной железы
Без адекватного лечения на последних стадиях ДГПЖ резко возрастает риск острой задержки мочи.
Чем опасна аденома простаты
Другие распространённые осложнения, ассоциированные с ДГПЖ:
Инфекционные осложнения на третьей стадии ДГПЖ:
Острая задержка мочеиспускания — наиболее грозное осложнение и неотложное состояние, при котором увеличенная предстательная железа полностью перекрывает просвет мочевыводящих путей.
Без своевременной цистостомии (отвода мочи путём установки трубки в мочевой пузырь через переднюю брюшную стенку) может развиться:
Диагностика аденомы предстательной железы
Обязательный диагностический минимум включает:
Сбор анамнеза
Анкета IPSS представлена в российских, европейских и американских клинических рекомендациях. Уточнению жалоб пациента помогает заполнение дневников мочеиспускания, оценивающих:
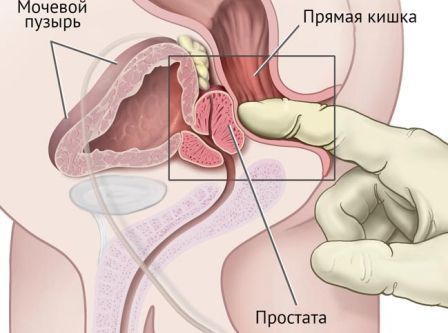
Физикальное обследование
Пальцевое ректальное исследование позволяет оценить размеры простаты и выявить очаги, подозрительные на рак предстательной железы.
Нормы ПСА при аденоме простаты
Оценка мочеиспускания
Урофлоурометрия и ТРУЗИ (трансректальное ультразвуковое исследование)
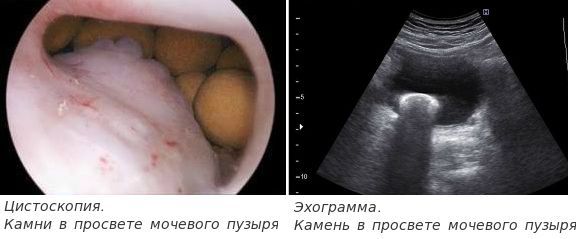
УЗИ органов мочевыводящей системы
Кроме исследования предстательной железы, обязательно выполняется УЗИ почек и мочевого пузыря. Ультразвуковое исследование позволяет выявить такие осложнения ДГПЖ, как камни мочевого пузыря и уретерогидронефроз, а также исключить опухоли паренхимы почек и мочевого пузыря.
Лечение аденомы предстательной железы
Лечение больных с ДГПЖ направлено на улучшение качества их жизни, предотвращение прогрессирования гиперплазии и развития осложнений.
Методы лечения врач подбирает индивидуально с учётом ряда факторов:
После анализа данных, полученных в ходе обследования, врач может выбрать тактику динамического наблюдения, назначить медикаментозную терапию или рекомендовать хирургическое лечение.
Неоперативные способы лечения аденомы простаты
Динамическое наблюдение — это периодические обследования пациента, его информирование и предоставление рекомендаций по образу жизни. К таким рекомендациям относятся:
Оптимальной терапией доброкачественной гиперплазии предстательной железы считается консервативное лечение, которое предотвращает или отодвигает на неопределённый срок оперативное вмешательство.
Медикаментозная терапия
При лечении ДГПЖ используется несколько видов лекарственных средств, однако базовую терапию составляют три группы препаратов:
Учитывая прогрессирующий характер заболевания, медикаментозную терапию ДГПЖ проводят длительно, иногда в течение всей жизни.
В настоящее время в клинической практике используются пять препаратов данной группы:
Самым часто принимаемым альфа-адреноблокатором в мире, в том числе и в России, является тамсулозин.
Отличия между перечисленными препаратами заключаются в их переносимости, которая обусловлена фармакологическим действием. Без рекомендации врача приём препаратов может привести к развитию побочных реакций, таких как: астения, головокружение и ортостатическая гипотензия (чрезмерное снижение артериального давления при принятии вертикального положения). Наличие сердечно-сосудистых заболеваний и приём вазоактивных препаратов повышают риски развития нежелательных состояний.
В настоящее время в клинической практике используются два препарата данной группы: дутастерид и финастерид. Наиболее частые нежелательные побочные явления, связанные с приёмом препаратов данной группы: снижение либидо, эректильная дисфункция, редко — гинекомастия и эякуляторные нарушения.
В отличие от альфа-1-адреноблокаторов, ингибиторы 5-альфа-редуктазы снижают риск прогрессирования ДГПЖ благодаря снижению риска острой задержки мочи и риска хирургического лечения.
Ингибиторы фосфодиэстеразы 5 типа (ФДЭ-5) показаны при умеренных и выраженных нарушениях мочеиспускания в сочетании или без эректильной дисфункции. Наиболее частные побочные явления: головные боли, боль в спине, головокружения, диспепсия (боль в верхнем отделе живота).
При множественных жалобах назначают комбинированную терапию — приём двух и более лекарственных препаратов.
Оперативное лечение
Показания к проведению оперативного лечения аденомы простаты:
До операции необходимо провести лечение мочевой инфекции.
Все операции, выполняемые при ДГПЖ, можно условно разделить на несколько видов:
Основным критерием для выбора между открытыми операциями и трансуретральными вмешательствами остаётся объём предстательной железы, возможности медицинского учреждения и квалификация хирурга.
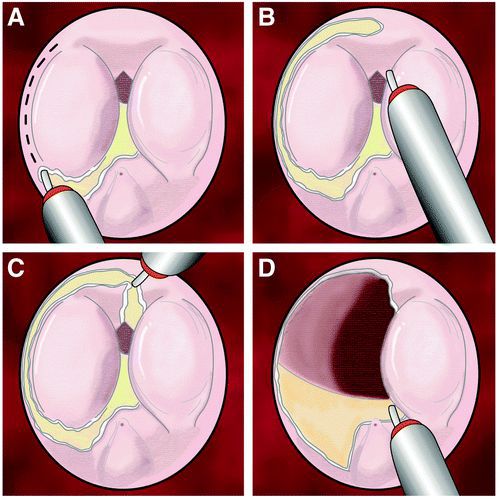
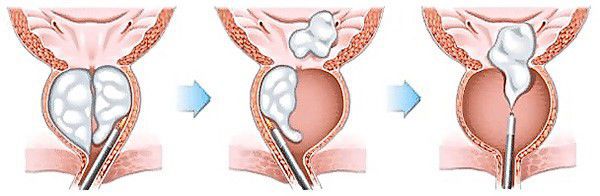
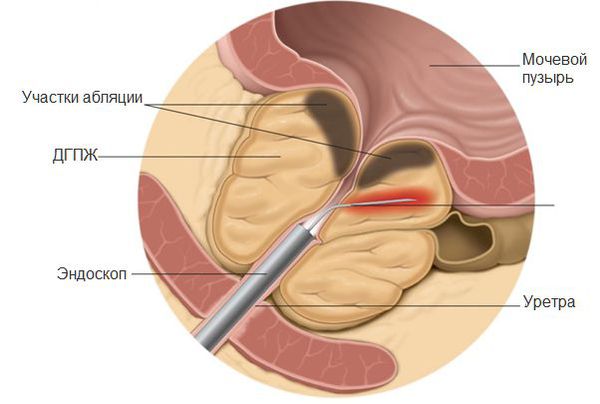
Трансуретральная резекция предстательной железы
В числе приемлемых или сопоставимых по эффективности модификаций биполярной ТУР являются биполярная трансуретральная электровапоризация, биполярная трансуретральная энуклеация, лазерные методы и некоторые комбинированные методики.
Последствия операции при аденоме простаты
Трансуретральная электровапоризация
Принцип действия данного метода основан на комбинации биполярной резекции и вапоризации в физиологическом растворе, а кардинальное отличие заключается в самой петле, которая даёт возможность одновременной резекции и вапоризации ткани предстательной железы.
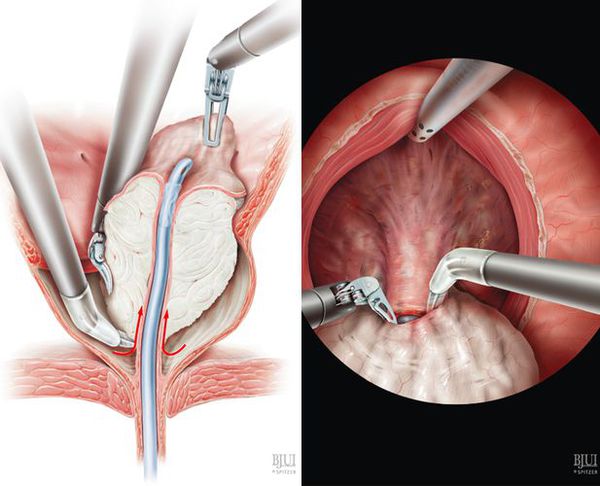
Лазерная энуклеация
В последнее время с развитием лазерных технологий врачи всё больше начинают отдавать предпочтение новым методикам хирургического лечения больных гиперплазией предстательной железы — трансуретральной энуклеации простаты с использованием гольмиевого или тулиевого лазера.
Преимущества гольмиевой энуклеации:
Лазерная вапоризация
Вапорезекция тулиевым лазером может быть альтернативой ТУР простаты при малых и средних размерах предстательной железы.
Интерстициальная лазерная коагуляция, криодеструкция, трансуретральная микроволновая термотерапия (ТУМВ), трансуретральная радиочастотная термодеструкция, баллонная дилатация, уретральные стенты для лечения аденомы предстательной железы не применяются, в клинических рекомендациях эти методы отсутствуют.
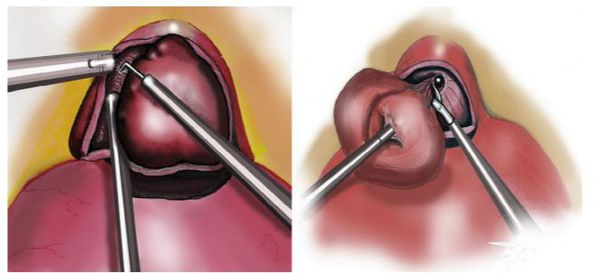
Открытая простатэктомия (аденомэктомия)
Варианты открытой аденомэктомии: промежностная аденомэктомия, чреспузырная аденомэктомия и позадилонная аденомэктомия. Открытая аденомэктомия различается в основном операционными доступами.
Чреспузырная аденомэктомия
Позадилонная аденомэктомия
Лапороскопия
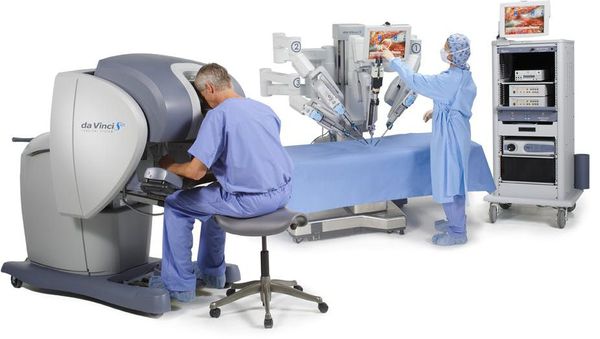
Роботическая хирургия
Трансуретральная инцизия аденомы простаты
Так как любая операция не лишена недостатков, то постоянно совершенствуется техника и продолжается поиск альтернативных вариантов оперативного лечения ДГПЖ. Выбор метода лечения должен осуществляться врачом индивидуально с учётом всех сопутствующих факторов (медицинских и социальных) и при активном участии самого пациента.
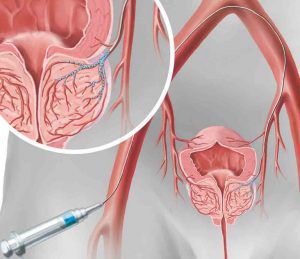
Эмболизация простатических артерий
Метод предполагает селективную окклюзию (нарушение проходимости) кровеносных сосудов с намеренным вводом эмболов в артерию простаты. Другими словами, преднамеренно блокируется кровеносный сосуд. Процедура проводится с использованием специальной ангиографической аппаратуры эндоваскулярным хирургом.
Борьба с обструкцией
Обструкция — это препятствие нормальному потоку мочи, при которой возникает задержка мочеиспускания.
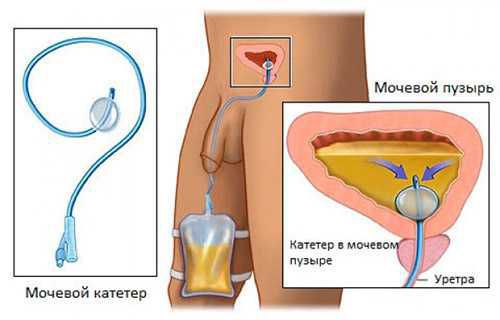
Кратковременная катетеризация проводится при острой задержке мочеиспускания в сочетании с назначением альфа-адреноблокаторов.
Длительная катетеризация — при острой и хронической задержке мочеиспускания на фоне тяжёлых острых заболеваний, когда выполнение цистостомии невозможно.
Периодическая катетеризация — при нейрогенных нарушениях функции опорожнения мочевого пузыря.
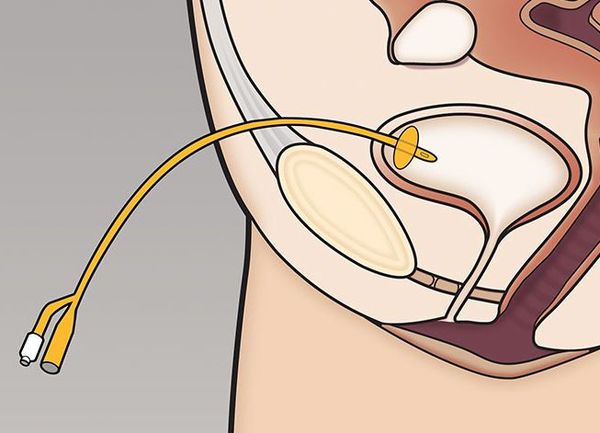
Эпицистостомия (надлобковая катетеризация мочевого пузыря) — при невозможности катетеризации мочевого пузыря уретральным катетером, как первый этап лечения перед оперативным вмешательством или в качестве пожизненного дренирования мочевого пузыря.
Все методы катетеризации мочевого пузыря имеют свои преимущества и недостатки. Длительное дренирование мочевого пузыря постоянным уретральным катетером сопряжено с высоким риском инфицирования половых органов и мочевых путей внутрибольничной инфекцией, приводит к инфицированию мочи уропатогенами практически у всех пациентов в течение недели. К другим осложнениям относятся стриктуры и пролежни уретры, камни мочевых путей, снижение ёмкости мочевого пузыря.
Методика стентирования
Установка простатического стента является альтернативой катетеризации при лечении пациентов с противопоказаниями к оперативному вмешательству, однако они дают временное улучшение, могут мигрировать и имеют высокую частоту развития побочных эффектов, поэтому их применение ограничено.
Физиотерапевтические методы для лечения аденомы простаты
У больных симптоматической ДГПЖ с сопутствующим хроническим простатитом на начальной стадии развития заболевания в составе комплексного лечения могут применяться физиотерапевтические методы, однако в клинических рекомендациях упоминаний о них нет.
Народные методы лечения аденомы простаты
Наиболее часто применяют:
Растительные экстракты, согласно рекомендациям Европейской ассоциации урологов, не имеют доказанного терапевтического эффекта и поэтому не могут быть рекомендованы для терапии ДГПЖ.
Физические упражнения
Можно рекомендовать упражнения по тренировке мышц мочеполовой диафрагмы, например упражнения Кегеля.
Как делать упражнения Кегеля:
Диета
Массаж
Массаж предстательной железы при аденоме опасен и может быть применён только на начальных стадиях заболевания, пока разрастание тканей не приобрело угрожающий характер. В большинстве случаев прямое воздействие на предстательную железу не используется.
Прогноз. Профилактика
Исследования подтверждают эффективность препаратов — ингибиторов 5α-редуктазы (5-ARI) для первичной и вторичной профилактики ДГПЖ. Однако использование этих препаратов в широкой клинической практике исключительно с профилактической целью ещё окончательно не обосновано.
Немаловажным фактором риска развития ДГПЖ и её осложнений является образ жизни: питание, физическая активность, вредные привычки. Симптомы нарушенного мочеиспускания часто отмечаются у мужчин с неправильным питанием и низкой физической активностью.
Пациенту с ДГПЖ рекомендуется:
Прогноз
За последние десятилетия прогноз при ДГПЖ стал значительно более благоприятным. Это связано с внедрением:
Бережное отношение к своему здоровью, обязательное ежегодное обследование у уролога, начиная с 40 лет, позволит во многом избежать проблем, связанных с обструкцией увеличенной простаты мочевыводящих путей, существенно улучшит качество жизни и сохранит мужскую силу. Оптимальная частота контрольных обследований является предметом обсуждения, однако большинство специалистов согласны с необходимостью ежегодных осмотров.
Обязательный ежегодный стандарт исследования включает:
Ультразвуковая оценка эмболизации простатической артерии
Авторы: Hippocrates Moschouris, Andreas Dimakis, Anastasia Anagnostopoulou, Konstantinos Stamatiou, Katerina Malagari
Введение
В последние годы эмболизация простатической артерии (ЭПА) стала эффективным, малоинвазивным эндоваскулярным лечением симптоматической доброкачественной гиперплазии предстательной железы (ДГПЖ).
Технически успешная ЭПА предполагает суперселективную катетеризацию и эмболизацию простатических артерий (ПА) по крайней мере одной тазовой стороны микрочастицами (сферическими или не сферическими, диаметром 50-500 мкм). Ишемия, вызванная ЭПА, приводит к уменьшению предстательной железы и функциональным изменениям, которые в конечном итоге приводят к облегчению симптомов ДГПЖ.
Таким образом, характеристика клинического успеха ПАЭ в первую очередь основана на улучшении симптомов. Последнее количественно выражается в снижении показателей согласно Международной шкале симптомов простаты (IPSS), при этом сообщаемые средние показатели снижения после ЭПА составляют 53,9–62,5%.
Тем не менее, роль изображений в оценке терапевтической эффективности PAE также важна. Ожидается, что радиологическая визуализация обеспечит неинвазивную, надежную и воспроизводимую оценку размера предстательной железы, а также морфологических, текстурных и перфузионных изменений, которые происходят в простате после ЭПА. Последующее визуализационное наблюдение также необходимо для оценки стойкости эффектов лечения с течением времени и для диагностики некоторых осложнений.
В настоящее время МРТ считается «золотым стандартом» для визуализации оценки ЭПА. Благодаря превосходному контрастному разрешению мягких тканей, МРТ точно показывает изменения размера и текстуры простаты. Однако затраты на оборудование и обследование могут ограничивать доступность и воспроизводимость МРТ, а методика (или соответствующие контрастные вещества) может быть противопоказана некоторым пациентам.
УЗИ – более доступный, гибкий и широко доступный метод, который также использовался для проведения ЭПА с самого начала применения этого метода лечения. Хотя стандартное УЗИ (серошкальное) ограничивается оценкой размера и формы простаты до и после ЭПА, более продвинутые методы могут значительно увеличить диагностическую ценность УЗИ.
Серошкальное УЗИ
Серошкальное УЗИ обычно используется во многих центрах для расчета объема простаты (PV) до и после ЭПА, а также для оценки уменьшения простаты. Хотя некоторые исследователи предпочитают трансректальное УЗИ (ТР-УЗИ), трансабдоминальное УЗИ (ТА-УЗИ) также приемлемо. В опытных руках ТА-УЗИ измерения объема простаты (ОП) тесно коррелируют с измерениями ТР-УЗИ, и первый метод более удобен для пациента и больше подходит для повторного применения.
Следует отметить, что было продемонстрировано, что вариации объема мочевого пузыря имеют незначительное влияние на трансабдоминальные измерения ОП, если объем мочевого пузыря находится в диапазоне 100-400 мл. При обоих подходах простата сканируется в аксиальной, коронарной и сагиттальной плоскостях, а ОП рассчитывается по формуле эллипсоида (длина × высота × ширина × 0,52). Общепризнанным недостатком этой формулы является ее ограниченная точность при увеличении простаты неправильной формы или асимметрично увеличенной площади.
Трехмерное УЗИ может обеспечить более точную оценку ОП, но, как более сложный и технически требовательный метод, обычно не используется для последующего наблюдения после ЭПА. Уменьшение простаты, вызванное технически успешной ЭПА, незначительно в течение первых дней после процедуры, но становится выраженным через месяц и через 3, 6 и 12 месяцев наблюдения. Сообщенные средние показатели снижения ОП после ЭПА составляют 31,9%, 32,1% и 37,6% через 6, 12 и 24 мес после вмешательства, соответственно.
CEUS
Необратимая ишемия предстательной железы и последующий инфаркт играют центральную роль в терапевтическом действии ЭПА. Эмболизированные инфарктные аденомы постепенно уменьшаются в размерах, уменьшается массовое воздействие на простатическую уретру и улучшаются симптомы, а также мочеиспускание.
В настоящее время наши знания относительно визуализации ишемии предстательной железы после ЭПА получены в основном из исследований МРТ с контрастированием. Тем не менее, УЗИ с контрастным усилением (CEUS), как метод детальной визуализации микро- и макроциркуляции в реальном времени, также дал многообещающие результаты. Фактически, благодаря своему анатомическому расположению, относительно небольшому размеру и неподвижности простата может быть даже более подходящей мишенью для исследования CEUS по сравнению с печенью и другими органами брюшной полости.
Действительно, CEUS пост-ЭПА доказал свою осуществимость, рентабельность и способность детально отображать инфаркты простаты. Подобно другим абдоминальным аппликациям CEUS, контрастное вещество для ультразвука второго поколения вводится болюсно в вену предплечья с последующей промывкой физиологическим раствором. Используется специальная методика непрерывного сканирования, специфичного для контраста, с низким механическим индексом (MI = 0,09-0,13), и простата сканируется в трех плоскостях в течение 1-2 минут после инъекции.
Как ТР так и ТА-CEUS могут применяться для изображения инфарктов простаты, при этом первый подход предлагает более высокое пространственное и контрастное разрешение; однако сравнение этих двух подходов показало незначительные различия в измерениях инфаркта простаты после ЭПА.
Когда узелки ДГПЖ полностью инфарктированы, они появляются как дефекты округлой или овальной формы на CEUS; когда возник неполный инфаркт, дефекты усиления могут быть неправильной формы. Инфаркт простаты может быть обнаружен практически сразу после ЭПА; однако он более четко очерчен в первые дни после процедуры. В следующие недели инфаркты предстательной железы постепенно уменьшаются, и большинство из них исчезают через 3-6 месяцев после ЭПА (Рисунок. 1).
Следует отметить, что инфаркты, вызванные ЭПА, локализуются исключительно в переходной зоне; периферическая зона сохраняется, возможно, из-за различий в ее кровоснабжении и микроциркуляции.
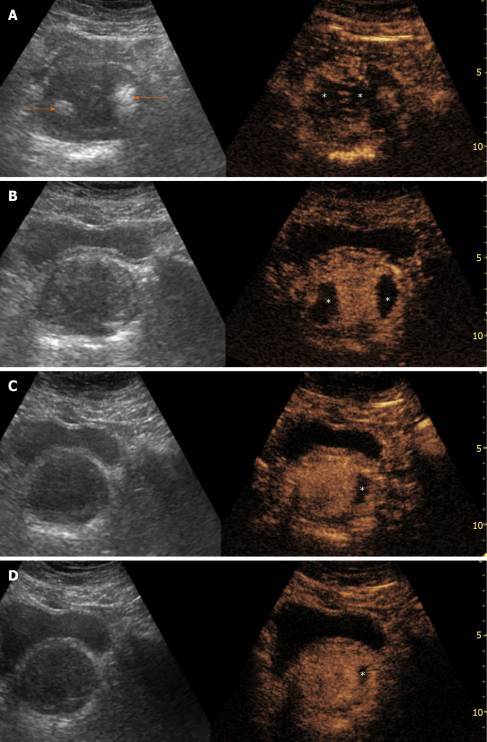
Рисунок 1 : Эволюция результатов серошкального УЗИ и контрастного УЗИ после эмболизации артерии простаты. Результаты представлены в режиме «разделенного экрана» с не лучшенным эталонным изображением в B-режиме слева и соответствующим ультразвуковым изображением с контрастным усилением (CEUS) справа. A: Трансабдоминальное УЗИ показывает недавно появившиеся эхогенные очаги в обеих долях простаты (стрелки). CEUS показывает обширный двусторонний инфаркт простаты; B: через месяц после ЭПА эхогенные очаги исчезли, инфаркты простаты стали лучше очерчены и меньше по размеру; C и D : Оценка через 6 и 12 месяцев после ЭПА, соответственно, показывает, что инфаркты уменьшились или исчезли, и можно оценить уменьшение простаты. Звездочки указывают на инфаркт простаты на всех изображениях CEUS. Все изображения в аксиальной плоскости
Объем инфаркта простаты можно рассчитать по формуле эллипсоида (так же, как и ОП), и это приемлемый метод для регулярных, круглых или яйцевидных инфарктов. Объемная оценка с помощью планиметрии и специального программного обеспечения дает превосходную точность, особенно в случае множественных инфарктов неправильной формы.
Объем инфаркта предстательной железы делится на ОП (рассчитанный одновременно) и определяется процент ишемии предстательной железы (pИП). pИП сильно коррелирует с последующим уменьшением предстательной железы, (последнее является конечным результатом абсорбции инфарктной ткани) и может прогнозировать его. Степень инфаркта предстательной железы, по-видимому, является предиктором клинического успеха ЭПА, по крайней мере, в подгруппе пациентов с ДГПЖ, задержкой мочи и постоянным катетером мочевого пузыря (Рисунок 2).
В недавнем исследовании с систематической оценкой CEUS после ЭПА успешное удаление катетера было достигнуто только у пациентов с pИП> 10%.
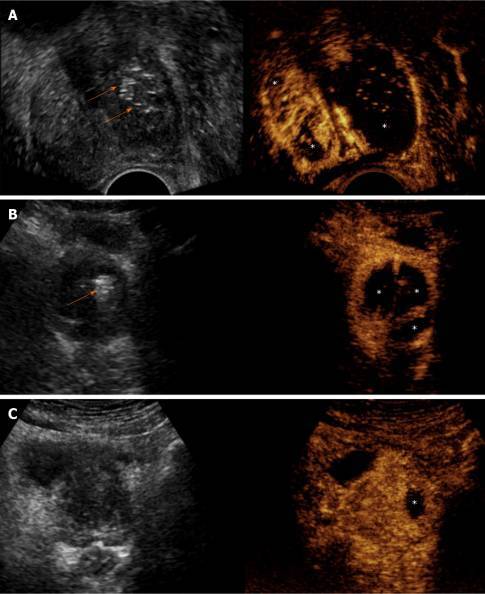
Рисунок 2 : Различная степень и распространение инфарктов предстательной железы у пациентов с разными клиническими исходами. A : Трансректальная CEUS 5-дневная пост-билатеральная эмболизация простатической артерии у пациента с постоянным катетером мочевого пузыря показывает обширный инфаркт левой доли простаты и меньшие инфаркты справа. Через неделю стало возможным удаление катетера Фолея и спонтанное мочеиспускание; B : Трансабдоминальное CEUS через один день после двусторонней ЭПА показывает обширный двусторонний инфаркт простаты. Пациент испытал быстрое и стойкое улучшение симптомов; C: CEUS через день после односторонней (слева) ЭПА у пациента с постоянным катетером мочевого пузыря показывает небольшой инфаркт левой доли. Множественные попытки удаления катетера Фолея у этого пациента потерпели неудачу, и в конечном итоге ему была сделана трансуретральная резекция. Стрелки указывают на эхогенные очаги, которые появляются в эмболизированных частях простаты вскоре после ЭПА. Обратите внимание, что при небольшом одностороннем инфаркте эхогенных очагов не обнаруживается. Все изображения в аксиальной плоскости.
Эластография
Почти наверняка инфаркт, за которым следует сокращение простаты, – не единственный терапевтический механизм ЭПА. Фактически, уменьшение ОП и облегчение внешнего сдавления простатической уретры затрагивает только «статический» (анатомический) компонент ДГПЖ. Однако существует также «динамический» (функциональный) компонент в патофизиологии ДГПЖ, связанный с активацией альфа1-адренорецепторов простаты и связанный со снижением эластичности аденоматозной ткани простаты.
Считается, что ЭПА блокирует поступление симпатических медиаторов, которые дополнительно необходимы для активации альфа1-рецепторов; ЭПА уменьшает количество самих рецепторов, тем самым улучшая эластичность простаты. Этот потенциальный механизм подтверждается клиническим наблюдением «размягчения» простаты при пальцевом ректальном исследовании после успешной ЭПА.
Эластография также использовалась для получения соответствующих доказательств (Рисунки 3 и 4). Эластография сдвиговой волны (ЭСВ) использует ультразвуковой толкающий импульс для генерации поперечной волны в тканях. На скорость поперечной волны влияет жесткость ткани (более высокая скорость в более жестких тканях); Скорость поперечной волны может быть рассчитана и закодирована по цвету для каждого пикселя соответствующего УЗИ-изображения, таким образом создавая эластографическую цветовую карту, которая накладывается на полутоновое изображение. Сравнивая ткань до и после сжатия, степень локальной деформации ткани оценивается в режиме реального времени и отображается на цветной карте.
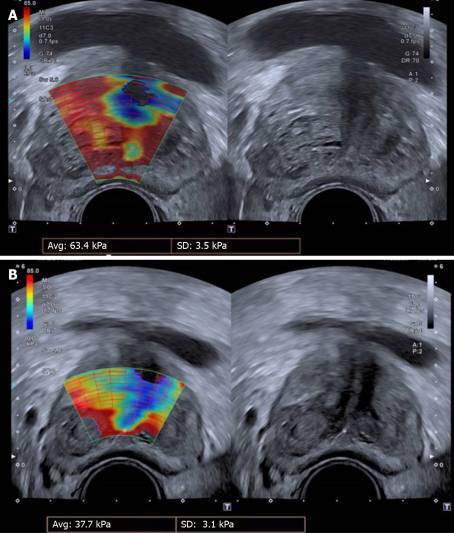
Рисунок 3 : Эластография сдвиговой волны простаты. A : Раннее; B : Через три месяца после двусторонней эмболизации простатической артерии. Продемонстрировано значительное снижение (40,5%) модуля упругости (ЕМ) переходной зоны, что указывает на повышенную эластичность ткани простаты после ЭПА. Эластографические изменения сопровождались заметным улучшением клинических показателей, а также объема простаты (уменьшение на 55%) и остаточного объема после мочеиспускания (уменьшение на 76%). Случай любезно предоставлен доктором де Ассис А.М., Отделение интервенционной радиологии, Институт радиологии, Медицинская школа Университета Сан-Паулу.
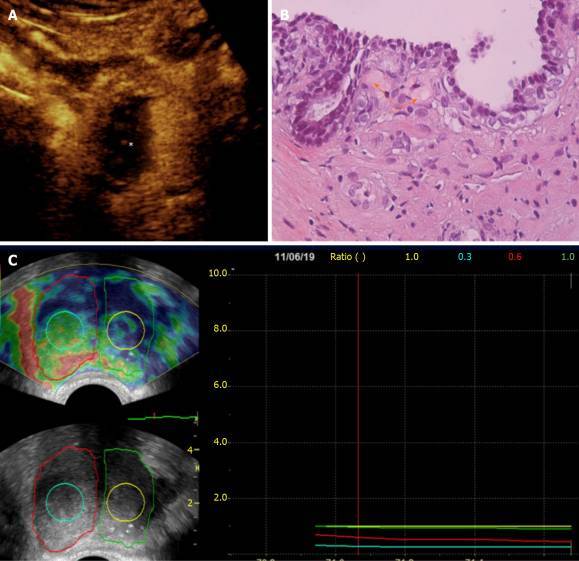
Рисунок 4 : Корреляция результатов ультразвукового исследования с контрастным усилением, гистопатологические и эластографические данные после односторонней (правой) эмболизации простатической артерии. A: Изображение трансабдоминального УЗИ с контрастным усилением (CEUS) (аксиальный разрез), полученное через одну неделю после эмболизации простатической артерии, показывает обширный инфаркт правого гемипростата (звездочка); B: Гистопатология (окраска гематоксилин-эозином, исходное увеличение × 40) образца трансректальной биопсии под контролем УЗИ правой переходной зоны подтверждает присутствие эозинофильных микросфер (стрелки) в артериолах, окружающих ацинус простаты. Эта биопсия была проведена через 12 месяцев после ЭПА; C: Трансректальные эластографические изображения деформации (аксиальные срезы) простаты через 13 месяцев после ЭПА демонстрируют повышенную деформацию в правом гемипростате и в центре правой переходной зоны (обведены красной и бирюзовой линиями соответственно) по сравнению с левым гемипростатом. И до центра левой переходной зоны (обозначенной зеленой и желтой линиями соответственно).
Внутрипоцедурное УЗИ при ЭПА
Некоторые исследователи, пользуясь преимуществами портативности и гибкости УЗИ оборудования, применили методы УЗИ в ангио-блоке, где выполняется ЭПА, для оценки процедуры на месте. При серошкальном УЗИ эхогенные очаги появляются в предстательной железе сразу после ЭПА и остаются видимыми в течение нескольких дней после процедуры. Это открытие, вероятно, вызвано крошечными пузырьками воздуха, захваченными смесью контрастного вещества и эмболического материала. Эти механизмы аналогичны тем, которые вызывают «эхогенный ответ» в опухолях печени после трансартериальной (химио) эмболизации. Эхогенные очаги более выражены и многочисленны в простате с обширным инфарктом после ЭПА.
ТА-CEUS со стандартным (внутривенным) путем введения контраста также может быть выполнено в ангиографическом кабинете вскоре после инъекции эмболического материала, чтобы продемонстрировать ишемический эффект. Инфаркт предстательной железы можно обнаружить уже через несколько минут после эмболизации; однако иногда точная оценка их степени в это время может быть скомпрометирована вышеупомянутыми эхогенными очагами.
Последнее можно отличить от микропузырьков контраста путем сравнения (на разделенном экране устройства) не улучшенного изображения в оттенках серого с соответствующим изображением CEUS и наблюдения, что эхогенные очаги неподвижны, а микропузырьки постоянно циркулируют. Эта немедленная оценка ишемического эффекта может привести к дальнейшим решениям относительно процедуры: если CEUS демонстрирует неадекватный инфаркт, несмотря на очевидный ангиографический стаз кровотока в ПА, следует рассмотреть повторную оценку кровотока с помощью ангиографии (после времени ожидания в несколько минут) и поиск дополнительных вариантов. (Рисунок 5).

Рисунок 5 : Внутрипроцедурная сонографическая оценка эмболизации простатической артерии с помощью ультразвукового исследования с внутривенным контрастированием. A : Рентгенограмма (переднезадняя проекция) сразу после эмболизации правой предстательной артерии показывает кончик микрокатетера (пунктирная стрелка) в проксимальной (экстрапростатической) части правой предстательной артерии. Объединение контраста эмболической смеси вызвало помутнение правого гемипростата (стрелки). «F» обозначает баллон катетера Фолея; B и C: Трансабдоминальное УЗИ с контрастным усилением (CEUS), аксиальный и правый парасагиттальный срез, соответственно, подтверждает адекватную деваскуляризацию (инфаркт) правого гемипростата (звездочки).
Внутриартериальный CEUS также использовался для внутрипроцедурного руководства ЭПА. Этот метод включает сонографию простаты с алгоритмом CEUS во время инъекции разбавленного контраста через микрокатетер, расположенный в ПА. Одна группа использовала суспензию липидных микросфер перфлютрена (Definity, Lantheus Medical Imaging, North Billerica, MA, США), разведенных 1:20 в физиологическом растворе и вводимых небольшими аликвотами (0,3-0,5 мл); разбавленный SonoVue также может быть использован для ВА-CEUS, хотя следует признать, что это будет не по прямому назначению.
ПРАВИЛЬНО ЛИ ВЫ УХАЖИВАЕТЕ ЗА УЗ-АППАРАТОМ?
Скачайте руководство по уходу прямо сейчас
Внутриартериальное УЗИ может быть выполнено до эмболии, чтобы показать часть простаты, питаемую выбранной артерией (Рисунок 6). Визуализация соседних органов (например, мочевого пузыря, прямой кишки) также может быть продемонстрирована, если части этих органов имеют то же артериальное кровоснабжение, что и простата. Таким образом, ВА-CEUS может подтвердить успешный выбор ПА и предотвратить некоторые случаи нецелевой эмболизации.
Внутриартериальный CEUS может играть роль в управлении ЭПА, особенно когда КТ-оборудование с коническим пучком недоступно.
Внутрипроцедурная сонография может быть технически сложной задачей, и получение изображений приемлемого качества не гарантируется: сканирование должно выполняться трансабдоминально, под стерильными простынями; катетеризованный мочевой пузырь обычно пуст, и сам катетер Фолея может быть препятствием для ультразвукового луча.
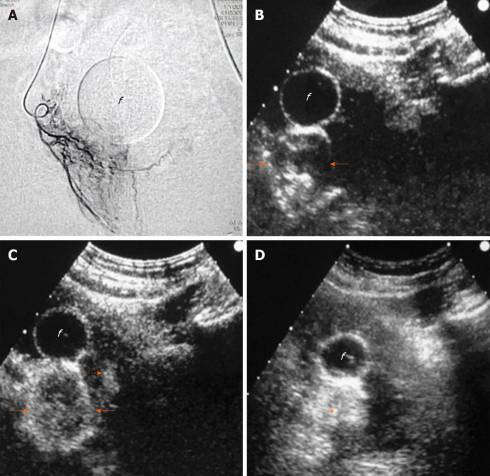
Рисунок 6 : Внутрипроцедурная сонографическая оценка эмболизации простатической артерии с помощью внутриартериального ультразвукового исследования с контрастированием. A : Ангиографическое изображение (переднезадняя проекция) показывает правую предстательную артерию и ее ветви; B : Изображение трансабдоминального УЗИ с контрастным усилением через 3 секунды после внутриартериальной инъекции разбавленного Sonovue показывает быстрое, интенсивное усиление правой доли простаты, более заметное на ее периферии (стрелки); C : изображение через 7 секунд показывает более диффузное усиление правой доли и едва различимое усиление в небольшой области левой доли (пунктирная стрелка). Признаков экстрапростатического усиления замечено не было, эмболизация проводилась микросферами (диаметр: 100-300 мкм); D : Не улучшенное УЗИ изображение через 10 минут после эмболизации показывает повышенную эхогенность правой доли (звездочка). «F» обозначает баллон катетера Фолея на всех изображениях. Изображения CEUS в аксиальной плоскости.