Инфравезикальная обструкция у мужчин что это
Лечение функциональных нарушений опорожнения мочевого пузыря
Лечение больных с функциональными нарушениями опорожнения мочевого пузыря является насущной проблемой нейроурологии. Это связано с тем, что до настоящего времени не разработано эффективных и этиопатогенетически обоснованных методов лечения таких больных
Лечение больных с функциональными нарушениями опорожнения мочевого пузыря является насущной проблемой нейроурологии. Это связано с тем, что до настоящего времени не разработано эффективных и этиопатогенетически обоснованных методов лечения таких больных.
Выделяют нейрогенные, миогенные (миопатии) и психогенные (неврозы, шизофрения, истерия и др.) факторы, лежащие в основе функциональных нарушений опорожнения мочевого пузыря. Нейрогенные нарушения и повреждения — основная причина таких нарушений. В отсутствие причины функциональных нарушений опорожнения мочевого пузыря следует думать об идиопатических формах заболевания.
Согласно классификации Международного общества по удержанию мочи, функциональные нарушения опорожнения мочевого пузыря — это результат недостаточной функции мочевого пузыря, гиперактивности уретры или следствие комплексного воздействия обоих нарушений [1]. Недостаточная функция мочевого пузыря возникает вследствие снижения или отсутствия сократительной способности детрузора (арефлексия), которые встречаются при локализации повреждения или неврологического поражения в области фронтальных долей и моста головного мозга, сакрального отдела спинного мозга, при повреждении волокон конского хвоста, тазового сплетения и нервов мочевого пузыря, а также при рассеянном склерозе. Гиперактивность уретры — это следствие наружной детрузорно-сфинктерной диссинергии (ДСД) или нерасслабляющегося (спастического) поперечно-полосатого (п/п) сфинктера уретры, также может проявиться как вариант синдрома Фоулера у женщин. При этом наружная ДСД наблюдается при супрасакральном уровне поражения спинного мозга.
В литературе имеются лишь единичные сообщения о распространенности функциональных нарушений опорожнения мочевого пузыря. Так, P. Klarskov и соавт., оценивая обращаемость в лечебные учреждения Копенгагена, выявили, что ненейрогенные формы нарушения опорожнения мочевого пузыря встречаются в среднем у 7 женщин на 100 000 населения [2]. По данным T. Tammela и соавт., после оперативных вмешательств на органах брюшной полости нарушения опорожнения мочевого пузыря встречаются у 2,9 % пациентов, а после проктологических операций — у 25% больных [3]. Многие авторы считают данную проблему особенно значимой у неврологических больных.
Клиническим проявлением снижения сократительной способности детрузора и нерасслабляющегося п/п сфинктера уретры являются симптомы нарушения опорожнения мочевого пузыря, к которым относятся затрудненное мочеиспускание тонкой, вялой струей, прерывистое мочеиспускание, необходимость прилагать усилия и натуживаться, чтобы начать мочеиспускание, ощущение неполного опорожнения мочевого пузыря.
При отсутствии сократительной способности детрузора в сочетании с паралитическим состоянием п/п сфинктера уретры больные опорожняют мочевой пузырь, искусственно увеличивая внутрибрюшное давление, что клинически проявляется мочеиспусканием слабой струей мочи. При отсутствии сократительной способности детрузора в сочетании со спастическим состоянием наружного сфинктера уретры в большинстве случаев самостоятельное мочеиспускание невозможно и отмечается хроническая задержка мочи.
Нерасслабляющийся п/п сфинктер уретры приводит к инфравезикальной обструкции с симптомами нарушения опорожнения мочевого пузыря.
Клинические проявления наружной ДСД (непроизвольное сокращение п/п сфинктера уретры во время мочеиспускания или непроизвольного сокращения детрузора) включают два вида симптомов, а именно: нарушения опорожнения и накопления мочи в мочевом пузыре. Последние включают учащенное и ургентное мочеиспускание нередко в сочетании с ургентным недержанием мочи и никтурией. Для наружной ДСД характерно неполное опорожнение мочевого пузыря и развитие пузырно-мочеточникового рефлюкса.
Таким образом, различные формы нарушения опорожнения мочевого пузыря могут иметь во многом сходную клиническую картину. В связи с этим правильная и своевременная диагностика функциональных нарушений опорожнения мочевого пузыря является залогом успешного лечения.
Диагностика функциональных нарушений опорожнения мочевого пузыря складывается из сбора жалоб и анамнеза, урологического и неврологического обследования, а также дополнительных методов обследования, среди которых основное место занимает уродинамическое исследование. На начальном этапе обследования обязательна оценка симптомов нижних мочевых путей на основании вопросника I-PSS (Internanional Prostate Symptom Score). Вопросник I-PSS был предложен для оценки нарушений акта мочеиспускания вследствие заболеваний предстательной железы, однако в настоящее время он с успехом применяется и в случаях проявления симптомов заболеваний нижних мочевых путей, вызванных различными факторами, в том числе и неврологического характера.
Для уточнения поведения детрузора и его сфинктеров в фазу опорожнения мочевого пузыря наиболее информативным методом исследования больных является комплексное уродинамическое исследование.
Уродинамическими признаками наружной ДСД, характерной для надкрестцовой локализации патологического процесса, особенно в шейном отделе спинного мозга, являются регистрируемые с помощью электромиографии во время мочеиспускания «всплески» сократительной активности п/п сфинктера уретры и мышц тазового дна. Сокращение мышц тазового дна затрудняет или полностью прерывает поток мочи. Для нерасслабляющегося сфинктера уретры характерно отсутствие снижения электромиографической активности п/п сфинктера уретры во время мочеиспускания. Снижение или отсутствие сократительной способности детрузора уродинамически проявляется отсутствием плавного повышения детрузорного давления в ходе цистометрии или отсутствием позыва к акту мочеиспускания.
Следует подчеркнуть, что только уродинамическое обследование дает возможность достоверно установить форму нарушения функции нижних мочевых путей, приводящих к нарушению опорожнения мочевого пузыря, и во многом определить выбор метода лечения.
Ультразвуковое исследование почек и мочевого пузыря, также как и экскреторная урография, позволяет уточнить анатомическое состояние верхних мочевых путей и количество остаточной мочи в мочевом пузыре. По количеству остаточной мочи в мочевом пузыре после акта мочеиспускания (в норме до 50 мл) можно косвенно судить о функциональном состоянии детрузора и наличии инфравезикальной обструкции.
В таблице перечислены методы лечения больных с функциональными нарушениями опорожнения мочевого пузыря, из которых только медикаментозная терапия и дорзальная ризотомия с электростимуляцией передних корешков могут действительно считаться методами лечения, тогда как другие скорее являются способами опорожнения мочевого пузыря. При этом даже медикаментозная терапия во многом является симптоматическим методом лечения. Несмотря на это, назначение лекарственных средств представляет собой первый этап лечения больных с функциональными нарушениями опорожнения мочевого пузыря. Выбор медикаментов зависит от вида нарушения функции нижних мочевых путей. Так, в случае нарушения сократительной способности детрузора применяют антихолинэстеразные средства и М-холиномиметики, а при гиперактивности уретры — центральные миорелаксанты и α-блокаторы.
У 22 больных со сниженной сократительной способностью детрузора использовали дистигмина бромид (убретид) в дозе 5 мг через день за 30 мин до завтрака в течение 2 мес. При этом через каждые 2 нед делали 7-дневный перерыв в приеме препарата. Механизм действия дистигмина бромида заключается в блокировании ацетилхолинэстеразы, что сопровождается увеличением концентрации ацетилхолина в синаптической щели и соответственно приводит к облегчению передачи нервного импульса.
У всех больных терапевтический эффект развивался в первую неделю приема препарата и выражался в снижении среднего балла I-PSS c 15,9 до 11,3, а количества остаточной мочи — с 82,6 до 54,3 мл. Субъективно пациенты отмечали усиление ощущения позыва и облегчение начала акта мочеиспускания.
Следует отметить, что до настоящего времени остается открытым вопрос о продолжительности лечения антихолинэстеразными средствами. По нашим данным, у 82% больных в разные сроки после окончания 2-месячного курса лечения отмечалось возобновление симптомов, потребовавшее повторного назначения препарата.
К сожалению, мы не накопили собственного опыта применения бетанехола у больных со сниженной сократительной способностью детрузора, так как данный препарат не зарегистрирован для клинического применения в нашей стране и соответственно отсутствует в аптечной сети. Механизм действия бетанехола аналогичен действию ацетилхолина на гладкие миоциты. Данные других авторов показывают, что бетанехол может применяться при лечении больных с легкой степенью нарушения сократительной способности детрузора [4, 5].
α1-адреноблокатор доксазозин (кардура) использовали в ходе лечения 30 больных с гиперактивностью уретры, в том числе 14 пациентов с наружной ДСД и 16 с нарушением произвольного расслабления п/п сфинктера уретры. Доксазозин назначали в дозе 2 мг/сут на ночь.
Через 6 мес средний балл по шкале I-PSS у больных с наружной ДСД снизился с 22,6 до 11,4, количество остаточной мочи уменьшилось с 92,6 до 32,4 мл, а максимальная скорость потока мочи увеличилась с 12,4 до 16,0 мл/сек.
Кроме того, через 6 мес у больных с нарушением произвольного расслабления п/п сфинктера уретры средний балл I-PSS снизился с 14,6 до 11,2, количество остаточной мочи — с 73,5 до 46,2 мл, а максимальная скорость потока мочи увеличилась с 15,7 до 18,4 мл/сек.
Баклофен и тизанидин (сирдалуд) являются центральными миорелаксантами. Они снижают возбуждение моторных нейронов и интернейронов и могут ингибировать передачу нервного импульса в спинном мозге, уменьшая спастичность п/п мышц. По нашим данным, после применения баклофена в дозе 20 мг/сут и тизанидина в дозе 4 мг/сут не было выявлено существенной динамики субъективных и объективных симптомов как у больных с наружной ДСД, так и у пациентов с нарушением расслабления п/п сфинктера уретры. Выраженная слабость мускулатуры конечностей на фоне приема этих препаратов не позволяет увеличивать дозу препаратов, что существенно ограничивает их применение в клинической практике.
Следует отметить, что медикаментозная терапия эффективна у больных с начальными и легкими формами нарушения опорожнения мочевого пузыря. Тем не менее ее целесообразно использовать в качестве первого этапа лечения. В случае недостаточной эффективности медикаментозной терапии необходимо искать новые пути решения проблемы адекватного опорожнения мочевого пузыря.
Предложенная Lapides и соавт. в 80-е гг. прошлого столетия интермиттирующая аутокатетеризация мочевого пузыря до настоящего времени остается одним из основных методов опорожнения мочевого пузыря [6]. Однако этот метод имеет ряд осложнений, к которым относятся инфекции нижних мочевых путей, стриктуры уретры и, самое главное, значительное снижение качества жизни. При невозможности выполнения (неврологические больные с тетраплегией, больные с ожирением) или отказе пациента от аутокатетеризации, у лиц с наружной ДСД и нерасслабляющимся сфинктером уретры, а также со сниженной сократительной способностью детрузора для адекватного опорожнения мочевого пузыря применяют в последние годы имплантацию специальных стентов (производства фирм Balton, Mentor, МедCил) и инъекции ботулинического токсина в зону п/п сфинктера уретры.
 |
| Рисунок 1. Временный уретральный стент |
Временные уретральные стенты имеют форму цилиндра, выполненного из проволочной спирали толщиной 1,1 мм, изготовлены они на основе полимолочной и полигликоликовой кислот с различным периодом разрушения (от 3 до 9 мес) посредством гидролиза (рис. 1). Механические свойства и время разрушения временных стентов зависят от степени поляризации, места и формы зоны имплантации.
Мы имеем опыт применения временных уретральных стентов у семи мужчин с наружной ДСД и у четырех пациентов, у которых отсутствовала сократительная способность детрузора. Временный уретральный стент устанавливали при уретроцистоскопии таким образом, чтобы он «шинировал» как простатический, так и мембранозный отделы уретры. Такое положение стента обеспечивает адекватное опорожнение мочевого пузыря.
У всех больных отмечалось восстановление самостоятельного мочеиспускания сразу после имплантации уретрального стента. Пациенты с наружной ДСД осуществляли мочеиспускание по позыву, а больные с отсутствием сократительной способности детрузора с интервалом 4 ч (6 раз в сутки) с использованием приема Креда. По данным ультразвукового сканирования, через 10 нед после установки стента у больных с наружной ДСД не отмечалось остаточной мочи, а у больных с отсутствием сократительной способности детрузора среднее количество остаточной мочи составило 48 мл и зависело от адекватности выполнения приема Креда. Очень важно, что у больных с наружной ДСД было выявлено снижение максимального детрузорного давления во время мочеиспускания в среднем с 72 до 35 см вод. ст. (профилактика развития пузырно-мочеточникового рефлюкса).
Мы считаем, что временные уретральные стенты обеспечивают адекватное опорожнение мочевого пузыря и показаны тем больным с нарушением опорожнения мочевого пузыря, которым не может быть выполнена интермиттирующая катетеризация мочевого пузыря или которые воздерживаются от нее по различным причинам. Временные стенты могут являться методом отбора больных для установки постоянных (металлических) стентов.
В последние годы в литературе появились сообщения об успешном использовании ботулинического токсина у больных с функциональными нарушениями опорожнения мочевого пузыря. В нашей клинике ботулинический токсин применялся у 16 больных с нарушением опорожнения мочевого пузыря, в том числе у девяти с наружной ДСД, у трех с нерасслабляющимся п/п сфинктером уретры и у четырех с нарушением сократительной способности детрузора. Мы использовали ботулинический токсин типа А фармацевтической фирмы Allergan. Коммерческое название препарата — ботокс (Botox), он представляет собой лиофилизированный порошок белого цвета в вакуумных стеклянных флаконах объемом 10 мл, закрытых резиновой пробкой и герметичным алюминиевым затвором. В одном флаконе содержится 100 ЕД ботулинического токсина типа А.
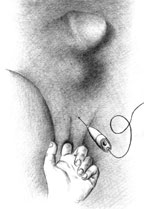 |
| Рисунок 2. Введение ботулинического токсина у мужчин |
Механизм действия ботокса заключается в блокировании выброса ацетилхолина из пресинаптической мембраны в нервно-мышечном синапсе. Фармакологическим эффектом этого процесса является стойкая хемоденервация, а клиническим проявлением — расслабление мышечных структур.
Согласно рекомендациям фирмы-производителя, лиофилизированный порошок разводили 8 мл стерильного 0,9% раствора натрия хлорида без консервантов (1 мл полученного раствора содержит 12,5 ЕД ботокса). Использовали трансперинеальную методику введения препарата. У мужчин под контролем указательного пальца, введенного в прямую кишку, специальную иглу с изоляционным покрытием вводили в точку, находящуюся на 2 см латеральнее и выше анального отверстия (рис. 2). У женщин иглу под контролем указательного пальца, введенного во влагалище, вводили в точку на 1 см латеральнее и выше наружного отверстия уретры на глубину 1,5–2,0 см (рис. 3). Во всех случаях положение иглы контролировали электромиографически по характерному звуку динамика электромиографа. В каждую точку вводили по 50 ЕД ботокса.
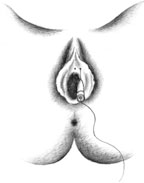 |
| Рисунок 3. Введение ботулинического токсина у женщин |
У всех больных через 10 дней после введения ботулинического токсина исчезла остаточная моча и было отмечено увеличение максимальной скорости потока мочи. Важно, что хемоденервация сфинктера уретры после инъекции ботокса у всех пациентов с нерасслабляющимся п/п сфинктером и наружной ДСД приводила к снижению детрузорного давления, а у больных с нарушением сократительной способности детрузора — к снижению максимального абдоминального давления, вызывающего выделение мочи из наружного отверстия уретры. Это наблюдение представляется крайне важным в отношении профилактики развития пузырно-мочеточникового рефлюкса и сохранения функциональной способности почек. Только у одного больного клинический эффект после инъекции ботокса продолжал сохраняться на протяжении 16 мес, остальным пациентам потребовались повторные инъекции препарата с периодичностью 3–8 мес.
В отдельных случаях, при выраженной инвалидизации больных с нарушением опорожнения мочевого пузыря, используют трансуретральную инцизию или резекцию наружного сфинктера уретры, дренируют мочевой пузырь постоянным уретральным катетером или выполняют цистостомию.
Таким образом, нарушение опорожнения мочевого пузыря может быть следствием различных форм дисфункции нижних мочевых путей. Требуются проведение комплексного уродинамического обследования для уточнения функционального состояния мочевого пузыря и его сфинктеров и выбор адекватного метода опорожнения мочевого пузыря. Отсутствие высокоэффективных и универсальных способов лечения больных с функциональными нарушениями опорожнения мочевого пузыря диктует необходимость поиска новых методов терапии таких больных.
Г. Г. Кривобородов, доктор медицинских наук
М. Е. Школьников, кандидат медицинских наук
РГМУ, Москва
Основные виды недержания мочи у мужчин
Согласно рекомендациям Международного Общества по Проблемам Удержания (ICS) недержанием мочи называется непроизвольная потеря мочи вследствие нарушения функции детрузора и/или сфинктерного аппарата уретры, что приводит к социальным и гигиеническим проблемам как самих пациентов, так и их окружения. На наш взгляд наиболее приемлемым было бы разделить непроизвольные потери мочи у мужчин по нозологическому принципу.
Таким образом, у мужчин непроизвольные мочеиспускания могут иметь место в следующих случаях:
1) при инфравезикальной обструкции;
2) после операций на предстательной железе;
3) при нейрогенном мочевом пузыре;
4) ночное недержание мочи.
Непроизвольные потери мочи вследствие инфравезикальной обструкции.
Непроизвольные потери мочи у мужчин чаще всего связаны с инфравезикальной обструкцией. Инфравезикальная обструкция является собирательным понятием и включает в себя ряд заболеваний, вызывающих затруднение оттока мочи через просвет уретры. К ним относятся доброкачественная гиперплазия предстательной железы, стриктуры уретры, камни и новообразования мочеиспускательного канала, рак предстательной железы, простатит. Эти причины, в свою очередь, обусловливают возникновение у мужчин синдрома нижних мочевых путей (СНМП) (LUTS-синдром – lower urinary tract symptoms), частью которого являются и непроизвольные потери мочи. Физиологически, причины возникновения СНМП включают как минимум четыре состояния: 1) обструкция просвета уретры; 2) нарушения сократимости детрузора; 3) нестабильность детрузора; 4) сенсорная повелительность мочеиспускания ( Blaivas J.G., 1998). Хотя СНМП подразделяются на ирритативные и обструктивные, не всегда есть корреляция между этими красноречивыми терминами и обозначаемыми ими физиологическими процессами. По этой причине обоснованней пользоваться разделением СНМП на симптомы нарушения накопления мочи и симптомы нарушений опорожнения мочевого пузыря (Wein, 1981). Первые включают в себя учащенное мочеиспускание, повелительность мочеиспускания вплоть до неудержания мочи, никтурию и некоторые виды болевых ощущений. Симптомы нарушений опорожнения мочевого пузыря включают прерывистую, вялую струю мочи, затрудненное мочеиспускание, остаточную мочу и подтекание мочи как после мочеиспускания, так и при переполненном мочевом пузыре. Таким образом, основными видами непроизвольных потерь мочи при простатической обструкции являются 1) ургентное неудержание мочи и 2) недержание при переполнении – парадоксальная ишурия.
Неудержание мочи является основным клиническим проявлением такого состояния, как нестабильность детрузора, которое, в свою очередь, является частым спутником простатической обструкции. Нестабильность детрузора имеет место более чем у 50% мужчин с ДГПЖ, хотя и не всегда коррелирует с обструкцией уретры (Abrams, 1984). Другими словами, у пациента с клиническими проявлениями ДГПЖ может иметь место нестабильность детрузора как при простатической обструкции, так и без нее. Нестабильность детрузора является основной причиной непроизвольных потерь мочи у мужчин и значительно превосходит по частоте все остальные состояния, обусловливающие инконтиненцию. Turner (1979) указывает, что от 10% до 15% как женщин, так и мужчин в возрасте от 10 до 50 лет имеют нестабильный мочевой пузырь без других симптомов. Частота возникновения нестабильности детрузора увеличивается с возрастом и достигает 25% среди пожилых мужчин (Resnick, Yalla, 1982). P. Abrams (1985), K. Nielsson (1994) на основании наполнительной цистометрии выявили нестабильность детрузора у 55-80% пациентов с простатической обструкцией.
Определение. Комиссией по стандартизации терминологии ICS нестабильностью детрузора решено определять объективно демонстрируемые в фазу накопления при цистометрии спонтанные или провоцируемые непроизвольные сокращения детрузора, которые пациент может подавить (Abrams P.H.,Blaivas J.G., Stanton S.L. et al.). Нестабильность детрузора является, по сути, сононимом гиперактивности детрузора и оба этих определения правомерны и одинаково часто употребляются в современной литературе. Гиперактивность детрузора, как диагноз, устанавливается только у пациентов без неврологической патологии, в то время как непроизвольные сокращения детрузора у неврологических больных принято обозначать термином «гиперрефлексия детрузора». Гиперактивность детрузора не всегда сопровождается непроизвольными потерями мочи, поскольку некоторые пациенты до определенного момента в состоянии подавить непроизвольные сокращения детрузора за счет напряжения мышц тазового дна, активирующих наружный сфинктер уретры. Однако со временем наступает «утомление» сфинктера и больной уже не может остановить истечение мочи, вызванное непроизвольным сокращением детрузора.
Клиническим проявлениям нестабильности детрузора является так называемый «ургентный синдром», объединяющий следующие симптомы: 1) учащенное мочеиспускание (как в дневное, так и в ночное время); 2) наличие императивных позывов к мочеиспусканию; 3) неудержание мочи (ургентная инконтиненция). Последнее клиническое проявление является наиболее угнетающим и мучительным для пациентов. Согласно требованием ICS (1976), неудержание мочи является общепризнанным термином и характеризуется наличием императивных (повелительных) позывов к мочеиспусканию и связанных с ними непроизвольных потерь мочи. Неудержание мочи разделяется на моторную форму, при которой не подавляемые сокращения детрузора сочетаются с ощущениями неотложности мочеиспускания с последующей невозможностью удержать мочу, и сенсорную форму, при которой ощущения повелительного позыва к мочеиспусканию не связаны с активностью детрузора. Разделение ургентной инконтиненции на сенсорную и моторную формы основывается на данных цистометрии. Так, при моторной форме у больного во время наполнительной цистометрии регистрируются непроизвольные сокращения детрузора, не подавляемые волей и сопровождающиеся неудержанием мочи. При сенсорной форме непроизвольные сокращения детрузора отсутствуют и неудержание мочи происходит за счет повелительного, не подавляемого позыва к мочеиспусканию. Однако ряд исследователей приводят данные о возможности регистрации непроизвольных сокращений детрузора при провокационной цистометрии и амбулаторном уродинамическом мониторинге у второй группы больных (Porru, Usai, 1994; van Waalwijk van Doorn ESC, Remmers, Janknegt, 1992).
Изучения мускулатуры мочевого пузыря человека и животных сформулировали несколько гипотез возникновения гиперактивности детрузора. Сверхчувствительность зоны дистальнее пузырно-уретрального сочленения вследствие частичной парасимпатической денервации остается основной гипотезой. Эксперименты показали взаимосвязь возрастания чувствительности мускулатуры мочевого пузыря к ацетилхолину и простатической обструкции. Более того, очевидно доказано, что при устранении обструкции мочевой пузырь может реиннервироваться и вернуться к состоянию нормального физиологического функционирования (Cumming, Chisholm, 1992; Mundy, 1988). Персистирование симптомов нестабильности детрузора после устранения обструкции, если нет доказанной нейропатии, может быть связано с невозможностью восстановления поврежденного нервного аппарата детрузора. Другими возможными факторами считаются повреждение функции адренорецепторов, дисфункция афферентных нервных волокон, нейротрансмиттерный или пептидный дисбаланс, повреждение механизмов подавления спонтанного нервного импульса в мускулатуре детрузора.
Лечение. Основными объектами лечебных мероприятий при гиперактивности детрузора являются уменьшение симптомов учащенного мочеиспускания, ургентности мочеиспускания и ургентного неудержания мочи. Лечебную тактику можно представить следующим образом.
1) Лечение сопутствующей патологии:
— устранение простатической обструкции, воспаления и других факторов;
2) Лечение непосредственно гиперактивности детрузора:
-поведенческие модификации (тренировка мочевого пузыря, метод ответной реакции);
-фармакотерапия (антихолинергические препараты, спазмолитики, трициклические антидепрессанты);
-электростимуляция;
-хирургическое лечение (расширительная энтероцистопластика, миомэктомия, искусственное отведение мочи).
Лечение выявленной простатической обструкции является основным моментом, поскольку, как указывалось выше, она является главной причиной возникновения синдрома нижних мочевых путей. Кроме того, не устраненная простатическая обструкция, которая также сопровождается наличием остаточной мочи, является противопоказанием к применению антихолинергических препаратов и миотропных релаксантов. Если обструкция вызвана простатитом, то бактериологически обоснованная антибиотикотерапия в сочетании с массажем простаты, физиопроцедурами и применением нестероидных противовоспалительных препаратов дает положительный результат и снижает ургентные симптомы. Обструкция, связанная с ДГПЖ, успешно устраняется различными методами удаления и уменьшения объема аденоматозной ткани (TUMT, TUNA, TURP). Золотым стандартом в лечении ДГПЖ является трансуретральная резекция простаты. Устранение повелительного мочеиспускания или значительное снижение его проявлений наблюдалось после ТУРП у 22-50% больных с ДГПЖ (Abrams, 1988; Nielsson, 1994).
Поведенческие модификации – тренировка мочевого пузыря и метод ответной реакции – зарекомендовали себя как неинвазивные и достаточно эффективные варианты лечения легких степеней гиперактивности детрузора. Тренировка мочевого пузыря основана на постепенном увеличении интеравала между мочеиспусканиями и наращивании емкости мочевого пузыря. При возникновении повелительного позыва больной должен за счет напряжения мышц тазового дна максимально долго препятствовать непроизвольному мочеиспусканию, поскольку активация наружного сфинктера рефлекторно ингибирует сокращения детрузора. Кроме того пациентам рекомендуется мочиться сторого через определенные интервалы времени, что не позволяет превысить объем мочи, вызывающий непроизвольное сокращение детрузора. Суть метода ответной реакции (biofeedback) заключается в информировании пациента о нормальных значениях различных физиологических показателей, например, о давлении, которое необходимо создать напряжением мышц тазового дна. Для этого используются различные измерительные приборы – перинеометры, с помощью которых пациент может сам контролировать эффективность используемых им упражнений для укрепления мускулатуры промежности. Эффективность поведенческих модификаций колеблется от 50% объективного улучшения до 85% субъективного, однако в более отдаленном периоде у 43% пациентов возникает рецидив гиперактивности детрузора (Frewen, 1979).
Фармакотерапия является основным и наиболее эффективным методом лечения гиперактивности детрузора. Самыми распространенными препаратами, используемыми для лечения непроизвольных сокращений детрузора, являются антихолинергические средства, трициклические антидепрессанты и мускулотропные релаксанты.
Антихолинергические средства.
Главным местом приложения нейрогуморальных импульсов для физиологического сокращения мочевого пузыря является стимуляция постганглионарных парасимпатических мускариновых холинергических рецепторов, расположенных в стенке мочевого пузыря. Атропин и атропиноподобные вещества по этой причине подавляют нормальную сократимость мочевого пузыря и непроизвольные его сокращения любого происхождения.
Хотя антимускариновые препараты обычно вызывают значительное клиническое улучшение у пациентов с нестабильностью детрузора, их эффект не всегда оказывается достаточным и стойким. Это объясняется феноменом «атропиновой резистентности». Теоретически атропин должен полностью подавлять ответ гладкой мускулатуры мочевого пузыря на экзогенную холинэргическую стимуляцию. Однако, в эксперименте на животных наблюдается только частичный антогонизм. Наиболее привлекательная и общепринятая теория, объясняющая «атропиновую резистентность», заключается в том, что сокращение детрузора, в конечном счете, обусловлено не адренергической и не холинергической инервацией, а неким другим более сложным механизмом.
Пропантилена бромид это классический препарат с выраженным антимускариновым действием на нижние мочевые пути. При оценке антимускориновой активности in vitro пропантилен является наиболее эффективным, пригодным для длительного применения и относительно недорогим препаратом. Несмотря на низкую всасываемость, он достаточно эффективен при приеме внутрь, обычная доза для взрослых составляет 15-30 мг через каждые 4-6 часов. При оценке данных клинических испытаний в 5% случаев достигается излечение, более чем у 50% больных происходит уменьшение неудержания мочи, у половины наблюдались побочные эффекты различной степени выраженности, а 9% больных были вынуждены прекратить лечение из-за побочных эффектов.
Атропин, как и другие алакалоиды беладонны, хорошо всасывается из желудочно-кишечного тракта и применяется внутрь, до еды по 0,5 мг, 5-6 раз в сутки, так как период полувыведения составляет около 4 часов. Левовращающие изомеры атропина – гиосциамин (цистоспаз) и гиосциамина сульфат (левзин, цистоспаз М), которые теоретически в два раза активнее исходного алкалоида, при испытаниях не показали достоверного улучшения эффективности. Гиосциамина сульфат выпускается в сублингвальной форме (левзин СЛ) и является наиболее перспективной формой из данной группы препаратов.
Трицикличные антидепрессанты
Трицикличные антидепрессанты, в частности имизин (мелипрамин) способствуют удержанию мочи, уменьшая сократимость мочевого пузыря и повышая сопротивляемость в области шейки и задней уретры.
Механизм действия трицикличных антидепрессантов (имизина) на нижние мочевые пути складывается из нескольких фармакологических эффектов. Прежде всего, имизин центральный и периферический холинолитик. В результате блокады активного транспорта в пресинапсе, выделенного при возбуждении норэпинефрина и серотонина, происходит нарушение нервной проводимости и снижение тонуса детрузора.
Имизин вызывает симптоматическое и объективное улучшение при лечении больных с ургентным синдромом. При хорошей переносимости, возможно сочетание трициклических антидепрессантов с холинолитиками (атропин).
Жалобы о выраженных побочных действиях (сильные брюшные боли, тошнота, рвота, головная боль, вялость и раздражительность) следующих сразу после отмены имизина говорят о том, что прекращать употребление надо постепенно, особенно пациентам принимающим большие дозы препарата.
Миотропные релаксанты.
Эти соединения относятся к группе прямых спазмолитиков или гладкомышечных релаксантов, чья « антиспазмическая» активность, согласно имеющимся данным, направлена на гладкую мускулатуру в месте, которое расположено дистальнее холинергических или других сократительных рецепторных механизмов. Хотя эти средства расслабляют гладкую мускулатуру in vitro посредством папаверино-подобной (прямой) активности, все они обладают различной степенью выраженности антихолинергическим и местноанестезирующем действиеми. Серьезным вопросом остается то, какая доля клинической эффективности прямых спазмолитиков обусловлена атропиноподобным действиями. Если антимускариновое действие не играет значимой роли в подавлении активности детрузора, то это является основанием для комбинированной терапии с, так называемыми, чистыми антихолинэргическими средствами.
Механизм действия оксибутинина хлорида основан на его выраженном, независимом, прямом мускулотропном релаксирующем действии. Оксибутинин обладает антихолинергическим и местноанестезирующим действиями. По последним данным при исследовании in vitro, этот препарат вызывает блокаду кальциевых каналов в гладкомышечных клетках детрузора.
Впервые оксибутинин был успешно применен при гиперрефлексии детрузора у больных с нейрогенными расстройствами мочевого пузыря. Дальнейшие исследования показали его успех при терапии других типов гиперактивности мочевого пузыря.
Местноанестезирующее действие оксибутинина позволяет эффективно использовать его для внутрипузырного введения. Более того, при исследовании уровня оксибутинина в сыворотке крови доказано, что его концентрации после внутрипузырного и перорального введения значимо не отличаются, а при внутрипузырном введении максимально-эффективная концентрация препарата поддерживается в несколько раз дольше, чем при назначении внутрь. Эти данные несколько изменяют, если не ставят под сомнение постулат об отсутствии всасывания в стенке мочевого пузыря.
Со стороны уродинамических показателей наблюдается достоверное снижение объемной скорости потока мочи, увеличение емкости мочевого пузыря и остаточной мочи, возрастание порога возникновения первого позыва на мочеиспускание, увеличение объема мочевого пузыря, при котором возникают неконтролируемые сокращения, снижение амплитуды непроизвольных сокращений детрузора.
По сравнению с пропантелином и атропином, оксибутинин быстрее формирует положительный ответ на лечение, более значимо улучшает уродинамические показатели, оказывает более длительное действие и имеет меньше побочных эффектов.
Основываясь на приведенных данных, можно заключить, что применение дриптана (оксибутинина гидрохлорид) при лечении гиперактивности детрузора наиболее эффективно и безопасно. Внутрипузырный путь введения дриптана является предпочтительным, если больной применяет самокатетеризацию для отведения мочи. При лечении больных с рассеянным склерозом назначение дриптана или любого другого препарата с антихолинэргической активностью должно быть индивидуальным.
Антагонисты кальция, НПВС, селективные -блокаторы, вещества, открывающие калиевые каналы, имеют ограниченное применение из-за низкой избирательности действия, большого количества побочных эффектов и малой эффективности.
Отдельное место в фармакотерапии нестабильности детрузора занимает внутрипузырное введение препарата Капсаицин, в основу которого входит жгучий ингредиент красного перца. Капсаицин является нейротоксическим веществом, которое вначале вызывает раздражение, а затем потерю чувствительности не миелинизированных сенсорных нейронов. Потенциальное клиническое применение препарата основано на фармакологическом нарушении функции афферентных сенсорных нейронов мочевого пузыря. Такой механизм действия представляется оптимальным в лечении нестабильности детрузора и сенсорного неудержания мочи. Клиническая эффективность препарата изучается, а первые результаты показали достаточно выраженное уменьшение симптомов и хорошую переносимость Капсаицина.
Электростимуляция. В настоящее время достаточно широко применяемый на западе метод подавления непроизвольных сокращений детрузора. Существует два основных метода электростимуляции у мужчин: 1)подача токов низкой частоты через ректальный датчик или промежностные электроды; 2) имплантация электронейростимуляторов в область срамного нерва или крестцовых корешков S2-S4 после положительной перкутанной пробы. Первый метод направлен на укрепление мышц тазового дна и на улучшение работы сфинктеров уретры, в особенности наружного. Второй используется прежде всего для подавления патологической детрузорной активности. Нейростимуляция в обоих видах не эффективна при выраженных повреждениях сфинктеров уретры, что имеет место после различных операций на предстательной железе, особенно неоднократных.
Хирургическое лечение. Многие из предложенных когда-то методов хирургического лечения нестабильности детрузора не нашли широкого применения и представляют только исторический интерес. В настоящее время используются расширительная энтероцистопластика, миотомия и искусственное отведение мочи как последний метод терапии гиперактивности детрузора при неэффективности или невозможности проведения других видов лечения.
Принцип расширительной энтероцистопластики заключается в продолжительном рассечении стенки мочевого пузыря, фронтально или сагиттально, с последующим вшиванием в образовавшийся дефект детубуляризованного сегмента тонкой кишки на брыжейке. Этим достигается увеличение емкости мочевого пузыря и устранение непроизвольных сокращений детрузора. В 1982 году Bramble сообщил об излечении 13 из 15 больных энурезом, не получивших положительного эффекта от всех видов консервативного лечения. В современной литературе большинство авторов указывает на высокую эффективность этой операции как при нестабильности, так и при гиперрефлексии детрузора. Однако существенным недостатком данной методики является наличие таких осложнений, как образование опухолей и метаболические нарушения. Поиск альтернативы привел урологов к внедрению в практику миотомии – пересечению мышечного слоя по всей окружности мочевого пузыря без захвата слизистой с последующим формированием рубца, нарушающего сократимость детрузора. Ближайшие результаты изучаются в настоящее время во многих центрах и по предварительным данным показывают достаточную эффективность этого метода для увеличения емкости мочевого пузыря и устранению непроизвольных сокращенй детрузора.
Последним из возможных методов хирургической коррекции нестабильности детрузора является отведение мочи. Не плохо себя зарекомендовал метод энтеровезикостомии, когда из аппендикса или отрезка тонкой кишки формируется цистостома, открывающаяся на передней брюшной стенки в области пупка. Необходимость в ряде случаев интермиттирующей самокатетеризации несколько ухудшает качество жизни пациентов, однако в значительно меньшей степени, чем оставление эпицистостомы. Катетер Фоллея или ЦИСТОФИКС вызывают у больных болевые ощущения, индуцируют и поддерживают воспаление, способствуют камнеобразованию. Однако возраст больного, серьезная сопутствующая патология иногда определяют единственно возможный вариант – наложение надлобкового свища.