Ингаляции протеолитических ферментов что это
Трипсин кристаллический (Trypsin crystal) инструкция по применению
Владелец регистрационного удостоверения:
Контакты для обращений:
Лекарственная форма
Форма выпуска, упаковка и состав препарата Трипсин кристаллический
Лиофилизат для приготовления раствора для инъекций и местного применения в виде лиофилизированного порошка или пористой массы, уплотненной в таблетку белого или белого со слегка желтоватым оттенком цвета.
| 1 фл. | |
| трипсин* | 10 мг |
* получен из поджелудочной железы крупного рогатого скота.
Фармакологическое действие
Трипсин обладает выраженными противовоспалительным и противоотечным свойствами, способен расщеплять омертвевшие участки тканей, фибринозные образования, вязкие секреты и экссудаты. По отношению к здоровым тканям фермент неактивен и безопасен в связи с наличием в них ингибиторов трипсина (специфических и неспецифических). Не влияет на систему гемостаза.
Показания препарата Трипсин кристаллический
Открыть список кодов МКБ-10
| Код МКБ-10 | Показание |
| H04.6 | Другие изменения слезных протоков |
| H20.0 | Острый и подострый иридоциклит (передний увеит) |
| H21.0 | Гифема |
| H66 | Гнойный и неуточненный средний отит |
| I80 | Флебит и тромбофлебит |
| J01 | Острый синусит |
| J32 | Хронический синусит |
| J47 | Бронхоэктатическая болезнь |
| J85 | Абсцесс легкого и средостения |
| J86 | Пиоторакс (эмпиема плевры) |
| J90 | Плевральный выпот |
| J98.1 | Легочный коллапс (в т.ч. ателектаз) |
| K05 | Гингивит и болезни пародонта |
| M86 | Остеомиелит |
| S05 | Травма глаза и глазницы |
| T30 | Термические и химические ожоги неуточненной локализации |
| T79.3 | Посттравматическая раневая инфекция, не классифицированная в других рубриках |
Режим дозирования
Трипсин кристаллический применяется в/м, интраплеврально, в виде аэрозолей и электрофореза.
Ингаляционно: по 0.005-0.01 г в 2-3 мл 0.9% раствора натрия хлорида через ингалятор или через бронхоскоп. После ингаляции прополоскать рот теплой водой и промыть нос.
Глазные капли: 0.2-0.25% раствор, который готовят непосредственно перед применением, 3-4 раза/сут в течение 1-3 дней.
Интраплеврально: 1 раз/сут 10-20 мг препарата, растворенного в 20-50 мл 0.9% раствора натрия хлорида, после введения желательно частое изменение положения тела; на 2 день после инсталляции выпускают, как правило, разжиженный экссудат.
Побочное действие
Возможно: аллергические реакции, повышение температуры тела, тахикардия.
Местные реакции: болезненность и гиперемия в месте инъекции при в/м введении. При ингаляции трипсина могут появиться раздражение слизистых оболочек верхних дыхательных путей и охриплость голоса.
Противопоказания к применению
Применение при беременности и кормлении грудью
Применение препарата при беременности возможно только при условии, что ожидаемая польза для женщины превышает возможный риск, как для женщины, так и для ребенка.
Ингаляции протеолитических ферментов что это
Одной из основных задач Национальной программы «Здоровье» основателем которого является Президент Туркменистана Гурбангулы Беодымухамедов – обеспечение населения страны лекарственными препаратами за счет лекарств отечественного производства,изучение возможности выращивания ценных лекарственных растений в условиях Туркменистана, разработка агротехники возделывания и обеспечение страны медицинскими препаратами и ценным сырьем для промышленности [1].
В современном мире большое внимание уделяется использованию в медицинской практике биологически активных препаратов растительного происхождения.
Мировая медицина ограничиваются от использования антибиотиков, так как снижается иммунная система и приводит к другим сложным последствиям. Ученые полагают, что в будущем антибиотики могут быть заменены супер-антителами, для которых не будет препятствием клеточная стенка, которые смогут проникать внутрь клеток и уничтожать болезнетворные бактерии, вирусы и токсины. Они испытывают технологию модификации антител, которая позволяет им свободно проникать в клетки и покидать их [1, 2–9, 12].
Авторы осознают, что при написании статьи не все задуманное удалось реализовать в полном объеме. Прекрасно понимают, что делают научный обзор по использованию лекарственных энзимов растительного происхождения в широком направлений, поэтому имеется недостатки как в теоретическом плане, так в прикладной, практической части. Но тем не мене вопрос использования нанотехнологии в генной инженерий и, прежде всего расшифровка геном человека позволяют создавать новые лекарственные препараты. Если будем лучше понимать роль генов в развитии болезней и то, как протекают процессы в наших клетках на наноуровне, сможем более целенаправленно вести исследования. С помощью генетики и биотехнологии сможем в будущем более эффективно выявлять причины заболеваний; тем самым исследования в области фармакология – это существенный шаг будет в деле создания инновационных лекарственных средств, устраняющих саму почину болезни. Большой интерес в этом предоставляют протеолитические ферменты растительного происхождения дынного древа [1–4].
Сделанный научно-информационый обзор, собранные материалы и методика подхода могут быть полезны для применения их не только в клинической медицине Туркменистана, но и в других странах мира.
Биотехнологические особенности дынного дерева
Лекарственное сырье. В качестве лекарственного сырья используют высушенный млечный сок – латекс. Коагулированные комья латекса крошат и высушивают на солнце или при легком искусственном подогревании (в последнем случае получают папаин более высокого качества). Полученный латекс растворяют в воде и осаждают спиртом для очистки папаина. В меньших количествах папаин содержится и в других частях растения, в частности в листьях (Folia Caricae Papayae) [2–4, 8–11].
Биологически активные вещества. Методом электрофореза в кислой среде в латексе Carica papaya L. идентифицировано 7 белков: липаза, хитиназа, лизоцим и комплекс протеолитических ферментов:
Папаин (EC 3.4.22.2) – монотиоловая цистеиновая эндопротеаза. По характеру ферментативного действия ее называют «растительным пепсином». Но, в отличие от пепсина, папаин активен не только в кислых, но и в нейтральных и щелочных средах (диапазон рН 3–12, оптимум рН 5) [2–4, 8–11, 17–20].
Химопапаин (EC 3.4.22.6) – монотиоловая цистеиновая протеиназа. Благодаря субстратной специфичности похожа на папаин, но отличается от него электрофоретической подвижностью, стойкостью и растворимостью [2–4, 12, 13].
Протеиназа IV – цистеиновая протеиназа, основная протеиназа латекса, составляет около 30 % присутствующего в нем белка (Buttle D. J. etc., 1989).Проявляет высокую степень гомологии с протеиназой III папайи (81 %), химопапаином (70 %) и папаином (67 %). Очень близка к химопапаину по молекулярной массе и заряду молекулы. Загрязнение этим ферментом химопапаина является причиной его гетерогенности в ходе исследований. M.P. Thomas и соавт. (1994) относят этот фермент к фракции химопапаина М [2–4, 8–11, 15, 16].
Карикаин (EC 3.4.22.30) – наиболее щелочная среди цистеиновых протеиназ латекса папайи. Подобно папаину, он сначала продуцируется в форме неактивного зимогена прокарикаина, содержащего ингибиторный прорегион из 106 N-терминальных аминокислот. Активация фермента заключается в отщеплении прорегиона молекулы без ее последующих конформационных изменений. Строение протеиназ папайи изучено с помощью рентгенструктурного анализа (Maes D. etc., 1996) [2–4, 11–18].
Протеиназа w (эндопептидаза А, пептидаза А) – монотиоловая цистеиновая протеиназа. Это полипептид, содержащий 216 аминокислотных остатков и 3 дисульфидные связи. Для проявления его ферментативной активности важно наличие свободного остатка цистеина в активном центре (Dubois T. etc., 1988). Проявляет высокую степень гомологии с папаином (68,5 %). По специфичности ферментативного действия напоминает папаин, поскольку связывается с субстратом в участках локализации дисульфидных связей. Расщепление происходит тогда, когда в следующей позиции находятся лейцин, валин или треонин. Пептидаза ІІ – щелочная монотиоловая цистеиновая протеиназа. В каталитическом центре содержит дитиоацильную группу.
В латексе неспелых плодов папайи содержатся также ингибиторы протеолитических ферментов: цистатин (ингибитор протеиназ с молекулярной массой 11 262 Да) и белок со свойствами ингибитора цистеиновых протеиназ, молекула которого состоит из 184 аминокислотных остатков, содержит 2 дисульфидные связи и 2 углеводных остатка в позициях Asp84 и Asp90 (Odani S. etc., 1996) [2–4, 12–19].
В спелых плодах дынного дерева содержится 8–12 % сахара, значительное количество витаминов А, В1, В2, С и D, тонизирующие вещества. В листьях папайи выявлены свободные и связанные фенольные соединения, танины, органические кислоты и алкалоиды.
В листьях имеются свободные и связанные фенольные соединения, танины, органические кислоты, стероидные и тритерпеновые сапонины, флавониды, липиды, кумарины, глюкозы, альколоиды, применяемые при лечении туберкулеза и обладающие желче- и мочегонными свойствами [2–4, 11–20].
Фармакологические свойства. Эти протеолитические ферменты растительного происхождения обладают противовоспалительными, антикоголяционными, диградрационными, болеутоляющими, бактерицидными, гемолитивными свойствами. Данные ферменты широко применяются в медицинской практике: офтомологии, хирургии, нейрохирургии, ортопедии, урологии, гастроэнтрологии и др. Они способствуют разрушать белки полупепдидов и аминокислот, растворяют мертвые клетки, при этом не влияя на нормальные.
Модификация комплекса протеиназ папайи синтетическими полимерами. Изучение деструкции ферментных препаратов
Проблема повышения эффективности терапии во многом решается благодаря поиску новых лекарственных средств, важное место среди которых отводится модифицированным производным биокатализаторов с пролонгированным терапевтическим действием [6–8]. Как правило, модификацию ферментов выполняют с использованием растворимых полимеров. В Институте молекулярной биологии и биологической физики АН Грузинской ССР получены водорастворимые и биосовместимые производные полиуретанов и полиамидов [6]. Ранее уже была показана их пригодность для использования в качестве стабилизирующих фермент (трипсин, химотрипсин) носителей [12]. В настоящей работе изучена модификация этими полимерами терапевтически значимого ферментного препарата – комплекса протеиназ папайи [12, 13].
С целью определения целесообразности дальнейшего медико-биологического испытания модифицированных ферментов проведено сравнительное изучение их деструкции под действием экстремальных рН и протеаз. Сопоставление данных о целостности набора молекул ферментного препарата (на основе результатов молекулярно-массового распределения и его каталитической активности) позволяет не только оценить влияние носителя на лекарственный агент, но и сформулировать рекомендации для фармакологического исследования модифицированных препаратов биокатализаторов.
В своей научной статье А.В. Максименко, Л.А. Надирашвили, В.В. Абрамова, Г.С. Еркомаишвили, Р.Д. Кацарава, В.П. Торчилин «Модификация комплекса протеиназ папайи синтетическими полимерами. Изучение деструкции ферментных препаратов» проведённых в Институт экспериментальной кардиологии Всесоюзного кардиологического научного центра АМН СССР и Институт фармакохимии имени И.Р. Кутателадзе АН Грузинской ССР, Тбилиси.
В статье авторами описана химическая модификация комплекса протеиназ папайи синтетическими полимерами – полиамидом, полиуретаном. Изучены свойства модифицированных ферментных препаратов: показана их устойчивость к протеолизу при физиологических условиях и деструкция в щелочной области рН. Модификация комплекса протеиназ папайи усиливает влияние цистеина на стабильность модифицированных препаратов. Осаждение их при кислых значениях рН позволяет легко отделять биокатализатор от реакционной смеси. Обсуждаются перспективы дальнейшего исследования полученных производных.
Условия проведения эксперимента
Реагенты. Нативный препарат комплекса протеиназ папайи (КПЛ) из млечного сока дынного дерева был выделен и охарактеризован по описанному методу [6, 7]. Полимерные носители были получены из Института физиологии им. И.С. Бериташвили АН Грузинской ССР. Ими были водорастворимый полиамид с молекулярной массой 50–60 кД.
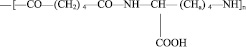
и полиуретан с молекулярной массой 45–50 кД [4]
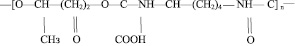
Этиловый эфир N-бензол-L-аргинина (ВАЕЕ), L-цистеин, «субтилизин Карлсберг» произведены фирмой Sigma (США). Проназа Е, N-этил-3-(3-диметиламинопропил) карбодиимид, 3-меркапто-1,2-пропандиол – производства фирмы Serva (ФРГ); сефадексG-75 superfine получен от фирмы Pharmacia (Швеция). Все остальные реагенты – продукты производства «Реахим» (СССР) аналитической степени чистоты.
Ковалентное присоединение КПЛ к полимерным носителям. Связывание ферментного препарата с карбоксилсодержащими полимерами проводили через карбодиимидную активацию в соответствии с [8]. 20 мг носителя (полиамида или полиуретана) растворяли в 2 мл 0,01 М раствора трис-буфера, рН 8,0. Затем добавляли 1 мл того же буферного раствора, содержащего 2,5 мг карбодиимида. Смесь инкубировали в течение 30 мин при 4°, после чего добавляли 1 мл раствора того же буфера, содержащего 10 мг нативного КПЛ и 2,5 мг цистеина (для сравнения были выполнены эксперименты и без цистеина в реакционной смеси). Дальнейшую инкубацию проводили в течение 20 ч при 4°. Препараты выделяли методом ультрафильтрации на установке «Amicon» (США) с фильтром ХМ-30, проводя отмывку дистиллированной водой до постоянной оптической плотности промывных вод (220 нм). После этого препараты лиофилизовали. Сравнительное определение молекулярной массы производных проводили методами гель-хроматографии и электрофореза.
Изучение деструкции ферментных препаратов. За деструкцией полимерных образцов cледили, сопоставляя профили элюции проб инкубационной смеси с колонки сефадекса G-75 [9]. Инкубацию препаратов проводили в 0,1 М трис-буфере, рН 7,4 и 0,1 М боратном буфере, рН 9,6, при 30° как в отсутствие, так и в присутствии протеаз – проназы или субтилизина. Концентрация в инкубационной смеси нативного препарата 1 мг/мл, модифицированных – 1–3 мг/мл; проназы 0,2 мг/мл, субтилизина 0,1 мг/мл; носителей (1 мг/мл). Оптическую плотность проб элюата для нативного и модифицированных препаратов регистрировали при 280 нм, для полимерных носителей – при 208 нм.
Определение каталитической активности. Каталитическую активность ферментных препаратов определяли методом измерения начальных скоростей гидролиза 0,05 М раствора ВАЕЕ с 0,1 М КС1 на рН-стате «Radiometer» (Дания) при рН 7,0 и комнатной температуре.
Влияние сульфгидрильных реагентов на каталитическую активность ферментных препаратов исследовали измерением последней до и после (в течение 5 ч) добавления 10 мг/мл меркапто-пропандиола (1 мМ) к растворам биокатализаторов [6].
Измерение термостабильности ферментных препаратов. Растворы нативного и модифицированного полиамидом или полиуретаном (10 мг/мл) комплекса протеиназ папайи инкубировали при 37 °С в 0,1 М буферных растворах, рН 7,4 или рН 9,6, в присутствии 6 мг/мл и в отсутствие цистеина. Периодически отбирали пробы из инкубационной смеси (0,2 мл) и определяли на рН-стате их каталитическую активность, как описано выше.
Титрование сульфгидрильных групп ферментных препаратов. Эксперимент проводили по методу Эллмана [10], как описано ранее [7]. Титрант – 5,5-дитио-бис-2-нитробензойная кислота (получен от фирмы Calbiochem, США), коэффициент экстинкции 13 600 М•см–1 [6, 7, 12. 13].
В результате получены:
Свойства препаратов комплекса протеиназ папайи, модифицированного синтетическими полимерами. В результате ковалентного присоединения КПЛ к полиамиду или полиуретану с носителем связывается около 90 % исходного количества белка (как в присутствии, так и в отсутствие цистеина в инкубационной смеси). Однако проведение модификации в присутствии цистеина обеспечивает получение препаратов с большей величиной остаточной каталитической активности, чем без этой аминокислоты. Так, для препаратов КПЛ-полиамид, полученных с цистеином и без него, остаточная каталитическая активность составляет 70 и 50 %, соответственно, а для КПЛ-поли- уретан – 70 и 20 %. Данные титрования сульфгидрильных групп в ферментных препаратах показывают, что, по-видимому, ковалентного присоединения цистеина к полимерной матрице не происходит (табл. 1). Цистеин способствует только реактивации обратимо инактивированных ферментов [6], повышая, как уже говорилось, остаточную каталитическую активность модифицированных препаратов.
Каталитические параметры – ферментативного гидролиза ВАЕЕ нативным и модифицированным комплексами протеиназ папайи (0,1 М KCI, рН 7,0, комнатная температура)
ГБОУ «НИКИО им. Л.И. Свержевского» Департамента здравоохранения города Москвы
ГБУЗ НИКИО им. Л.И. Свержевского ДЗМ
Применение ингаляционной терапии при воспалительных заболеваниях гортани
Учреждение разработчик: Государственное учреждение Здравоохранения «Московский научно-практический центр оториноларингологии» Департамента Здравоохранения г. Москвы.
Составители: Директор ГУЗ «МНПЦО» ДЗ Москвы профессор А.И. Крюков, заведующий отделением микрохирургии гортани и фониатрии МНПЦ оториноларингологии ДЗ Москвы к.м.н. С.Г. Романенко, старший научный сотрудник отделения микрохирургии гортани и фониатрии ГУЗ «МНПЦО» ДЗ Москвы к.м.н. О.Г. Павлихин, отделением микрохирургии гортани и фониатрии ГУЗ «МНПЦО» ДЗ Москвы Елисеев О.В.
Рецензент: доктор медицинских наук, профессор В.П. Гамов
Доктор медицинских наук, профессор В.Ф. Антонив
Предназначение: В методических рекомендациях представлены схемы ингаляционной терапии больных воспалительными заболеваниями гортани. Методические рекомендации рассчитаны на врачей – оториноларингологов поликлинического и стационарного звена, врачей – фониатров.
Данный документ является собственностью Департамента здравоохранения Правительства Москвы и не подлежит тиражированию и распространению без соответствующего разрешения.
ВВЕДЕНИЕ
Ингаляционную терапию применяли еще в глубокой древности. Основоположником ингаляционной терапии считают Гиппократа. Тогда же появились и простейшие ингаляционные препараты. Прародители современных ингаляционных аппаратов появились в 19 веке и постепенно совершенствовались вместе с развитием технического прогресса. В 1932г норвежский химик Э. Ротхейм получил патент на первый аэрозольный аппарат. В дальнейшем, до настоящего времени, происходит усовершенствование ингаляционной аппаратуры, и продолжает расширяться круг лекарственных препаратов, применяемых для ингаляционной терапии.
Основным преимуществом аэрозольтерапии является возможность достижения быстрого и эффективного лечебного действия с применением относительно небольшой дозы лекарственного препарата и значительном снижении отрицательного системного эффекта. Во время ингаляции происходит быстрое и интенсивное всасывание лекарственных препаратов, с увеличением активной поверхности и депонированием его в подслизистом слое. Создается высокая концентрация лекарственного средства непосредственно в очаге воспаления.
Эндоларингеальные вливания значительно менее эффективны, чем аэрозольтерапия, т.к. вводимые лекарственные препараты неглубоко проникают в ткани гортани из-за непродолжительного контакта лекарственного вещества со слизистой оболочкой гортани. Применение эндоларингеальных вливаний часто бывает ограничено анатомическими и индивидуальными особенностями пациента. К тому же, вливания в гортань невозможно осуществлять несколько раз в день. Все выше сказанное не означает, что от эндоларингеальных вливаний следует вообще отказаться. Этот вид местной терапии незаменим в фониатрической и ЛОР-практике в тех случаях, когда требуется быстрый лечебный эффект без глубокого проникновения лекарственного вещества. Например, в случае кровоизлияния в голосовую складку, вызванного форсированной фонацией, или острого катарального ларингита, сопровождающегося нарушением микроциркуляции голосовой складки на фоне твердой атаки, более эффективными оказываются вливания в гортань сосудосуживающих средств (адреналин 0,1% — 0,3 в 2 мл физиологического раствора). Лекарственные средства вливают в гортань подогретыми до температуры тела по каплям до достижения клинического эффекта: побледнения слизистой оболочки, сужения сосудов голосовой складки. При этом достигается быстрый терапевтический эффект и не возникают побочные эффекты в виде сухости слизистой оболочки гортани.
Ингаляторы, исходя из методов получения аэрозольной среды, бывают ультразвуковые, компрессорные, пневматические, паровые и тепловлажные. При выборе того или иного вида ингаляционной терапии следует учитывать не только форму того или иного лекарственного средства, но и все параметры процедуры (форма лекарственного вещества, концентрация аэрозоля, температура аэрозоля, и др.).
Исследованиями доказано, что температура вдыхаемых аэрозолей серьезно влияет на мерцательный эпителий и состояние самого лекарственного вещества. Высокая и низкая температуры ингалируемых растворов отрицательно влияют на течение воспалительного процесса. При температуре вдыхаемого лекарственного препарата выше 39-40 градусов по Цельсию подавляется функция мерцательного эпителия (выше 41 градуса происходит его гибель). Растворы температурой ниже 25 — 28 градусов являются холодовым раздражающим фактором. Оптимальной температурой аэрозоля считается 36-38 градусов. Тепловлажные и паровые ингаляции на фоне острого ларингита могут быть причиной развития отека слизистой оболочки гортани со стенозированием её просвета. Следует так же отметить, что многие препараты резко снижают, или даже теряют свою биологическую активность при нагревании их до высоких температур. В связи с этим, применение тепловлажных и паровых ингаляций для лечения воспалительной патологии гортани мы считаем не целесообразным. Данный вид терапии может с осторожностью применяться при субатрофических и атрофических процессах в гортани.
В последние годы расширяется арсенал карманных ингаляторов. Существуют карманные жидкостные ингаляторы и порошковые ингаляторы. Карманные ингаляторы применяются для введения в дыхательные пути дозированного количества препарата. Несмотря на удобство их применения, область использования этого вида ингаляторов при патологии гортани ограничена. Основная масса аэрозоля оседает в полости рта. К недостаткам аэрозольных упаковок следует отнести низкую температуру получаемого аэрозоля. Так же одним из недостатков аэрозольных баллонов является и то, что по мере его использования давление внутри его уменьшается и лекарственный препарат выбрасывается не полностью.
Ингаляционная аппаратура.
Ингаляционная аппаратура подразделяется на стационарные установки и портативные переносные аппараты. В связи с тем, что терапия воспалительных заболеваний гортани требует многократных ингаляций в течение дня, все большее внимание уделяется переносным ингаляционным аппаратам.
В лечебной практике чаще используются небулайзеры (от лат. nebula — туман, облачко). Различают два основных типа небулайзеров: компрессорные и ультразвуковые. Компрессорные ингаляторы бывают струйными или пневматическими. Компрессорный ингалятор представляет собой устройство для преобразования лекарственного вещества в мелкодисперсный аэрозоль под действием сжатого воздуха от компрессора или под действием сжатого кислорода. В ультразвуковых ингаляторах распыление осуществляется в результате высокочастотной вибрации пьезоэлектрических кристаллов.
Результаты проведенного нами клинико-экспериментального исследования доказывают, что ингаляционные процедуры, проводимые на индивидуальных ультразвуковых ингаляционных аппаратах, более эффективны, по сравнению с ингаляциями, проводимыми на компрессорных аппаратах. Это объясняется тем, что аэрозоль ультразвуковых ингаляционных аппаратов представляет собой электроаэрозоль. Такой аэрозоль помимо лечебных свойств самого лекарственного вещества, практически полностью состоит из отрицательно заряженных частиц, оказывающих дополнительное противовоспалительное действие. Во время же ингаляционных процедур, проводимых на компрессорных ингаляционных аппаратах, помимо отрицательно заряженных частиц образуются так же и положительно заряженные частицы и частицы без заряда. Недостатком использования ультразвукового ингалятора является большой расход лекарственного средства, так как потеря препарата происходит и в фазе выдоха.
По степени дисперсности выделяют аэрозоли высокодисперсные (размер частиц 0,05-0,1 мкм.), среднедисперсные (размер частиц 0,1-1мкм) и крупнодисперсные (размер частиц более 1 мкм). Частицы диаметром 8 — 10 мкм обычно оседают в полости рта, 5 — 8 мкм в глотке и гортани, 3 – 5 мкм – в трахее и бронхах, 1 – 3 мкм в бронхиолах, 0,5 – 2 мкм – в альвеолах. Для лечения заболеваний верхних дыхательных путей преимущественно используются аэрозоли средней и низкой дисперсности.
Показания к ингаляционной терапии
Ингаляционная терапия для лечения заболеваний гортани может использоваться как монотерапия, так и в комплексе с другими методами лечения. Применение ингаляционной терапии показано пациентам с воспалительной патологией гортани, при отечных ларингитах различной этиологии, узелках голосовых складок, как симптоматическая терапия для достижения муколитического эффекта, увлажнения слизистой оболочки гортани.
Противопоказания к ингаляционной терапии
Правила проведения ингаляции
Аэрозольтерапия — основные положения.
Аэрозоли лекарственных средств обладают муколитическим, противовоспалительным, противоотечным, антибактериальным действием, способны поддерживать мукоцилиарный клиренс регулировать степень увлажнения.
В аэрозольной форме вводят антибактериальные и противогрибковые средства, ферменты, гормональные препараты, муколитики, минеральные воды, лекарственные средства растительного происхождения, биостимуляторы, биологически активные вещества.
Применение ингаляционной терапии позволяет сократить прием антибактериальных и других лекарственных средств, значительно повысить эффективность лечения, уменьшить проявление системных и побочных эффектов действия других лекарственных средств.
Одним из необходимых условий нормальной фонаторной активности голосовых складок является достаточная влажность слизистой оболочки голосовых складок. Сухость слизистой гортани может быть вызвана не только воспалительным процессом, но и побочными эффектами применения таких лекарственных препаратов, как топические кортикостериоды при бронхиальной астме, десенсибилизирующих препаратов и др. Это особенно важно для пациентов голосовых профессий. Применение ингаляционной терапии с минеральной водой или физиологическим раствором в этих случаях позволит нивелировать побочные эффекты этих лекарственных средств, улучшить качество голоса и ускорить процессы эпителизации после эндоларингеальных вмешательств.
В последнее время изменилось отношение к применению масляных ингаляций. Цель масляных ингаляций — покрыть слизистую оболочку тонким защитным и смягчающим слоем. Продолжительность масляных ингаляций составляет в среднем 5-8 минут. За 5 минут в аэрозоль превращается 0,25 г масла. По данным многочисленных исследований проведенных за последние годы установлено, что ингалируемое масло попадая в альвеолы способствует развитию альвеолитов и разрушению сурфактанта. Поэтому этот метод лечения, широко распространенный ранее, в настоящее время рекомендовано не использовать.
При проведении ингаляционной терапии необходимо соблюдение определенной последовательности применения лекарственных веществ. Наличие большого количества мокроты, корок на поверхности слизистой оболочки препятствует всасыванию ингалируемых веществ. В этих случаях лечение надо начинать с ингалирования муколитических средств и лишь после этого, через 20-30 минут, назначать аэрозоли других лекарственных препаратов. При появлении выраженной сухости слизистой оболочки ротоглотки и гортани после применения ингаляций кортикостероидами показана ингаляция с физиологическим раствором или минеральной водой для увлажнения слизистой оболочки.
При планировании ингаляционной терапии следует придерживаться принципа последовательного применения в течение суток медицинских препаратов с различной фармакологической активностью и направленностью и подбора индивидуальных схем лечения в зависимости от характера, выраженности и стадии воспаления.
Лекарственные препараты для небулайзерной аэрозолетерапии.
Антибактериальные препараты.
Высокая эффективность антибактериальных и противогрибковых препаратов при их местном применении при лечении воспалительной патологии гортани давно известна. Однако перед началом проведения ингаляции следует особенно тщательно собрать аллергологический анамнез. Известны случаи анафилактического шока во время ингаляционной процедуры с антибактериальными средствами. Ранее часто назначались ингаляции со стрептомицином, пенициллином, тетрациклином, левомицетином и олеандомицином. В настоящее время наиболее часто в практике применяются ингаляции 2 мл 0,01% раствора мирамистина или 2 мл 1% раствора диоксидина в смеси с 3 мл физиологического раствора. Высокую терапевтическую эффективность показал Флуимицил-антибиотик, который обладает еще и муколитическим эффектом. Для ингаляции используется ½ флакона препарата на ингаляцию, 2 раза в день. Возможно применение и других антибактериальных средств, которые назначают в соответствии с результатом микробиологического исследования. Длительность курса терапии в среднем составляет 5 дней.
Противогрибковые препараты
Для лечения микозов гортани кроме общей противогрибковой и противовоспалительной терапии применяются ингаляции 3000 ЕД/мл нистатина. Раствор готовится перед применением: 75 мг порошка натриевой соли нистатина в 5 мл дистиллированной воды 1 раз в сутки. Применяется так же натриевая соль леворина по 200 000 ЕД на ингаляцию. Курс лечения, как правило, длится 12-15 дней. Так же, как и при любой другой патологии гортани, ингаляции с противогрибковыми препаратами, при необходимости, чередуют с ингаляциями с протеолитическими ферментами, физиологическим раствором или минеральной водой.
Кортикостероиды.
Кортикостероиды в виде ингаляции обладают противоотечным и противовоспалительным действием. Ингаляции кортикостериодов применяются при всех воспалительных заболеваниях гортани, особенно сопровождающихся отеком слизистой оболочки. Используются смеси гидрокортизона гемисукцината 25 мг или преднизолона 15 мг или дексаметазона 2 мг в 3 мл физиологического раствора. Ингаляции назначают 2 раза в сутки. В случае выраженного отека слизистой оболочки гортани — до 4 раз в сутки. Длительность лечения зависит от динамики воспалительных изменений. При хронических воспалительных процессах курс лечения в среднем составляет 10 дней. Побочным эффектом действия этих препаратов является сухость слизистой оболочки гортани. У пациентов с воспалительными заболеваниями гортани, особенно после хирургического вмешательства, это может замедлять процесс эпителизации. В связи с этим после проведения ингаляции кортикостероида возможно проведение через 10-15 минут ингаляции физиологического раствора или минеральной воды.
Протеолитические ферменты.
Аэрозоли протеолитических ферментов обладают муколитическим эффектом, улучшают мукоцилиарный клиренс. Ферментные препараты оказывают местное противовоспалительное и противоотечное действие. Применение протеолитических ферментов в виде ингаляций особенно показано для лечения ларингитов, сопровождающихся образованием плотных фибриновых пленок или корок, при подскладковом ларингите на фоне системных заболеваний, при атрофическом ларингите.
Препараты разводят на физиологическом растворе или дистиллированной воде: Химотрипсин –3мг в 1 мл, Трипсин 3 мг в 1 мл, Химопсин 5 мг в 1 мл. Лизоцим используется в виде 0,5% раствора, на 1 ингаляцию расходуют 3-5 мл раствора. Ингаляции назначают 1-3 раза в день в течение 7 дней. Ферментные препараты могут вызывать аллергические реакции, в связи с чем применяться они должны с большой осторожностью.
Муколитики и мукорегуляторы.
Муколитики и мукорегуляторы применяются при воспалительных заболеваниях гортани с целью разжижения секрета, облегчения мукоцилиарного клиренса. Ацетилцистеин применяется в виде 20% р-ра по 2-4 мл 3-4 раза в день. В терапевтической дозировке обладает хорошим муколитическим эффектом. В высоких дозировках подавляет деятельность ресничатых клеток слизистой бронхов и мукоцилиарный клиренс. Нежелательный эффект ацетилцистеина – рефлекторный кашель из-за местного раздражения дыхательных путей. Усиливает склонность к бронхоспазму, поэтому у больных с сочетанной патологией легких рекомендовано не применять. Флуимицил антибиотик – препарат с антибактериальным и муколитическим эффектом. Применяемая дозировка: ½ флакона на 1 ингаляцию 2 раза в день. Лазолван — метаболит бромгексина, обладающий бронхосекретолитическим и отхаркивающим эффектом. Улучшает реологические свойства мокроты, уменьшает её вязкость и адгезивные свойства, нормализует мукоцилиарный клиренс. Лазолван применяется в дозировке 4 мл 2-3 раза в день, затем по 2мл 3-4 раза в день в чистом виде или в разбавлении физиологическим раствором 1:1. Курс лечения составляет 7 дней.
Для усиления муколитического эффекта и увлажнения слизистой оболочки гортани в клинике успешно применяется натрия хлорид 0,9% изотонический р-р 2-3 мл на ингаляцию, натрия гидрокарбонат 2% р-р 2-3 мл на ингаляцию. Ингаляции физиологического раствора могут применяться длительно, как симптоматическое средство при сухости слизистой оболочки гортани.
Минеральная вода
Главными составными компонентами минеральной воды являются натрий, кальций, магний, хлор, железо, радон. Иодистый калий увеличивает количество слизи, разжижает её. Углекислый магний усиливает секрецию слизи, углекислый натрий уменьшает секрецию слизи и разжижает её. Соляно-щелочные воды уменьшают чувство сухости, кашлевое раздражение. Минеральные воды, содержащие сероводород, вызывают расширение сосудов и кратковременное повышение температуры при этом активируется функция мерцательного эпителия. Применяются минеральные воды с концентрацией солей до 150 иг/л. Наилучший лечебный эффект оказывают по нашим данным оказывают среднеминерализованные воды: Ессентуки №17, Славянская.
Растительные препараты, биостимуляторы, биологически активные вещества.
В течение многих лет в терапии воспалительных заболеваний гортани успешно применяются растительные препараты, которые обладают противовоспалительным, бактерицидным, муколитическим действием. Для ингаляции допускаются только смеси лекарственных препаратов, разрешенные в РФ
Возможно применение настоя ромашки, смесь экстракта алоэ 5 мл, сока каланхоэ, подорожника, экстракта шиповника, 10% раствора белого натурального меда. Для уменьшения отечности слизистой оболочки и секреции слизи назначают ингаляции с вяжущими веществами отвар коры дуба, шалфея, настой травы зверобоя или цветов бессмертника Хороший терапевтический эффект отмечен при использовании гумизоля 2,0 и пеллоидина. Клинические данные свидетельствуют об увлажняющем и репаративном действии этих препаратов за счет улучшения микроциркуляции. При использовании многокомпонентных растительных препаратов и меда следует с особой тщательностью собирать аллергологический анамнез.
Нами разработаны схемы лечения воспалительных заболеваний гортани с применением ингаляционной терапии. Ингаляционная терапия применяется в комплексном лечении, включающем в себя антибактериальные, противовоспалительные, десенсибилизирующие средства, физиотерапию, энзимотерапию, микрохирургические вмешательства. В виде монотерапии проведение ингаляционного лечения показано при нетяжелых формах воспалительных заболеваний гортани.
Схема ингаляционной терапии острого катарального ларингита, обострения хронического катарального ларингита:
Курс лечения 7-10 дней.
Схема ингаляционной терапии острого отечного ларингита, обострения хронического отечно-полипозного ларингита:
Курс лечения при остром воспалительном процессе составляет 3-7 дней, при хроническом – 7-10 дней.
Схема ингаляционной терапии инфильтративного флегмонозного, абсцедирующего ларингита, обострения хронического гиперпластического ларингита:
Курс лечения составляет 7-10 дней. При хроническом гиперпластическом ларингите на срок до 2-3 недель назначают ингаляции с минеральной водой или физиологическим раствором 2-4 раза в сутки с целью увлажнения слизистой оболочки гортани и уменьшения вязкости секрета.
Схема ингаляционной терапии хронического субатрофического и атрофического ларингита:
Рекомендовано длительное, регулярное использование ингаляций с минеральной водой или физиологическим раствором 2-4 раза в сутки с целью увлажнения слизистой оболочки гортани и уменьшения вязкости секрета до ремиссии заболевания.
Схема ингаляционной терапии острого ларингита после перенесенного эндоларингеального вмешательства:
Курс лечение составляет 7-10 дней. При затяжном течении воспалительного процесса назначают ингаляции с физиологическим раствором или минеральной водой 2-4 раза в сутки на длительный срок.
Лечение воспалительных заболеваний гортани должно быть комплексным. При планировании терапии следует учитывать индивидуальные особенности пациента: возраст, давность заболевания, характер голосовой нагрузки, особенности профессиональной деятельности, наличие сопутствующей патологии. Только лечебная тактика, построенная на принципах индивидуального подхода, этапности, комбинированных методов лечения позволяет реабилитировать пациента с патологией гортани.