Инсулиннезависимый сахарный диабет с неврологическими осложнениями что это
Инсулиннезависимый сахарный диабет с неврологическими осложнениями что это
Этиология и встречаемость инсулиннезависимого сахарного диабета (ИНСД). Сахарный диабет — разнородная болезнь, подразделяемая на диабет I типа (ИЗСД) и II типа (ИНСД) (см. табл. С-30). ИНСД (MIM № 125853) составляет от 80 до 90% всех случаев сахарного диабета и встречается в США у 6-7% взрослых. По неизвестным пока причинам существует поразительно высокая встречаемость болезни среди американских индейцев из племени пима в Аризоне, составляющая почти 50% к возрасту 35-40 лет.
Приблизительно 5-10% пациентов с инсулиннезависимым сахарным диабетом имеют сахарный диабет взрослого типа в молодости (MODY, MIM №606391); 5-10% — редкие генетические заболевания; остальные 70-85% — «типичную форму» инсулиннезависимого сахарного диабета II типа, характеризующуюся относительным недостатком инсулина и повышенной резистентностью к нему. Молекулярная и генетическая основы типичного инсулиннезависимого сахарного диабета остаются недостаточно выясненными.
Патогенез инсулиннезависимого сахарного диабета (ИНСД)
Инсулиннезависимый сахарный диабет (ИНСД) вызван нарушением секреции инсулина и резистентностью к его действию. В норме основная секреция инсулина происходит ритмично, в ответ на нагрузку глюкозой. У больных инсулиннезависимым сахарным диабетом (ИНСД) нарушено базальное ритмическое выделение инсулина, ответ на нагрузку глюкозой неадекватный, а базальный уровень инсулина повышен, хотя относительно ниже гипергликемии.
Сначала появляется устойчивая гипергликемия и гиперинсулинемия, инициирующая развитие инсулиннезависимого сахарного диабета (ИНСД). Устойчивая гипергликемия снижает чувствительность b-клеток островков, приводя к уменьшению выброса инсулина для данного уровня глюкозы крови. Аналогично хронически повышенный базальный уровень инсулина подавляет инсулиновые рецепторы, увеличивая их резистентность к инсулину.
Кроме того, так как чувствительность к инсулину снижена, увеличивается секреция глюкагона; в результате избытка глюкагона возрастает выброс глюкозы из печени, что усиливает гипергликемию. В конце концов, этот порочный круг и приводит к инсулиннезависимому сахарному диабету.
Типичный инсулиннезависимый сахарный диабет возникает вследствие комбинации генетической предрасположенности и факторов влияния окружающей среды. Наблюдения, поддерживающие генетическую предрасположенность, включают различия в конкордантности между монозиготными и дизиготными близнецами, семейное накопление и различия в распространенности в разных популяциях.
Хотя тип наследования расценивают как многофакторный, идентификация главных генов, затрудненная влиянием возраста, пола, этнической принадлежности, физического состояния, рациона питания, курения, ожирения и распределения жира, достигла некоторых успехов.
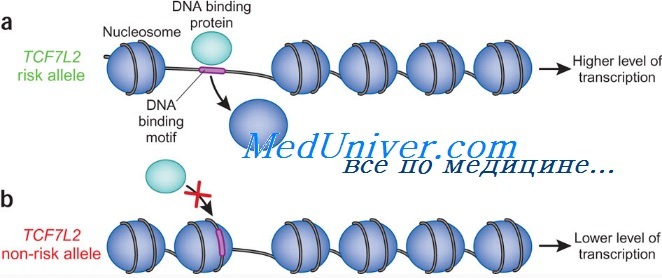
Полногеномный скрининг показал, что в исландской популяции с инсулиннезависимым сахарным диабетом тесно сцеплены полиморфные аллели коротких тандемных повторов в интроне фактора транскрипции TCF7L2. Гетерозиготы (38% популяции) и гомозиготы (7% популяции) имеют повышенный относительно неносителей риск по ИНСД приблизительно в 1,5 и 2,5 раза соответственно.
Повышенный риск у носителей варианта TCF7L2 также обнаружен в датской и американской когортах больных. Риск ИНСД, соотнесенный с этим аллелем, составляет 21%. TCF7L2 кодирует фактор транскрипции, участвующий в экспрессии гормона глюкагона, повышающего концентрацию глюкозы крови, действуя противоположно действию инсулина, снижающего уровень глюкозы крови. Скринирование финских и мексиканских групп выявило другой вариант предрасположенности, мутацию Рго12А1а в гене PPARG, очевидно, специфическую для этих популяций и обеспечивающую вплоть до 25% попу-ляционного риска ИНСД.
Более частый аллель пролина встречается с частотой 85% и вызывает незначительное увеличение риска (в 1,25 раза) сахарного диабета.
Ген PPARG — член семейства ядерных рецепторов гормонов и важен для регуляции функции и дифференцировки жировых клеток.
Подтверждение роли факторов окружающей среды включает конкордантность менее 100% у монозиготных близнецов, различия в распространении в генетически сходных популяциях и ассоциации с образом жизни, питанием, ожирением, беременностью и стрессом. Экспериментально подтверждено, что хотя предварительным условием для развития инсулиннезависимого сахарного диабета является генетическая предрасположенность, клиническая экспрессия инсулиннезависимого сахарного диабета (ИНСД) сильно зависит от влияния факторов окружающей среды.
Фенотип и развитие инсулиннезависимого сахарного диабета (ИНСД)
Обычно инсулиннезависимый сахарный диабет (ИНСД) встречается у полных людей в среднем возрасте или старше, хотя число больных детей и молодых лиц становится все большим в связи с увеличением числа полных и недостаточной подвижностью среди молодежи.
Сахарный диабет 2 типа имеет постепенное начало и обычно диагностируется по повышенному уровню глюкозы при стандартном обследовании. В отличие от больных с сахарным диабетом 1 типа, у пациентов с инсулиннезависимым сахарным диабетлм (ИНСД) обычно кетоацидоз не развивается. В основном развитие инсулиннезависимого сахарного диабета (ИНСД) подразделяется на три клинических фазы.
Сначала концентрация глюкозы крови остается нормальной, несмотря на повышенный уровень инсулина, указывая, что ткани-мишени инсулина остаются сравнительно устойчивыми к влиянию гормона. Затем, несмотря на повышенную концентрацию инсулина, развивается гипергликемия после нагрузки. Наконец, ухудшение секреции инсулина вызывает голодную гипергликемию и клиническую картину сахарного диабета.
Кроме гипергликемии, метаболические расстройства, вызванные дисфункцией b-клеток островков и резистентностью к инсулину, вызывают атеросклероз, периферическую нейропатию, почечную патологию, катаракты и ретинопатию. У одного из шести пациентов с инсулиннезависимым сахарным диабетом (ИНСД) разивается почечная недостаточность или тяжелая сосудистая патология, требующая ампутации нижних конечностей; один из пяти слепнет вследствие развития ретинопатии.
Развитие этих осложнений обусловливается генетическим фоном и качеством метаболического контроля. Хроническую гипергликемию можно выявлять определением уровня гликозилированного гемоглобина (НbА1c). Строгое, как можно более близкое к норме, поддержание концентрации глюкозы (не более 7%), с определением уровня HbA1c, уменьшает риск осложнений на 35-75% и может продлить средний ожидаемый срок жизни, составляющий в настоящее время в среднем 17 лет после установления диагноза, на несколько лет.
Особенности фенотипических проявлений инсулиннезависимого сахарного диабета:
• Возраст начала: от детства до взрослого возраста
• Гипергликемия
• Относительная недостаточность инсулина
• Резистентность к инсулину
• Ожирение
• Акантоз кожи чернеющий
Лечение инсулиннезависимого сахарного диабета (ИНСД)
Снижение массы тела, повышение физической активности и изменения диеты помогают большинству больных инсулиннезависимым сахарным диабетом (ИНСД) заметно улучшить чувствительность к инсулину. К сожалению, множество пациентов не в состоянии или не склонны радикально изменить свой образ жизни, чтобы добиться улучшения, и требуют лечения с перо-ральными гипогликемическими препаратами, например сульфонилуреатами и бигуанидами. Третий класс препаратов — тиазолидиндионы — уменьшают резистентность к инсулину, связываясь с PPARG.
Можно также использовать четвертую категорию лекарственных средств — ингибиторы а-глюкозидазы, действующие путем замедления внутрикишечного всасывания глюкозы. Каждый из этих классов лекарств одобрен как монотерапия для инсулиннезависимого сахарного диабета (ИНСД). Если один из них не останавливает развитие болезни, может быть добавлен препарат из другого класса.
Пероральные гипогликемические препараты не так эффективны в достижении контроля уровня глюкозы, как снижение массы тела, повышение физической активности и изменения диеты. Чтобы добиться контроля уровня глюкозы и уменьшить риск осложнений, некоторым больным требуется инсулинотерапия; тем не менее она усиливает резистентность к инсулину, увеличивая гиперинсулинемию и ожирение.
Риски наследования инсулиннезависимого сахарного диабета (ИНСД)
Популяционный риск инсулиннезависимого сахарного диабета (ИНСД) очень зависит от изучаемой популяции; в большинстве популяций этот риск составляет от 1 до 5%, хотя в США он равен 6-7%. Если пациент имеет больного сибса, риск возрастает до 10%; наличие больного сибса и другого родственника первой степени родства повышает риск до 20%; если болен монозиготный близнец, риск поднимается до 50-100%.
Кроме того, поскольку некоторые формы инсулиннезависимого сахарного диабета (ИНСД) пересекаются с сахарным диабетом 1 типа, дети родителей с инсулиннезависимым сахарным диабетом (ИНСД) имеют эмпирический риск 1 к 10 по развитию сахарного диабета 1 типа.
Пример инсулиннезависимого сахарного диабета. М.П., здоровый мужчина 38 лет, американский индеец племени пима, консультируется в связи с риском развития инсулиннезависимого сахарного диабета (ИНСД). Оба его родителя страдали инсулиннезависимым сахарным диабетом; отец умер в 60 лет от инфаркта миокарда, мать — в 55 лет от почечной недостаточности. Дед по отцу и одна из старших сестер также болели инсулиннезависимым сахарным диабетом, но он и его четыре младших сибса здоровы.
Данные медицинского осмотра оказались нормальными, за исключением незначительного ожирения; уровень глюкозы крови натощак в норме, однако обнаружено повышение уровня инсулина и глюкозы в крови после пероральной нагрузки глюкозой. Эти результаты соответствуют ранним проявлениям метаболического состояния, вероятно, ведущего к инсулиннезависимому сахарному диабету. Его врач посоветовал пациенту изменить образ жизни, похудеть и увеличить физическую активность. Пациент резко уменьшил употребление жира, начал ездить на работу на велосипеде и бегать три раза в неделю; его масса тела уменьшилась на 10 кг, а толерантность к глюкозе и уровень инсулина в крови пришли в норму.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Чем опасны неврологические осложнения сахарного диабета?
По распространённости сахарный диабет является лидирующим эндокринным заболеванием в мире. По данным Российской Диабетической Ассоциации, в 2016 году в мире насчитывалось около 415 миллионов диабетиков.
Сахарный диабет опасен тем, что сопровождается нарушением всех видов обмена веществ: углеводного, жирового, белкового, минерального, водно-солевого. Столь серьёзные нарушения метаболизма закономерно приводят к тяжелым осложнениям, в том числе со стороны нервной системы. Подробно о неврологических осложнениях сахарного диабета рассказала невролог калининградского медицинского центра Class Clinic Пенькова Анна Валерьевна.

Какие неврологические осложнения способен вызвать сахарный диабет и как они проявляются?
Ключевой момент в развитии осложнений диабета, в том числе и неврологических, — стойкое увеличение содержания глюкозы в крови, которое приводит к поражению сосудистой стенки. При этом страдают как крупные сосуды, так и капилляры. Наиболее развитая капиллярная сеть в нашем организме находится в почках, глазах, головном мозге, а также в конечностях. Именно эти органы являются мишенями диабета.
Когда поражаются крупные и мелкие сосуды — это вызывает увеличение их проницаемости, возникает ломкость сосудов. Легко развиваются такие явления, как тромбозы и атеросклероз. Результатом таких сосудистых нарушений со стороны нервной системы являются инсульты, а также хроническое поражение головного мозга – диабетическая энцефалопатия. Важно отметить, что при развитии диабета вероятность инсультов и других угрожающих жизни состояний возрастает многократно.
Достаточно часто при сахарном диабете повреждаются и отдельные крупные нервы в виде мононевропайтий – невропатия лицевого нерва (сопровождается параличом мимической мусклатуры), невралгия тройничного нерва (характеризуется интенсивными стреляющими болями в лице), невралгия затылочных нервов (стреляющие боли и онемения в затылочной области), невропатия локтевого, лучевого, срединного нервов верхних конечностей со слабостью и онемением в пальцах одной руки) и т.д.
Каким образом лечится диабетическая полинейропатия?
Это тот случай, когда мы можем улучшить состояние и устранить симптомы, но не можем гарантировать того, что они не вернутся, так как состояние является следствием диабета. Добиться длительной ремиссии достаточно сложно, но существуют современные способы, с помощью которых можно существенно улучшить качество жизни. Точную схему лечения в подобных случаях назначают эндокринолог и невролог, учитывая все особенности заболевания.
Важно отметить, что лечить это состояние необходимо даже при незначительных проявлениях, чтобы улучшать питание тканей и максимально замедлить процесс поражения нервов. При развитии диабета и отсутствии адекватного лечения питание тканей нарушается настолько сильно, что приводит к мгновенному присоединению вторичной инфекции, развитию незаживающих трофических язв, серьёзным последствиям даже после незначительных царапин и ссадин. Появление гангренозных поражений при диабете нередко приводит к ампутации конечностей.
Что важно помнить о симптомах диабета?
К сожалению, люди редко обращают внимание на изменения в их организме, и часто случаются ситуации, когда диагноз «сахарный диабет» ставит невролог. Типичный случай – это когда пациент обращается к неврологу по поводу зябкости в ногах и по результатам исследований ему ставят сахарный диабет. А потом пациент вспоминает, что у него давно сухость во рту, зябкость и высокая утомляемость.
При любых изменениях чувствительности конечностей, зябкости, судорогах лучше перестраховаться и обратиться к специалисту, в первую очередь — к неврологу. Наиболее ранние симптомы диабета – это жажда и сухость во рту, увеличенное количество выделяемой мочи, повышенный аппетит. Уже сочетание этих трёх симптомов должно насторожить. Появление неврологических признаков (онемение, судороги, зябкость и т.п.) на этом фоне — серьезный повод для обращения к неврологу и эндокринологу.
В тяжелых случаях, на поздних стадиях развития диабета, изменения в питании тканей и обмене веществ могут стать необратимыми. Важно понимать: чем раньше начато лечение диабетических осложнений, тем эффективнее оно будет.
Нами разработан комплекс физиотерапевтических процедур в сочетании с медикаментозной терапией для предотвращения развития осложнений сахарного диабета и для лечения уже имеющихся неврологических осложнений.
Запишитесь на приём к Анне Валерьевне Пеньковой на сайте или по телефону (4012) 33-44-55.
Поражение нервной системы при сахарном диабете: точка зрения невролога
Приведены современные представления о диабетической невропатии (ДН) как о комплексе клинических и субклинических синдромов, каждый из которых характеризуется диффузным или очаговым поражением периферических и (или) автономных нервных волокон в результате
The article gives modern ideas of diabetic neuropathy (DN) as a complex of clinical and sub-clinical syndromes. Each of them is characterized by diffusive or focal affection of peripheral and/or autonomous nerve fibers as a result of diabetes mellitus. The guidelines for doctors which allow to timely reveal diabetic affection of nervous system and/or cerebral vessels in patients, were given. Directions of DN treatment were considered.
Актуальность изучения сахарного диабета (СД) как важной медико-социальной проблемы обусловлена значительной распространенностью этого заболевания, являющегося одной из ведущих причин инвалидности и смертности населения. По мнению экспертов ООН, «диабет является хроническим, изнурительным, требующим больших расходов и сопровождающимся тяжелыми осложнениями заболеванием, которое создает большую угрозу для семей, государств-членов и всего мира» [1].
Всемирная диабетическая федерация (International Diabetes Federation, IDF) констатирует ежегодный значительный рост распространенности СД, достигшей среди взрослого населения в 2015 г. уровня 8,8% (415 млн человек), и прогнозирует дальнейшее увеличение числа больных СД — до 642 млн человек к 2040 г. По данным IDF, во всем мире число случаев смерти вследствие СД в 2015 г. составило 5 млн. В Российской Федерации, по оценке экспертов IDF, распространенность СД в 2015 г. достигла 11,1% (12 млн человек), вследствие СД в 2015 г. умерло 186 тыс. граждан РФ [2].
Эти цифры существенно отличаются от данных, полученных отечественными исследователями. Согласно Государственному регистру СД, по состоянию на 01.01.2015 г. условная распространенность СД в РФ рассчитана как 3113,9 × 10 –5 (4 млн человек), а смертность — 47,65 × 10 –5 [3]. Результаты исследования NATION свидетельствуют о том, что распространенность СД в 2015 г. среди взрослого населения РФ составила 5,4%, причем, что крайне важно, 54% обследованных не ведали, что были больны. Очевидно, что эти пациенты получали лечение по поводу диагнозов иных заболеваний или не обращались за медицинской помощью вовсе [4].
Согласно определению экспертов в области эндокринологии, сахарный диабет представляет собой группу болезней обмена, характеризующихся хронической гипергликемией, которая является результатом нарушения секреции и (или) действия инсулина. Хроническая гипергликемия при СД приводит к поражению органов и систем организма [5]. Наибольшее клиническое значение имеет нарушение зрения, функции почек, нервной и сердечно-сосудистой систем.
Классификацией ВОЗ предусмотрено выделение первого и второго типов СД, других специфических типов и гестационного СД. Развитие СД 1-го типа в настоящее время связывают в основном с деструкцией β-клеток поджелудочной железы, что обычно приводит к абсолютной инсулиновой недостаточности. СД 2-го типа считают мультифакторным заболеванием. По мнению специалистов, патологический процесс не ограничивается нарушением функции клеток поджелудочной железы, в него вовлекаются желудок, толстый и тонкий кишечник, печень, почки; имеют значение нарушение функции нейротрансмиттеров и развитие иммунного воспаления. СД 2-го типа может протекать с преимущественной инсулинорезистентностью и относительной инсулиновой недостаточностью или с преимущественным нарушением секреции инсулина с инсулинорезистентностью или без таковой. К другим специфическим типам СД относят: 1) генетические дефекты функции β-клеток; 2) генетические дефекты действия инсулина; 3) заболевания экзокринной части поджелудочной железы; 4) эндокринопатии; 5) СД, индуцированный лекарственными или химическими веществами; 6) инфекции; 7) необычные формы иммунологически опосредованного СД; 8) другие генетические синдромы, иногда сочетающиеся с СД. Среди ситуаций, когда СД может быть индуцирован лекарственными препаратами или химическими веществами, актуальным с точки зрения невролога следует отметить прием никотиновой кислоты, глюкокортикоидов, α-адреномиметиков, β-адреномиметиков, β-адреноблокаторов, тиазидов, менее часто в практике невролога может наблюдаться СД, индуцированный тиреоидными гормонами, диазоксидом, дилантином, пентамидином, вакором, α-интерфероном, препаратами для лечения ВИЧ. Описан посттрансплантационный СД. Заслуживает внимания информация о том, что СД может сочетаться с генетически детерминированными заболеваниями нервной системы (атаксия Фридрейха, хорея Гентингтона, миотоническая дистрофия Штейнерта) и хромосомными болезнями (синдром Дауна, синдром Клайнфельтера, синдром Прадера–Вилли, синдром Тернера). Ассоциированы с СД синдром Лоренса–Муна–Бидля, синдром Вольфрама, порфирия и некоторые другие заболевания [5–8].
В основе развития клинических проявлений осложнений СД лежат микроангиопатии и макроангиопатии. К диабетическим микроангиопатиям относят ретинопатию и нефропатию. Развитие диабетических макроангиопатий, способствуя прогрессированию атеросклероза, приводит к развитию ишемической болезни сердца (ИБС), заболеваний артерий нижних конечностей и, что особенно важно для неврологов, цереброваскулярных заболеваний (ЦВЗ). Перечисленные выше заболевания не являются непосредственными осложнениями СД, однако именно СД приводит к их раннему развитию, усугубляет тяжесть, ухудшает течение, видоизменяет их клинические проявления [8, 9].
Наиболее значимыми сопутствующими заболеваниями, контроль за которыми обязательно необходим при СД, считают ожирение, артериальную гипертензию, дислипидемию и хроническую сердечную недостаточность. Сочетание их с СД увеличивает риск развития нарушений мозгового кровообращения (НМК), в т. ч. прогрессирования хронических форм НМК и развития повторных острых НМК (ОНМК) [5, 10].
Отдельного внимания заслуживает поражение нервной системы, непосредственно связанное с СД, для обозначения которого наиболее часто в медицинской литературе используют термин «диабетическая невропатия». Однако трактовка его в зарубежной и отечественной медицинской литературе, в работах эндокринологов и неврологов может значительно отличаться [11–15]. С точки зрения отечественных эндокринологов, диабетическая невропатия (ДН) представляет собой комплекс клинических и субклинических синдромов, каждый из которых характеризуется диффузным или очаговым поражением периферических и (или) автономных нервных волокон в результате СД. Поражение центральной нервной системы (ЦНС) рассматривается в рамках клинических проявлений ЦВЗ [5].
Состояния, характеризующиеся сочетанным вовлечением периферической нервной системы (ПНС) и опорно-двигательного аппарата в виде прогрессирующей деструктивной артропатии с поражением одного или нескольких суставов, называют диабетической нейроостеоартропатией.
Под наименованием «синдром диабетической стопы» подразумевают патологические изменения ПНС, артериального и микроциркуляторного русла, костно-суставного аппарата стопы, представляющие непосредственную угрозу, или развитие язвенно-некротических процессов и гангрены стопы.
Кардиоваскулярная автономная невропатия (КАН), являющаяся одной из форм вегетативной ДН, представляет собой нарушение регуляции сердечной деятельности и тонуса сосудов вследствие повреждения нервных волокон вегетативной нервной системы (ВНС), что может привести к летальному исходу. Частота развития КАН у больных СД составляет около 25% [16, 17].
Для врачей общей практики и участковых терапевтов, непосредственной задачей которых является выявление и наблюдение больных СД, важно своевременно заподозрить диабетическое поражение нервной системы и (или) церебральных сосудов, поскольку распознавание этой патологии именно в ранние сроки позволяет провести коррекцию лечения и избежать серьезных осложнений, опасных для жизни пациента. Однако выполнение такой задачи может вызвать затруднения, поскольку симптомов и признаков, специфичных для диабетического поражения нервной системы, не существует, а для детальной оценки неврологического статуса требуются специальные навыки. Роль невролога в скрининге неврологической патологии у больных СД окончательно не определена. Эндокринологи активно апробируют альтернативные рутинному неврологическому осмотру способы скрининга с использованием микрофиламентов, камертона, конфокальной микроскопии роговицы и другие [5, 18].
В помощь докторам амбулаторно-поликлинических учреждений рекомендуют использовать простые скрининговые диагностические шкалы, среди которых шкала симптомов невропатии (Neuropathy Symptom Score, NSS), Мичиганский опросник для скрининга невропатии (The Michigan Neuropathy Screening Instrument, MNSI), шкала невропатического дисфункционального счета (Neuropathy Disability Score, NDS), визуально-аналоговая шкала (ВАШ) для оценки болевого синдрома.
С точки зрения неврологов, с целью скрининга осложнений, связанных с патологией ПНС, во время визита к доктору больного СД необходимо расспросить о наличии таких жалоб, как боль, стойкие нарушения чувствительности, слабость в одной или нескольких конечностях; нарушение ходьбы и неустойчивость. Нужно помнить о возможном нарушении функции отдельных черепно-мозговых нервов (ЧМН) или спинномозговых нервов (СМН), проявляющемся жалобами на двоение перед глазами, онемение и (или) асимметрию лица, нарушение глотания, стойкие нарушения чувствительности в виде полос на туловище или конечностях.
Жалобы на снижение памяти, повышенную утомляемость, снижение переносимости умственных и физических нагрузок, нарушение равновесия и координации у больных СД в отсутствии коморбидной патологии должны настораживать в отношении поражения ЦНС, ассоциированного с СД.
Увеличивают вероятность развития неврологических осложнений сведения анамнеза, указывающие на: 1) несвоевременность диагностики СД; 2) эпизоды угнетения или нарушения сознания, включая коматозные состояния; 3) коморбидные заболевания ПНС и ЦНС; 4) низкую приверженность лечению; 5) использование перечисленных выше лекарственных препаратов, способствующих развитию или усугублению клинических проявлений СД.
Для того чтобы диагностировать автономную (вегетативную) ДН, необходимо расспросить пациента о симптомах, связанных с нарушением функции сердца, мочевыделительной системы, желудочно-кишечного тракта, потоотделения, сексуальной функции [5, 8, 16, 17].
Не менее сложно решаемая задача может возникнуть в практике невролога при обращении к нему пациента с симптомами и признаками поражения ПНС неуточненной этиологии. Безусловно, одной из первых и основных этиологических версий развития полиневропатии, наряду с воздействием алкоголя, неврологи всегда выдвигают заболевание СД, однако период времени до установки диагноза СД и назначения адекватного лечения может быть весьма длительным. Поводом для обращения пациентов к неврологам нередко служат жалобы, характерные для поражения ПНС (боль и онемение, нарушение функции ходьбы). При объективном осмотре специалисты обнаруживают у них соответствующие признаки: нарушение чувствительности и (или) двигательных функций, угнетение рефлексов, атрофию мышц и другие. Нередко неврологи «случайно» выявляют клинические симптомы и признаки невропатии при активном осмотре в тех случаях, когда поводом для обращения пациента являются иные, не связанные с поражением ПНС жалобы, например, головная боль, эпизоды угнетения или нарушения сознания, снижение памяти и другие. В некоторых случаях неврологи вынуждены проводить дифференциальную диагностику на протяжении нескольких месяцев или даже лет, исключая разные причины поражения ПНС, время от времени возвращаясь к версии о СД.
Косвенными доказательствами диабетической невропатии могут быть: 1) хронологически связанные события (развитие симптомов поражения ПНС одновременно или после дебюта клинических проявлений или диагностики СД); 2) позитивный «ответ» на терапию, назначенную по поводу СД в виде регресса неврологических нарушений; 3) достоверное исключение иных причин поражения ПНС.
Особую сложность представляют ситуации, когда версия невролога о диабетическом поражении нервной системы является обоснованной (и нередко впоследствии подтверждается), но диагноз СД эндокринологом еще не установлен и больного продолжают наблюдать по поводу нарушенной толерантности к глюкозе или нарушенной гликемии натощак.
Не завершена дискуссия в отношении диагноза диабетической энцефалопатии (ДЭ). Как отдельная нозологическая форма неврологических осложнений при СД она была описана R. De Jong в 1950 г. В дебюте ДЭ обычно проявляется жалобами на общую слабость, головную боль, постоянную повышенную утомляемость, снижение работоспособности, эмоциональную лабильность и тревожность. Очаговая симптоматика тика при ДЭ складывается из глазодвигательных расстройств (анизокория, нарушения конвергенции), пирамидной недостаточности, расстройства равновесия и координации и, что особенно важно, прогрессирующей когнитивной недостаточности [19–22].
В настоящее время энцефалопатия, ассоциированная с СД, не упоминается в МКБ за исключением рубрики E16.1 Другие формы гипогликемии — «Энцефалопатия после гипогликемической комы». В ряде зарубежных и отечественных публикациях термины «диабетическая энцефалопатия» и «диабетическая центральная невропатия» используют в качестве синонимов для обозначения диабетического поражения ЦНС, а говоря о «диабетической невропатии» имеют в виду поражение ПНС при СД. В других литературных источниках употребление названия «диабетическая невропатия» подразумевает любые проявления поражения центральной и (или) периферической нервной системы, ассоциированные с СД, и предполагает выделение центральной и периферической форм [11, 12, 19, 21, 23].
Чрезвычайно важным для разработки мероприятий по профилактике и лечению диабетического поражения нервной системы является понимание патогенеза СД и его осложнений. Очевидно, что именно хроническая гипергликемия при СД является ключевым патогенетическим механизмом, устранение которого позволяет надеяться на предотвращение осложнений СД. Однако не во всех случаях интенсивный контроль и коррекция уровня глюкозы в крови позволяет добиться полного устранения метаболических и сосудистых нарушений, возникших вследствие СД, и значительного уменьшения выраженности клинических проявления невропатии, микроангиопатии и макроангиопатии.
Большинство специалистов в области биохимии представляют патогенез ДН как многостадийный процесс, включающий в себя: 1) активацию полиолового пути утилизации глюкозы, что приводит к накоплению в нервной ткани сорбитола и снижению активности протеинкиназы С; 2) неэнзиматическое гликозилирование белков; 3) нарушение обмена жирных кислот (в первую очередь дигомо-γ-линоленовой и арахидоновой); 4) нарушение синтеза нейротрофных факторов и (или) их рецепторов; 5) оксидативный стресс [11, 14, 24].
С точки зрения нейрофизиологов, в основе клинических проявлений поражения ПНС любой этиологии, в том числе при СД, лежат универсальные механизмы: атрофия и дегенерация аксона и сегментарная демиелинизация, что при обследовании может быть обнаружено соответственно в виде нарушения амплитуды и длительности М-ответа на стимуляцию нервов (аксонопатия) и снижения скорости проведения нервного импульса вплоть до развития полной блокады (миелинопатия). При СД эти механизмы могут сочетаться, однако ведущим является аксональное повреждение.
Согласно современным представлениям, важной особенностью ДН является то, что на ранних этапах развития СД повреждение нервных волокон может быть обратимым. Вместе с тем ДН считается самым частым осложнением СД и нередко является причиной нетрудоспособности, ранней инвалидизации и смерти пациентов. Сведения о частоте поражения ПНС при СД значительно варьируют (от 15% до 100%), что, очевидно, зависит от выбора метода диагностики. По данным электронейромиографии (ЭНМГ) частота выявления невропатии при СД составляет 70–90%, причем к моменту определения диагноза СД не менее чем у 25% больных уже имеются клинические проявления невропатии. Частота поражения ПНС при СД зависит от длительности, тяжести заболевания, возраста пациентов [5, 13].
Принято выделять три стадии ДН: доклиническую, клинических проявлений и осложнений. Впрочем, это деление носит весьма условный характер. Максимальный риск развития ДН имеют больные СД 1-го типа с декомпенсацией углеводного обмена спустя 3 года от дебюта заболевания, а больные СД 2-го типа — с момента диагностики заболевания [5].
Систематизация клинических форм ДН оказалась весьма сложной задачей, наиболее емкой и удобной среди них представляется классификация диабетического поражения ПНС, предложенная D. A. Greene, М. J. Brown (1987) [25]:
I. Симметричная дистальная невропатия.
II. Симметричная проксимальная моторная невропатия.
III. Локальные и множественные невропатии:
Поражение «толстых» сенсорных волокон приводит к развитию безболевой формы сенсорной ДН, что клинически проявляется нарушением глубокой чувствительности, развитием сенситивной атаксии, снижением рефлексов, формированием артропатий и трофических нарушений. Поражение «тонких» сенсорных тонких волокон влечет за собой болевую форму сенсорной ДН, которая характеризуется нейропатической болью, парестезией и гипостезией в виде «носков» и «перчаток». Поражение вегетативных волокон опосредует развитие вегетативной ДН с развитием ортостатической гипотензии и тахикардии в покое (кардиоваскулярная форма), гастропареза (гастроинтестинальная форма), дизурии и импотенции (урогенитальная форма), гипогидроза и других симптомов.
Заслуживает внимания классификация диабетического поражения ЦНС, предложенная В. М. Прихожаном (1981) [26]:
Диагноз ДН определяют клинически. Необходимо учитывать следующие критерии: 1) наличие сахарного диабета; 2) наличие симптомов и признаков поражения ПНС, наиболее часто — в виде симметричной дистальной сенсомоторной полиневропатии; 3) наличие хронической гипергликемии; 4) наличие диабетической ретинопатии или нефропатии; 5) отсутствие других неврологических заболеваний.
Больные могут быть недостаточно комплаентны. Несмотря на рекомендацию невролога они могут не обратиться к эндокринологу для подтверждения или исключения СД, но будут продолжать посещать невролога, поскольку основными жалобами будут оставаться боль, онемение или слабость в конечностях. План рутинного обследования при дифференциальной диагностике этиологии невропатии включает: 1) клинический анализ крови; 2) комплексное биохимическое исследование крови; 3) определение уровня глюкозы в крови; 4) определение уровня тиреотропного гормона (ТТГ) в крови; 5) определение уровня витамина В12 в крови [27–30]. Невролог должен хорошо ориентироваться в диагностических критериях СД и уметь определить этот диагноз (табл.) [5].
Важно помнить, что характерные для ДН жалобы отмечает только половина пациентов, у остальных заболевание протекает бессимптомно. По этой причине представляется чрезвычайно важным при первичном обращении пациента с подозрением на ДН детально описать неврологический статус, обратив особое внимание на наличие боли и нарушений болевой, температурной, вибрационной чувствительности; слабости и (или) атрофии мышц, угнетения сухожильных рефлексов; расстройств деятельности сердечно-сосудистой и мочевыделительной систем, желудочно-кишечного тракта, нарушения потоотделения и сексуальной функции.
В ряде случаев решающее значение в диагностике диабетического поражения ПНС приобретают результаты ЭНМГ. С точки зрения эндокринологов показанием для ЭНМГ является неэффективность стандартной терапии диабетической невропатии в течение 6 месяцев для выявления редко встречающихся форм поражения периферических нервов при СД или сопутствующей неврологической патологии. Однако с точки зрения нейрофизиолога решение таких задач в условиях практического здравоохранения может вызывать значительные затруднения.
Для диагностики типичной формы — диабетической сенсомоторной полиневропатии (ДСП) актуальны минимальные диагностические критерии (Toronto Diabetic Neuropathy Expert Group) [6]:
Вопросы разработки индивидуальной программы профилактики ДН, безусловно, в большей степени находятся в компетенции эндокринолога, который диагностирует СД и должен обеспечить мониторинг состояния нервной системы для своевременного обнаружения симптомов и признаков ДН. Важное значение при выполнении программы профилактики осложнений СД имеет приверженность больных к лечению. Последнее во многом зависит от сохранности когнитивных функций, которые у больных сахарным диабетом могут страдать на самых ранних стадиях. Одни специалисты склонны рассматривать это как проявление диабетической энцефалопатии, описанной выше, другие — как проявление цереброваскулярной патологии в форме хронической ишемии головного мозга на фоне диабетических макроангиопатий — фактора раннего развития и быстрого прогрессирования атеросклероза с поражением крупных и средних артерий. Поэтому важным направлением ведения больных сахарным диабетом является профилактика ЦВЗ, в том числе острых нарушений мозгового кровообращения [5, 19–22].
Стратификация сердечно-сосудистого риска при СД имеет особенности. Использование шкалы SCORE, равно как и других шкал, служащих для оценки сердечно-сосудистого риска, не рекомендуется. Все больные СД, страдающие сердечно-сосудистыми заболеваниями (ССЗ), или имеющие признаки поражения органов-мишеней, или имеющие другие факторы риска (курение, гиперхолестеринемия, артериальная гипертензия), относятся к группе крайне высокого сердечно-сосудистого риска. Большинство других больных СД (за исключением больных СД 1-го типа молодого возраста, не имеющих факторов риска) относятся к группе высокого сердечно-сосудистого риска. Основными задачами в плане профилактики ССЗ у больных СД являются модификация образа жизни и контроль факторов риска, среди которых специфическими для СД факторами риска развития инсульта считаются: 1) гипергликемия; 2) гипогликемия; 3) альбуминурия; 4) снижение скорости клубочковой фильтрации; 5) инсулинорезистентность. В диагностике ЦВЗ используют методы, общепринятые в неврологии. Профилактику макрососудистых осложнений у больных СД осуществляет эндокринолог. Целевой диапазон гликемии у больных с ЦВЗ окончательно не определен, однако, по общему мнению, при выборе схемы лечения следует избегать гипогликемий, как острых, провоцирующих развитие нарушений сердечного ритма, так и хронических, повышающих риск развития когнитивных расстройств. Рекомендованы: 1) здоровый образ жизни (отказ от курения, регулярная физическая активность); 2) снижение массы тела; коррекция АД (целевой уровень систолического АД > 120 и ≤ 140, диастолического АД > 70 и ≤ 85 мм рт. ст.; 3) коррекция дислипидемии; 4) профилактика гиперкоагуляции и тромбоза. Если ОНМК у больных СД все-таки случилось, во многих случаях необходимо изменить характер сахароснижающей терапии. Показаниями к инсулинотерапии у больных с ОНМК являются: 1) любая степень нарушения сознания; 2) дисфагия; 3) парентеральное питание, питание через зонд; 4) стойкое повышение уровня гликемии ≥ 10 ммоль/л [5].
Важным направлением в тактике ведения больных СД является учет коморбидных состояний, возможных побочных эффектов препаратов, которые могут быть назначены по поводу других состояний и могут отрицательно сказаться на эффективности лечения СД.
Успешность профилактики и лечения диабетической невропатии во многом зависит от эффективности лечения сахарного диабета и складывается из нескольких направлений. С точки зрения многих экспертов, коррекция гликемии назначением сахароснижающих препаратов — это единственный способ адекватного лечении сахарного диабета и профилактики, сдерживания и даже обратного развития диабетической невропатии. При этом основой успешного лечения ДН считают достижение и поддержание индивидуальных целевых показателей углеводного обмена [2, 5, 6].
Вопрос о патогенетическом лечении и иных возможностях профилактики ДН другими препаратами широко обсуждается в литературе. Высказывают точку зрения о том, что даже адекватная сахароснижающая, в том числе инсулинотерапия, не всегда гарантирует положительный результат в плане профилактики ДН или ее прогрессирования. Отмечают положительный эффект от назначения тиоктовой кислоты, витаминов группы В и других препаратов. Однако большинство зарубежных авторов склонны считать, что других, помимо сахароснижающих, средств с достоверно доказанным эффектом для профилактики и лечения ДН не существует [11, 13, 25, 31–33].
Второе направление служит купированию нейропатической боли, препаратами выбора являются антидепрессанты (венлафаксин, дулоксетин) или антиконвульсанты (прегабалин, габапентин). Одновременное назначение этих препаратов из разных групп вполне допустимо и нередко целесообразно, поскольку антиконвульсанты могут нивелировать нежелательные явления, обусловленные эффектами антидепрессантов. Важным является: 1) назначение точно рассчитанной адекватной терапевтической суточной и разовой дозы; 2) достаточная длительность курса — не менее 6 месяцев; 3) правильная кратность применения препаратов. Использование опиоидов для лечения болевых синдромов при ДН в РФ рекомендуют только при отсутствии эффекта от других препаратов [34–36].
Третье направление имеет целью устранение факторов риска развития как неврологических осложнений непосредственно сахарного диабета, так и ЦВЗ, опосредованных прогрессированием диабетических макроангиопатий. Его реализация регламентирована соответствующими «Порядками оказания медицинской помощи…», принятыми в нашей стране. Комплексный подход в лечении больных СД позволяет обеспечить независимость пациентов в повседневной жизни и отсрочить развитие инвалидизирующих осложнений.
Литература
О. В. Колоколов, доктор медицинских наук
ФГБОУ ВО СГМУ им. В. И. Разумовского МЗ РФ, Саратов
.gif)