Интактный миокард что это
Клинико-инструментальная характеристика некомпактного миокарда левого желудочка
УЗИ сканер HS70
Точная и уверенная диагностика. Многофункциональная ультразвуковая система для проведения исследований с экспертной диагностической точностью.
Введение
Данная величина тесно коррелирует со степенью и скоростью развития СН и имеет прогностическое значение для дальнейшего развития заболевания и возникновения осложнений.
Дифференциальная диагностика
Прогноз и предикторы неблагоприятного течения заболевания. Летальность в течение 6 лет составляет около 50%. У детей летальность около 17,1%. Предикторы неблагоприятного прогноза:
Прогноз также ухудшает наличие желудочковых тахиаритмий, что нередко является причиной внезапной сердечной смерти у больных с некомпактным миокардом, которая может быть первым и единственным проявлением НМЛЖ.
Лечение
Специфической терапии НМЛЖ не существует. Проводят симптоматическое лечение застойной СН, нарушений ритма и профилактику тромбоэмболических осложнений. В терминальных стадиях возможна трансплантация сердца.
Клиническое наблюдение
Больной Г., 1962 года рождения, поступил в экстренном порядке в приемно-диагностическое отделение с жалобами на выраженную одышку, в том числе в покое, ортопноэ, увеличение живота, уменьшение количества мочи, отеки нижних конечностей, резкую слабость при незначительной физической нагрузке. Больным себя считает в течение последнего месяца, когда появилась субфебрильная температура, стала нарастать одышка при физической нагрузке и в горизонтальном положении, появились отеки на ногах, увеличился живот. Принимал антибиотики в течение 5 дней. Температура тела нормализовалась, но самочувствие не улучшалось.
При осмотре общее состояние тяжелое. Сознание ясное. Телосложения правильного. Питания удовлетворительного. Кожные покровы бледные. Склеры субиктеричны. Видимые слизистые оболочки цианотичные. Массивные отеки нижних конечностей. Пульс 102 уд/мин, ритмичный, низкого наполнения. АД 140/80 мм рт.ст. Набухание шейных вен. Цианоз лица в горизонтальном положении. Тоны глухие, систолический шум с максимумом в точке Боткина. Частота дыхания 19 в 1 мин. Живот увеличен за счет асцита. При поверхностной пальпации напряжен.
В анализе крови обращает на себя внимание: увеличение D-димера в 24 раза. Ультразвуковое исследование органов грудной и брюшной полостей: увеличение и диффузные изменения печени. Уве ли чение и диффузные изменения поджелудочной железы. Каликоэктазия и кисты паренхимы левой почки. Свободная жидкость в брюшной полости. Двусторонний гидроторакс. Компьютерная томография: косвенные признаки тромбоэмболии мелких ветвей легочной артерии. Признаки инфарктпневмонии SX правого и левого легкого.
По данным ЭКГ имели место: синусовая тахикардия с частотой 104 уд/мин. Увеличение левого и правого предсердия. Выраженные вольтажные критерии гипертрофии ЛЖ. Вторичные изменения в миокарде ЛЖ, связанные с гипертрофией ЛЖ. Неполная блокада левой ножки пучка Гиса (QRS 110 мс).
Стенка ЛЖ в средней и верхушечной области представляет собой 2 слоя: наружный, толщиной 5,5 мм, однородной структуры (компактный миокард) и внутренний, представленный широкими трабекулами, лакунами, доходящими до компактного слоя (по типу губчатой структуры). На всем протяжении лакун регистрируется кровоток. Толщина некомпактного слоя в средней части ЛЖ до 16 мм, в области верхушки до 29 мм. На сканограммах (рис. 1-4) при хорошем уровне ультразвуковой визуализации видны четкие признаки некомпактности миокарда ЛЖ. Таким образом, имеется типичная эхокардиографическая картина НМЛЖ. Данное клинико-эхокардиографическое описание представляет собой первое клиническое выявление и описание НМЛЖ в Приволжском федеральном округе.
Рис. 1. Пятикамерная позиция при локации с верхушки.
ДИАГНОСТИКА И ЛЕЧЕНИЕ миокардита
Миокардит — это клинический синдром, для которого характерно множество возможных причин и проявлений. Полагают, что вирусная инфекция является самой частой причиной миокардита, но аналогичные изменения могут вызывать и другие инфекционные и неинфекционны
Миокардит — это клинический синдром, для которого характерно множество возможных причин и проявлений. Полагают, что вирусная инфекция является самой частой причиной миокардита, но аналогичные изменения могут вызывать и другие инфекционные и неинфекционные факторы, воздействие которых приводит к воспалительной инфильтрации между кардиомиоцитами.
Весьма разнообразны не только причинные факторы этого патологического состояния, но и его проявления. Диагноз ясен при наличии ярких и характерных признаков острой дисфункции сердца, возникшей в связи с вирусным заболеванием, но при стертой клинической картине диагностика миокардита представляет собой весьма сложную задачу.
Определение. Миокардит — это такое патологическое состояние, при котором в миокарде протекает активный воспалительный процесс с некрозом и дегенеративными изменениями кардиомиоцитов; патоморфологическая картина отличается от изменений, наблюдаемых при инфаркте. Наблюдается гибель клеток и фиброз. Воспалительная инфильтрация может быть представлена любым типом иммунных клеток, при этом гистологическая природа воспалительной реакции нередко указывает на этиологический фактор.
Заболеваемость. Трудно назвать точные цифры, касающиеся миокардита, т. к. это патологическое состояние весьма гетерогенно: в ряде случаев оно протекает скрыто и поэтому не попадает в поле зрения врачей; его хроническая форма может привести к дилатационной кардиомиопатии с манифестацией через много лет после начала заболевания.
Миокардит обнаруживается в 1—4% случаев рутинных аутопсий. В Европе и Северной Америке вирусные инфекции считаются самой частой причиной миокардитов. Кардиальная патология, по некоторым оценкам, развивается в 5% всех случаев вирусных заболеваний; при этом клинически выраженное поражение сердца, согласно крупным исследованиям, наблюдается в 0,5—5,0% случаев.
На заболеваемость оказывают влияние экстремальные факторы, среди которых возраст, а также беременность и время года. Частота миокардита высока у грудных младенцев, второй пик приходится на подростковый возраст.
Этиология. Воспалительная реакция в миокарде может возникать от ряда различных воздействий, повреждающих кардиомиоциты (см. табл.). Вирусные инфекции считаются наиболее частой причиной возникновения миокардита.
Механизмы повреждения кардиомиоцитов при вирусных инфекциях активно исследуются: в настоящее время полагают, что вирусы изменяют антигены, экспрессируемые кардиомиоцитами, поэтому, кроме непосредственной репликации возбудителя, на эти клетки оказывает повреждающее воздействие постоянно текущая клеточная иммунная реакция.
Если это так, то иммунная реакция у данного больного определяет клинические проявления инфекции.
Вирусы Коксаки А и В, энтеровирусы и вирусы гриппа — наиболее частые этиологические факторы миокардита. Приблизительно у 25—40% пациентов, инфицированных ВИЧ (вирусом иммунодефицита человека), наблюдаются признаки дисфункции сердца, которая в 10% случаев проявляется клинически.
В последнее время находит все большее признание тот факт, что патология сердца может развиваться и как отдаленное осложнение лучевой терапии, при этом повреждаются миокард, клапаны или артерии — иногда через много лет после облучения. Более совершенные методики лучевой терапии призваны защитить от таких осложнений.
Патоморфология. Непосредственное воздействие ионизирующего облучения, влияние токсина (например, при дифтерии) или реакции аутоиммунного типа (такой как при инфекции Mycoplasma pneumoniae) способны привести к повреждению кардиомиоцитов и вызвать сердечную недостаточность и нарушения ритма, при этом клиническая картина зависит от степени повреждения.
Воспаление придает миокарду бледный оттенок с редкими мелкими кровоизлияниями. При микроскопии выявляется нарушение структуры мышечных волокон из-за интерстициального отека и изолированных очагов некроза. Воспалительный инфильтрат обычно представлен лимфоцитами.
В зависимости от этиологического фактора могут обнаруживаться более специфические гистологические признаки — такие как неказеозная гранулема при саркоидозе (см. рис. 1). В дальнейшем часто происходит полное разрешение процесса без остаточного фиброза, но в некоторых случаях наблюдается фокальное заживление с интерстициальным фиброзом.
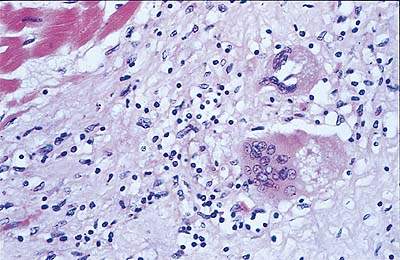 |
| Рисунок 1. Препарат биопсии миокарда при саркоидозе (окраска гематоксилином и эозином): видна воспалительная лимфоцитарная инфильтрация и неказеозная гранулема |
Клинические признаки. Клинические проявления очень разнообразны и зависят от степени дисфункции сердца и от природы этиологического фактора.
Вирусному миокардиту может предшествовать продромальная фаза с гриппоподобными симптомами, лихорадкой, болями в мышцах и суставах и высыпаниями. Между проявлением этих признаков и возникновением симптомов сердечной патологии может пройти от нескольких недель до нескольких лет. Вирус Коксаки представляется самым кардиотоксичным, особенно у детей.
Поражение миокарда впервые проявляется в виде утомляемости, одышки, болей в груди и сердцебиения, иногда в виде обмороков. Эти симптомы объясняются недостаточностью систолы и повреждением проводящей системы.
При физикальном обследовании выявляются признаки сердечной недостаточности: тахикардия (в классических случаях она выражена больше, чем можно было бы объяснить лихорадкой), ритм галопа, а в более тяжелых случаях — отек легких или периферические отеки. Размеры сердца обычно нормальные, может выслушиваться шум митральной регургитации. Иногда развивается фибрилляция предсердий. В некоторых случаях можно услышать шум трения перикарда.
Диагностика. Не существует специфических клинических признаков, на основании которых можно было бы поставить данный диагноз. Сочетание острого инфекционного заболевания и симптомов патологии миокарда дает основание заподозрить миокардит.
О патологии миокарда можно судить на основании данных ЭКГ (см. рис. 2), рентгенографии органов грудной клетки, эхокардиографии и определения уровня кардиальных ферментов. Патологические признаки на ЭКГ наблюдаются часто в виде неспецифических изменений сегмента SТ и зубца Т.
При рентгенографии органов грудной клетки выявляются признаки отека легочной ткани, сердце может быть увеличено. При эхокардиографии нередко обнаруживается дисфункция левого желудочка, причем это изменение может носить регионарный, а не диффузный характер. Неспецифические показатели воспаления: лейкоцитоз, скорость оседания эритроцитов и С-реактивный белок — также помогают поставить диагноз.
Наличие острой вирусной инфекции подтверждается при анализе мазков из зева, кала, а также на основании серологических тестов (которые могут выявить четырехкратное увеличение титра антител). Иногда удается выделить возбудитель из жидкости, взятой из полости перикарда.
Среди более сложных методов исследования можно отметить сканирование с галлием-67, которое способно выявить активный воспалительный процесс.
Некоторые специализированные центры пропагандируют биопсию миокарда.
Лечение миокардита проводится с целью:
В идеале всех больных с подозрением на поражение миокарда следует помещать в стационар и следить, насколько эффективно проводимое лечение.
Общие поддерживающие мероприятия включают постельный режим и ограничение физической активности. Эксперименты на животных ясно показали, что физическая нагрузка во время острого миокардита вредна; в период выздоровления надо рекомендовать больным ограничение занятий спортом. Это важно, учитывая, что многие пациенты, страдающие данным заболеванием, молодые люди.
В острой фазе миокардита за состоянием больных необходимо тщательно наблюдать. При застойной сердечной недостаточности эффективно обычное лечение диуретиками и ингибиторами ангиотензин-превращающего фермента, а также антикоагулянтная терапия — когда имеются признаки эмболии периферических или легочных сосудов, тяжелая желудочковая недостаточность или фибрилляция предсердий.
В некоторых случаях наблюдается клиническая картина кардиогенного шока и низкого желудочкового выброса — при этом необходима адекватная интенсивная терапия.
Может возникать аритмия, требующая специфической терапии. Изредка появляется необходимость во временном или постоянном вживлении искусственных водителей ритма. Общепризнанно, что после миокардита повышается риск внезапной кардиальной смерти, особенно у молодых пациентов.
Специфическая терапия, направленная на причинный фактор, носит ограниченный характер. Поскольку в большинстве случаев миокардит развивается на фоне вирусных инфекций и в его основе лeжaт иммунологические реакции, то в некоторых исследованиях изучалась роль антивирусной и иммунодепрессивной терапии. Многие из этих исследований плохо контролировались, и их результаты оказались неубедительными. В настоящее время нет четких данных, на основании которых можно было бы рекомендовать иммуномоделирующую терапию.
Лучше всего не назначать нестероидные противовоспалительные препараты, так как, по данным некоторых экспериментов на животных, при их применении усиливается повреждение сердца.
Большинство пациентов полностью выздоравливают без признаков остаточной кардиальной дисфункции. Эхокардиография позволяет точно и неинвазивно оценивать функцию сердца, и, по крайней мере пока работа сердца не вернется к норме, все больные должны получать ингибиторы ангиотензин-превращающего фермента.
При остаточной дисфункции миокарда требуется непрерывное лечение и наблюдение специалиста, так как в небольшом проценте случаев заболевание рецидивирует. Часто причинный фактор не удается выяснить, но когда он известен, необходимо его адекватным образом устранить.
Раджеш К. Харбанда, член Королевской коллегии врачей, Британский фонд по исследованиям сердца
Хауэрд Свонтон, доктор медицины, член Королевской коллегии врачей Больница Мидлсекса
Интактный миокард что это
В XXI в. диагноз некомпактного миокарда левого желудочка (НМЛЖ) по частоте среди всех кардиомиопатий выходит на третье место [1].
Некомпактный миокарда левого желудочка (изолированная некомпактность левого желудочка, губчатая кардиомиопатия, гипертрабекулярность левого желудочка) – одна из редких форм кардиомиопатии, которая, как правило, наследуется по аутосомно-доминантному или Х-сцепленному рецессивному типу, характеризуется повышенной трабекулярностью миокарда ЛЖ с формированием широких межтрабекулярных пространств и постепенно прогрессирующим снижением сократительной способности ЛЖ [2–4]. Данную патологию Американская ассоциация сердца относит к первичным генетическим кардиомиопатиям, а Европейское общество кардиологов и Всемирная организация здравоохранения считают, что это заболевание входит в группу неклассифицируемых кардиомиопатий [5].
На сегодняшний день НМЛЖ остается недостаточно хорошо изученной и малоизвестной патологией для большинства специалистов терапевтического звена, однако его диагностика постепенно набирает обороты, в связи с чем, на наш взгляд, следует напомнить в данном обзоре медицинским работникам об основных его клинических признаках, методах диагностики и лечения.
Цель исследования: представить обзор современной отечественной и зарубежной литературы по некомпактному миокарду левого желудочка.
Материал и методы исследования
С помощью поисково-информационных (eLibrary, PubMed, Medline, Scopus) и библиотечных баз данных проводилось изучение литературных источников (отечественных и зарубежных) за последние 10 лет по некомпактному миокарду левого желудочка.
Результаты исследования и их обсуждение
Учитывая данные современной отечественной и зарубежной литературы, в представленном обзоре рассмотрены эпидемиология, исторические аспекты, этиопатогенические механизмы развития, диагностика и лечение, а также прогноз при НМЛЖ.
Некомпактный миокарда левого желудочка, по разным литературным данным, верифицируют у 3–26 человек на 10 тыс. населения [6, 7]. Истинная частота встречаемости НМЛЖ неизвестна, что может быть обусловлено асимптомным течением заболевания. Данная кардиомиопатия встречается среди всех возрастных групп, но у взрослых реже, что, скорее всего, связано с развитием фатальных осложнений в детском и подростковом возрасте. Повышенную трабекулярность миокарда ЛЖ чаще выявляют у мужчин (в 56–82% случаев) [6, 8].
Выявляют как спорадические, так и семейные формы НМЛЖ. Семейная форма НМЛЖ встречается среди детской популяции в 40–50% случаев, а среди взрослой – в 18% случаев [9]. Данная патология может встречаться как изолированно, так и сочетаться с рядом врожденных пороков сердца (дефектом межпредсердной перегородки, дефектом межжелудочковой перегородки, стенозом легочной артерии) и/или нейромышечной патологией (метаболической миопатией, миотубулярной кардиомиопатией, дефектами лицевого черепа).
Краткий исторический экскурс
В 1932 г. S. Веllet при аутопсии новорожденного с атрезией аорты и коронарно-желудочковой фистулой выявил губчатую структуру миокарда – это было первое упоминание о НМЛЖ, затем в течение нескольких десятилетий о данной патологии не было никаких сведений. В 1960–1970 гг. в зарубежной литераторе появились публикации о сочетании гипертрабекулярности миокарда с другими патологиями сердца. Повышенная трабекулярность миокарда ЛЖ длительное время именовались верхушечной формой гипертрофической кардиомиопатии. В 1990 г. для обозначения данных изменений миокарда появляется термин «изолированная некомпактность миокарда левого желудочка», предложенный T. Chin с соавторами [9].
В основе развития НМЛЖ в настоящее время выделяют две патофизиологические теории. Первая теория связана с несовершенным эмбриогенезом, что может быть обусловлено аутосомно-доминантным типом наследования (мутации в гене в генах DTNA, локус 18q12.1-q12.2) и Х-сцепленным с полом (мутации в гене TAZ, локус Xq28), вследствие чего на 5–8-й неделе эмбрионального развития происходит сбой, нарушается процесс уплотнения рыхлой сети волокон миокарда ЛЖ и формирования коронарного кровообращения, что приводит к постоянному сообщению межтрабекулярных пространств с полостью ЛЖ и коронарными сосудами [4, 10]. Учитывая, что ген дистробревина (DTNA) играет важную роль во внутриклеточной передаче сигнала и обеспечивает мембранный каркас в мышцах, а ген тафаззина (TAZ) является компонентом мембраны мышечных клеток и участвует в морфогенезе миокарда, становятся понятными последствия мутаций в них.
Вторая патофизиологическая теория развития НМЛЖ основана на формировании повышенной трабекулярности миокарда ЛЖ на протяжении жизни пациента вследствие растяжения его с улучшением визуализации на фоне ослабленных сокращений и компенсаторной гипертрофией трабекул под действием ряда факторов (таких как микроциркуляторная дисфункция, нарушение обмена веществ и др.) [11]. В пользу данной патофизиологической теории также свидетельствует регресс гипертрабекулярности на фоне проводимого лечения [12].
По всей видимости, степень выраженности симптоматики при данном заболевании пропорционально зависит от площади некомпактности миокарда левого желудочка.
При НМЛЖ в первую очередь развивается нарушение систолической функции левого желудочка, в последующем присоединяется нарушение и диастолической функции [15]. Систолическая дисфункция левого желудочка является следствием хронической ишемии миокарда, обусловленной коронарной недостаточностью, и характеризуется снижением ударного, минутного объемов и фракции выброса, признаками левожелудочковой сердечной недостаточности. Диастолическая дисфункция левого желудочка характеризуется нарушением процессов расслабления и заполнения в результате наличия патологической трабекулярности ЛЖ, что приводит к значительному и раннему повышению конечного диастолического давления и застойным явлениям.
Развитие аритмий и нарушения проводимости при гипертрабекулярности ЛЖ, как правило, связывают с электрической нестабильностью миокарда и несостоятельностью проводящей системы сердца вследствие губчатого строения некомпактного слоя. Наиболее распространенными среди всех нарушений сердечного ритма и проводимости при данной кардиомиопатии являются пароксизмальная или постоянная желудочковая тахикардия (в 47% случаев) и фибрилляция предсердий (в 25% случаев). Наличие желудочковой аритмии является предиктором внезапной смерти, которая может быть дебютом клинической картины НМЛЖ. Несколько реже по сравнению с нарушениями ритма встречаются нарушения предсердно-желудочковой проводимости различной степени (в 26–56% случаев) [2].
В основе тромбоэмболических осложнений при НМЛЖ первостепенное значение имеет снижение скорости кровотока в области межтрабекулярных пространств, вследствие чего формируются тромбы. Процесс тромбообразования при данной кардиомиопатии становится более активным у пациентов с наличием различных нарушений ритма, прежде всего с фибрилляцией предсердий [16]. У больных с НМЛЖ тромбоэмболия по большому кругу кровообращения встречается в 21% случаев, а тромбоз полости левого желудочка – в 9% случаев [2]. По данным С. Stöllberger с соавторами (2011 г.), у 22 пациентов (15%) с НМЛЖ из 144 произошли инсульт или периферическая эмболия, у 14 из них была выявлена фибрилляция предсердий в сочетании с систолической дисфункцией или без нее [17].
Достаточно редко в клинической картине НМЛЖ выделяют ишемические проявления (инфаркт миокарда, стенокардию, безболевую ишемию), которые могут иметь место вследствие неполноценного кровоснабжения миокарда под некомпактным слоем, а также из-за смещения тромбов из межтрабекулярных пространств в коронарные артерии [18]. Подтверждением вышеописанных проявлений являются зоны субэндокардиального фиброза, различимые при магнитно-резонансной томографии сердца (МРТ сердца) при отсутствии атеросклеротического поражения сосудистого русла [19]. В соответствии с разными клиническими рекомендациями, инфаркт миокарда, развившийся на фоне НМЛЖ, будет относиться ко 2-му типу [20, 21].
В настоящее время диагностика НМЛЖ основана, в первую очередь, на допплерэхокардиографии как наиболее распространенном и доступном для населения методе исследования [22, 23]. Гипертрабекулярность в большинстве случаев локализуется в верхушечной области, межжелудочковой перегородке, боковой и нижней стенках ЛЖ, в некоторых случаях патологический процесс распространяется на правый желудочек. Однако в правом желудочке повышенная трабекулярность может встречаться и в норме, что вызывает большие сложности при ее дифференцировке от некомпактного слоя. Выделяют гипертрабекулярность изолированно ЛЖ, а также в сочетании с правым желудочком, и изолированное поражение правого желудочка, последний вариант встречается крайне редко. Впервые эхокардиографические критерии диагностики НМЛЖ предложил T. Chin с соавторами [9], в последующем они были дополнены и систематизированные R. Jenni и E. Oechslin: утолщение стенки ЛЖ за счет некомпактного слоя, в 2 превышающее толщину компактного слоя; визуализация при цветном допплеровском картировании глубоких межтрабекулярных синусов, соединяющихся с полостью ЛЖ, с множественными турбулентными потоками крови в них; отсутствие другой органической патологии структур сердца и сосудов (в случае изолированного синдрома) [2]. Трансэзофагеальная допплерэхокардиография является более достоверным методом диагностики НМЛЖ по сравнению с трансторакальной, но не так широко распространена в связи с более сложной техникой проведения. При возникновении подозрения на НМЛЖ при проведении допплерэхокардиографии с целью дифференциации от повышенной трабекулярности ЛЖ необходимо рекомендовать пациентам проведение МРТ сердца или компьютерной томографии.
Визуализировать двухслойную структуру миокарда при НМЛЖ с более высоким пространственным разрешением позволяет МРТ сердца. Сканирование в косых проекциях дает возможность выявить изменения в области верхушки ЛЖ и дифференцировать их с апикальной формой гипертрофической кардиомиопатии, декомпенсированным гипертоническим сердцем, аномальными хордами, тромбозом верхушки ЛЖ, дилатационной кардиомиопатией [24, 25]. Наиболее часто применяются два метода диагностики НМЛЖ с помощью МРТ: соотношение массы некомпактного слоя и общей массы миокарда 20% и более свидетельствует в пользу НМЛЖ (метод Jaquier с соавторами); отношение толщины некомпактного и компактного слоев более 2,3 позволяет дифференцировать НМЛЖ с повышенной трабекулярностью ЛЖ (метод Petersen с соавторами). Диагностика НМЛЖ возможна с помощью метода компьютерной томографии [26].
Кроме инструментальных методов исследования, дополнительно может проводиться генетическое картирование с целью поиска мутаций в генах DTNA (локус 18q12.1-q12.2) и TAZ (локус Xq28), характерных для НМЛЖ [10]. Наиболее распространенным является исследование мутаций в гене TAZ (локус Xq28), однако достаточно высокая стоимость анализа для большинства жителей нашей страны становится препятствием для его проведения. Помимо мутаций в вышеобозначенных генах, также известны еще около 20 генов (MYH7, MYBPC3, АСТС1, LMNA, ТРМ1 и др.), мутации в которых ответственны за развитие различных типов кардиомиопатий, в том числе и НМЛЖ. При подтверждении мутаций в генах DTNA (локус 18q12.1-q12.2) и TAZ (локус Xq28) у пациента с НМЛЖ необходимо рекомендовать проведение генетического картирования и допплерэхокардиографии его родственникам, особенно 1-й степени родства.
Остальные лабораторно-инструментальные методы исследования (острофазовые клинико-биохимические показатели, показатели липидного обмена, маркеры некроза миокарда, коронароангиография и др.) используются не для подтверждения диагноза НМЛЖ, а скорее для исключения других заболеваний, под масками которых может выступать гипертрабекулярность ЛЖ.
Дифференциальная диагностика НМЛЖ проводится чаще с дилатационной кардиомиопатией, тромбоэмболией легочной артерии, диффузным миокардитом, острым инфарктом миокарда, реже с опухолями сердца, атрезией легочной артерии, добавочными хордами и трабекулами в левом желудочке [27, 28, 29].
Пациентам с бессимптомным течением НМЛЖ показано исключительно регулярное динамическое наблюдение, кратность которого четко не обозначена. Терапия пациентов с НМЛЖ проводится с учетом основных клинических проявлений НМЛЖ в соответствии с рекомендациями по лечению [30, 31, 32,33]. Достаточно неоднозначно представляется назначение антикоагулянтов у пациентов с НМЛЖ без тромбоэмболических проявлений, в связи с чем рекомендуется ориентироваться на шкалу CHA2DS2-Vasc [34]. При наличии у пациентов с данной кардиомиопатией достоверных данных о фибрилляции предсердий, тромба левого желудочка или указаний в анамнезе на тромбоэмболические осложнения показана в течение длительного времени терапия антикоагулянтами независимо от количества баллов по шкале CHA2DS2-Vasc [35]. Из хирургических методов лечения, учитывая частое развитие стойких жизнеугрожающих аритмий, используется имплантация кардиовертер-дефибриллятора, при нарушениях атриовентрикулярной проводимости высокой степени – имплантация двухкамерного электрокардиостимулятора, а при терминальной сердечной недостаточности – трансплантация сердца, на более ранних стадиях сердечной недостаточности возможна имплантация устройств вспомогательного кровообращения длительного постоянного функционирования [11]. Спорными представляются случаи НМЛЖ при отсутствии документального подтверждения жизнеугрожающих аритмий, но наличии в анамнезе синкопальных состояний и внезапной сердечной смерти у родственников. В данных ситуациях, по всей видимости, необходимо динамическое проведение холтеровского мониторирования электрокардиограммы в течение 48–72 ч, что увеличивает шансы выявления нарушений сердечного ритма и проводимости.
Прогноз при НМЛЖ неблагоприятный, что обусловлено непрерывно прогрессирующим течением заболевания и частым развитием фатальных осложнений. У пациентов с асимптомным течением данной патологии степень неблагоприятности прогноза может пропорционально зависеть от площади некомпактности миокарда левого желудочка. Смертность, по данным разных авторов, составляет от 22% до 80% в течение 6–7 лет после постановки диагноза [2, 6]. Причинами смерти при НМЛЖ, как правило, являются терминальная сердечная недостаточность, массивная тромбоэмболия легочной артерии, желудочковые нарушения ритма.
Заключение
Некомпактный миокард левого желудочка – это сравнительно недавно выявленная патология, которую относят к первичным генетическим или неклассифицируемым кардиомиопатиям. Данная кардиомиопатия имеет низкую распространенность и неспецифическую клиническую картину, что затрудняет ее диагностику. Диагноз НМЛЖ ставится на основании допплерэхокардиографических признаков. Повышение с каждым годом доступности допплерэхокардиографии для населения и возрастание профессионализма врачей функциональной диагностики будут способствовать более частому выявлению НМЛЖ. Однако следует избегать гипердиагностики, при сомнительных случаях необходимо направлять пациентов на проведение магнитно-резонансной томографии сердца / компьютерной томографии, генетическое картирование с целью поиска мутаций в генах DTNA (локус 18q12.1-q12.2) и TAZ (локус Xq28). Высокий риск развития фатальных осложнений при НМЛЖ делает необходимыми верифицирование диагноза на ранних стадиях заболевания и соответственно проведение своевременной терапии методами консервативного и хирургического лечения.



