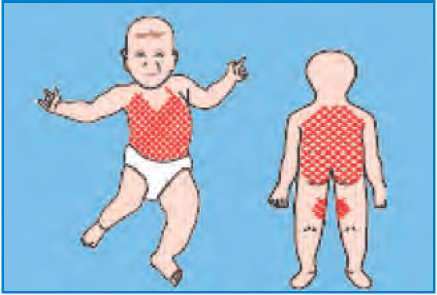
Интенсивная терапия что это в роддоме
Детская реанимация
Рождение ребенка — самое значимое и волшебное событие в жизни женщины. В преобладающем большинстве случаев после рождения ребенок нуждается преимущественно в материнской любви и заботе. Иногда же малыш может появиться на свет раньше времени или родиться с проблемой, требующей особых условий, сложного лечения с применением современных высоких перинатальных технологий. Кроме того, в процессе родов также могут возникнуть осложнения, неблагоприятно отражающиеся на состоянии младенца. В таких случаях новорожденного переводят в палату интенсивной терапии (реанимации).
Показания к переводу:
Палата интенсивной терапии в нашем роддоме расположена в непосредственной близости с родильным отделением, что в случае необходимости позволяет оказывать малышам незамедлительную интенсивную и реанимационную помощь. В палате интенсивной терапии находятся новорожденные, которые требуют особого внимания. Здесь есть все для проведения качественного контроля за состоянием и развитием маленького пациента, включая новейшее оборудование, квалифицированный персонал, понимание и любовь.
Палата интенсивной терапии оснащена самым современным оборудованием:
Все используемые приборы сертифицированы и подключены к автономной станции, что гарантирует их бесперебойную работу.
Питание наши дети получают по индивидуальной схеме — при отсутствии противопоказаний дается сцеженное молоко, в иных случаях — подбирается оптимальная смесь.
Реанимация и интенсивная терапия новорожденных с асфиксией
Общепринятого определения асфиксии новорожденного пока не существует. Наиболее информативной и объективной представляется дефиниция асфиксии, представленная Н. П. Шабаловым и соавторами (2003). Они считают асфиксией новорожденного синдром, характеризующ
Общепринятого определения асфиксии новорожденного пока не существует. Наиболее информативной и объективной представляется дефиниция асфиксии, представленная Н. П. Шабаловым и соавторами (2003). Они считают асфиксией новорожденного синдром, характеризующийся отсутствием эффективности газообмена в легких сразу после рождения, неспособность самостоятельно дышать при наличии сердцебиений и (или) других признаков живорожденности (спонтанное движение мышц, пульсация пуповины).
До середины 1980-х гг. основным критерием диагностики асфиксии была оценка по шкале Апгар, что нашло отражение в Международной классификации болезней 9-го пересмотра (1975). Однако в 1986 г. Американская академия педиатрии и Американский колледж акушеров и гинекологов на основании многочисленных катамнестических исследований пришли к заключению о том, что баллы по шкале Апгар через 1 и 5 мин после рождения слабо коррелируют как с причиной данного состояния, так и с прогнозом и сами по себе не должны рассматриваться как показатели проявления или последствия асфиксии.
В то же время при состоянии с низкой оценкой по шкале Апгар (0–3 балла), сохраняющемся в течение 15 мин, детский церебральный паралич наблюдается у 10%, а в течение 20 мин — у 60% пациентов.
Несмотря на критическое отношение к шкале Апгар и вопреки мнению о том, что она не должна рассматриваться в качестве критерия диагностики и степени тяжести асфиксии в родах (Н. П. Шабалов и соавт., 2003), целесообразо обратиться непосредственно к Международной классификации болезней 10-го пересмотра (1993).
Рубрика Р 21. Асфиксия при родах
Примечание. Эту рубрику не следует использовать при низких показателях по шкале Апгар без упоминания об асфиксии и других дыхательных расстройствах.
Р 21.0. Тяжелая асфиксия при рождении.
Пульс при рождении менее 100 уд./мин, замедляющийся или устойчивый, дыхание отсутствует или затруднено, кожа бледная, мышцы атоничны. Асфиксия с оценкой по шкале Апгар 0–3 балла через минуту после рождения. Белая асфиксия.
Р 21.1. Средняя и умеренная асфиксия при рождении.
Нормальное дыхание в течение первой минуты после рождения не установилось, но частота сердцебиений составляет 100 уд./мин или более, незначительный мышечный тонус, незначительный ответ на раздражение.
Оценка по шкале Апгар 4–7 баллов через минуту после рождения. Синяя асфиксия.
Различают также острую асфиксию, являющуюся проявлением интранатальной гипоксии, и асфиксию, развившуюся на фоне хронической внутриутробной антенатальной гипоксии.
Частота встречаемости асфиксии новорожденных, по данным различных авторов, колеблется в весьма широких пределах, что, очевидно, связано с отсутствием общепринятой дефиниции. Так, Саrter и соавторы (1993) полагают, что частота асфиксии составляет 1–1,5%. Еще в 10–15% случаев низкая оценка по шкале Апгар оказывается обусловлена кардиореспираторной депрессией. В сумме названные состояния составляют до 16,5%. Примерно такие же показатели за 2003 г. опубликованы Министерством здравоохранения и социального развития РФ. При этом летальность от асфиксии среди доношенных детей составляет 0,2%, а среди недоношенных — 1,16%.
По данным С. Г. Эзутаган (1999), частота перинатальной асфиксии у недоношенных детей составляет 30%, а у доношенных новорожденных — 20%.
Н. Н. Володин и С. О. Рогаткин (2004) сообщают, что ежегодно в мире рождаются в состоянии асфиксии 4 млн детей: 840 тыс. из них умирают, еще столько же в дальнейшем страдают от стойких нарушений функциональной деятельности центральной нервной системы.
Выделяют пять главных причин асфиксии новорожденного.
Гипоксемия, гиперкапния и связанный с ними ацидоз являются ведущими звеньями патогенеза асфиксии. Они активируют гемодинамическое перераспределение объемов крови, секрецию гормонов стрессового типа, продукцию цитокинов, молекул адгезии и факторов роста, каскадную систему плазменных протеаз. Эти же факторы после реоксигенации активируют перекисное окисление липидов клеточных мембран с образованием метаболитов арахидоновой кислоты (простагландинов и лейкотриенов) и повышением содержания клеточных метаболитов (аденозина, оксида азота, эндотелина и др.).
Напряжение кислорода в крови ниже 40 мм рт. ст. включает так называемый «ишемический рефлекс», хеморецепторный механизм которого приводит к возбуждению одновременно вазомоторного и дыхательного центров, централизации кровообращения, т. е. ишемии кожи, легких, почек, печени, желудочно-кишечного тракта, ради обеспечения жизненно важных органов (сердца, мозга, диафрагмы, надпочечников).
В процессе централизации кровообращения, кроме адреналина и норадреналина, участвуют ангиотензин II и вазопрессин.
Высокое сопротивление сосудов малого круга, поддерживаемое гипоксемией и гиперкапнией, является причиной легочной гипертензии и шунтирования крови, дыхательной недостаточности, а также перегрузки правых отделов сердца давлением, а левых отделов — объемом.
Отрицательным эффектом гипоксемии, гиперкапнии и централизации кровообращения является накопление недоокисленных продуктов и тяжелый смешанный ацидоз. Компенсаторная активация анаэробного гликолиза с накоплением лактата еще больше усиливает ацидоз. Последний крайне отрицательно влияет на системную гемодинамику, микроциркуляцию, гемореологию, водно-электролитный баланс, обменные процессы.
Нарастание гипоксии и смешанного ацидоза вызывает раскрытие прекапиллярных сфинктеров, децентрализацию кровообращения с падением артериального давления, т. е. гемодинамический коллапс, снижающий тканевую перфузию в жизненно важных органах.
В сосудах ишемизированных тканей активизируются тромбоциты, эндотелиоциты, моноциты, что приводит к активации каскада плазменных протеаз, а также освобождению клеточных ферментов, про- и антикоагулянтов, метаболитов арахидоновой кислоты, активных форм кислорода и оксида азота, которые причастны к повреждению функции органов.
Активация тромбиновой, фибринолитической, кининовой и системы комплемента ведет к эндотоксикозу продуктами протеолиза и наряду с ацидозом — к повреждению мембран клеток, митохондрий, лизосом, гематоэнцефалического барьера, повышению сосудистой проницаемости, падению сосудистого тонуса, деструкции клеток, отеку интерстициального пространства, сладж-феномену, запуску внутрисосудистого свертывания, тромбозу, блокаде микроциркуляции, дистрофическим процессам, в конечном счете — к полиорганной недостаточности.
Клинические признаки и симптомы
При асфиксии средней тяжести ребенок рождается с апноэ или с единичными гаспами, с частотой сердцебиений 90–160 уд./мин, со сниженным мышечным тонусом и рефлекторным ответом на назофарингеальный катетер, с выраженным цианозом (синяя асфиксия). Общее состояние оценивается как тяжелое или средней тяжести. В первые минуты жизни ребенок вял, быстро охлаждается. Слабо реагирует на осмотр и раздражения. Спонтанная двигательная активность низкая. Физиологические рефлексы угнетены. При аускультации сердца часто выявляют тахикардию, приглушенность тонов, акцент II тона над легочной артерией. Дыхание нередко с участием вспомогательной мускулатуры, аускультации — ослабленное, с обилием сухих и разнокалиберных влажных хрипов.
Нередко уже в первые часы жизни появляются гипервозбудимость, крупноразмашистый тремор рук, гиперстезия, спонтанный рефлекс Моро, кратковременные судороги. В то же время у некоторых пациентов нарастают клинические признаки угнетения центральной нервной системы. Динамика мышечного тонуса, физиологические рефлексы, признаки угнетения или повышенной возбудимости нервной системы весьма индивидуальны и во многом зависят от адекватности оказания помощи.
Тяжелая асфиксия характеризуется наличием при рождении признаков II или III стадии шока: дыхание отсутствует или наблюдаются неэффективные гаспы, пульс менее 100 уд./мин, кожные покровы очень бледные (белая асфиксия), мышцы атоничны, реакция на назофарингеальный катетер отсутствует, симптом «белого пятна» более 3 с, артериальная гипотония.
Общее состояние оценивается как тяжелое или крайне тяжелое.
В первые часы и дни жизни клиническая картина обусловлена полиорганной недостаточностью. Со стороны центральной нервной системы: гипоксически-ишемическая энцефалопатия, отек мозга, внутричерепные кровоизлияния, судороги.
Со стороны легких: синдром аспирации меконием, легочная гипертензия, синдром дыхательных расстройств II типа.
Со стороны сердечно-сосудистой системы: шок, гипотензия, полицитемия, гиперволемия или гиповолемия, патологическое шунтирование крови, трикуспидальная недостаточность, ишемические некрозы эндокарда/миокарда.
Со стороны выделительной системы: олигурия, острая почечная недостаточность с тромбозами сосудов почек или без них.
Со стороны желудочно-кишечного тракта: функциональная непроходимость, рвота, срыгивания, печеночные дисфункции, некротизирующий энтероколит.
Со стороны эндокринной системы: транзиторная недостаточность симпато-адреналовой системы, щитовидной железы, надпочечников.
Все это сопровождается нарушениями гомеостаза (декомпенсированный ацидоз, гипогликемия, гипокальциемия, гипоантриемия, гипомагниемия) и гемостаза (тромбоцитопения, ДВС-синдром).
Вторичный иммунодефицит, сопровождающий полиорганную недостаточность, способствует активации и генерализации внутриутробных инфекций, а также развитию госпитальных инфекций.
Диагностика и рекомендуемые клинические исследования
Критериями тяжелой асфиксии являются:
Важными критериями тяжести асфиксии являются ответ на адекватную терапию, а также течение и исход патологии в раннем неонатальном периоде, отражающие выраженность повреждения витальных функций. Следовательно, окончательно тяжесть асфиксии диагностируют не сразу после родов, а по окончании раннего неонатального периода.
Необходимый объем исследований:
В оптимальном варианте — допплерографическое определение центральной и церебральной гемодинамики.
С учетом необходимости проведения дифференциального диагноза с тяжелыми инфекционными заболеваниями показано микробиологическое, вирусологическое исследование.
Дифференциальный диагноз в первую очередь необходимо проводить со следующими состояниями:
Общие принципы лечения
Проведение реанимационных мероприятий при асфиксии новорожденных регламентируется приказом министра здравоохранения и медицинской промышленности РФ «Первичная и реанимационная помощь новорожденному в родильном зале» (1995 г.).
При оказании реанимационной помощи новорожденному необходимо строго соблюдать следующую последовательность действий:
Лекарственные средства (ЛС) при первичной реанимации назначаются при отсутствии сердцебиения и в тех случаях, когда несмотря на искусственную вентиляцию легких (ИВЛ) 100% кислородом и непрямой массаж сердца, проведенные в течение 30 с, у ребенка сохраняется брадикардия ниже 80 уд./мин.
Используются следующие ЛС: раствор адреналина гидрохлорида, препараты, восполняющие объем циркулирующей жидкости (раствор альбумина 5%, изотонический раствор натрия хлорида, раствор рингера), раствор гидрокарбоната натрия 4%.
Адреналина гидрохлорид является синтетическим аналогом адреналина надпочечников. Обладает адренопозитивным действием, оказывая стимулирующее влияние на α- и β-адренорецепторы. Инотропное кардиотоническое действие адреналина связано с воздействием на β1-адренорецепторы, локализующиеся в миокарде. Это ведет к повышению силы и частоты сердечных сокращений. Наряду с этим адреналин, воздействуя на α-адренорецепторы, повышает периферическое сосудистое сопротивление и артериальное давление крови, тем самым увеличивая коронарный кровоток и кровоснабжение миокарда.
Бронхорасширяющее действие адреналина обусловлено воздействием на β2-адренорецепторы.
Адреналин вводится новорожденным в разведении 1:10 000 в объеме 0,1–0,3 мл/кг массы тела (0,01–0,03 мг/кг) внутривенно или эндотрахеально. При введении через эндотрахеальную трубку требуется дополнительное разведение физиологическим раствором (1:1). Внутривенно адреналин вводится струйно.
В результате должно наблюдаться увеличение частоты сердечных сокращений до 100 уд./мин и выше через 30 с после введения ЛС. Если частота сердечных сокращений остается менее 100 уд./мин, следует повторить введение адреналина. При отсутствии эффекта и признаков общей кровопотери или гиповолемии необходимо ввести восполнители объема циркулирующей крови.
Показаниями к восполнению объема циркулирующей крови служат кровопотеря и гиповолемия. При этом наблюдаются следующие симптомы:
Восполнители объема циркулирующей крови (изотонический раствор натрия хлорида, раствор альбумина 5%, раствор рингера) вводятся новорожденным при первичной реанимации в вену пуповины из расчета 10 мл/кг массы тела в течение 5–10 мин.
Показания к применению гидрокарбоната натрия:
Используется 4% раствор гидрокарбоната натрия, содержащий 0,5 мэкв/мл. Назначается в дозе 2 мэкв (4 мл 4% раствора) на кг массы тела. Вводится в вену пуповины на фоне ИВЛ со скоростью не выше 1 мэкв /кг/мин.
Ожидаемый эффект: увеличение частоты сердечных сокращений до 100 и более ударов в минуту на фоне уменьшения метаболического ацидоза.
Положительный эффект от реанимационных мероприятий — в течение первых 20 мин после рождения восстанавливаются адекватное дыхание, нормальные частота сердечных сокращений и цвет кожных покровов — служит основанием к прекращению ИВЛ и непрямого массажа сердца. Однако реанимация в родильном зале является лишь первым этапом оказания помощи детям, родившимся c асфиксией.
Дальнейшее наблюдение и лечение новорожденных, перенесших асфиксию, в том числе и детей, у которых не восстановилось адекватное дыхание, наблюдаются судороги, центральный цианоз, проводится в отделении интенсивной терапии.
При внутривенном введении раствора гидрокарбоната натрия на фоне неадекватной вентиляции возможно усиление ацидоза, а избыточное введение этого ЛС ведет к гипернатриемии и риску развития внутрижелудочковых кровоизлияний.
Эффективная сердечно-легочная реанимация при асфиксии является главным фактором, улучшающим прогноз. При средней и умеренной асфиксии прогноз, как правило, благоприятный. При тяжелой асфиксии персистирующая низкая оценка по шкале Апгар (0–3 балла) на 10, 15 и 20-й минутах достаточно тесно коррелирует с неблагоприятным исходом и указывает на повышенный риск смерти (60% — у доношенных новорожденных и 50–100 % — у детей с очень малой массой тела).
Литература
А. Г. Антонов, доктор медицинских наук, профессор
НЦАГиП РАМН, Москва
Интенсивная терапия и принципы выхаживания детей с экстремально низкой и очень низкой массой тела при рождении
Министерство здравоохранения и социального развития Российской Федерации направляет методическое письмо «Интенсивная терапия и принципы выхаживания детей с экстремально низкой и очень низкой массой тела при рождении» для использования в работе руководителями органов управления здравоохранением субъектов Российской Федерации, главными врачами перинатальных центров, центров планирования семьи, родильных домов, а также для специалистов, в чьи функциональные обязанности входит оказание специализированной медицинской помощи новорожденным детям.
МЕТОДИЧЕСКОЕ ПИСЬМО
Под редакцией профессоров Е.Н. Байбариной, Д.Н. Дегтярева и директора Департамента развития медицинской помощи детям и службы родовспоможения Минздравсоцразвития России В.И. Широковой.
Заведующий кафедрой неонатологии ГБОУ «Российская медицинская академия последипломного образования» Минздравсоцразвития России, д.м.н., профессор М.С. Ефимов; заведующая отделом неонатологии ФГБУ «Ивановский научно-исследовательский институт материнства и детства имени В.Н. Городкова» Минздравсоцразвития России, д.м.н., профессор, заслуженный врач Российской Федерации Т.В. Чаша.
Переход на новые технологии выхаживания глубоко недоношенных детей, родившихся с экстремально низкой (ЭНМТ) и очень низкой массой тела (ОНМТ), является одной из приоритетных задач, поставленных перед практическим здравоохранением Правительством Российской Федерации.
Методическое письмо предназначено для специалистов, в чьи функциональные обязанности входит оказание специализированной медицинской помощи новорожденным детям.
СОДЕРЖАНИЕ
ОСОБЕННОСТИ ОКАЗАНИЯ ПЕРВИЧНОЙ РЕАНИМАЦИОННОЙ ПОМОЩИ В РОДИЛЬНОМ ЗАЛЕ
Профилактика гипотермии является одним из ключевых элементов выхаживания критически больных и глубоконедоношенных детей.
При ожидающихся преждевременных родах температура в родильном зале должна составлять 26-28С. Основные мероприятия по обеспечению тепловой защиты проводятся в первые 30 секунд жизни в рамках начальных мероприятий первичной помощи новорожденному.
Объем мероприятий профилактики гипотермии различается у недоношенных детей массой тела более 1000 г (срок гестации более 28 недель) и детей массой тела менее 1000 г (срок геста-ции менее 28 недель).
У детей, родившихся на сроке гестации более 28 недель, также как и у более зрелых новорожденных, используется стандартный объем профилактических мероприятий: обсушивание кожных покровов и обертывание в теплые сухие пеленки. Однако учитывая значительно более высокий риск гипотермии у глубоконедоношенных детей, стандартные мероприятия требуют особой тщательности выполнения. Поверхность головы ребенка дополнительно защищается от теплопотери при помощи пеленки или шапочки. На остаток пуповины накладывается зажим, обработка остатка пуповины откладывается до поступления ребенка в отделение интенсивной терапии.
Для контроля эффективности проводимых мероприятий и профилактики гипертермии всем недоношенным детям рекомендуется проводить непрерывный мониторинг температуры тела в родильном зале, а также фиксировать температуру тела ребенка при поступлении в блок интенсивной терапии.
Профилактика гипотермии в родильном зале у недоношенных новорожденных. Дифференцированный подход в зависимости от массы тела/срока гестации. Правила и техника использования полиэтиленового мешка или пленки у детей с ЭНМТ.
Профилактика гипотермии у недоношенных детей, родившихся до завершения 28-й недели гестации, предусматривает обязательное использование пластиковой пленки (пакета).
Принципы и техника использования пластикового пакета (пленки) в родильном зале
Техника использования пластикового пакета (пленки) может различаться в зависимости от типа приспособления при условии соблюдения общих принципов:
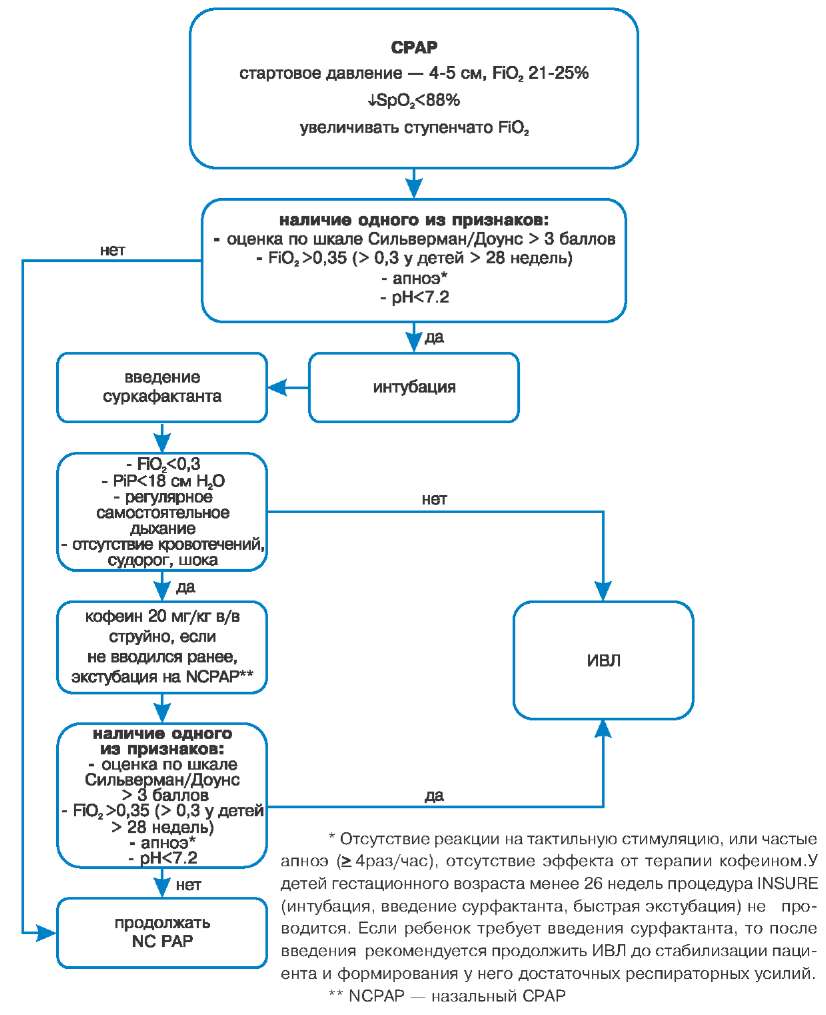
Методы респираторной стабилизации
Ранний СРАР/ РЕЕР
Создание и поддержание непрерывного положительного давления в дыхательных путях является необходимым элементом ранней стабилизации глубоконедоношенного ребенка как при нахождении на спонтанном дыхании, так и на ИВЛ. Постоянное положительное давление способствует созданию и поддержанию функциональной остаточной емкости легких, препятствует ателекта-зированию, снижает работу дыхания.
Новорожденным, которым в первую минуту жизни потребовалось проведение масочной ИВЛ в связи с отсутствием спонтанного дыхания, нерегулярным дыханием, и/или брадикардией 100.
Критериями неэффективности СРАР как стартового метода респираторной поддержки можно условно считать нарастание степени тяжести дыхательных нарушений в динамике в течение первых 10-15 минут жизни: выраженное участие вспомогательной мускулатуры, потребность в дополнительной оксигенации более 50-60%. Эти клинические признаки, как правило, свидетельствуют о тяжелом течении респираторных расстройств, что требует перевода ребенка на ИВЛ и введения сурфактанта.
Новорожденным, потребовавшим интубации трахеи в родильном зале, следует проводить ИВЛ с созданием остаточного давления в конце выдоха РЕЕР +4-5 см Н2О. Вопрос о возможности ранней экстубации и перевода на СРАР рассматривается на основании оценки респираторного статуса после транспортировки ребенка из родильного зала в палату интенсивной терапии.
Маневр «продленного раздувания легких»
В случаях, когда у недоношенного ребенка с первой минуты жизни имеются показания для проведения ИВЛ, определенными клиническими преимуществами обладает маневр «продленного раздувания легких», выполняемый до начала традиционной искусственной вентиляции. Известно, что для наиболее эффективного расправления альвеол и формирования функциональной остаточной емкости легких у недоношенных первые вдохи требуют большего давления и продолжительности, чем последующие. Маневр «продленного раздувания» представляет собой «стартовый искусственный вдох» продолжительностью 15-20с с давлением 20 см Н2О.
Маневр можно выполнить с помощью ручного или автоматического аппарата ИВЛ, при возможности у последнего задержать давление на вдохе на 10-15 секунд. Невозможно выполнить продленное раздувание с помощью дыхательного мешка.
Техника выполнения:
Особенности проведения ИВЛ в родильном зале
Необходимыми условиями для эффективной ИВЛ у глубоконедоношенных новорожденных являются:
— контроль давления в дыхательных путях;
— обязательное поддержание РЕЕР +4-6 см Н2О;
— возможность плавной регулировки доставляемой концентрации О2 от 21 до 100%;
— непрерывный мониторинг ЧСС и Sр02
Первые несколько вдохов обычно требуют более высокого среднего давления в дыхательных путях, чем последующие.
Основным показателем эффективности ИВЛ является возрастание ЧСС > 100 уд/мин.
Такие общепринятые критерии, как визуальная оценка экскурсии грудной клетки, оценка цвета кожных покровов у глубоконедоношенных детей имеют ограниченную информативность, так как не позволяют оценить степень ин-вазивности респираторной терапии. Так, хорошо видимая на глаз экскурсия грудной клетки у новорожденных с экстремально низкой массой тела с большой долей вероятности указывает на вентиляцию избыточным дыхательным объемом и высокий риск волюм-травмы.
Верификация положения интуба-ционной трубки методом аускультации у детей с экстремально низкой массой тела может представлять определенные трудности вследствие малой интенсивности дыхательных шумов и их значительной иррадиации. Использование метода капнографии в родильном зале позволяет быстрее и надежнее, чем другие способы, подтвердить корректное расположение интубационной трубки.
Терапия сурфактантом в родильном зале
Обобщая рекомендации, изложенные в методическом письме Минздравсоцраз-вития россии от 21.04.2010 г. № 15-4/10/2 3204 «Первичная и реанимационная помощь новорожденным детям», терапия сурфактантом в родильном зале показана с профилактической целью (до реализации клинических признаков респираторного дистресс-синдрома) новорожденным менее 27 недель гестации, новорожденным 27-29 недель, матери которых не получили курс антенатальной стероидной профилактики рдС, а также с ранней терапевтической целью всем новорожденным менее 32-х недель гестации, потребовавшим интубации трахеи в родильном зале в связи с развитием дыхательных нарушений*.
- *В зарубежных источниках термин «профилактическое введение сурфактанта» подразумевает все случаи введения в первые 15 минут жизни. Европейские рекомендации по ведению РДС пересмотра 2010 года предусматривают профилактическое применение сурфактанта у детей менее 26 недель гестации, а также у всех недоношенных с клиникой РДС, потребовавших интубации в родильном зале.
С профилактической целью должны использоваться препараты сурфактанта натурального происхождения. в россии для профилактики и лечения рдС препаратом выбора является порактант-альфа.
Дозировка сурфактанта
Для получения эффекта требуется введение не менее 100 мг/кг сурфактанта, хотя получены фармакологические и клинические данные, свидетельствующие о том, что сурфактант в стартовой дозе 200 мг/кг имеет более длительный период полужизни и оказывает более выраженный и быстрый эффект. в соответствии с Европейскими рекомендациями по ведению рдС у недоношенных пересмотра 2010 года, порактант-альфа в начальной дозе 200 мг/кг оказывает лучший эффект, чем порактант-альфа в дозе 100 мг/кг или берактант для лечения среднетяжелого и тяжелого рдСН.
При наличии показаний наиболее эффективным считается введение сурфак-танта в первые 15 минут жизни ребенка. в родильном зале могут использоваться два основных метода введения: через боковой порт интубационной трубки (без размыкания контура ИвЛ) и при помощи катетера, вводимого в ЭТТ с размыканием дыхательного контура. техника введения при этом практически не различается.
Техника введения сурфактанта в родильном зале
¦ Измерить длину ЭТТ.
¦ При использовании техники введения при помощи катетера — отрезать стерильными ножницами катетер на 0,51 см короче длины ЭТТ.
¦ Проверить глубину расположения Этт выше бифуркации трахеи; проконтролировать симметричность аускульта-тивной картины и отметку длины Этт у угла рта ребенка (от 6 до 7 см, в зависимости от предполагаемой массы тела).
¦ ввести сурфактант через катетер или боковой порт Этт быстро болюсно. Бо-люсное введение обеспечивает наиболее эффективное распределение сурфактанта в легких. У детей массой тела менее 750 г допустимо разделить препарат на 2 равные части, которые следует ввести одну за другой с интервалом в 1-2 минуты.
¦ Под контролем БрС^ снизить параметры ИвЛ. Снижение параметров следует проводить быстро, так как изменение эластических свойств легких после введения сурфактанта происходит уже в течение нескольких секунд, что может спровоцировать гипреоксический пик и венлитятор-ассоциированное повреждение легких. в первую очередь следует снизить давление на вдохе, затем (при необходимости) — концентрацию дополнительного О2 до минимально достаточных цифр, необходимых для достижения SpO2 91-95%. Как правило, после эффективного введения сурфактанта удается снизить давление на вдохе до 16-20 см Н20 (у крайне незрелых детей — до 14-16 см Н20), концентрацию О2 — до 21%.
Дифференцированный подход к CPAP, ИВЛ и введению сурфактанта в родильном зале
Выбор стартового метода респираторной поддержки зависит от первичного кардио-респираторного статуса недоношенного, а также от его гестационного возраста (см. табл.):
Стартовый метод респираторной терапии в зависимости от гестационного возраста
регулярное дыхание, нет
брадикардии
неэффективное дыхание
(гаспинг, нерегулярное)/ отсутствие дыхания/ брадикардия
Интубация, введение сурфактанта/ ИВЛ через ЭТТ
Продленное раздувание/ ИВЛ маской, интубация, введение сурфактанта
Продленное раздувание / ИВЛ маской
СРАР при наличии дыхательных нарушений
Продленное раздувание / ИВЛ маской
Дальнейшие шаги выполняются в зависимости от динамики кардио-респираторного статуса и определяются в соответствии с общей схемой проведения первичной реанимации новорожденных.
особенности мониторинга оксигенации крови и адекватность оксигенотерапии недоношенных новорожденных в родильном зале
«Золотым стандартом» мониторинга в родильном зале при оказании первичной и реанимационной помощи недоношенным новорожденным является мониторинг показателей ЧСС и Sa02 методом пульсоксиметрии, а также регистрация и контроль СО2 в выдыхаемом воздухе калориметрическим методом или методом капнографии.
Рекомендуется также проводить непрерывный мониторинг температуры тела (см. Профилактика гипотермии).
Регистрация ЧСС и Sa02 методом пульсоксиметрии начинается с первой минуты жизни. Пульсоксиметрический датчик устанавливается в области запястья или предплечья правой руки ребенка («предуктально») при проведении начальных мероприятий (см. Профилактика гипотермии).
После рождения ребенка соблюдение последовательности, при которой датчик вначале подсоединяется к ребенку, а затем — к включенному монитору, обеспечивает максимально быстрое выведение на экран показателей ЧСС и врй2.
Пульсоксиметрия в родильном зале имеет 3 основные точки приложения:
— Непрерывный мониторинг ЧСС начиная с первых минут жизни;
— Предупреждение гипероксии ^р02 не более 95% на любом этапе проведения реанимационных мероприятий, если ребенок получает дополнительный кислород);
— Предупреждение гипоксии ^р02 не менее 80% к 5 минуте жизни и не менее 85% к 10 минуте жизни).
оксигенотерапия у недоношенных новорожденных в зависимости от срока гестации
Изначально при нахождении ребенка любого гестационного возраста на спонтанном дыхании (в т.ч. при проведении СРАР) с ЧСС более 100 оксигено-терапия не показана.
Начиная с конца 1-й минуты у детей с ЧСС более 100, вне зависимости от наличия респираторной поддержки следует ориентироваться на показатели пульсоксиметра (см. табл.) и следовать описанному ниже алгоритму изменения концентрации О2.
Целевые показатели оксигенации крови
(по данным Sp02)
глубоко недоношенных детей в первые 10 минут жизни:
время от рождения
целевые показатели SpC>2
Алгоритм изменения концентрации дополнительного О2 под контролем показателей пульсоксиметрии.
При нахождении показателей ребенка за пределами указанных значений, следует изменять (увеличивать/ уменьшать) концентрацию дополнительного О2 ступенчато на 10-20% каждую последующую минуту до достижения целевых показателей и/или ЧСС более 100.
ПРАВИЛА ТРАНСПОРТИРОВКИ ИЗ РОДИЛЬНОГО ЗАЛА НА ПОСТ ИНТЕНСИВНОЙ ТЕРАПИИ
ПЕРВИЧНАЯ СТАБИЛИЗАЦИЯ СОСТОЯНИЯ ГЛУБОКО НЕДОНОШЕННЫХ ДЕТЕЙ С ЭНМТ И ОНМТ НА ПОСТУ ИНТЕНСИВНОЙ ТЕРАПИИ
Перечень основных медицинских мероприятий по первичной стабилизации состояния детей с ЭНМТ и ОНМТ в первые 48 часов жизни представлен в нижеследующей таблице:
Перечень медицинских мероприятий по первичной стабилизации в первые 48 ч жизни
возраст в часах
перечень мероприятий
Термометрия (кожная и ректальная); Взвешивание (предпочтительно — в инкубаторе);
Введение сурфактанта при наличии показаний (если не было выполнено в родзале);
Профилактика гипервениляции, гипероксии (контроль газов крови в первые 30 минут после поступления, SpO2 90-95%);
Сосудистый доступ: пупочный венозный катетер, по показаниям —пупочный артериальный катетер;
Контроль АД в первые 30 минут после поступления; Инфузионная терапия (раствор глюкозы 4-6 мг/(кг/мин); Предотвращение потери воды с испарением (установка влажности в инкубаторе 80-90%);
Снижение уровня сенсорной стимуляции до минимума (помещение в «гнездо», светоизолирующая накидка на инкубатор);
Эмпирическая антибактериальная терапия (антибиотик пенициллинового ряда и аминогликозид);
Малоинвазивный забор крови из венозного или артериального катетера на клинический анализ с подсчётом лейкоцитарной формулы, гемокультуру до назначения антибактериальной терапии.
первые 24-48 ч жизни
Стабилизация гемодинамики: мониторинг АД, введение вазопрессоров по показаниям. Оценка гемодинамического значения ОАП;
Респираторная терапия: повторное введение сурфактанта (по показаниям); диагностическая рентгенография грудной клетки, верификация положения эндотрахеальной трубки, сосудистых катетеров; ИВЛ низким дыхательным объёмом 4-6 мл/кг; профилактика гипервентиляции, гипероксии. При наличии регулярного СД — ранняя экстубация с переводом на назальный CPAP;
Назначение кофеина в дозе насыщения 20 мг/кг с переходом на поддерживающую дозу 5-10 мг/кг на 2-е сутки жизни;
Поддержание баланса жидкости и электролитов: взвешивание каждые 12-24 ч; определение содержания электролитов каждые 12 часов, глюкозы — 4-8 ч; предотвращение потерь воды с испарением;
Контроль гематологических показателей: повторный клинический анализ крови; СРБ, ПКТ, определение концентрации билирубина; проведение фототерапии при показателе более 70 ммоль/л. Трансфузия эритроцитов при гемоглобине менее 130;
Профилактика инфекционных осложнений: уточнение адекватности проводимой антибиотикотерапии (на основании полученных клинических и лабораторных данных);
Нутритивная поддержка: введение аминокислот с 12 часов жизни в дозе 1-2 г/кг и жировых эмульсий с 24-х часов жизни в дозе 1 г/кг;
Охранительный режим: минимум сенсорной стимуляции (свет, шум, боль, тактильный контакт);
Социальные контакты: посещение родителями;
Выполнение эхограммы головного мозга;
УЗИ внутренних органов.
ПОДДЕРЖАНИЕ ТЕРМОНЕЙТРАЛЬНОГО ОКРУЖЕНИЯ
Создание термонейтрального окружения, при котором теплообмен осуществляется с минимальными затратами энергии и кислорода, является необходимым условием выживания новорожденных с ЭНМТ, так как резервы теплопродукции у них крайне невелики, а последствия гипотермии подчас катастрофичны.
Для выхаживания детей с ОНМТ и ЭНМТ используются инкубаторы с функциями сервоконтроля температуры и влажности. Индикатором адекватной терморегуляции у недоношенного считается аксиллярная температура в пределах 36,3-36,9 С.
После созревания эпидермального барьера, скорость которого находится в прямой зависимости от срока гестации и от температурно-влажностного режима выхаживания, дополнительное увлажнение инкубатора обычно не требуется. Следует помнить, что длительное поддержание высокой влажности в инкубаторе замедляет процесс созревания эпидермиса и создаёт условия для колонизации кожи госпитальными микроорганизмами.
Режим и длительность дополнительного увлажнения воздуха в инкубаторе у новорожденных различного гестационного возраста:
Гестационный возраст
2 : 19-23 мм.рт.ст. (2,5-3 kPa) и spC2 = 65-70 %.
Пульсоксиметрия
— удобный неинвазивный метод мониторинга, дающий непрерывную информацию о насыщении гемоглобина кислородом (sp02) и частоте пульса. Однако у этого метода есть существенные недостатки, о которых необходимо помнить. Степень оксигенации крови отражает величина напряжения кислорода в крови p02(a). sp02 зависит от напряжения кислорода в крови p02(a), и эту зависимость определяет кривая диссоциации оксигемоглобина (см рис.). Нормальные физиологические значения сатурации приходятся на пологую часть этой кривой, поэтому существенные изменения напряжения кислорода сопровождаются лишь незначительным изменением сатурации. Другими словами, sp02 дает лишь весьма приблизительное представление о концентрации кислорода в крови, что подтверждено обширными клиническими исследованиями.
Высокая частота ложных тревог снижает внимание персонала и может привести к тому, что реакция на серьезное ухудшение состояния будет несвоевременной.
В современных пульсоксиметрах используется алгоритм обработки сигнала Masimo SET, позволяющий нивелировать погрешности, вызванные двигательными артефактами, венозной пульсацией и недостаточной периферической перфузией.
Один из основных недостатков пульсоксиметрии — неспособность адекватно отражать степень гипероксии. Это объясняется тем, что при высоких цифрах РаО2 кривая диссоциации гемоглобина имеет пологий ход. По этой причине показателю SрО2= 95% могут соответствовать значения РаО2 в артериальной крови от 60 мм рт ст до 160 мм рт. ст, что потенциально опасно в плане возникновения недиагносцированной гипероксии.
При интерпретации данных, полученных при пульсоксиметрии, во избежание ошибок, необходимо:
—оценивать данные применительно к конкретной клинической ситуации;
—учитывать вероятные технические артефакты и погрешности;
—обращать внимание на форму плетизмограммы и наличие на ней патологических зубцов и дополнительных волн;
—при несоответствии клинического статуса и показателей прибора определить оксигенацию в артериальной крови инвазивно;
—у пациентов, находящихся в отделениях реанимации в критическом состоянии, пульсоксиметрия не должна оставаться единственным методом для определения оксигенации крови.
Мониторинг CO2 в конце выдоха (EtCO2) — капнография
Основной принцип капнографии заключается в том, что молекулы СО2 поглощают инфракрасное (ИК) излучение со специфическими длинами волн. Кап-нограф имеет специальные фотодетекторы, которые настроены на эти волны и позволяют вычислить содержание СО2 в образце выдыхаемого воздуха.
В современных капнографах используется излучатель, генерирующий сфокусированный поток ИК-излучения, что позволяет применять маленькие ячейки для проб выдыхаемого воздуха, что, в свою очередь, повышает точность измерений.
Этот метод в настоящее время может использоваться даже у недоношенных новорожденных с ОНМТ и ЭНМТ, поскольку мертвое пространство современных датчиков капнографии уменьшено (0,5 мл). Капнография может использоваться только у новорожденных не требующих респираторной поддержки или у интубированных пациентов, но не может быть применен у новорожденных на nCPAP. К тому же этот метод не позволяет оценить оксигена-цию, т.к. не измеряет p02.
Оценивая форму капнографической волны можно быстро диагностировать гипо- и гипервентиляцию, перегиб или смещение эндотрахеальной трубки, ее обструкцию или отсоединение пациента от респиратора. У неинтубированных новорожденных причиной внезапного исчезновения волны и снижения EtC02 до нуля может быть апноэ, поверхностное дыхание (вентиляция мертвого пространства), полная обструкция ВДП, перегиб или смещение назальной канюли.
Транскутанный мониторинг pO2 и pCO2
Транскутанное измерение p02 и pC02 основано на нагревании кожи под электродом, что увеличивает диффузию газов через неё. Увеличение температуры повышает парциальное давление газов в зависимости от температуры электрода. Электрод измеряет парциальное давление газов в подлежащей ткани, а не парциальное давление газов в артериальной крови.
Снижающиеся в динамике величины tcp02 — ранние маркеры нарушения циркуляции, приводящие к ухудшению доставки кислорода к тканям.
Транскутанный мониторинг pCC2
Поскольку различие между артериальными и венозными величинами pC02 незначительно и углекислый газ диффундирует через ткани легче, чем кислород, циркуляторный статус оказывает меньшее влияние на tcpC02, чем на tcp02. Величины tcpC02, скорректированные на 37°C с учетом интенсивности метаболизма, обычно близки к артериальным величинам pC02.
Транскутанный мониторинг tcp02/tcpC02 должен применяться у новорождённых всегда, когда есть риск внезапных изменений вентиляции (pC02) или оксигенации (p02), например, при следующих состояниях:
—асфиксия, кровоизлияния в герминативный матрикс, менингит или родовая травма;
—респираторный дистресс-синдром (РДС);
—персистирующая легочная гипер-тензия или пневмоторакс;
—проведение заместительной терапии экзогенными сурфактантами;
—проведение новорожденным различных видов искусственной вентиляции и других видов дыхательной поддержки, в том числе назального СРАР и неинвазивной ИВЛ;
—во время отлучения от вентиляции или изменения ее стратегии;
—после экстубации.
Особенности практического применения транскутанного мониторинга
Транскутанный комбинированный электрод объединяет кислородный датчик Кларка и датчик углекислого газа Северингауза. После быстрой автоматической калибровки, электрод подсоединяется к пациенту. Непрерывный мониторинг возможен после короткого времени стабилизации показаний электрода. Это обстоятельство создает некоторые сложности использования транскутанного мониторинга p02 и pC02 по сравнению с использованием пульс-оксиметра. Поэтому важно соблюдать инструкцию по применению приборов.
Традиционно существует настороженность относительно транскутанных электродов, поскольку они могут вызвать чрезмерное нагревание кожи и ожог, а также некроз вследствие давления на кожу. Эти риски могут быть устранены или минимизированы при использовании следующих советов: чем тоньше кожа (т.е., чем меньше зрелость новорожденного), тем ниже должна быть температура электрода. Например, для взрослых и детей старшего возраста рекомендуется температура электрода 44°C. Температура электрода 43,5°C считается достаточной для доношенных новорождённых, температура 42°C используется, в основном, у недоношенных новорожденных с очень низкой и экстремально низкой массой тела (см табл.) Чем ниже температура, тем меньше риск ожога кожи. При более низких температурах электрода потребуется более длительное время для стабилизации показателей, а различие между артериальным и транску-танным парциальным напряжением кислорода будет больше.
Во время нахождения электрода на коже ребенка не должно быть никакого прямого давления на него. Ребенок не должен лежать на электроде. Обе вышеупомянутые ситуации могут привести к неправильным показаниям электрода и вызвать ожог или некроз кожи.
В редких случаях использование транскутанных мониторов у новорожденных не желательно. К ним относятся некоторые дерматологические проблемы или отек кожи, как, например, при водянке.
Рекомендуемая температура электрода и время измерения для TCM 4/40
Масса тела при рождении
Рекомендуемая температура датчика
Время измерения
Метаболический коррекционный фактор
Примечание: у пациентов с функционирующим артериальным протоком и сбросом крови справа налево tcp02 будет выше на верхней части грудной клетки, чем на нижней части туловища. У этих пациентов датчик должен быть размещен на нижней части спины, на животе или бедре.
Время, необходимое для стабилизации показателя tcpC02 после аппликации датчика на коже новорожденного при условии удовлетворительной гемодинамики пациента, составляет приблизительно от 3 до 7 минут; чтобы получить надежные показания tcp02 необходимо от 10 до 20 минут. Функция дополнительного нагрева кожи
(SmartHeat), в течение 5 минут повышающая температуру датчика на 1°C относительно установленной, может незначительно уменьшить это время, но рекомендуется применять лишь новорожденным массой тела более 1000 граммов. Показатели tcp02/tcpC02 считаются надежными, если они не меняются более чем ± 2 mmHg в течение 1 минуты.
Расположение датчиков у новорожденных
У новорождённых очень тонкая кожа, которая позволяет размещать датчик даже на спине (см рис.). В то же время, она более уязвима для воздействия высокой температуры. Поэтому важно или снижать температуру датчика или менять его расположение на коже более часто, особенно у новорожденных с очень низкой и экстремально низкой массой тела. Следует обязательно протереть датчик и фиксирующее кольцо и снова наполнить его контактной жидкостью перед использованием. Фиксирующие кольца должны использоваться не более 12-24 часов, в зависимости от состояния кожи казателей tcp02 и tcpC02 по результатам анализа газов артериальной крови. В результате показатели tcp02/tcpC02 приближаются к реальным значениям в артериальной крови, однако это не означает, что прибор показывает именно артериальные p02 и pC02. Корректировка осуществляется чисто арифметически, поэтому ее необходимо обновлять при следующем анализе проб артериальной крови.
Наиболее объективным методом мониторинга газового состава крови является комбинация чрезкожного измерения tcp02 и определения уровня насыщения гемоглобина кислородом (пульсоксиметрия) с периодическим взятием проб артериальной крови для определения концентрации газов и лак-тата. Пульсоксиметрия обеспечивает быструю реакцию на изменения в поглощении и транспорте кислорода. Величина tcp02 предоставляет информацию о доставке кислорода к тканям. Пробы артериальной крови необходимы для коррекции показателей, измеренных неинвазивно, и формирования более четкого представления о газовом гомеостазе пациента.
Примечания:
— не следует применять калибровку in vivo у гемодинамически нестабильных пациентов, т.к. разница между чрескожными значениями и концентрацией газов в артериальной крови может значительно колебаться;
— можно применять калибровку in vivo по значениям капиллярной (артериализованной) крови, но следует учитывать значительное отличие показателей p02 и pC02 капиллярной и артериальной крови.
— иногда применяется калибровка in vivo по значениям венозной пробы, но она проводится только для параметра pC02, т.к. показатели p02 артериальной и венозной крови отличаются значительно.
Участки кожи новорожденного пригодные для фиксации датчика
Калибровка датчика in vivo
Данный вид калибровки рекомендуется применять с целью коррекции по-
Референтные значения КОС, pO2 и pCO2 артериальной, смешанной венозной и венозной крови у новорожденных детей, измеренные инвазивным способом представлены в нижеследующих таблицах
Референтные значения КОС, газов капиллярной крови у новорожденных:
показатели.
среднее
2.5%-иль
97.5%-иль
Референтные значения КОС, pO2 и pCO2 артериальной, смешанной венозной и венозной крови у новорожденных детей:
показатели
артериальная кровь
смешанная венозная кровь
венозная кровь
p02 (mm Hg) снижается с возрастом
Избыток оснований (дефицит/избыток)
Разница показателей КОС, pO2 и pCO2 артериальной и венозной крови у новорожденных:
артериаль
ная кровь
АВ разница
венозная кровь
ОБЕСПЕЧЕНИЕ ДОСТУПА К СОСУДИСТОМУ РУСЛУ
Если ребёнку проводят вспомогательную ИВЛ и есть необходимость частых исследований газового состава артериальной крови, целесообразно установить пупочный артериальный катетер. Следует помнить, что постановка пупочного артериального катетера у детей с ЭНМТ и ОНМТ требует навыка и должна выполняться опытным неонатологом. Обязательным условием применения пупочных катетеров является немедленная (в течение часа) рентгенологическая верификация положения катетера.
Периферический сосудистый доступ для забора крови на лабораторные анализы, проведения лекарственной и инфузионной терапии используется ор-ганиченно, поскольку такой подход способствует защите целостности кожного покрова, уменьшению болезненности манипуляций и соответствует концепции охранительного режима.
В первые дни жизни наиболее оправдан сосудистый доступ через сосуды пуповины, так как он технически прост, малотравматичен, обеспечивает возможность неинвазивных заборов крови и инфузии любых сред.
ПОДДЕРЖАНИЕ БАЛАНСА ЖИДКОСТИ И ЭЛЕКТРОЛИТОВ
Новорождённые с ЭНМТ и ОНМТ предрасположены к значительным потерям жидкости вследствие повышенного испарения через кожу и респираторный тракт, низкой концентрационной способности почек, сниженной толерантности к инфузии растворов глюкозы, вследствие чего часто возникает гипергликемия и осмотический диурез. Возникающая в результате гипертоническая дегидратация — один из основных факторов риска ВЖК.
Согласно литературным данным, величина транзиторной потери массы тела у глубоконедоношенных новорождённых варьирует в пределах 5-25% и зависит не столько от степени зрелости, сколько от условий выхаживания и объёма инфузионной терапии. В повседневной практике следует стремиться к тому, чтобы максимальные потери массы тела у детей с ЭНМТ в первую неделю жизни не превышали 10-15%.
Долженствующий объём жидкости в первую неделю жизни детей с ЭНМТ рассчитывают, исходя из предполагаемой величины неощутимых потерь, диуреза, потерь воды со стулом. Ориентировочные потребности в жидкости детей с ЭНМТ (см. табл.) на первой неделе жизни, выхаживание которых проводят в условиях кувеза, представлены в табл. Начиная со 2-3-й недели жизни к этим цифрам прибавляют 15-30 мл/кг на обеспечение прибавки массы тела.
Основная причина повышенной потребности в жидкости детей с ЭНМТ в первые дни жизни — большая величина неощутимых потерь жидкости, причина которых — увеличение соотношения площади поверхности тела к весу и несостоятельная барьерная функция эпидермиса.
Величина неощутимых потерь жидкости напрямую зависит от гестацион-ного возраста (чем меньше гестационный возраст, тем больше неощутимые потери жидкости) и от пост-натального возраста (по мере созревания барьерной функции кожи величина неощутимых потерь жидкости снижается).
Ежесуточная потребность в жидкости существенно изменяется, если имеется дополнительный источник патологических потерь жидкости, имеются факторы, изменяющие величину неощутимых потерь жидкости, диурез превышает 2,5-5 мл/(кг/ч).
Ориентировочные потребности детей с ЭНМТ в жидкости:
Количество выводимой жидкости,
мл/(кг/сут)
Количество необходимой жидкости мл/кг/сут
1-е
сутки жизни
2-3
сутки жизни
4-5-е
сутки жизни
6-7-е
сутки жизни
Неощутимые потери жидкости
При недостаточной влажности окружающего воздуха потребность в жидкости и объём необходимой инфузионной терапии у новорождённых с ЭНМТ возрастают.
Как и у других категорий новорождённых, для оценки водно-электролитного баланса у детей с ЭНМТ в обязательном порядке оценивают почасовой диурез, динамику массы тела и уровень сывороточного натрия (наиболее чувствительный индикатор гипертонической дегидратации).
В первую неделю массу тела ребёнка следует измерять каждые 12 ч, хотя в отдельных клинических ситуациях (крайняя степень тяжести состояния ребёнка при отсутствии встроенных в кювез весов) может послужить поводом для отказа от частых взвешиваний при условии адекватного увлажнения воздуха и контроля почасового диуреза.
Сывороточный уровень электролитов у новорождённых с ЭНМТ подвержен резким значительным колебаниям, что требует регулярного (каждые 24-48 ч) контроля и своевременной коррекции. Сразу после рождения скорость клубоч-ковой фильтрации и фракционная экскреция натрия снижены, вследствие чего возникает олигурия. В первые 2448 ч новорождённые с ЭНМТ, как правило, не нуждаются в назначении препаратов калия, натрия и хлора.
ЭНТЕРАЛЬНОЕ И ПАРЕНТЕРАЛЬНОЕ ПИТАНИЕ ДЕТЕЙ С ЭНМТ И ОНМТ
Обобщенные рекомендации по проведению полного парентерального питания новорожденным с ЭНМТ и ОНМТ
При проведении парентерального питания еще совсем недавно доминировала стратегия так называемой «традиционной дотации нутриентов», предусматривающая начало поступления аминокислот со 2-3 суток жизни с последующим добавлением жировых эмульсий и постепенное (в течение первой недели жизни) достижение конечных целевых значений поступления всех нут-риентов, не отвечающее затратам недоношенного ребенка на пластические и энергетические нужды. Возникающий при этом дефицит нутриентов способен привести к задержке роста и нарушению формирования ЦНС.
Чтобы избежать указанных недостатков и добиться внутриутробной скорости роста у глубоконедоношенного ребенка, в последние годы используется стратегия «форсированной дотации нут-риентов», основные принципы которой изложены ниже.
Энтеральное питание
Признаки, свидетельствующие о готовности ребенка с ЭНМТ к энтераль-ному питанию, включают в себя: отсутствие вздутия живота, наличие перистальтики, отсутствие желчи в желудочном содержимом, отсутствие признаков желудочного кровотечения.
Противопоказаниями к раннему началу энтерального питания являются: шок, желудочное кровотечение, подозрение на атрезию пищевода и другиепороки развития, несовместимые с эн-теральным вскармливанием.
Наличие прокрашивания желудочного содержимого желчью или зеленью без других признаков непереносимости питания не является противопоказанием к началу и наращиванию объема энтерального питания.
Допустимый объем остаточного содержимого желудка определяется как объем, поступающий в течение одного часа капельного кормления (или 50% объема одного кормления). Измерение объема остаточного содержимого при капельном кормлении проводится через 1 час с момента прекращения инфузии.
Оптимальным субстратом для энтерального питания ЭНМТ является натив-ное материнское молоко. Среди преимуществ нативного молока можно отметить: более быструю эвакуацию из желудка, лучшее всасывание жиров, большую частоту стула, снижение риска возникновения сепсиса и некротизирую-щего энтероколита, лучшее психомоторное и интеллектуальное развитие новорожденных. Необходимым условием использования нативного материнского молока у детей с ОНМТ и ЭНМТ является его мультикомпонентное обогащение.
При отсутствии материнского молока рекомендуется специализированная смесь для недоношенных.
В последние годы широкое распространение получила двухэтапная система искусственного вскармливания глубоконедоношенных новорожденных,
Примерный протокол энтерального питания новорожденных с ЭНМТ
Рекомендации для новорожденных массой тела легких и реализации РДС. _
Алгоритм респираторной поддержки детей с ЭНМТ
Уход за детьми на СДППД
Традиционная ИВЛ
Стратегия «защиты легких» заключается в поддержании альвеол в расправленном состоянии на всем протяжении дыхательной терапии. С этой целью устанавливается РЕЕР 4-5 см Н2О. Второй принцип стратегии «защиты легких» заключается в дотации минимально достаточного дыхательного объема, что предотвращает волютравму. Для этого следует подбирать пиковое давление под контролем дыхательного объема. Для корректной оценки используется дыхательный объем выдоха, так как именно он участвует в газообмене. Пиковое давление подбирается таким образом, чтобы дыхательный объем выдоха был 4-6мл/кг. Порядок проведения ИВЛ
После установки дыхательного контура и калибровки аппарата ИВЛ следует выбрать режим вентиляции.
У недоношенных предпочтительно использовать триггерную ИВЛ, в частности, режим assist/control. В этом режиме каждый вдох будет поддерживаться респиратором. Если самостоятельного дыхания нет, то режим А/С автоматически становится режимом принудительной вентиляции — IMV при установке определенной аппаратной частоты дыхания.
В редких случаях режим А/С может оказываться избыточным для ребенка, когда несмотря на все попытки оптимизировать параметры, ребенок имеет стойкую гипокапнию из-за тахипноэ. В этом случае можно перевести ребенка в режим SIMV и установить желаемую частоту респиратора.
Поскольку у маловесных пациентов преимущественно используются интуба-ционные трубки малого диаметра, то актуальной становится проблема высокой аэродинамической резистентности дыхательных путей. Для снижения аэродинамического сопротивления интубационной трубки следует ее подрезать и оставлять не более 1-2 см от края губ ребенка. Кроме того, в этой ситуации целесообразно использовать вместо ИВЛ ограниченной по давлению (Pressure limited), вентиляцию с контролем по давлению (Pressure control). При вентиляции в режиме pressure control скорость потока автоматически определяется аппаратом и варьирует в зависимости от инспиратор-ной потребности пациента. Это облегчает вдох и снижает работу дыхания у маловесных пациентов.
После того как режимы выбраны, до подключения ребенка к аппарату устанавливаются стартовые параметры ИВЛ.
Стартовые параметры ИВЛ у маловесных пациентов:
Аппаратная частота устанавливается 30-35 и является лишь страховкой на случай апноэ у пациента.
PIP обычно устанавливается в диапазоне 14-20 см вод. ст.
После подключения ребенка к аппарату ИВЛ проводится оптимизация параметров:
FiO2 устанавливается таким образом, чтобы уровень сатурации был в пределах 91-95%. При наличии в аппарате ИВЛ функции автоматического подбора FiO2 в зависимости от уровня сатурации у пациента ее целесообразно использовать для профилактики гипоксических и гипроксических пиков, что в свою очередь является профилактикой бронхолегочной диспла-зии, ретинопатии недоношенных, а так же структурных геморрагических и ишемических повреждений головного мозга.
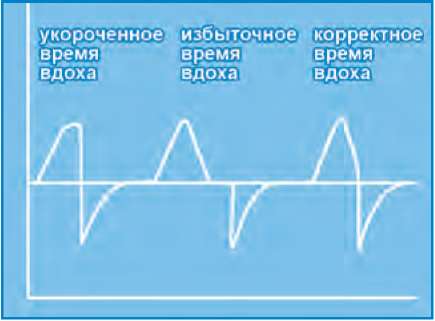
Время вдоха является динамическим параметром. Время вдоха зависит от заболевания, его фазы, от частоты дыхания самого пациента и некоторых других факторов. Поэтому при использовании привычной тайм-циклической вентиляции время вдоха желательно устанавливать под контролем графического мониторинга кривой потока (см. нижеследующий рис.).
Подбор времени вдоха по кривой потока:
Устанавливать время вдоха следует так, чтобы на кривой потока выдох являлся бы продолжением вдоха. Не должно быть паузы вдоха в виде задержки кривой на изолинии, и в то же время выдох не должен начинаться раньше, чем закончится вдох. При использовании вентиляции, цикличной по потоку время вдоха будет определяться самим пациентом в случае наличия у ребенка самостоятельного дыхания. Такой подход имеет некоторое преимущество, так как позволяет глубоко недоношенному пациенту самому определять комфортное время вдоха. В этом случае время вдоха будет варьировать в зависимости от частоты дыхания пациента, его инспираторной активности. Вентиляция, цикличная по потоку, может использоваться в ситуациях, когда у ребенка присутствует самостоятельное дыхание, нет выраженной экссудации мокроты и отсутствует склонность к ателектазированию.
При проведении вентиляции, цикличной по потоку, необходимо мониторировать фактическое время вдоха пациента. В случае формирования неадекватно короткого временя вдоха, такой пациент должен быть переведен в режим тайм-циклической ИВЛ и вентилироваться с заданным, фиксированным временем вдоха. Оптимизация Pip проводится таким образом, чтобы дыхательный объем выдоха был в диапазоне 4-6мл/кг. При наличии в аппарате ИВЛ функции автоматического подбора пикового давления в зависимости от дыхательного объема пациента, ее целесообразно использовать у тяжелых пациентов с целью профилактики ИВЛ ассоциированного повреждения легких.
Синхронизация ребенка с аппаратом ИВЛ
Регулировка параметров ИВЛ Схематичная регулировка параметров в зависимости от газового состава крови: