Интерферон и антитела в чем разница
Cобственный интерферон —
лучший из возможных
Как организм вырабатывает интерферон. Эффективность естественных интерферонов для иммунитета. Бактериальные лизаты как естественный активатор иммунной системы и стимуляции собственного интерферона.
Человек борется с вирусами с незапамятных времен. За миллионы лет эволюции наш организм выработал универсальную стратегию борьбы с неприятелем. Одним из ключевых игроков этого противостояния являются интерфероны. Это вещества, помогающие организму в короткий срок справиться с вирусами. Сегодня существует большое количество препаратов, содержащих в своем составе те или иные интерфероны. Но так ли они эффективны как собственный интерферон, вырабатываемый организмом?
Что такое интерферон?
В настоящее время известно более 20 интерферонов, которые подразделяются на три типа 3,4 :
Как работают собственные интерфероны человека?
Противовирусные свойства интерферонов вызывали у исследователей большой интерес с точки зрения терапии ряда заболеваний. И со временем благодаря различным медицинским и технологическим возможностям удалось получить лекарственные препараты, которые содержат в своем составе интерферон.
Использование препаратов интерферона в медицине
Препараты интерферона активно используются в лечении широкого спектра вирусных заболеваний. В частности, речь идет о вирусе папилломы человека, вирусных гепатитах, герпетической инфекции, а также гриппа и простудных заболеваний. Важным фактором выбора препаратов, содержащих интерферон для лечения того или иного заболевания, будет являться концентрация интерферона в препарате, то, каким способом он получен и какой тип интерферона (α, β, γ или λ) содержит в своем составе. Несмотря на то, что существуют препараты интерферона, которые отпускаются без рецепта, все же с врачом лучше заранее проконсультироваться, поскольку в отношении этих препаратов есть ряд противопоказаний. По способу получения препараты интерферона можно поделить на 4 типа 6,7 :
Преимущества и недостатки привнесенных интерферонов
К преимуществам препаратов, содержащих в своем составе интерфероны, можно отнести их доступность. Немаловажное преимущество интерферонов – возможное их применение против широкого спектра вирусов.
Сравнительно высокий уровень безопасности препаратов интерферона позволяет их применять и детям, которые, как известно, часто болеют гриппом и другими ОРВИ.
Экстренная иммунозащита от вирусов
Наш организм в процессе эволюции приспособился к борьбе с вирусами, однако при необходимости мы можем ему помочь, не сильно вмешиваясь в его работу.
Иммунитету в помощь. Почему организму нужен интерферон после прививки
В период вакцинации от COVID-19 у многих возникают разные вопросы: «Как мой организм перенесет прививку? Есть ли риск заболеть ОРВИ? Как защититься от коронавируса между приемами двух компонентов вакцины?» О препаратах, которые помогают не только бороться с вирусом, но и укреплять иммунитет, мы поговорили с Александром Карауловым, доктором медицинских наук, академиком РАН, заведующим кафедрой клинической иммунологии и аллергологии, заведующим лабораторией иммунопатологии ФГАОУ ВО «Первый МГМУ им. И. М. Сеченова».
— Александр Викторович, как организм реагирует на введение вакцины?
— Фактически с помощью вакцины мы тренируем нашу иммунную систему для будущей встречи с возбудителем. Ученые подчеркивают, что примерно 3% населения переносят COVID-19 тяжело, у 0,3% возможно жизненно угрожающее течение заболевания. Причем если раньше мы видели, что тяжелое течение чаще встречалось среди пожилых и пациентов с сопутствующими заболеваниями, то сейчас большинство жизнеугрожающих состояний приходится на пациентов в возрасте от 40 до 60 лет. Только у 50% тех, кто перенес COVID-19, сформировались антитела.
Вакцинация защищает от инфицирования, а если оно все же происходит, то инфекция протекает в легкой форме. Однако поствакцинальный иммунитет у разных групп людей формируется неодинаково. Его формирование может быть замедлено у пожилых людей или пациентов со слабым иммунитетом, то есть у тех, у кого защитные силы организма ослаблены перенесенными или сопутствующими инфекциями, хроническими заболеваниями, стрессом, недостаточностью питания, экологией и т. д.
— Сейчас много говорят об интерферонах, о том, что они укрепляют иммунитет. Уже вышло множество исследований о применении препаратов этой группы при COVID-19, в России они вошли в стандарты оказания медпомощи. А как работают интерфероны при вакцинации?
— Интерфероны в нашем организме выполняют регулирующую функцию. Если говорить иносказательно, то интерферон — это регулировщик на перекрестке: он направляет иммунный ответ в правильное русло, таким образом содействуя выздоровлению. Это свойство интерферона отлично подходит и для подготовки к вакцинации, которая, по сути, также является иммунной реакцией организма, но не с целью выздоровления, а с целью более эффективной выработки антител против возбудителя заболевания.
— Как именно интерферон влияет на уровень выработки антител?
— Интерфероны способствуют активации иммунитета, усиливают продукцию и созревание клеток, которые запускают формирование качественного иммунного ответа. Препараты на основе интерферона можно применять до вакцинации, спустя несколько часов или на следующий день после введения вакцины. Только нужно понимать, что они не действуют мгновенно: это процесс, который потребует определенного времени. С учетом накопленного клинического опыта я бы рекомендовал, например, ректальную форму препарата интерферона в течение пяти дней до вакцинации или пяти дней после. Это может усиливать формирование иммунного ответа и препятствовать возможности заражения пациента другими заболеваниями, пока адекватный уровень антител на введение вакцины еще не выработан.
— А можно ли во время вакцинации заболеть ОРВИ или той же «короной»?
— Заболеть можно, потому что в этот момент вся энергия организма направлена, как я уже сказал ранее, на выработку антител: иммунитет формируется не с первого дня, это уже многократно озвучено. Конечно, есть риск получить другую или ту же инфекцию, от которой вы прививаетесь, если антитела еще не выработались. Чтобы этого не произошло, нужна профилактика. К сожалению, люди так устали от пандемии, что, сделав первую прививку, зачастую перестают даже носить маски. Но важно понимать, что любое заболевание в период вакцинации — это двойная нагрузка на организм. Поэтому нужно очень ответственно вести себя в этот период.
— В каких случаях, помимо вакцинации, можно использовать препараты интерферона во время эпидемии COVID-19?
— Прежде всего — в качестве профилактики гелем, мазью с интерфероном, которые наносятся на слизистую оболочку носа. По сути, это универсальное средство профилактики ОРВИ, эффективность которого доказана еще до пандемии коронавируса, во время ежегодных эпидемий гриппа. Гелевые основы обладают пролонгированным (длительным) профилактическим эффектом, их удобно наносить.
— А можно ли препаратами интерферона лечить COVID-19?
— Что касается лечения, то не могу не обратить внимание на важность применения именно ректальной формы интерферона: свечей. В этом случае организм, ослабленный болезнью, получает недостающий интерферон, необходимый для адекватного ответа инфекции, дополнительно в лекарственном препарате. Свечи оказывают системное действие на организм в целом, то есть интерферон, введенный ректально, может проникать во все органы и ткани, поражаемые вирусом. Сегодня мы столкнулись с огромным количеством нейродегенеративных осложнений COVID-19. Вирус легко проникает в органы центральной нервной системы, вызывая в них порой необратимые изменения. Благодаря ректальному введению интерферон, используя лимфатические пути, способен проникать в спинномозговую жидкость, препятствуя развитию опасных осложнений. Также он быстро доставляется в легкие — недаром он многие годы применяется при лечении пневмоний.
Исследования по применению интерферона при коронавирусе активно идут на Западе и в России. Мы практически ежемесячно получаем новые данные. Например, наши коллеги из Омского медицинского университета провели исследование с участием 140 больных COVID-19. 70 из них получали стандартную терапию, а еще 70 сочетали ее с ректальными суппозиториями «ВИФЕРОН» и гелем, то и другое регулярно применялось в течение 14 дней. По результатам исследования симптомы интоксикации у таких пациентов — головная и мышечная боль, слабость — прекращались на 2-8 дней раньше. Кашель исчезал к 5 дню от начала лечения, насморк регистрировали только в течение 3 дней, нарушение вкуса и обоняния пациенты переставали отмечать к четвертому дню от начала лечения, одышка прекращалась к третьему дню. У пациентов, которые не получали дополнительно интерферон, все симптомы заболевания держались статистически дольше.
Отмечу, что на начальных стадиях заболевания действительно работает правило «чем раньше, тем лучше». Раннее начало терапии интерфероном снижает показатель летальности и демонстрирует лучшие результаты терапии. Это подтвердили исследования наших китайских коллег, показавших, что если исходный уровень интерферона альфа возрастает, допустим, благодаря терапии, то, как правило, нас ждет благоприятный исход заболевания.
Обзор фармакологических особенностей интерфероновых препаратов в условиях потенциального риска 3-й волны пандемии инфекции COVID-19
Известно, что в процессе биологической эволюции природа наградила организм человека великолепным механизмом противостояния вирусным атакам, который реализован в системе цитокиновых белков – интерферонов…
Эра интерферонов началась в 1957 году, когда англичанин Айзекс и швейцарец Линдеман во время экспериментальных опытов открыли явление вирусной интерференции: зараженные вирусами клетки производили особый белок, который ингибировал рост этих вирусов и защищал интактные клетки от вирусной агрессии. С этого времени человечество вступило в эру интерферона, иными словами приобрело мощное естественное средство в борьбе с вирусными инфекциями. Уже в 1961 году английский вирусолог Тирелл впервые испытал на себе и своих сотрудниках интраназальный интерферон. И что поразительно, предварительное закапывание в нос раствора интерферона и последующее заражение вирусом Коксаки вызвало лишь легкое недомогание, но никак не заболевание, без всяких побочных явлений 4.
Уже через 5 лет после открытия, ВОЗ определила интерферон как «белок, способный препятствовать заражению здоровых/незараженных клеток». В международной классификации лекарственных средств интерферону альфа-2b, который используется в большинстве препаратов на основе интерферона присвоен код L03AB05 [5].
В настоящее время в мировой научной медико-биологической литературе наблюдается настоящий «бум» публикаций, посвященных терапевтическим возможностям интерферонов при лечении инфекции COVID-19. Так, например китайские авторы лечили COVID-19 либо распыленным препаратом интерферона-а2в, либо комбинацией его в сочетании с умифеновиром (Арбидол). Данная терапия значительно сокращала продолжительность обнаруживаемого вируса в верхних дыхательных путях и параллельно снижала продолжительность повышенного уровня в крови маркеров воспаления, в частности IL-6 [6].
Также в Китае, авторы, на основе национальных рекомендаций по лечению COVID-19 рекомендуют вводить пациентам вводить 5 млн. МЕ интерферона-α путем вдыхания паров два раза в день в комбинации с рибавирином [7].
Американские исследователи доказали, что EC50 (полумаксимальная эффективная концентрация) при лечении вирусной инфекции, вызываемой вирусом SARS-CoV-2 интерфероном-α составляет 1,35 МЕ/мл [8].
Комбинация препарата интерферона I типа с лопинавиром/ритонавиром, рибавирином или ремдесивиром может повысить его эффективность, поскольку эффективность таких комбинаций наблюдается in vitro и у других коронавирусов [10].
В ряде обзорных и проблемных статей 2020 года, иностранные авторы приводят убедительные доказательства необходимости и целесообразности применения препаратов интерферона при терапии COVID-19.
Таким образом, на сегодняшний день можно с уверенностью сказать, что интерферонотерапия новой коронавирусной инфекции заняла прочное место в арсенале клиницистов многих стран мира [11,12].
Более того, Временные методические рекомендации Минздрава России «Профилактика, диагностика и лечение новой коронавирусной инфекции COVID-19» (Версия 10 от 08.02.2021) рекомендуют использовать препараты интерферона- α в свечах, особенно с антиоксидантами.
Важно иметь ввиду, что в инструкциях всех рассматриваемых противовирусных препаратов есть показания – ОРВИ. Как известно, инфекция COVID-19 также является по сути ОРВИ, поэтому применение данных препаратов против коронавирусных агентов этио-патогенетически оправдано.
Препарат обладает иммуномодулирующим, противовоспалительным и противовирусным действием, применяется в схемах лечении ОРВИ и COVID-19 [15].
Препарат ВИФЕРОН обладает выраженными противовирусными и иммуномодулирующими свойствами, а витамины С и Е в его составе обеспечивают антиоксидантный, противовоспалительный, мембраностимулирующий и регенеративный эффекты. Препарат в указанных лекарственных формах практически лишен побочных эффектов и может применятся у детей с первых дней жизни, беременных и пациентов различных возрастных категорий [17].
Анализируя эффективность тех или иных интерфероновых препаратов, следует отметить, что выбор лекарственной формы имеет важное значение. Так, исследованиями, проведенными учеными МГУ было доказано, что действующее вещество в гелевых субстанциях и композициях фармакологических препаратов, легко преодолевают эпителиальные барьеры слизистых оболочек, поскольку обладая гидрофильными свойствами, гелевая лекарственная форма выделяет действующее вещество из своей композиции в течение 5 часов [18].
Учитывая риск наступления 3-й волны пандемии, представляется целесообразным применение препаратов интерферонового ряда в качестве средств активной профилактики инфекции COVID-19.
Интерферон-антитела
Интерфероны (ИФН) – важнейший компонент врождённой неспецифической защиты организма от инфекций (название интерфероны произошло от их свойства интерферировать с вирусной инфекцией клеток). Это семейство белков местной (аутокринной и паракринной) регуляции, которые способны активировать внутриклеточные процессы и межклеточные взаимодействия, обеспечивающие устойчивость к вирусным инфекциям, усиливающие врождённый и приобретённый иммунные ответы, модулирующие процессы развития и гибели нормальных и опухолевых клеток. Резистентность организма к вирусным инфекциям и ряду других заболеваний во многом зависит от активности группы генов системы интерферонов.
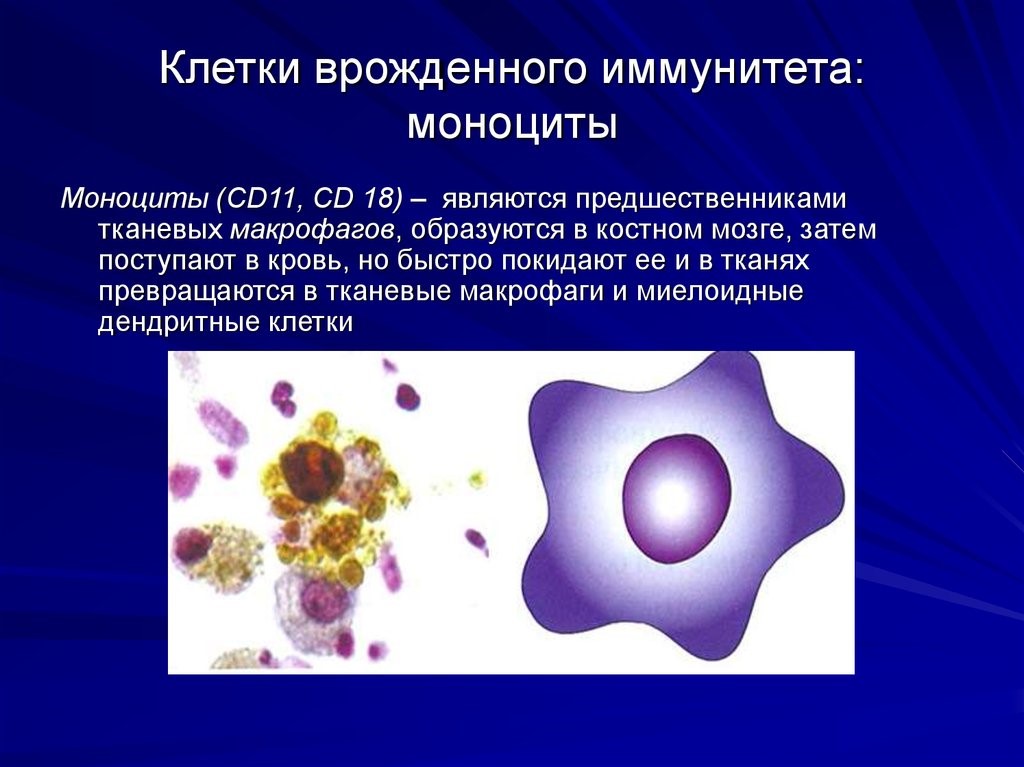
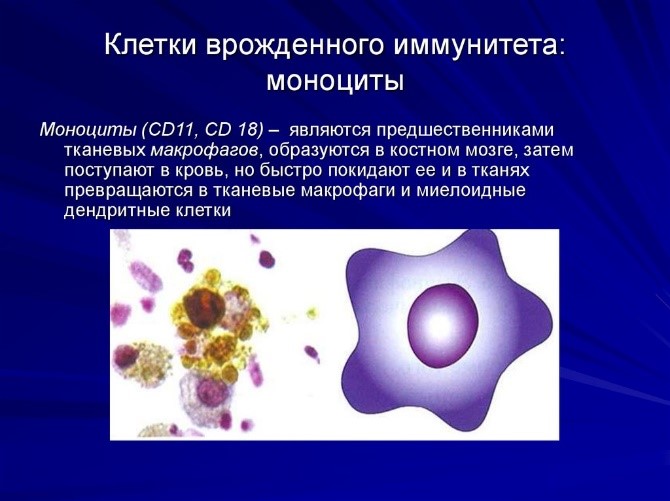
Интерферон α (выявлено более 20 его субтипов) — основной интерферон, который синтезируется в культуре лейкоцитов, индуцированной вирусом. Главными продуцентами ИФН-α являются плазмацитоидные дендритные клетки, существенный вклад в ИФН-α-продуцирующую способность крови вносят моноциты. Основные его функции – противовирусная активность и активация естественных киллеров.
Интерферон β — основной интерферон, продуцирующийся культурой фибробластов, индуцированной двухспиральной РНК. Его основные продуценты – фибробласты, эпителиальные клетки и макрофаги, основная функция – противовирусная активность.
Исследование параметров интерферонового статуса позволяет выявить недостаточность системы интерферона. Оценка выявляемых изменений может служить ориентиром при диагностике, лечении и прогнозе заболеваний как вирусной, так и невирусной этиологии. Здоровые люди характеризуются низким уровнем сывороточного интерферона и высокими значениями индуцированного синтеза интерферонов. Стрессы и острые вирусные инфекции, аллергические состояния сопровождаются повышением уровня циркулирующего интерферона и снижением уровня индуцируемой продукции альфа- и гамма-интерферонов лейкоцитами. При бронхиальной астме, крапивнице уровень циркулирующего интерферона коррелирует с тяжестью заболевания.
Хронические вирусные инфекции (герпес, гепатит), рассеянный склероз сопровождаются подавлением всех показателей интерферонового статуса. Аутоиммунные заболевания (системная красная волчанка, ревматоидный артрит) характеризуются подавлением индуцируемой продукции альфа-интерферона. Острый лимфолейкоз, злокачественные образования сопровождаются подавлением индуцируемой продукции гамма-интерферона. Результаты исследования интерферонового статуса следует рассматривать в комплексе с остальными лабораторными и клинико-анамнестическими данными. Снижение продукции альфа- и гамма- интерферона, которое может быть и причиной, и следствием острых и хронических вирусных заболеваний, свидетельствует о врождённом или приобретённом дефиците системы интерферонов и может рассматриваться как показание для интерферон-стимулирующей терапии. Нормализация показателей интерферонового статуса обычно совпадает с процессами выздоровления. У людей старше 50 лет относительно чаще выявляется недостаточность системы интерферонов. Исследование параметров интерферонового статуса с определением чувствительности к лекарственным препаратам используют для подбора эффективной терапии при использовании препаратов экзогенного интерферона, индукторов интерферона и иммуномодуляторов.
Иммунная система человека
к.м.н. Гольдинберг Б. М., Васюк Я.В.
Городской центр трансфузиологии учреждения здравоохранения «6-я городская клиническая больница», г. Минск,
учреждение здравоохранения «7-я городская детская поликлиника», г. Минск
ИММУНННАЯ СИСТЕМА ЧЕЛОВЕКА
Введение
Группа органов, имеющих общее происхождение, единый план строения и выполняющая общую функцию называется системой органов. Пять из всех десяти систем органов являются регулирующими (управляющими): нервная, кровеносная, эндокринная, лимфатическая и иммунная. Уточним, что лимфатические органы и лимфатических узлы, которых насчитывается около 600, функционально является частью иммунной системы, а к собственно лимфатической системе относится обширная сеть сосудов, которая проходит почти через все наши ткани, обеспечивая движение жидкости, называемой лимфой.
Слово «иммунитет» происходит от латинского «immunis» (на английском – immunity), что означает «чистый от чего-либо», невосприимчивый к чему-либо. Иммунная система появилась вместе с многоклеточными организмами и развивалась, как помощница их выживанию. Она объединяет органы и ткани, которые гарантируют защиту организма от генетически чужеродных клеток и веществ, поступающих из окружающей среды.
Иммунная система представлена тремя уровнями: органным, клеточным и молекулярным.
Органы иммунной системы человека
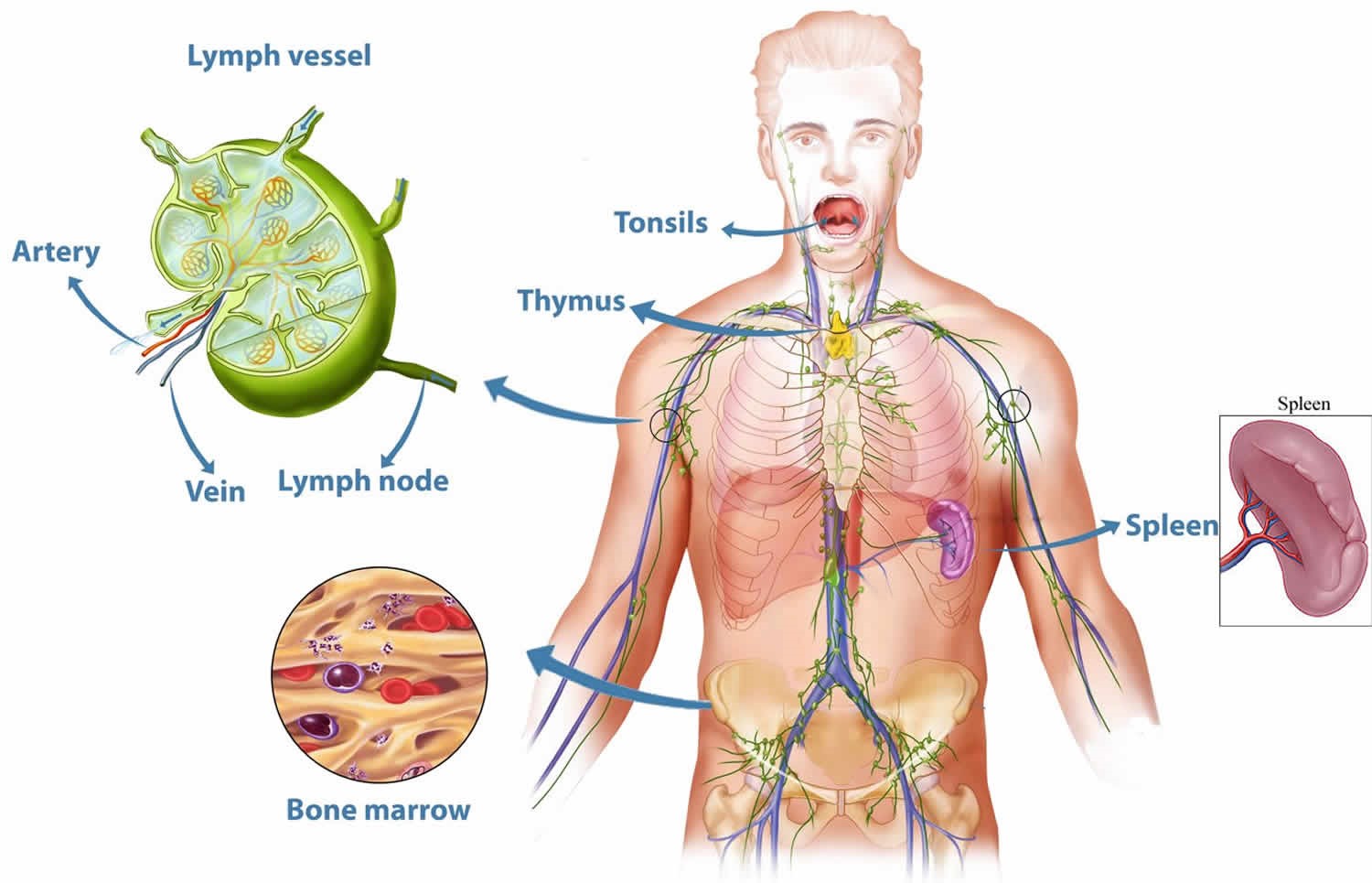
Иммунная система включает центральные и периферические органы.
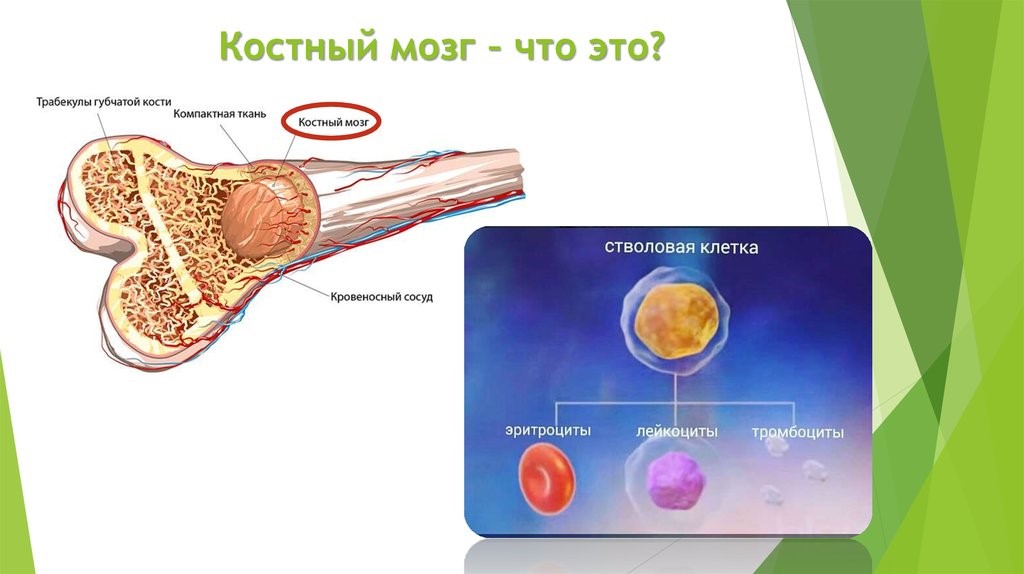
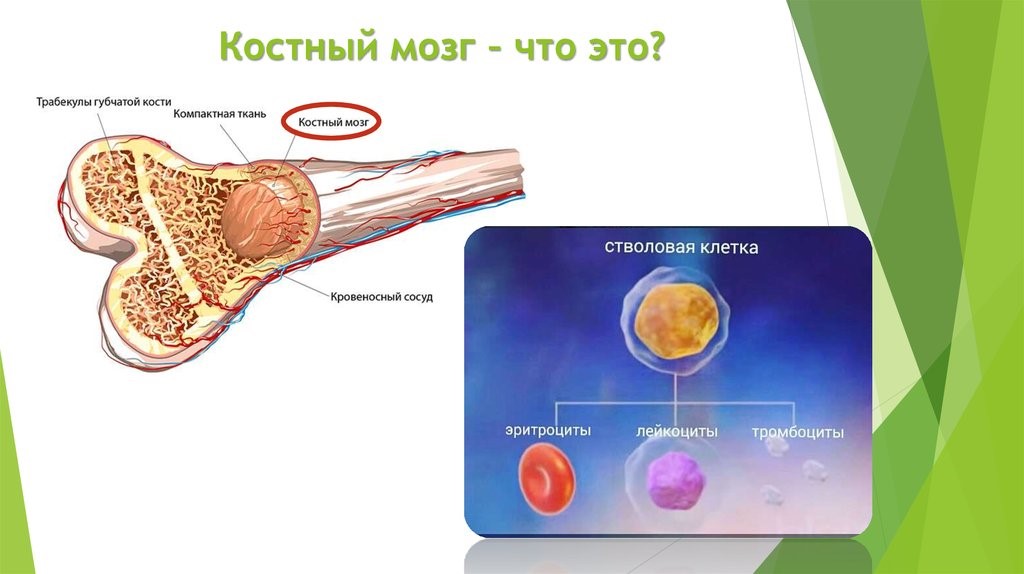
Центральные органы иммунной системы представляют собой красный костный мозг и тимус.
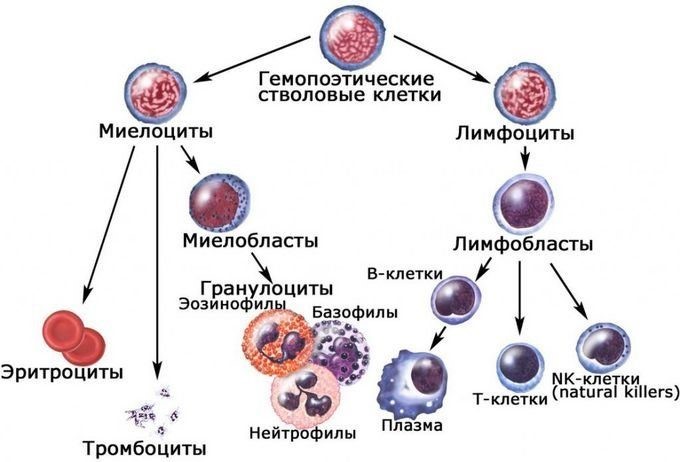
Костный мозг является хранилищем стволовых клеток, из которых образуются клетки крови (рис.1). В зависимости от ситуации, стволовые клетки трансформируются в иммунные В-лимфоциты. При необходимости, определенная часть B-лимфоцитов превращается в плазматические клетки, которые способны вырабатывать антитела.
Рис.1. Костный мозг содержит стволовые клетки
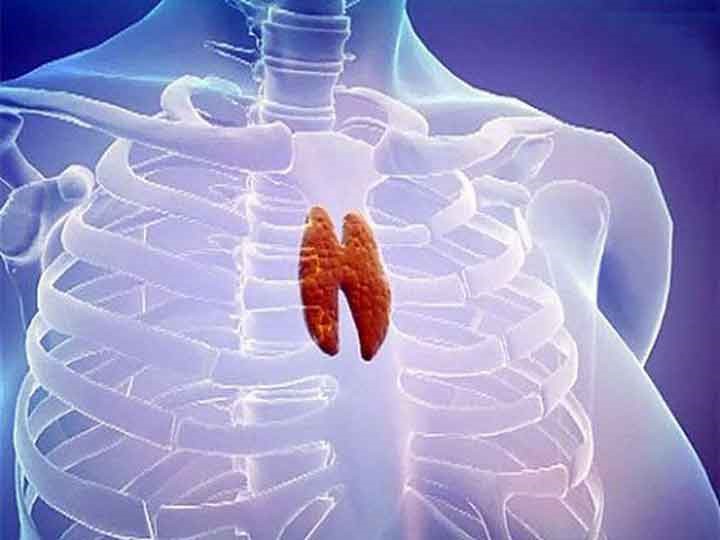
Тимус (или вилочковая железа) – один из главных органов иммунной системы, расположенный у человека за грудиной ниже ключиц, который отвечает за образование Т-клеток иммунной системы в лимфоидных тканях организма (рис.2).
К периферическим органам относятся селезенка, миндалины и лимфоузлы, в которых находятся зоны созревания иммунных клеток.
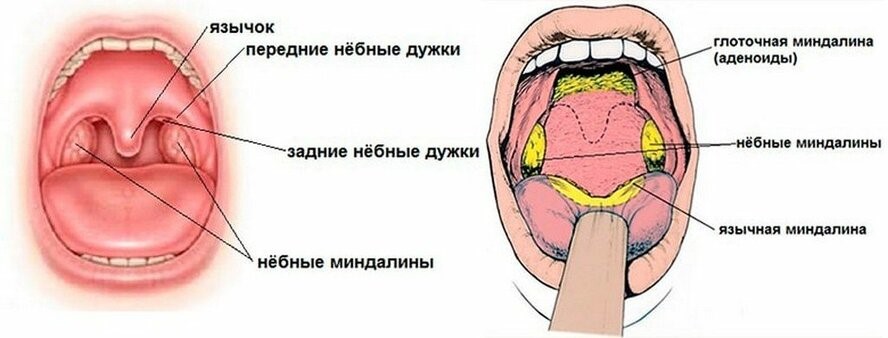
Миндалины, получившие свое название из-за внешней схожести с миндалем, представляют собой скопление лимфоидной ткани в верхней части носоглотки. У человека шесть миндалин: две небные, две грудные и по одной носоглоточной и язычной.
Самыми крупными из них являются небные миндалины, или гланды, которых легко осмотреть самостоятельно в зеркале, если достаточно широко раскрыть рот (рис.3).
Рис. 3. Небные миндалины
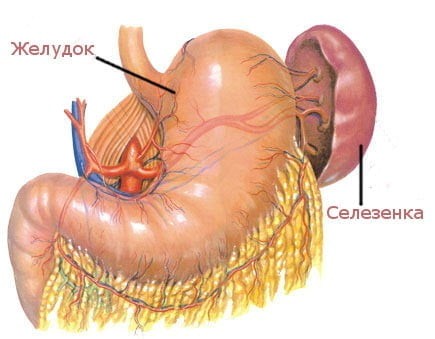
Селезенка является самым крупным лимфоидным органом (рис. 4). Кроме того, она может накапливать некоторое количество крови. В экстренных ситуациях селезенка способна послать свои запасы в общий кровоток. Это позволяет улучшить качество и скорость иммунных реакций организма. Селезенка очищает кровь от бактерий и перерабатывает всевозможные вредные вещества. В ней полностью разрушаются эндотоксины, а также остатки умерших клеток при ожогах, травмах или других повреждениях тканей. У людей, оставшихся по какой-либо причине без селезенки, ухудшается иммунитет.
Лимфатические узлы представляют собой небольшие образования округлой формы (рис. 5), расположенные в грудной полости (бронхолегочные, бронхотрахеальные) и брюшной полости (пейеровы бляшки, аппендикс и другие), окологрудные на поверхности грудной клетки, на шее и на конечностях. Лимфоузел – это один из барьеров на пути инфекций и раковых клеток, играющий роль своеобразной таможни (рис. 5). В нем образуются лимфоциты – специальные клетки, которые принимают активное участие в уничтожении вредных веществ.
Центральные органы иммунной системы отвечают за образование и созревание клеток, а периферические органы обеспечивают защиту, то есть иммунный ответ. Периферические и центральные органы иммунной системы выполняют свои работу только вместе и если выходит из строя какой-либо один из этих органов, то организм лишится защитного барьера.
Компоненты иммунной системы
Современная иммунология различает два взаимодействующих компонента иммунной системы – врожденный и приобретенный виды иммунитета, обеспечивающие развитие иммунного ответа на генетически чужеродные субстанции (сущности).
Врожденный (видовой) иммунитет – наследственно закрепленная система защиты организма человека от патогенных и непатогенных микроорганизмов, а также продуктов тканевого распада. Клетки врожденного иммунитета распознают патоген по специфичным для него молекулярным маркёрам – так называемым «образам патогенности». Эти маркёры не позволяют точно определить принадлежность патогена к тому или иному виду, а лишь сигнализируют о том, что иммунитет столкнулся с возмутителями спокойствия: чужаком или своим, но ставшим для организма предателем (рис.6).
Рис.6. Врожденный иммунитет: главное – спокойствие!
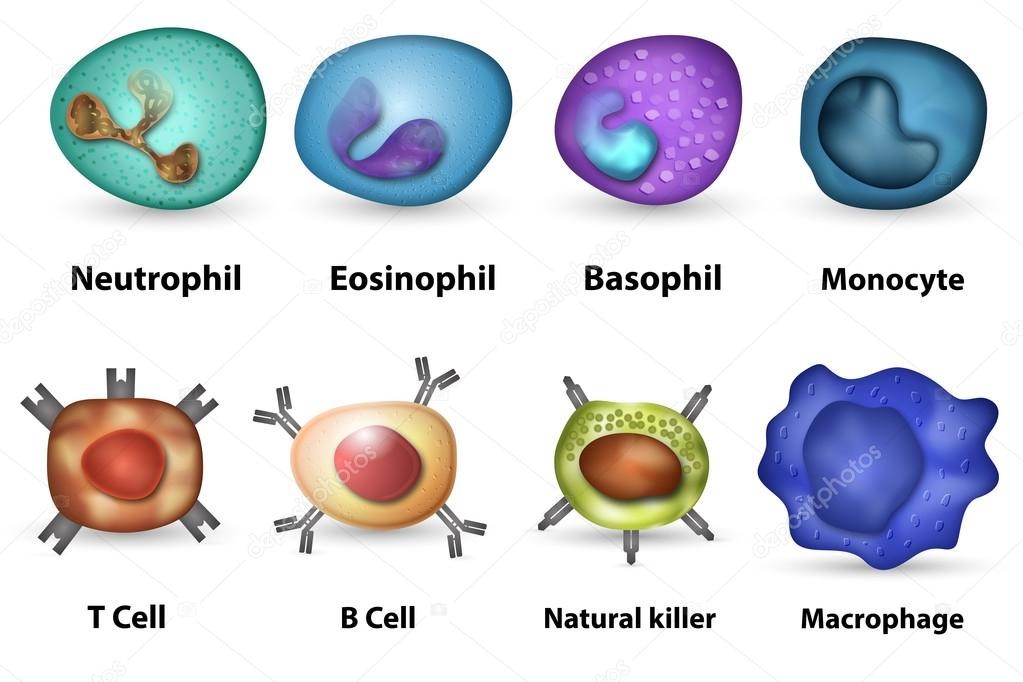
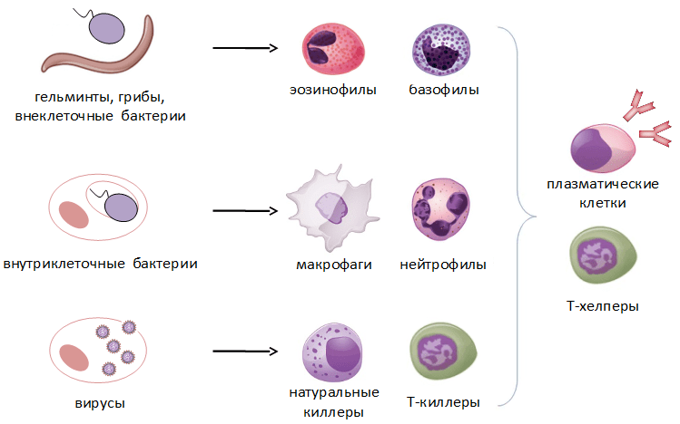
Врожденный иммунитет на клеточном уровне представляют:
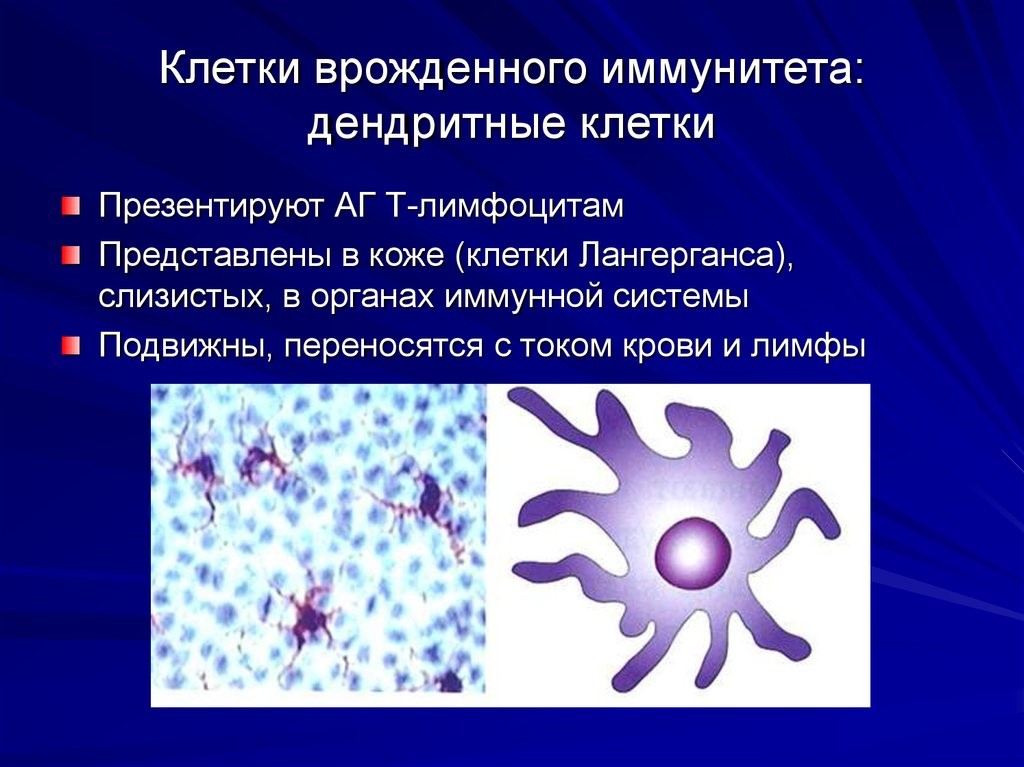
Рис.8. Дендритная клетка и
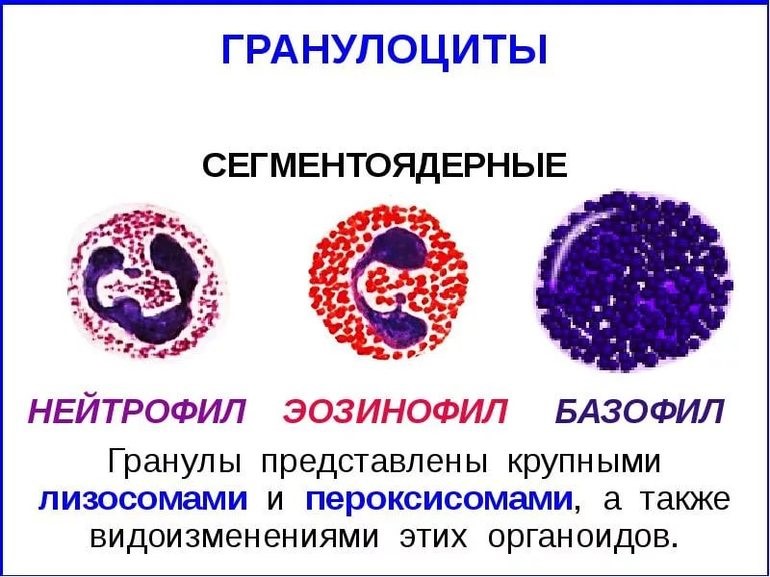
Нейтрофилы – самые многочисленные иммунные клетки в крови человека. Они циркулируют в крови всего 8-10 часов и бόльшую часть своей жизни путешествуют по тканям организма. При встрече с патогеном они его захватывают и переваривают, после чего обычно сами погибают. Из разрушенных нейтрофилов высвобождаются гранулы, содержащие антибиотические вещества.
Гранулы эозинофилов и базофилов осуществляют химическую защиту организма от крупных патогенов, например, паразитических червей, грибов, внеклеточных бактерий. Однако при чрезмерной активности могут участвовать и в развитии аллергической реакции;
Рис.10. Натуральный киллер
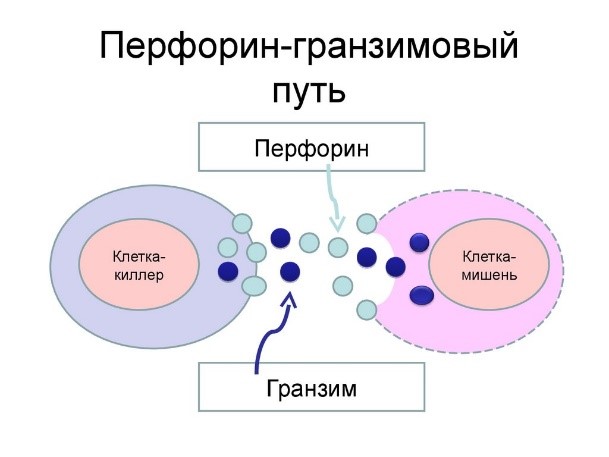
Действуют натуральные киллеры с помощью агрессивных веществ перфорина и гранзима, которые наподобие буравчиков «кусают» и разрушают пораженную клетку, ставшую для них мишенью (рис.11)
Рис.11. Проникновение перфорина и гранзима в раковую клетку и ее уничтожение
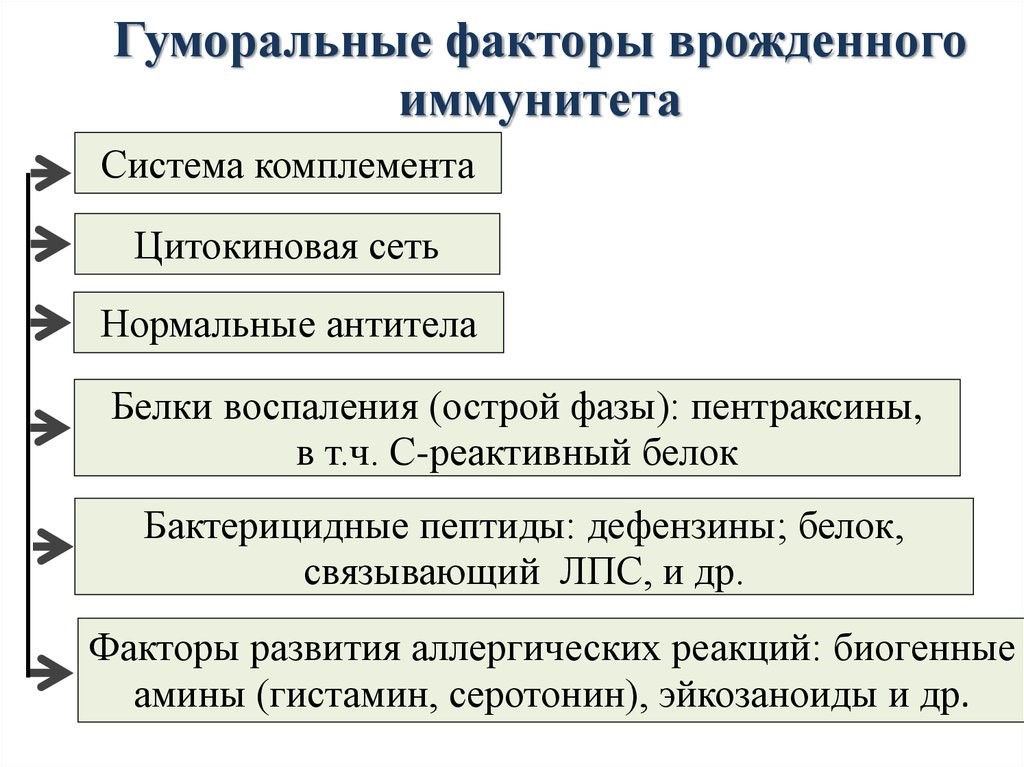
Молекулярными(гуморальные) факторами врожденного иммунитета являются (рис.12):
Рис.12.Гуморальные факторы врожденного иммунитета
Система комплемента – это многокомпонентная самособирающаяся система более 20 сывороточных белков, которые в норме находятся в неактивном состоянии.
После активации проявляются биологические эффекты комплемента: образование мембраноатакающего комплекса для лизиса патогенов, выброса медиаторов воспаления для привлечения фагоцитов и усиления их поглотительной способности.
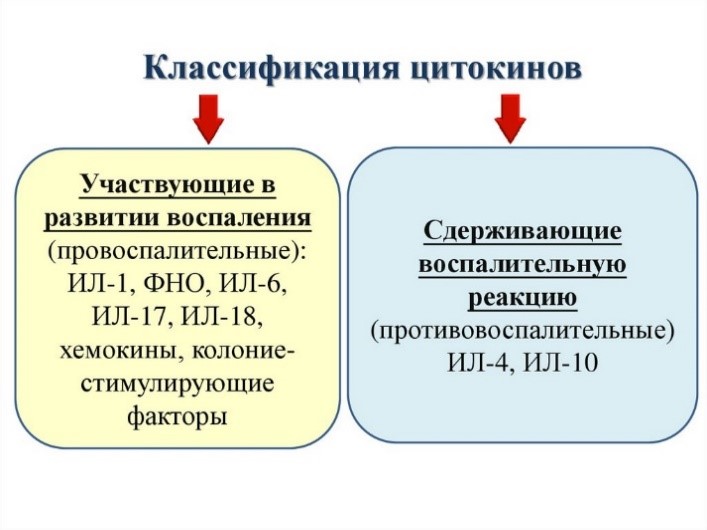
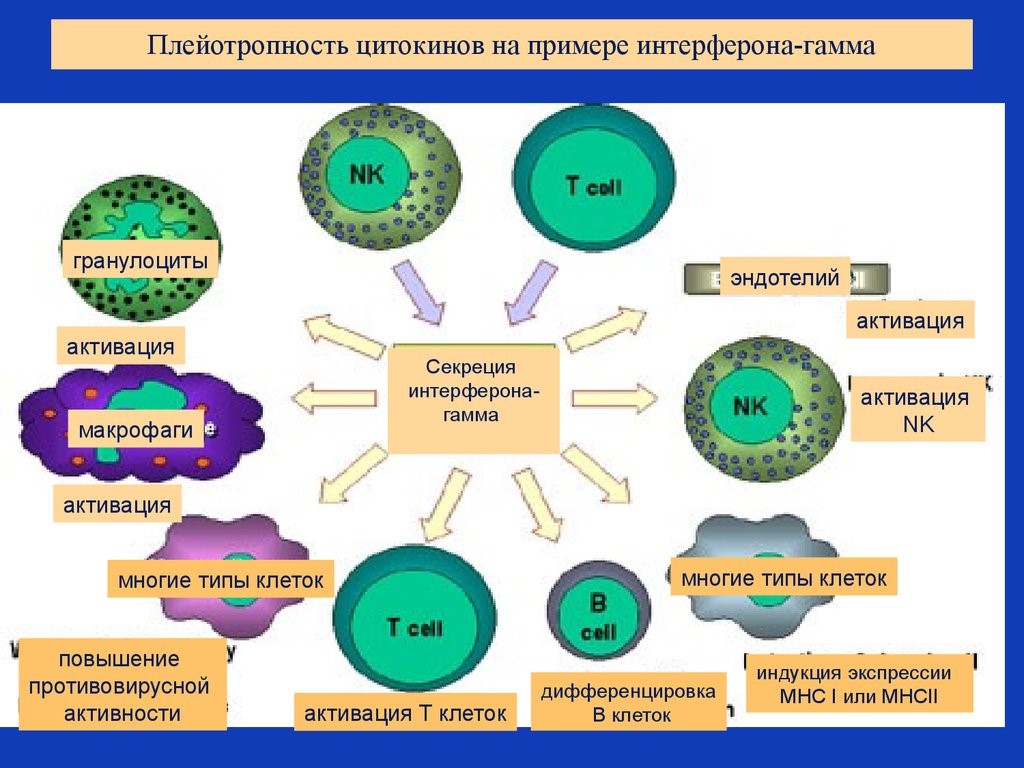
Цитокины – это система низкомолекулярных белков организма, синтезируемых преимущественно активными клетками иммунной и кроветворной систем, регулирующих межклеточные взаимодействия «универсальный» язык для всех клеток), представленные на рис.13 и 14.
Рис. 13. Цитокины: ИЛ – интерлейкины, которых в настоящее время насчитывается 34 разновидности;
Рис. 14. Разнонаправленность действия цитокинов на примере гамма-интерферона
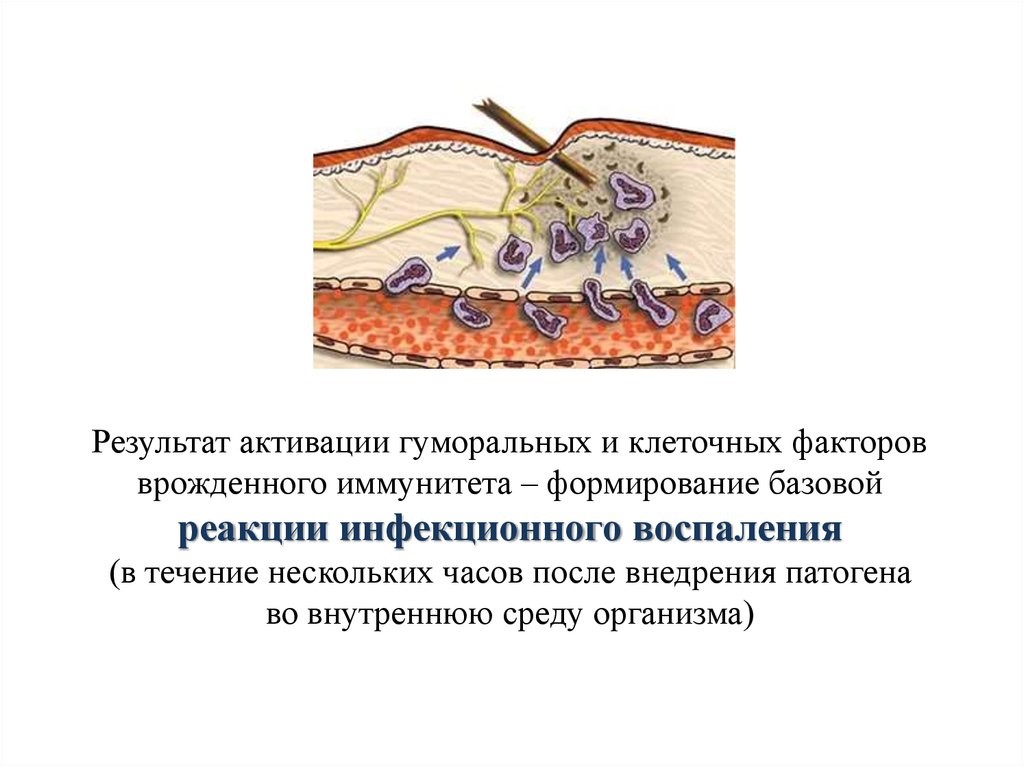
В результате активации гуморальных и клеточных факторов врожденного иммунитета в течение нескольких часов после внедрения патогена во внутреннюю среду организма формируется базовая реакция инфекционного воспаления (рис. 15)
Рис. 15. Инфекционное воспаление ткани на месте внедрения инородного тела с целью его удаления
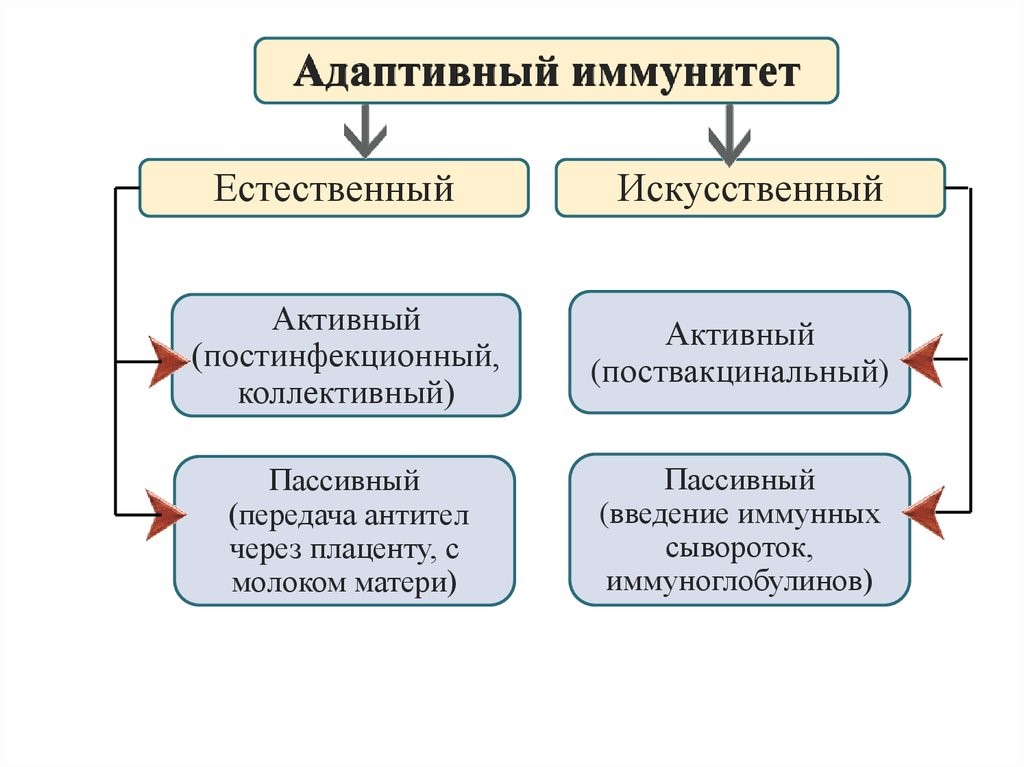
Приобретенный иммунитет (или адаптивный – от франц. adapter «приспосабливать») формируется индивидуально в течение жизни под влиянием антигенной стимуляции и, в свою очередь, подразделяется на естественный и искусственный (рис.16).
Естественный иммунитет формируется при встрече с патогеном, в результате чего в организме вырабатываются защитные иммунные факторы (активный естественный иммунитет), либо они попадают в готовом виде из материнского оргазма в период внутриутробного развития или при грудном вскармливании (пассивный естественный иммунитет).
Искусственный иммунитет создается путем введения вакцин или анатоксинов, которые стимулируют выработку антител против конкретных патогенов или их ядов. При этом с профилактической целью воспроизводится процесс реакции иммунной системы пациента на патоген, но в бессимптомной или легкой клинической форме с сохранением их защитной иммунной силы в течение нескольких месяцев, лет или даже пожизненно (искусственный активный иммунитет). Когда необходимо быстро и на короткое время защитить пациента от реального риска встречи с патогеном во время эпидемии или нейтрализовать уже проникший в его организм патоген применяются иммуноглобулины (антитела) как в очищенном виде, так и в дозированных объемах плазмы или сыворотки, полученных из крови донора (человека или животного). Применение готовых антител формирует пассивный искусственный иммунитет, сохраняющийся 2-3 недели.
Адаптивный иммунитет основывается на трех главных процессах:
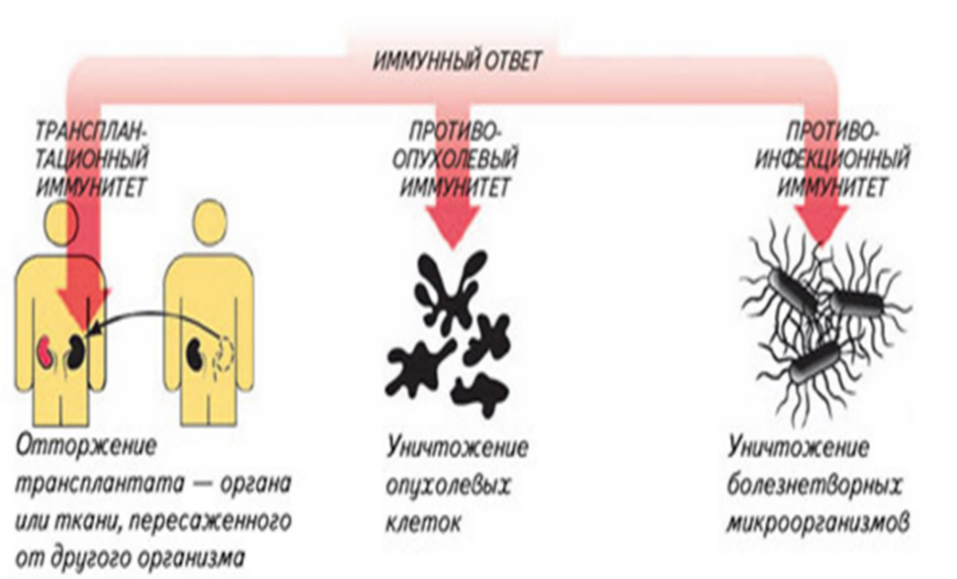
Рис.17.Варианты реагирования иммунной системы на пересадку органов или тканей, возникновение злокачественных новообразований и инфекций
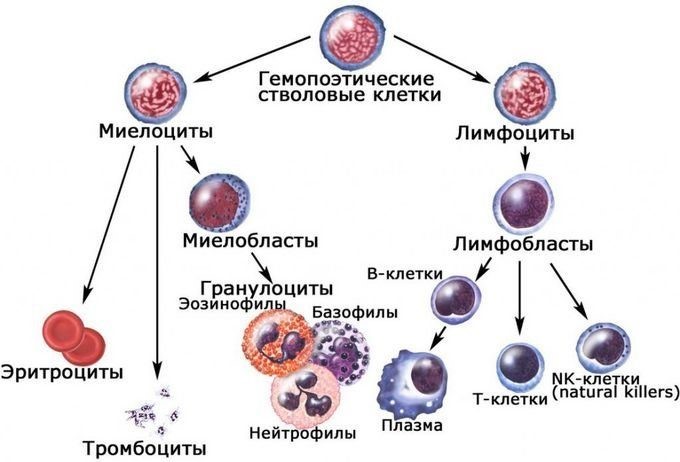
Иммунокомпетентными клетками адаптивного иммунитета являются лимфоциты, которые живут в организме человека от нескольких месяцев до несколько лет. По функциям клетки подразделяются на Т-лимфоциты – 80% и В-лимфоциты – 20%.
То, что Т-лимфоцит распознает только чужеродные антигены, а не молекулы собственного организма, является следствием процесса, называемого селекцией, которая происходит в тимусе, где завершают свое развитие Т-клетки. Суть селекции такова: клетки, окружающие юный, или наивный, лимфоцит, показывают (презентируют) ему пептиды собственных белков. Тот лимфоцит, который слишком хорошо или слишком плохо узнает эти белковые фрагменты, уничтожается. Выжившие же клетки (а это менее 1% всех предшественников Т-лимфоцитов, пришедших в тимус) обладают промежуточным сродством к антигену, следовательно, они, как правило, не считают собственные клетки мишенями для атаки, но имеют возможность среагировать на подходящий чужеродный пептид.
Для активации Т-лимфоцита нужно, чтобы он получил специальные сигналы от рецепторов лейкоцитарной антигенной системы и коктейля из множества провоспалительных цитокинов.
С помощью специальных реагентов определяются маркеры поверхностных белков лейкоцитов определенного типа, которые называются кластерами дифференциации (Сluster of differentiation) – CD. В настоящее время известно 350 CD-антигенов и их подтипов (табл. 1).
Таблица 1. Главные идентификациионные СD-маркёры клеток
Лимфоидная стволовая клетка
CD19, CD72, CD79 и др.
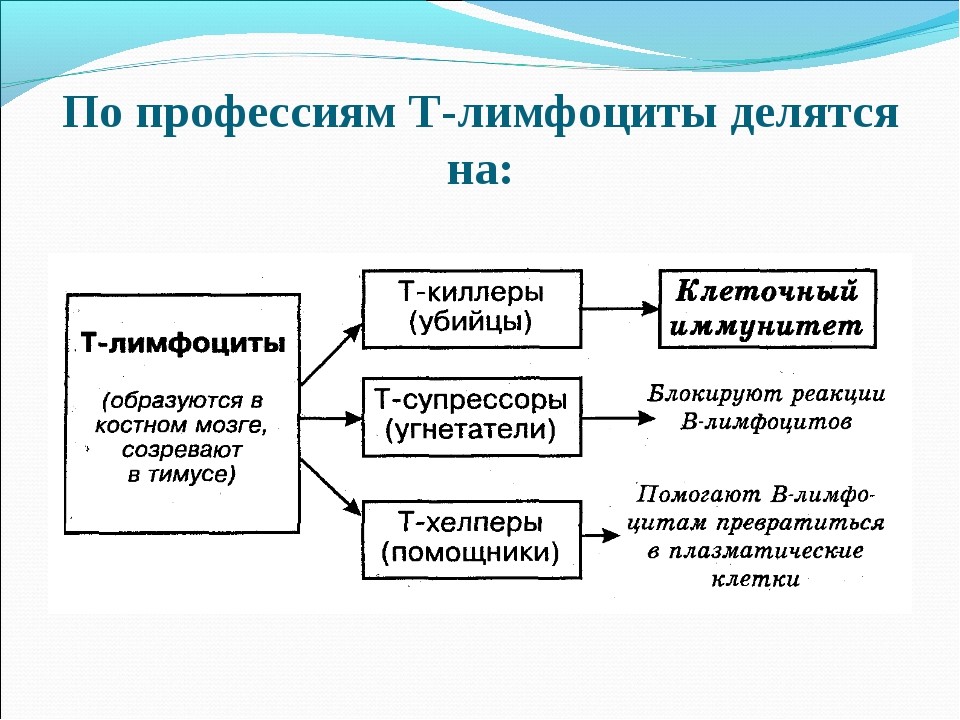
Т-лимфоциты распознают клетки, несущие чужеродные антигены, и уничтожают их после непосредственного контакта (атаки), а также выполняют функцию регуляции иммунного ответа.
Т-лимфоциты имеют подтипы (рис. 18):
Рис. 18. Подтипы Т-лимфоцитов и их функции
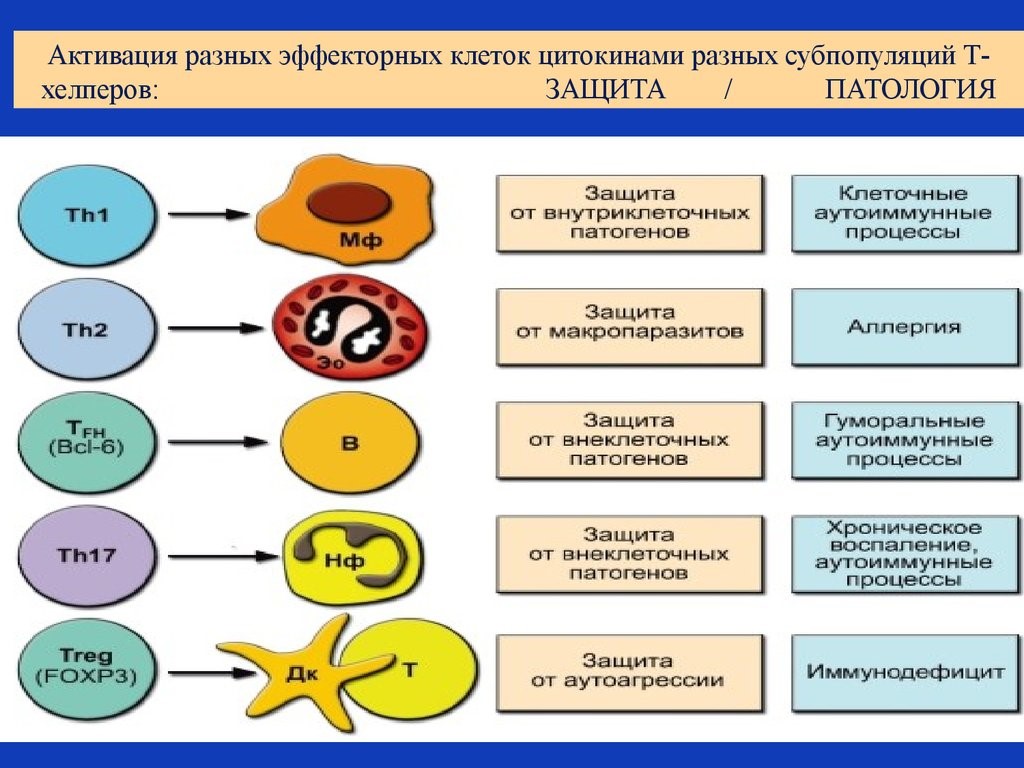
Рис. 19. Активация цитокинами разных субпопуляций Т-хелперов
Соотношение количества клеток CD4/CD8 называют иммунорегуляторным индексом (ИРИ). Если у пациента ИРИ повышен (более 2,2), то это говорит о чрезмерной активности T-хелперов и ослаблении регулирующей функции T-киллеров. При таком показателе иммунные клетки могут разрушать собственные ткани организма. Повышенный ИРИ чаще всего отмечается у пациентов с аутоиммунными болезнями (системной красной волчанкой, склеродермией, ревматоидным артритом и др.). Причиной чрезмерной активности T-хелперов может также стать опухоль вилочковой железы. При этой патологии продуцируется избыточное количество лимфоцитов. Высокие показатели ИРИ отмечаются при остром лимфобластном лейкозе. Это тяжелое онкологическое заболевание сопровождается неконтролируемым увеличением количества незрелых лимфоцитов.
Если иммунорегуляторный индекс понижен (менее1,6), то это говорит о серьезном ухудшении работы иммунитета. Низкие показатели ИРИ свидетельствуют о том, что в организме ослаблена функция защитных клеток, а регуляция со стороны T-киллеров чрезмерна. Обычно это отмечается при следующих патологиях, сопровождающихся иммунодефицитом: инфекционных болезнях (в том числе ВИЧ-инфекции); врожденном иммунодефиците; любых затяжных и хронических болезнях; опухолях костного мозга.
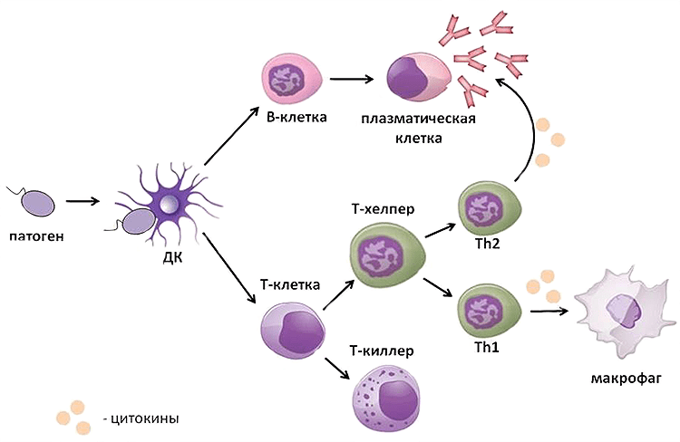
В-лимфоциты ответственны за гуморальное звено иммунитета – продукцию антител. После антигенного стимула В-лимфоцит превращается в лимфобласт – клетку, способную к делению. Часть лимфобластов дифференцируется в В-лимфоциты памяти, другая часть превращается в плазматические клетки, которые осуществляют продукцию антител.
В-лимфоциты несут на своей поверхности В-клеточный рецептор. При контакте с антигеном эти клетки активируются и превращаются в особый клеточный подтип – плазматические клетки, живущие до трех недель и обладающие уникальной способностью секретировать в этот срок тысячи антител.
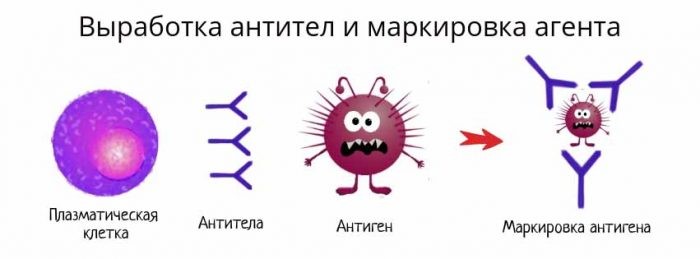
Антитело имеет сродство к распознаваемому им антигену, как бы «прилипает» к нему. Это дает возможность антителам обволакивать (опсонизировать) клетки и вирусные частицы, покрытые молекулами антигена, привлекая макрофаги и другие иммунные клетки для уничтожения патогена. Антитела также умеют активировать специальный каскад иммунологических реакций, называемый системой комплемента, который приводит к перфорации клеточной мембраны патогена и его гибели.
Рис. 20. Выработка антител и маркировка патогена
Различают несколько классов антител (иммуноглобулинов). Первыми после антигенного раздражения, вызывающих агглютинацию бактерий и нейтрализацию вирусов, появляются иммуноглобулины М (IgM). В длительном иммунитете участвуют иммуноглобулины G(IgG).
В табл.2 представлена интерпретация лабораторных исследований на наличие патогена на молекулярном уровне и с помощью тестов на иммуноглобулины М и G.
Таблица 2. Интерпретация лабораторных исследований на наличие патогена на молекулярном уровне
Результат молекулярного исследования
Инфицированный или повторно инфицированный пациент
Ранние стадии инфекции. Требуется дополнительное исследование
Инфекция. Требуется дополнительное исследование
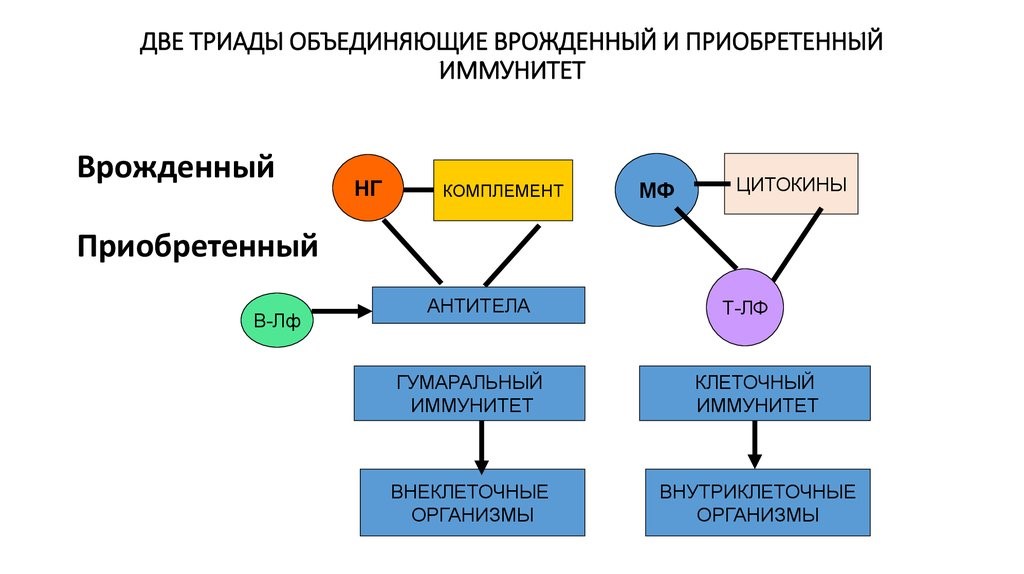
Врожденный и приобретенный виды иммунитета имеют точки соприкосновения, которые представляют две триады (рис.21)
Рис. 21. Две триады, объединяющие врожденный и приобретенный виды иммунитета
Развитие адаптивного иммунного ответа требует достаточно много времени (от нескольких дней до двух недель), и для того чтобы организм мог защищаться от уже знакомой инфекции быстрее, из Т- и В-клеток, участвовавших в прошлых битвах, формируются так называемые клетки памяти. Они, подобно ветеранам, в небольшом количестве присутствуют в организме, и, если появляется знакомый им патоген, вновь активируются, быстро делятся и целой армией выходят на защиту границ (рис.22).
Рис.22. Т-клетки памяти быстро формирует вторичный иммунный ответ
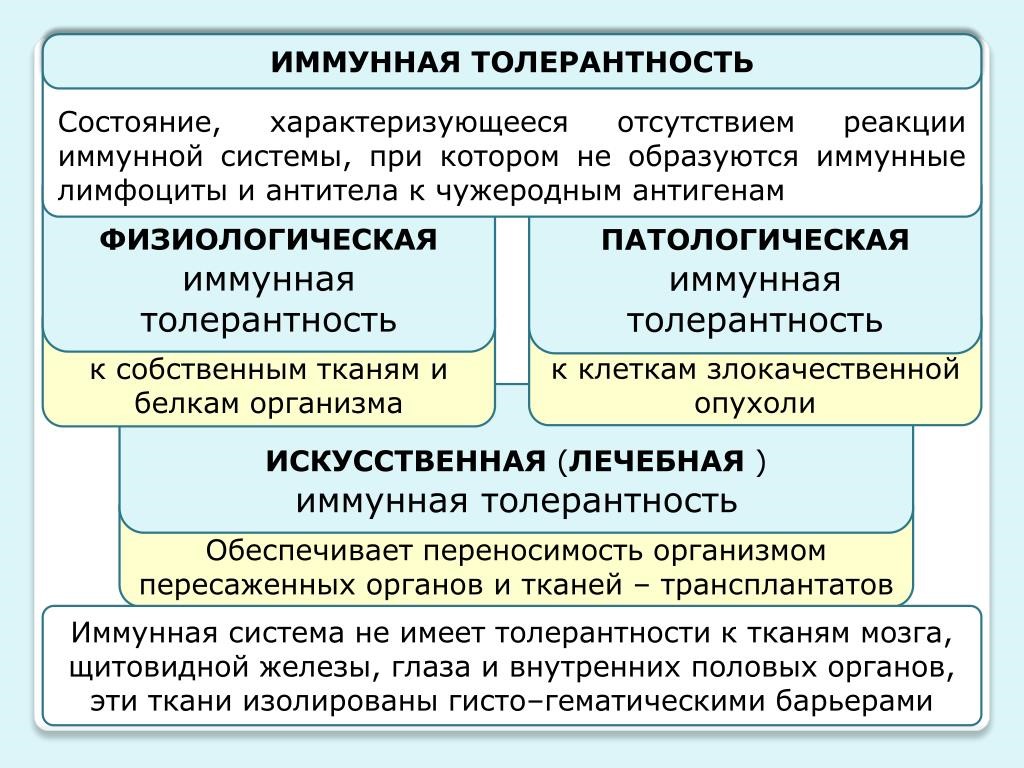
Иммунологическая толерантность
Под иммунологической толерантностью (терпимостью, ареактивностью) понимают отсутствие иммунного ответа на специфический антиген. Перечень антигенов, к которым может развиваться толерантность, практически неотличим от набора антигенов, против которых развивается специфический иммунный ответ (рис.23).
Рис. 23. Иммунная толерантность
Механизмы толерантности необходимы, поскольку иммунная система продуцирует огромное число разнообразных антиген специфичных рецепторов, и некоторые из них оказываются специфичными к собственным антигенам организма; толерантность предотвращает нежелательные реакции против собственных органов и тканей, также для нормального протекания беременности.
Нарушения иммунной системы у человека
Нарушения в работе иммунной системы можно подразделить на три категории: иммунодефициты, аутоиммунные заболевания и реакции гиперчувствительности.
Иммунодефициты
Иммунодефицит – снижение количественных показателей и/или функциональной активности основных компонентов иммунной системы, приводящее к нарушению защиты организма от патогенных микроорганизмов и проявляющееся повышенной инфекционной заболеваемостью.
Первичные иммунодефициты (ПИД) – наследственные заболевания, обусловленные дефектами генов, контролирующих иммунный ответ. В основном ПИД заявляют о себе уже в раннем детском возрасте, но иногда лишь к 30-40 годам жизни.
По механизмам развития выделяют 4 основные группы ПИД (табл.3):
Таблица 3. Некоторые первичные иммунодефициты
Частые бактериальные инфекции
Дефицит или полное отсутствие В-лимфоцитов
Антибиотики, пожизненное введение IgG
Частые респираторные инфекции, отиты
Дефекты Т- и В- лимфоцитов
Антибиотики, пожизненное введение IgG
Атаксия-телеангиоэкстазия (синдром Луи-Бар)
Аномалия двигательной функции, слабость мышц, нарушение речи
Дефицит Т- и В- лимфоцитов
ПИД, обусловленные дефектами фагоцитоза
Хроническая гранулёматозная болезнь
Частые пневмонии, гнойные инфекции
Пожизненная антибактериальная и противогрибковая терапия, интерферон гамма
ПИД, обусловленные дефектами в системе комплемента
Наследственный ангионевротический отек
Отеки губ и век при отсутствии зуда. Отеки гортани, носа, языка опасны для жизни
Низкая концентрация ингибитора эстеразы С1
Введение концентрата ингибитора эстеразы С1
Как следует из табл.3, основным и часто единственным методом лечения большинства пациентов с первичными В-клеточными иммунодефицитами являются иммуноглобулины. Это лекарственные средства, получаемые из плазмы крови человека. Они призваны заменить защитные антитела, отсутствующие в иммунной системе, с целью предотвращения или остановки развития тяжелых инфекционных заболеваний. Сегодня в арсенале врача имеются иммуноглобулины, различающиеся по концентрации активного вещества (5 и 10%), а также по способу введения (внутривенный и подкожный).
ПИД может проявиться в любом возрасте. В зависимости от этого у пациента возникают своеобразные проблемы, требующие определенных видов поддержки на протяжении всей жизни (табл. 4).
Таблица 4. Необходимость в видах поддержки пациента с ПИД в различных возрастных группах
В возрасте от 0 до 14 лет требуется уход со стороны родителей, направленный на профилактику инфекций и на период лечения. Могут потребоваться: обучение на дому; оказание психологической помощи; социальная поддержка в приобретении лекарственных средств.
В подростковом возрасте (14-18 лет) дополнительно могут возникнуть потребности в продолжении непрерывного обучения, профессиональной ориентации, налаживании взаимоотношений со сверстниками, организации досуга.
В возрасте от 18 до 65 лет у пациентов чаще возникают инфекционные осложнения, а с ними и расходы на приобретение лекарственных средств, не подлежащих восполнению, а также проблемы с трудоустройством.
В пожилом возрасте (старше 65 лет) возникают потребности в материальной, социальной и психологической поддержке пациента с ПИД.
Аутоиммунная патология
Повреждение собственных органов и тканей организма иммунной системой называется аутоиммунным процессом. Заболеваниями такого типа страдает около 5% человечества. В организме пациента развиваются боевые действия, напоминающие гражданскую войну: в атаку идут «свои против своих». В этой борьбе победителей нет – одни страдания.
Селекция Т-лимфоцитов в тимусе, а также удаление аутореактивных клеток на периферии (центральная и периферическая иммунологическая толерантность), о которых мы говорили ранее, не могут полностью избавить организм от аутореактивных Т-лимфоцитов. Что же касается В-лимфоцитов, вопрос о том, насколько строго осуществляется их селекция, до сих пор остается открытым. Поэтому в организме каждого человека обязательно присутствует множество аутореактивных лимфоцитов, которые в случае развития аутоиммунной реакции могут повреждать собственные органы и ткани.
В качестве аналога можно привести созданную турками в ХIV веке янычарскую пехоту, в которую набирали юношей-христиан 8-16 лет, воевших против своих сородичей.
Т-клеточная аутоиммуннная агрессия хорошо изучена при ревматоидном артрите, сахарном диабете первого типа, рассеянном склерозе и многих других болезнях.
Такие же клетки-янычары, не помнящие своего родства, прослеживаются среди В-лимфоцитов:
Например, вследствие срыва иммунологической толерантности происходит активация В-лимфоцитов, продуцирующих антитела. Это приводит к выраженному повышению выработки тиреоидных гормонов (Т4 и Т3), а также к увеличению щитовидной железы в размерах (гипертрофии). Патология носит название болезнь Грейвса.
Еще одним примером может быть миастения гравис, которая характеризуется слабостью скелетной мускулатуры вследствие образования аутоантител против структур, отвечающих за холинергическую передачу и сокращение мышечного волокна;
Как правило, аутоиммунное заболевание возникает внезапно, и невозможно точно определить, что стало его причиной. Считается, что триггером для запуска может послужить практически любая стрессовая ситуация, будь то перенесенная инфекция, травма или переохлаждение. Значительный вклад в вероятность возникновения аутоиммунного заболевания вносит как образ жизни человека, так и генетическая предрасположенность – наличие определенного варианта какого-либо гена.
Гиперчувствительность
Под гиперчувствительностью понимают чрезмерный иммунный ответ на какой-либо антиген. Реакции гиперчувствительности подразделяют на несколько типов в зависимости от их длительности и механизмов, лежащих в их основе:
Эффективные методы воздействия на иммунитет:
Спекулятивные методы вокруг иммунитета:
Заключение
Иммунная система представлена тремя уровнями: органным, клеточным и молекулярным со сложнейшими взаимодействиями между ними.
Современная иммунология различает два взаимодействующих компонента иммунной системы – врожденный и приобретенный (адаптивный) виды иммунитета, обеспечивающие развитие иммунного ответа на генетически чужеродные субстанции, которые представляют собой микроорганизмы, злокачественные опухолевые клетки, пересаженные органы и ткани.
Адаптивный иммунитет основывается на трех главных процессах: распознавание антигенов, их удаление (элиминация) и формирование иммунологической памяти.
Поломки в структуре иммунной системы приводят к развитию иммунодефицитов, аутоиммунным заболеваниям или реакции гиперчувствительности.
Иммунодефицит на генетическом уровне (первичный) или приобретенный (вторичный) может проявиться в любом возрасте и привести к повышенной инфекционной заболеваемости. В последние годы появились средства заместительной терапии, которые продлевают жизнь этим пациентам. Для повышения качества их жизни требуется не только обеспечение дорогостоящим лечением, но и организация поддержки со стороны семьи, психологов и социальных институтов.
Аутоиммунные заболевания и гиперчувствительность – это неспособность организма противостоять разбушевавшейся иммунной системе, которая перепутала свое и чужое.
К сожалению, ни одно из заболеваний иммунной системы медицина еще не научилась излечивать, а только применять заместительную терапию.
Эффективными профилактическими методами воздействия на иммунную систему являются вакцинация и здоровый образ жизни. Купить иммунитет в аптеке пока никому не удалось.