Интерфероногенные свойства что это
Интерфероногены
Интерфероногены
К интерфероногенам, или индукторам интерферонов, относится группа лекарственных средств, обладающих способностью усиливать синтез эндогенных интерферонов клетками организма, что влечет за собой повышение его (организма) устойчивости к вирусным инфекциям. Как правило, интерфероногенное действие этих лекарственных средств сочетается с их иммуностимулирующей активностью и/или общим стимулирующим влиянием на метаболизм.
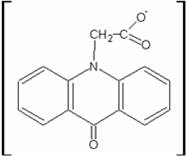
Препарат криданимод(син.: неовир) по химической структуре является производным антроцена. В основе противовирусного действия препарата лежит его способность индуцировать oбpaзование в организме высоких титров интерферонов, особенно ИНФ-а. Препарат обладает противовирусной активностью, распространяющейся как на РНК-, так и на ДНК-содержащие вирусы. Иммуностимулирующая активность препарата обусловлена его способностью активировать стволовые клетки костного мозга, Т-лимфоциты и макрофаги.
Применяют криданимоддля профилактики и лечения гриппа и острых респираторных вирусных заболеваний, инфекций, вызываемых вирусом семейства Herpesviridae, в том числе и цитомегаловирусных инфекций, острых и хронических гепатитов В и С, а также энцефалитов вирусной этиологии. Препарат, как правило, хорошо переносится больными.
Препарат тилорон по химической структуре относится к классу флуоренов. В основе механизма действия препарата лежит его стимулирующее (интерфероногенное) действие, в результате которого иммунокомпетентные клетки начинают синтезировать интерфероны α, β и γ. Основными структурами, продуцирующими интерфероны под воздействием тилерона, являются клетки эпителия кишечника, гепатоциты, Т-лимфоциты и лейкоциты.
Тилорон обладает способностью подавлять репродукцию ДНК-содержащих вирусов семейства Hepadnoviridae и Herpesviridae, а также некоторых РНК-содержащих вирусов семейства Orthomyxoviridae и Paramyxoviridae.
В клинической практике тилорон применяют для лечения вирусных гепатитов А, В и С, инфекционных заболеваний, вызванных вирусом герпеса, в том числе цитомегаловирусами, вирусных энцефаломенингитов, а также для профилактики и лечения гриппа и острых респираторных вирусных заболеваний.
Препарат хорошо всасывается в желудочно-кишечном тракте, его назначают в таблетках per os. Побочные эффекты на фоне лечения тилореном возникают редко и не требуют отмены препарата.
Способностью стимулировать выработку эндогенных интерферонов, т.е. интерфероногенной активностью, обладают не только противовирусные лекарственные средства, но и препараты других лекарственных групп. Так, например, препарат бендазол (син.: дибазол), широко применяемый в клинической практике в качестве спазмолитического препарата, обладает способностью активировать лейкопоэз и фагоцитоз, стимулировать oбpaзование антител, в связи с чем его используют для профилактики гриппа и острых респираторных вирусных заболеваний.
Краткое описание фармакологической группы. Интерфероногены криданимод, риданимод, тилорон, илорон усиливают синтез эндогенных интерферонов клетками организма, применяются для лечения вирусных гепатитов А, В и С, инфекционных заболеваний, вызванных вирусом герпеса.
ИНТЕРФЕРОН И ИНТЕРФЕРОНОГЕНЫ
Вещества, способные вызывать образование интерферонов – называются интерфероногены. К ним, помимо вирусов, многих бактерий, риккетсий, экстрактов грибков, относят различные химические вещества. Интерфероногенами являются, по сути, очень многие вещества: вакцины, иммуностимуляторы, лекарственные препараты. Считается, что сильной интерфероногенной активностью обладают препараты бактериальных липополисахаридов (продигиозан и др.), микробных полисахаридов (зимозан и др.).
Интерфероны оказывают не только противовирусное, но и антипролиферативное (противоопухолевое), иммуномодулирующее и радиопротективное действие.
В хромосомах человека клонированы структурные гены интерферонов всех трех классов (21 ген). Расшифровка их нуклеотидной последовательности позволила разработать генноинженерные методы получения рекомбинантных интерферонов. Последние не уступают природным по своей активности, при этом их действие лишено видовых ограничений.
Механизм противовирусного действия интерферона состоит из нескольких этапов. Интерферон, синтезированный соответствующими клетками под воздействием вирусов или других интерфероногенов, выходит из них и связывается со специфическими рецепторами тех же или соседних клеток. Эти рецепторы индуцируют внутриклеточный сигнал для синтеза ряда ферментов. Они активируются в зараженных клетках вирусными репликативными комплексами. При этом эндонуклеаза непосредственно расщепляет вирусную иРНК, а протеинкиназа блокирует инициацию трансляции вирусных белков на рибосомах клетки-«хозяина». В конечном итоге действие этих ферментов приводит к угнетению репродукции вирусов.
Таким образом, интерферон действует посредством регуляции синтеза нуклеиноных кислот и белков, активируя синтез ферментов и ингибиторов, блокирующих трансляцию вирусных и РНК. Как правило, интерферон не спасает клетку, уже пораженную вирусом, но предохраняет соседние клетки от вирусной инфекции.
Библиографический список
Глик Б., Пастернак Дж. Молекулярная биотехнология / Б.Глик, Дж. Пастернак. – М., Мир, 2002.
Фролов А.Ф., Вовк А.Д., Дядюн С.Т. и др. Эффективность рекомбинантного альфа-два-интерферона при вирусном гепатите В//Врачебное дело.- Киев, 1990.- № 9.- С. 105–108.
Интерфероногенные свойства что это
По мнению Хаитова Р.М.(2003), основным критерием для назначения иммуномодуляторов является клиническая картина заболевания, проявляющаяся хроническим инфекционно-воспали-тельным процессом, трудно поддающимся адекватному антиинфекционному лечению [23 ].
Таблица 1. Классификация индукторов интерферона [цит.по 10]
Синтетические соединения
Природные соединения
Индукторы интерферонов разных групп
Изучение эффективности индукторов при различных экспериментальных вирусных инфекциях выявило спектр активности этих препаратов и позволило наметить основные пути их дальнейшего клинического применения [ 8,9,14].
Таблица 2. Клиническое значение индукторов интерферона, разрешенных к применению МЗРФ (цит.по 8,14)
Амиксин
Кагоцел
Неовир
Полудан
Герпетический кератит и кератоконъюктивит икератоконьюнктивит
Ридостин
Известно, что одним из свойств индукторов интерферона является формирование в организме стойкой неспецифической резистентности длительный период времени после их введения, который может продолжаться иногда неделями. Сформировавшаяся резистентность не может быть объяснена только действием эндогенного интерферона, синтезированного в ответ на введение индуктора, так как этот интерферон выводится из организма гораздо раньше. Резистентность, по-видимому, является следствием непосредственного влияния индукторов интерферона на клеточный и гуморальный иммунитет, что требует углубленного и детального изучения [9].
Применяемые в клинике индукторы интерферона, индуцируют синтез смеси альфа, бета, гамма- интерферонов в разных пропорциях. Они хорошо сочетаются с другими индукторами, интерферонами разных типов, иммуномодуляторами и химиотерапевтическими средствами. Важно особо подчеркнуть, что комбинированное их введение с другими препаратами часто приводит к синергидному эффекту.
Хотя активность индукторов практически аналогична активности интерферонов, но они ( индукторы) имеют свои «точки приложения» в иммунной системе.
Например, амиксин вызывает медленную продукцию интерферона Т-лимфоцитами, а циклоферон вызывает быструю продукцию интерферона В-лимфоцитами.
Заметно отличаются индукторы и по способности «включать» синтез интерферона в различных органах (мозг, легкие, печень, селезенка и др.), что определяет тактику их использования при различных вариантах органной патологии. Так низкомолекулярные препараты (циклоферон, амиксин) способны преодолевать гематоэнцефаличесий барьер, поэтому активны при вирусных энцефалитах.
У индукторов интерферона есть достоинства, выходящие за рамки только «включения» системы интерферона. Как недавно показано в наших исследованиях, циклоферон вызывает образование ряда провоспалительных и противовоспалительных цитокинов. Это очень важное обстоятельство позволяет рассматривать данный препарат как биорегулятор цитокиновой сети.
Необходимо отметить и некоторые преимущества [9,10] индукторов интерферона:
Наконец, некоторые индукторы интерферона обладают уникальной способностью «включать» синтез интерферона в определенных популяциях клеток и органов, что в ряде случаев имеет определенные преимущества перед поликлональной стимуляцией иммуноцитов интерферонами.
Эта группа препаратов не лишена и недостатков:
Основными условиями для медицинского применения индукторов интерферона служат:
Для правильного использования индукторов интерферона, когда их биологические эффекты выявляются наиболее полно, необходимо знать:
Характеристика индукторов интерферона ( цит.по 8,14)
Амиксин— стимулирует образование альфа/бета и гамма интерферонов, усиливает антителообразование,обладает антибактериальным и противовирусным действием.Пик накопления интерферона в крови (60-120 МЕ/мл) отмечается через 12-18 часов после приема, затем полностью исчезает из кровотока к 72 часам.В лейкоцитах человека индуцированный интерферон не превышает 120 МЕ/мл.
Противопоказания: болезни почек, аллергические заболевания
Наибольшей чувствительностью к препарату обладают лейкоциты больных гриппом, генитальным герпесом.
Кагоцел — индуцирует поздний тип интерферона, пик продукции которого приходится на 48-72 часа, уровень его медленно снижается к 120 часам от момента введения препарата.
Наибольшей чувствительностью к препарату обладают лейкоциты больных генитальным герпесом, гриппом, ангиной, ОРВИ.
Арбидол — противовирусный препарат с интерферониндуцирующей активностью,оказывает ингибирующее действие на вирусы гриппа А,В; стимулирует фагоцитоз и антителообразование,Стимулирует гуморальные и клеточные реакции иммунитета.
ЦИКЛОФЕРОН
Метилглюкамина акридонацетат
Клинические исследования эффективности циклоферона проводились у детей и включали плацебо-контролируемые, сравнительно-контро-лируемые исследования. Мы приводим ниже основные результаты, полученные при исследовании эффективности препаратов циклоферона при различной патологии.
Вирусные гепатиты. Исследования проводились у детей, страдающих вирусными хроническими гепатитами с парентеральным механизмом заражения. В результате законченных исследований, установлено, что первичная ремиссия наблюдалась у 47,2%, а стабильная ремиссия у 55,4%, причем полная ремиссия установилась у 44,4% больных, рецидивы заболевания регистрировались лишь в 5,6% случаев.
У наркозависимых подростков с хроническим гепатитом С наблюдалась нормализация иммунного дисбаланса. Клиническое улучшение отмечено у 85% пролеченных лиц. Это проявилось в нормализации пигментного обмена, размеров печени, купированием болевого синдрома и цитолиза. Репликативная активность вируса сохранялась после 4-х месячного курса лечения, но у 58% пациентов уровень виремии снижался от 2-х до 7 раз. Максимальное снижение идет у больных с умеренной и низкой «нагрузкой» (до 600 000 копий), более низкий эффект у больных с высокой виремией (до 1-8 млн. копий) [2,6,7,18].
Повышение эффективности лечения гастродуоденальной патологии ( хронический гастродуоденит) с использованием циклоферона увеличилось на 20%. Терапия была направлена на элиминацию H.pylori, а также повышение иммунной защиты организма.
При наблюдении в катамнезе за детьми, страдающими хроническими эрозивными гастродуоденитами, после терапии циклофероном, отмечен рецидив у 6.0% больных, против 17-20.0% больных, получавших стандартный курс терапии [11].
Респираторные заболевания. При проведении многоцентровых плацебо-контролируемых исследований ( «эпидемиологический опыт») у детей и подростков, относящихся к категории часто и длительно болеющих отмечено снижение респираторной заболеваемости в 2.6-2.9 раза, установлен уровень защиты от 41 до 61%. При атопических состояниях наблюдалось снижение уровня Ig E и уменьшение в 2.4 раза частоты рецидивов и повторных обструктивных синдромов. При лечении бронхитов снижается частота и длительность рецидивов заболевания, за счет нормализации параметров иммунного ответа [4,5,15,17].
Результаты, вызывающие определенный интерес отмечены при использовании таблетированной лекарственной формы циклоферона в комплексной терапии острых кишечных инфекций [12,19,20].
Микробиологическая санация организма регистрировалась у 90,3% больных получавших циклоферон при дизентерии, сальмонеллезе, а применение циклоферона при сальмонеллезной инфекции обеспечило нормализацию микроэкологии просвета толстой кишки, увеличение индигенной анаэробной и факультативно-анаэробной флоры, элиминацию возбудителя и условно-патогенной микрофлоры, повышение уровня местного секреторного иммуноглобулина А. Включение циклоферона в терапию ротавирусных инфекций у детей приводило к стимуляции синтеза противоротавирусных антител ( до 0.58 отн.ед., против 0.36-0.39 до начала терапии и у больных группы сравнения), обеспечивая быструю санацию кишечника от возбудителя.
При клещевых нейроинфекциях отмечено сокращение лихорадочного периода и сроков санации ликвора, что привело к сокращению длительности пребывания в стационаре, а также к быстрейшему купированию менингеальных симптомов. В катамнезе в течение года не отмечено хронизации процесса.
Анализ клинического течения заболевания при бактериальных менингитах не выявил особой разницы в группе больных, получавших циклоферон и в группе сравнения; Но в группе больных, получавших циклоферон, обратное развитие субдурального выпота происходило на фоне консервативной терапии, а в группе сравнения в половине случаев, пришлось прибегнуть к дренированию субдурального пространства.
Таким образом, фармакотерапевтическая эффективность циклоферона при столь широкой патологии обеспечивается его механизмом действия, включающим противовирусный, интерферониндуцирующий, иммунокорригирующий и противовоспалительный компоненты [17, с.99-109].
Использование интерферонов в профилактике и лечении респираторных вирусных инфекций у взрослых и детей
В статье представлен анализ отечественных и зарубежных публикаций, отражающих эпидемиологические особенности гриппа и респираторных вирусных инфекций. Показана эффективность вакцинации против гриппа, проводимой на протяжении последних 17 лет. Представлены
The article analyzes national and foreign publications covering epidemiologic features of influenza and respiratory viral infections. Efficiency of vaccinations against influenza which has been held during the last 17 years, was shown. The results of interferon application, starting from the first years since it was discovered, were presented. The structure of ARVI and influenza morbidity, with allocation of age groups which were mostly involved in the epidemiologic process, was described. The material analysis allows to conclude that, in the period of epidemiologic increase in ARVI morbidity, timely application of recombinant interferon preparations for prevention and treatment allows to reduce influenza and ARVI morbidity, first of all, in organized groups of children and among the contingent under the risk.
Респираторные вирусные инфекции, в число которых входит и грипп, всегда представляли серьезную проблему общественного здравоохранения [1, 2]. Только за последние 100 лет зарегистрировано, описано и изучено 4 пандемии и 2 глобальные эпидемии гриппа, во время которых по разным оценкам умерло более 50 млн человек [3]. Несмотря на то, что человечество борется с гриппом на протяжении столетия, значительные успехи в борьбе с этой инфекцией достигнуты лишь в последние десятилетия.
За время изучения вирусов гриппа после их выделения от больных людей (1933 г. — вирус гриппа типа А; 1940 г. — вирус гриппа типа В; 1947 г. — вирус гриппа типа С) было установлено, что только вирус гриппа типа А способен к пандемическому распространению. Он вызывает ежегодные сезонные эпидемии и поражает не только людей, но и различных животных [4, 5]. Вирусы гриппа вызывают ежегодные сезонные эпидемии среди населения, а разные его подтипы широко циркулируют среди животных. У вирусов гриппа типа A обнаружено 17 вариантов гемагглютинина (H) и 10 вариантов нейраминидазы (N). Вирусы гриппа типа А подразделяют на подтипы, в соответствии с сочетаниями 2 видов белков вируса (H и N), расположенных на его поверхности.
Гемагглютинин связывает вирус гриппа с рецепторами клеток-мишеней человека, а нейраминидаза участвует в высвобождении новых вирусных частиц. РНК вируса гриппа состоит из фрагментов, которые кодируют синтез различных вирусных белков. Эта фрагментарность и определяет изменчивость вируса, так как при воспроизведении РНК легко возникают «ошибки» в расположении этих фрагментов по отношении друг к другу, что и приводит к мутациям и рекомбинациям [5].
У вируса гриппа постоянно происходят мутации в генах, кодирующих структуру гемагглютинина и нейраминидазы. Такие изменения называют «антигенным дрейфом». В результате этого возникают сезонные эпидемии, когда в основном болеют дети и те взрослые, которые раньше не встречались с похожим вирусом. Если же в клетки человека, птицы или животного попадут одновременно два разных подтипа вируса гриппа, то между ними возможна рекомбинация генов (реассортация). Возникает новый подтип вируса, у которого на поверхности будет находится «смесь» родительских антигенов «Н» и «N». Такие изменения называют «антигенный шифт».
Этот новый подтип вируса гриппа может за один-два года поразить на нашей планете огромное количество людей любого возраста, поскольку у них нет к нему адаптивного иммунитета. При этом заболевание может протекать тяжелее, возрастет в несколько раз летальность от гриппа и от его осложнений. Такие глобальные эпидемии (пандемии) на разных полушариях начинаются в разные сезоны года [5].
Антигенная изменчивость вируса позволяет ему ускользать от воздействия иммунной системы организма человека. Благодаря этому новый антигенный подтип вируса гриппа избегает сдерживающего эффекта коллективного иммунитета, приобретенного населением в период предыдущих эпидемий. Появление совершенно новых вариантов вируса гриппа типа А происходит нерегулярно. Эти события непредсказуемы и, как правило, могут быть неожиданными [6].
В отличие от большинства вирусов, вызывающих острые респираторные вирусные инфекции (ОРВИ), вирус гриппа отличается высокой вирулентностью, контагиозностью, низкой иммуногенностью и чрезвычайно высокой изменчивостью. Кроме того, разные подтипы вируса гриппа типа А способны инфицировать и циркулировать в организме не только человека, но и животных. Поэтому существует реальная угроза появления новых вирусов гриппа за счет реассортации «свиного», «птичьего» и других вирусов на основе скрещивания свиного, птичьего и других вирусов [6].
Благодаря значительным и впечатляющим успехам в результате применения программ вакцинопрофилактики в борьбе с инфекционными болезнями удалось добиться многократного снижения заболеваемости, прежде всего инфекциями дыхательных путей.
Вместе с тем ежегодно в мире до 2 млрд человек переносят инфекционные заболевания, из которых около 17 млн умирают. Ежегодно возникают эпидемии сезонного гриппа и респираторных вирусных инфекций, во время которых регистрируют до 5 млн случаев тяжелого гриппа, из которых до 500 000 имеют летальный исход [2].
По данным Всемирной организации здравоохранения ежегодно каждый взрослый человек «болеет» острыми респираторными инфекциями 2–4 раза, школьник — до 4–5 раз, дошкольник — до 6 раз, а ребенок в возрасте до 1 года имеет от 2 до 12 эпизодов болезни [2, 7].
Во время сезонных подъемов заболеваемости ОРВИ и гриппа в эпидемический процесс вовлекается до 20% населения, половину которых составляют дети в возрасте до 14 лет.
Анализ помесячной динамики заболеваемости ОРВИ и гриппом в Российской Федерации за 2015–2017 гг. показывает, что случаи заболеваний регистрируются круглый год, и только в течение трех месяцев с июня по август отмечается спад заболеваемости. В период эпидемического сезона с октября по апрель выявляют самые высокие показатели заболеваемости, особенно в январе-марте (рис. 1).
Для современной эпидемической ситуации ОРВИ и гриппа характерно распространение заболеваний в основном среди городских жителей, на долю которых приходится около 85% всех заболеваний. При ОРВИ на долю детей в возрасте до 17 лет приходится более 70% всех заболеваний.
Наиболее вовлечены в эпидемический процесс ОРВИ и гриппа дети первых лет жизни и подростки. Причем среди заболевших на детей возрастной группы от 3 до 6 лет, посещающих детские дошкольные организации, приходится более 80% случаев (рис. 2).
На протяжении последнего десятилетия в Российской Федерации ежегодно регистрируют до 35 млн случаев инфекционных (паразитарных) заболеваний, из них более 90% случаев приходится на ОРВИ и грипп, которыми в течение года переболевает до 30% населения Российской Федерации [7]. На долю заболеваний, вызываемых респираторными вирусами и вирусами гриппа, приходится до 40% больничных листов, а экономический ущерб от них составляет до 100 млрд рублей в год, т. е. более 80% совокупного ущерба от инфекционных заболеваний [6, 7].
Для нашей страны, также как и для всех стран мира, значительный социально-экономический ущерб от ОРВИ обусловлен высокими показателями заболеваемости, разнообразием вирусов, вызывающих клинически сходную картину. В настоящее время известно более 200 вирусов, вызывающих сходные заболевания [5, 7].
В Российской Федерации и странах северного полушария в настоящее время ОРВИ, включая грипп, остаются по-прежнему массовыми инфекционными болезнями [6].
По мнению ВОЗ самым эффективным научно обоснованным методом борьбы с гриппом является вакцинопрофилактика. Эффективность вакцинации против гриппа доказана многолетним мировым опытом и может составлять 70–90%. Для достижения эффекта вакцинации необходимо ежегодно охватывать прививками против гриппа не менее 75% людей в каждой группе высокого риска заражения [2, 8].
Результаты вирусологического мониторинга, проводимого ВОЗ, показали растущую резистентность штаммов вирусов к противовирусным препаратам. Наличие нежелательных явлений при их приеме, противопоказаний и ограничений к применению подчеркивает большую значимость вакцинопрофилактики [8].
Ежегодно увеличивающийся охват населения прививками против гриппа в Российской Федерации привел к снижению заболеваемости среди контингентов населения, входящих в группы риска, что подтверждено данными Минздрава России и Роспотребнадзора, среди которых достигается наиболее высокий процент охвата вакцинации. Постоянное планомерное увеличение объема прививок против гриппа среди контингентов, подлежащих вакцинации, позволило достичь в 2017 г. самого высокого охвата прививками за все годы проведения иммунизации (67,3 млн человек, т. е. 46,6% населения).
В 2017 г. по сравнению с 2000 г. на фоне увеличения охвата населения прививками против гриппа в 4,3 раза показатель заболеваемости гриппом в Российской Федерации снизился в 85 раз (с 2973,3 на 100 тыс. нас. до 34,93 на 100 тыс. нас. соответственно) (рис. 3).
Несмотря на резкое снижение заболеваемости гриппом за последние десятилетия в стране, по данным Роспотребнадзора, ежегодно около 30 млн случаев заболеваний ОРВИ, включая грипп, регистрируются во всех субъектах Российской Федерации (табл.).
Только вакцинопрофилактика гриппа не может решать в полной мере проблему ОРВИ, так как у привитых формируются антитела только к штаммам вируса гриппа, входящим в состав вакцины, а в этиологической структуре ОРВИ в настоящее время вирусы гриппа занимают от 5% до 15% (рис. 4). Против других респираторных вирусных заболеваний специфическая профилактика не разработана. Кроме того, не все вакцинируемые отвечают формированием протективного иммунитета, а также вакцины против гриппа не могут использоваться в разгар эпидемии [7].
Поэтому профилактика гриппа и ОРВИ должна быть комплексной, включая проведение неспецифической профилактики с широким применением противовирусных препаратов и лекарственных средств, которые могут оказывать существенное влияние как на предупреждение возникновения заболеваний, так и на благоприятный исход возникшего заболевания.
Среди средств неспецифической профилактики гриппа и ОРВИ особое место занимают препараты интерферонового ряда. Впервые интерферон (ИФН) был получен в 1957 г. и описан английским вирусологом Аликом Айзексом как «белок, значительно меньший, чем иммуноглобулины, который производится клетками различных видов животных после заражения живыми или инактивированными вирусами и способный ингибировать рост разнообразных вирусов в клетках тех же видов животных в дозах, нетоксичных для клеток». Первые исследования интерферона, проведенные английскими учеными, показали его эффективность при лечении кератита, вызванного вирусом осповакцины [9].
Антибактериальные препараты бессильны против болезней, возбудителями которых являются вирусы. Поэтому некоторые исследователи называют интерферон «противовирусным антибиотиком» широкого спектра действия, так как интерферон образуется живыми клетками и способен угнетать вирусы и задерживать размножение почти всех известных вирусов, в то же время оставаясь безвредным для организма [9].
В 1960 г., уже через три года после открытия ИФН, в Советском Союзе в лаборатории новых антибиотиков Центрального института усовершенствования врачей (ныне ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России), которую возглавляла Зинаида Виссарионовна Ермольева, впервые был получен противовирусный препарат интерферона — человеческий лейкоцитарный ИФН для интраназального введения [9].
В 1961 г. английский вирусолог Д. А. Тиррелл впервые исследовал на себе и на своих сотрудниках перспективу интраназального применения ИФН для профилактики респираторных заболеваний и гриппа. Предварительное закапывание в нос ИФН и последующее заражение вирусом Коксаки вызывало лишь легкое недомогание, но не заболевание, в то же время никаких побочных симптомов от применения интерферона у испытуемых не отмечалось [9].
В СССР уже в 1962 г. на добровольцах был получен адъювантный эффект отечественного ИФН при вакцинации, и он был впервые применен для лечения тяжелой формы гриппа, а также как профилактическое средство. В 1964 г. этот препарат с успехом применялся в глазной клинике для лечения вирусного кератоконъюнктивита. В дальнейшем исследования подтвердили безопасность и эффективность лечения вирусных конъюнктивитов с помощью ИФН [9].
Отечественный человеческий лейкоцитарный ИФН для интраназального введения стал первым препаратом, получившим широкое применение в практике здравоохранения Советского Союза.
Во время эпидемии гонконгского гриппа 1968–1969 гг. в СССР была показана высокая эффективность интраназального применения лейкоцитарного ИФН у детей и взрослых.
Однако оказалось, что человеческий лейкоцитарный ИФН имеет недостатки, заключающиеся в низкой степени очистки от вирусных частиц (например, вирусов гепатитов и др.). Эта проблема была решена в середине 80-х гг. прошлого столетия, когда с помощью методов генной инженерии был получен рекомбинантный ИФН, идентичный ИФН человека по аминокислотному составу [9].
После проникновения вируса в организм человека, в большинстве случаев иммунная система реагирует выработкой антител, защитный титр которых появляется на 10–14 день, достигая максимума еще через две недели. Преимущество интерферона заключается в том, что его выработка начинается практически сразу после проникновения вируса в организм, достигая максимума уже на 2-й день. Поэтому ИФН считают первой линией защиты организма от вирусов (рис. 5).
Интерфероны как эндогенные иммуномодуляторы можно отнести к полифункциональным биорегуляторам. Они определяют феномен невосприимчивости клеток к повторному заражению вирусом и обладают комбинированным свойством этиотропного и иммуномодулирующего действия, что позволяет включать их в комплексное лечение гриппа и ОРВИ [8].
В настоящее время наиболее изученными и широко применяемыми являются интерфероны первого типа: ИФН-α и ИФН-β. Действие этих ИФН защищает генетическую информацию клеток хозяина от изменений генома, вызываемого вирусами, и ограничивает пролиферацию поврежденных клеток. При обнаружении патогенных микроорганизмов, вирусов и бактерий макрофаги и дендритные клетки производят ИФН 1-го типа (ИФН-α и ИФН-β). Плазмоцитоидные дендритные клетки вырабатывают ИФН-α, а фибробласты и эпителиальные клетки — ИФН-β. При действии ИФН 1-го типа на дендритные клетки и макрофаги усиливается воздействие на Т- и В-клетки, приводящее к увеличению выработки специфических к вирусу антител.
Интерфероны оказывают действие на все клетки иммунной системы, на продукцию ИФН-α, синтезируемого на первых этапах иммунного ответа, и служат мощными активаторами продукции ИФН-γ, еще задолго до начала его синтеза Т-лимфоцитами [8].
Следует учитывать, что не у всех людей иммунная система способна адекватно реагировать как на внедрение в организм вируса, так и на введение вакцины.
Оптимальная комплексная профилактика ОРВИ, включая грипп, должна проводиться по двум основным направлениям: специфическая иммунопрофилактика и неспецифическая, направленная на усиление иммунорезистентности организма, преимущественно школьников и других возрастных групп риска, с применением в том числе препаратов ИФН.
Одна из основных причин частых и повторных ОРВИ и более тяжелого течения гриппа — несостоятельность местного иммунитета. Учитывая это обстоятельство, неспецифическая профилактика гриппа и ОРВИ в первую очередь должна быть направлена на усиление защитных свойств слизистых оболочек верхних дыхательных путей, что возможно при использовании иммуномодуляторов местного действия. Многочисленные исследования по применению, в рамках профилактических программ, ИФН-α2b, доказывали его эффективное противовирусное действие при всех респираторных инфекциях.
Установлено, что местное применение препаратов рекомбинантного интерферона (капли, мази и др.) оказывается эффективным за счет достижения высоких концентраций активного вещества непосредственно в очаге поражения, при этом развитие аутоиммунных процессов минимизируется [8].
В современных условиях в практике здравоохранения успешно применяют различные противовирусные средства, среди которых достойное место занимают интерферонсодержащие препараты (Гриппферон, Генферон, Реаферон, Виферон, Альфаферон).
Исследования, проводимые на протяжении последних лет, подтвердили, что одним из наиболее эффективных, безопасных и доступных препаратов рекомбинантного интерферона, которые применяются как с профилактической, так и лечебной целью при гриппе и различных ОРВИ, является препарат интерферона — Гриппферон. Данный препарат производится в виде готовых форм — стабильные назальные капли и спрей дозированного применения, а для людей с аллергическим ринитом выпускается мазь назальная с лоратадином.
Гриппферон содержит ИФН-α2b человеческий рекомбинантный не менее 10000 МЕ/мл. Полимерная основа в составе препарата обеспечивает более прочный контакт с клетками слизистой оболочки носа и способствует проникновению интерферона в межклеточное пространство. Препарат не имеет аналогов в мире и разрешен к применению у взрослых и детей с первых дней жизни.
Многолетний опыт изучения Гриппферона подтверждает его противовирусное действие для большинства респираторных вирусов, вызывающих ОРВИ. Особенность Гриппферона — прямое воздействие на первопричину заболевания — препарат предотвращает репродукцию вирусов в зараженном организме. Профилактическое использование препарата в организованных коллективах способствовало снижению заболеваемости гриппом и ОРВИ в 2,5–3,5 раза. Своевременное назначение ИФН-α2b, особенно на ранних стадиях заболевания, приводит к сокращению продолжительности болезни на 30–50%. Преимуществом препарата Гриппферон является то, что он может использоваться не только для профилактики, но и для лечения гриппа и ОРВИ у новорожденных, детей, беременных, взрослых, пожилых людей и пациентов с сопутствующими хроническими инфекциями, вариантами аллергозов, независимо от состояния их иммунного статуса [10–12].
Убедительная клиническая эффективность и переносимость препарата Гриппферон была показана на 7500 пациентах, применявших препарат как с лечебной, так и профилактической целью, не было зарегистрировано осложнений и побочных эффектов [13].
Клинико-лабораторная оценка использования препарата Гриппферон, капли назальные у детей с острой респираторной патологией в лечебных и оздоровительных учреждениях достоверно подтвердила его эффективность — сокращение сроков проявления катарального синдрома (ринит, кашль, гиперемия зева), интоксикации и лихорадки. При использовании препарата в санаториях бронхолегочного профиля было установлено, что снижалась частота повторных ОРВИ [14].
При изучении действия препарата Гриппферон, капли назальные у недоношенных детей в первые 7 недель жизни, имевших контакты с заболевшими ОРВИ, было показано снижение случаев заболевания (в 3,5 раза), а также сокращение как длительности заболевания (в 1,3 раза), так и частоты развития осложнений (в 9,2 раза). Индекс профилактической эффективности составил 9,2 [15].
Проведенное в Ивановском НИИ материнства и детства им. В. Н. Городкова (ФГБУ Ивановский НИИ материнства и детства им. В. Н. Городкова МЗ РФ) изучение эффективности применения препарата Гриппферон у недоношенных детей, родившихся с низкой массой тела и контактировавших с больными ОРВИ, показало, что у 38,5% детей из группы наблюдения заболевание не наступило, тогда как в группе сравнения заболело 96,2% детей. Средняя продолжительность клинического проявления заболевания была почти в два раза короче у детей из группы наблюдения по сравнению с детьми контрольной группы (6,4 против 11,5 дня соответственно). Частота осложнений в группе наблюдения составила 5,7%, тогда как в группе сравнения — у каждого пятого ребенка [16]. Аналогичный результат, показавший эффективность применения препарата Гриппферон, был получен и у детей в возрасте от 3 месяцев до 3 лет, контактировавших с больными ОРВИ.
На кафедре инфекционных болезней РМАНПО (ФГБОУ ДПО Российская медицинская академия непрерывного профессионального образования МЗ РФ) была проведена неспецифическая профилактика ОРВИ и гриппа препаратом Гриппферон среди медицинских работников групп риска в период эпидемического сезона 2016–2017 гг. В группу риска вошли все сотрудники кафедры, а также медицинский персонал инфекционного отделения больницы.
Профилактическое применение препарата Гриппферон проведено в два этапа: первый совпал с пиком заболеваемости гриппом в осенне-зимний период, а второй — с началом второй волны эпидемической заболеваемости, что позволило всем наблюдаемым из группы риска избежать заболевания ОРВИ и гриппом.
Таким образом, в рамках неспецифической профилактики гриппа и ОРВИ важное значение имеет своевременное применение, как с профилактической, так и с лечебной целью, препаратов, содержащих интерферон. Широкое использование в практике здравоохранения препаратов на основе рекомбинантных интерферонов, в частности препарата Гриппферон, уже сегодня может привести к значительному снижению заболеваемости населения ОРВИ и гриппом, а также снизить частоту эпидемических вспышек, в первую очередь в организованных коллективах и среди контингентов, относящихся к группам риска.
Литература
ФГБОУ ВО МГМСУ им. А. И. Евдокимова МЗ РФ, Москва
Использование интерферонов в профилактике и лечении респираторных вирусных инфекций у взрослых и детей/ Н. Д. Ющук, О. С. Хадарцев
Для цитирования: Лечащий врач № 3/2018; Номера страниц в выпуске: 67-72
Теги: вакцинация, заболеваемость, вирусные инфекции, профилактика









.gif)
.gif)
.gif)
.gif)
.gif)
.gif)