Интервал pq укорочен что значит
Интервал pq укорочен что значит
Несмотря на высокую медицинскую актуальность и общественный резонанс на случаи внезапной сердечной смерти (ВСС) профилактические мероприятия по поводу укороченного интервала PQ, должная диспасеризация, комплексное обследование пациента и профилактика проводятся недостаточно. Это связано со слабой настороженностью при укорочении PQ, вследствие большого количества бессимптомного течения, неунифицированным алгоритмом обследования, недоcтаточной информированностью о механизме формирования интервала PQ и возможной профилактике нарушения работы AV соединения.
Ведущим в формировании интервала PQ является не время проведения импульса от синусового узла к AV узлу, по основным или дополнительным путям, а время задержки импульса в самом AV узле. Одним из механизмов формирования укороченного интервала PQ является нарушение работы AV соединения, выражающееся в уменьшении времени задержки импульса из синусового узла [4].
Причинами, нарушающими работу AV соединения и приводящих к укорочению интервала PQ, могут быть, как функциональные нарушения в организме в целом, так и структурные нарушения сердца
(рис. 1).
Cтруктурные нарушения в сердце встречаются практически у всех лиц с феноменом. укороченого интервала PQ.[5][6] Дополнительные анатомические образования (МАРС) в серце, не влияющие на внутрисердечную гемодинамику, могут быть источником повышения электрической активности клеток миокарда в местах этих образований. Функциональные нарушения в организме, нарушая функцию AV соединения, активизируют аритмогенные механизмы и способствуют переходу феномена укороченого интервала PQ в синдром CLC.
Оценка риска нарушения ритма проводится по индексу PQs, а не по интервалу PQ. Риск внезапного нарушения ритма при тахикардии возможен при любом интервале PQ. Доля риска при разном интервале PQ возрастает по мере укорочения интервала. У лиц с абсолютно укороченным интервалом PQ, риск встречается в 70 % случаев, при относительном укорочении PQ в 40 % и при нормальном PQ в 7 %. [4] Это объясняется тем, что риск нарушения ритма связан не со временем укорочения интервала PQ, а с уменьшением времени сегмента PQ. Укорочение сегмента PQ создает условия для возникновения внутрисердечного гемодинамического конфликта между предсердиями и желудочками во время их систолы. Объективизировать наличие и степень риска можно с помощью индекса PQs, отображающего в процентах долю сегмента PQ ко всему интервалу PQ. В норме такое соотношение составляет 25 % и более как в покое, так и при учащении ЧСС [4]. Чем ниже индекс PQs, тем выше риск нарушения ритма сердца при тахикардии. У лиц с укороченным интервалом PQ необходимо проводить оценку и степень риска, как в покое, так и после нагрузки т.к. наиболее яркое снижение индекса PQs происходит после нее.
Изменение работы АV соединения чаще всего является следствием нарушения регуляции со стороны ВНС, нарушения электролитного баланса, нарушения клеточного метаболизма кардиомиоцитов. [2, 6]. Устраняя эти функциональные нарушения можно профилактировать переход феномена укороченого PQ в синдром CLC, уменьшать риск нарушения ритма сердца приводящего к внезапной сердечной
смерти.
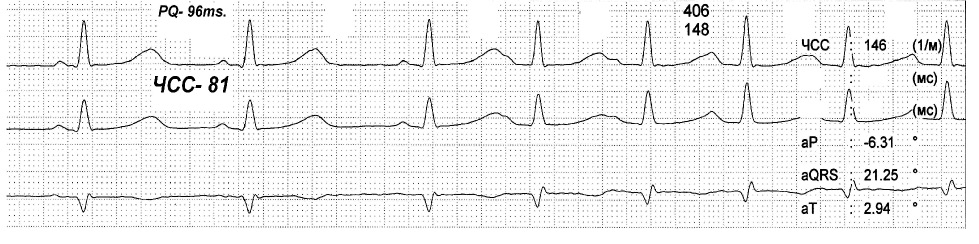
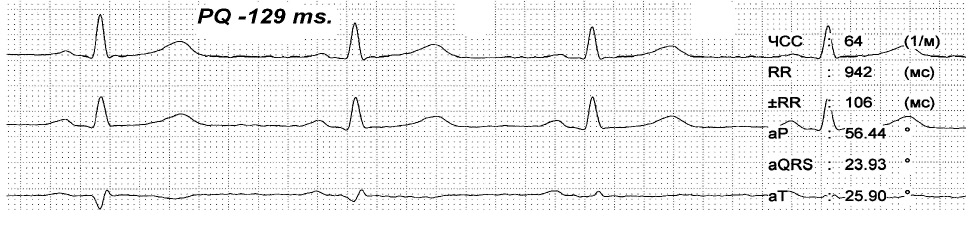
На представленных ЭКГ (рис. 2, 3) зарегистрирован синусовый ритм с ЧСС 81 в 1 минуту и интервалом PQ 96 мс, который после экстрасистолы, прерывается пароксизмом предсердной тахикардии с ЧСС 146 в 1 минуту. При вагусном воздействии синусовый ритм восстановился с ЧСС 64 в 1 минуту и PQ до 129 мс. Данный пример показывает, что функциональные нарушения выступают главным фактором срыва ритма сердца и устранение их приводит к нормализации в том числе и интервала PQ.
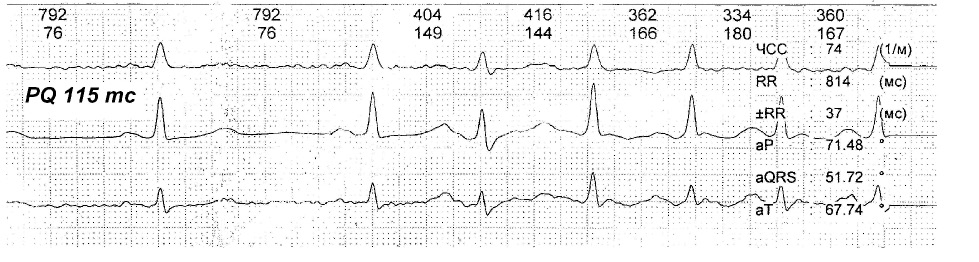
Данная ЭКГ (рис. 4) демонстрирует важность профилактики аритмогенных факторов у лиц с укороченным интервалом PQ, так как даже простая предсердная экстрасистола способна вызвать срыв ритма сердца в пароксизмальную тахикардию.
Цель и задачи. Целью данного исследования явилось изучение, у лиц с укороченным интервалом PQ, динамики течения этой патологии, как без вмешательства в неё, так и при проведении профилактических мероприятий. Профилактическими мероприятиями проверялась эффективность применения кардиопротекторов для нормализации клеточного метаболизма кардиомиоцитов и работы AV соединения.
Материалы и методы исследования
При проведении в 2013 году профилактического осмотра учащихся 16-19 лет в 14,4 % случаях был выявлен укороченный интервал PQ. Выявленный контингент с помощью индекса PQs был разделен на две группы: лица без риска нарушения ритма при тахикардии (30 %) и лица с риском (70 %). Для проведения исследования были отобраны 30 человек с укороченным интервалом PQ и риском внезапного нарушения ритма при тахикардии, у которых затем отслеживалась естественная динамика ЭКГ в течение года, результаты которой представлены в табл. 1.
Синдром укороченного интервала QT
Синдром укороченного интервала QT — это новый и еще недостаточно изученный вариант нарушения ритма, который сегодня выделяется как важный проаритмогенный фактор и предиктор внезапной сердечной смерти. Развитие этого состояния связывают с несколькими генетическими мутациями. У большинства больных синдром протекает без клинических проявлений, реже он манифестирует головокружениями, предобморочными и синкопальными состояниями. С диагностической целью проводятся ЭКГ, суточное мониторирование по Холтеру, другие инструментальные методы (Эхо-КГ, кардиальное ЭФИ). Единственный эффективный вариант лечения — установка дефибриллятора-кардиовертера.
МКБ-10
Общие сведения
В клинической кардиологии более известен синдром удлиненного QT, который зачастую связан с внезапной смертью молодых людей. Обратное состояние ‒ синдром укороченного интервала QT ‒ было описано только в 2000 г., а детальные клинические наблюдения за пациентами с такой патологией проведены в 2005 г. Истинная частота встречаемости этого типа расстройств ритма не установлена из-за сложности диагностики и отсутствия ярких клинических признаков, однако ученые предполагают большую распространенность проблемы в популяции.
Причины
Большинство ученых сходятся во мнении, что развитие синдрома укороченного QT связано с генетически детерминированными нарушениями процесса возбуждения в проводящей системе сердца. Это объясняет частые семейные случаи внезапной смерти при отсутствии органических кардиальных патологий. Мутации наследуются по аутосомно-доминантному типу. Выделяют следующие типы поврежденных генов, ответственных за возникновение синдрома:
Помимо генетических мутаций, уменьшению интервала могут способствовать внешние факторы. Наиболее опасными считаются учащение сердцебиения, повышение температуры тела, увеличение содержания калия и кальция в крови. Независимым фактором риска является дисбаланс вегетативной нервной системы с преобладанием тонуса симпатических нервов.
Патогенез
Электрофизиологическая основа синдрома укороченного интервала QT — ускорение второй фазы потенциала действия в миокарде правого желудочка. Патология возникает вследствие генетически обусловленного дефекта калиевых каналов, что приводит к усиленному выходу калиевых ионов из внутриклеточной жидкости, ионному дисбалансу. Роль в патогенезе синдрома играет гиперсимпатикотония, которая угнетает работу кальциевых каналов и усугубляет имеющиеся нарушения.
Чтобы определить, насколько укороченным является интервал, существует специальная формула, которая выглядит как «656/(1+ЧСС/100)». По этой формуле рассчитывается нормальный интервал в миллисекундах (мс) при соответствующей частоте сердечных сокращений. Синдром укороченного интервала устанавливается, если показатель составляет менее 88% от нормы. Выделено 2 варианта заболевания: постоянное идиопатическое укорочение, парадоксальное (брадизависимое) уменьшение интервала QT.
Симптомы
Главным клиническим проявлением синдрома служат синкопальные состояния — кратковременные эпизоды потери сознания, возникающие в сочетании с аритмией, нарушениями кровоснабжения головного мозга. Несмотря на быстроту развития симптоматики, при синкопе выделяется 3 последовательных фазы: пресинкопальное состояние, собственно синкопе постсинкопальное состояние. Большинство случаев начинаются в момент физической нагрузки или сразу после ее прекращения.
Пресинкопальная (липотимическая) фаза длится до нескольких минут. Пациенты ощущают внезапную нарастающую слабость, тошноту, головокружение и мелькание «мушек» перед глазами. Как правило, беспокоят шум и заложенность в ушах, человек предчувствует, что скоро он потеряет сознание. Кардиогенному обмороку могут предшествовать стеснение в грудной клетке, чувство нехватки воздуха, ощущение замирания сердца.
Второй этап представляет собой обморок — потерю сознания с резким снижением мышечного тонуса, вследствие чего человек падает. Объективно отмечается бледность кожных покровов, снижение АД, слабая наполненность пульса. Кардиогенное синкопе продолжается несколько минут, после чего сознание возвращается к больному. Постсинкопальный период длится от нескольких минут до нескольких часов, проявляется слабостью, повышенной потливостью, неуверенностью движений.
Осложнения
Диагностика
При физикальном обследовании врачу-кардиологу не удается обнаружить признаки, патогномоничные для синдрома укороченного QT. Исключение составляет сочетание патологии с фибрилляцией предсердий или желудочков, которая характеризуется выраженными объективными симптомами. Для диагностики нарушения длины интервала пациенту назначается расширенное обследование, куда входят следующие методы:
Генетическое исследование. При секвенировании генома можно обнаружить типичные для данного синдрома мутации, однако ввиду недостаточного объема данных по этому заболеванию и сложности исследования генетические тесты используются ограниченно.
Лечение синдрома укороченного интервала QT
При укороченном интервале QT стандартные противоаритмические препараты не демонстрируют должной эффективности, поэтому их применение нецелесообразно. Современные научные данные показывают позитивное действие алкалоидов коры хинного дерева на удлинение рефрактерного периода желудочков, предупреждения вентрикулярных аритмий. Основным методом остается хирургическое лечение — имплантация кардиовертера-дефибриллятора, которая проводится при:
Кардиовертер-дефибриллятор (ИКД) устанавливается малоинвазивным методом с использованием эндоваскулярного доступа. Такой способ сокращает период реабилитации пациентов, снижает риск послеоперационных осложнений. В периоде восстановления больным необходимо выполнять рекомендации по двигательному режиму и физическим нагрузкам, регулярно посещать кардиолога для контроля сердечной деятельности.
Прогноз и профилактика
Прогноз зависит от того, насколько укороченным при расчётах является QT, наличием или отсутствием клинических симптомов болезни, состоянием сердечно-сосудистой системы. При ранней диагностике и постановке ИКД прогноз относительно благоприятный. Для снижения риска жизнеугрожающих нарушений ритма пациентам с синдромом укороченного QT рекомендовано избегать тяжелых физических нагрузок, сильных эмоциональных стрессов. Эффективные меры первичной профилактики пока не разработаны.
Интервал pq укорочен что значит
В медицине, касательно ЭКГ есть один термин, о клинической значимости которого следовало бы уточнить некоторые позиции. Этот термин – укороченный интервал P-Q. Электрокардиографическую картину укорочения интервала P-Q при сохранении нормального комплекса QRS описали в 1938 году Clerc, Levy, Critesco. Несколько позже (в 1953 г.) Lown, Lanong, Levine выявили взаимосвязь между коротким интервалом P-Q и наджелудочковой аритмией.
Основные медицинские тревоги укороченного P-Q состоят в том, что он открывает дорогу пароксизмальным тахикардиям, аритмиям и возможной остановке сердца. Актуальность этого ЭКГ термина сегодня высветила сама жизнь. Если до середины 90 годов прошлого века укорочение P-Q встречалось относительно редко, то после этого срока встречается ежедневно. При ретроспективном анализе пяти тысяч электрокардиограмм 2012 года выявлено, что распространенность укороченного P-Q сегодня составляет 6.9 % от общей популяции населения, а в возрастной группе до 18 лет встречаемость укороченного P-Q составляет 10.8 %. Относительное укорочение интервала P-Q по отношению к фактической ЧСС (P-Q 120-130 мс. при ЧСС 60-70) дополнительно встречается еще у 15 % населения. В клинической, спортивной медицине проблеме укороченного P-Q, анализу причин приводящих к нему уделяется недостаточно внимания, хотя он и относится к факторам риска внезапной сердечной смерти.
Причины, приводящие к укорочению интервала P-Q, связаны как, с дополнительными аномальными путями проведения электрического импульса (пучка Джеймса) между предсердиями и АВ пучком, с наличием генетических аномалий, с функциональными нарушениями проводящей системы сердца, вызванными различными патологическими факторами воздействия на организм. Однако наличие дополнительных путей проведения не является главным и не объясняет факта стремительного роста этого ЭКГ феномена, не объясняет его динамику, нет однозначного понимания механизма активации – торможения дополнительных путей. Все эти факты также требуют своего обоснования и дополнительных акцентов в анализе ЭКГ.
Необходимым пояснением для изменения отношения к укорочению P-Q служат аксиомы физиологии – данные анатомии сердца, внутрисердечной гемодинамики, физиологии проведения импульсов в сердце.
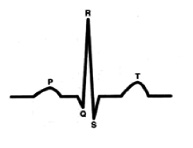
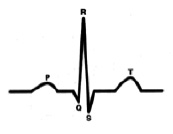
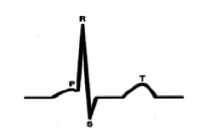
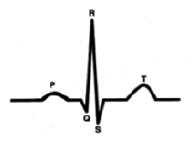
С точки зрения внутрисердечной гемодинамики сердце работает в двухтактном режиме. Первый такт переводит кровь из предсердий в желудочки (зубец Р), затем следует пауза (сегмент P-Q) и потом второй такт (комплекс QRS), который перемещает кровь из желудочков в сосудистое русло, что и находит свое отражение в графике ЭКГ.[4] (рис. 1).
С точки зрения физиологии, клинических тревог по поводу укороченного P-Q главным в анализе ЭКГ является понимание того для чего и какой величины должна быть пауза и что влияет на ее величину.
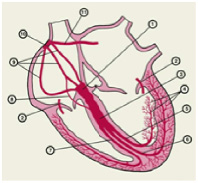
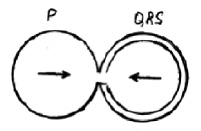
Характеристика работы АV узла. Электрический импульс из синусового узла направляется к АВ узлу по трем предсердным трактам. (Рис.2) Вследствие разной длины трактов время прихода импульса по каждому тракту – разное. Задержка и фильтрация волн возбуждения от предсердия к желудочкам, обеспечивает координированное сокращение предсердия и желудочков, что препятствует слишком частому возбуждению желудочков. Для синхронизации импульсов с целью их объединения снова в один импульс, идущий к желудочкам в АV узле происходит замедление проводимости. [4] Импульс из СА узла достигает АV узла через 30 мс, когда предсердия сократились всего на одну треть. С этого момента начинается этап задержки импульса. Общая продолжительность задержки проведения в системе АV узла (АV соединения) составляет 130 мс и её можно условно разделить на две части. (рис. 3).
Первая дает возможность предсердиям завершить деполяризацию (сокращение), вторая обеспечивает сердцу возможность (отраженную на ЭКГ сегментом P-Q) дополнительно, по потребности изменять ЧСС, не входя в состояние внутрисердечного гемодинамического конфликта. [5]
При отсутствии сегмента P-Q графика ЭКГ выглядит так. (рис. 4) При этом конфликта внутрисердечной гемодинамики еще нет.
В этом случае сразу после окончания сокращения предсердий начинается сокращение желудочков. В физиологии работы сердца заложен механизм изменения ЧСС (бради – тахикардия) в зависимости от потребности организма и именно сегмент P-Q формирует возможность сердца отвечать на нагрузку учащением ЧСС без развития внутрисердечного гемодинамического конфликта. Если бы этого сегмента не было бы, то время сокращения сердца не имело бы возможности изменяться, и сердце работало бы сразу на пределе своих возможностей, не реагируя на потребности организма (сон, бодрствование, нагрузка).
Если АВ узел не выполняет должной задержки импульса и проводит его на желудочки раньше, чем завершилось сокращение предсердий, то это является основой возникновения гемодинамического внутрисердечного конфликта.
Учащение ЧСС возможно за счет активации физиологических процессов, как в сердце, так и в организме в целом и графическим отображением этой активации является сокращение всех временных показателей ЭКГ (P, P-Q, QRS, Q-T, P-T, R-R) [3, 1]. Время сокращения предсердий достигает до 100-110 мс. [2, 4, 5]. В процессе увеличения ЧСС происходит изменение времени сокращения миокарда до 50 мс. В норме общее время прохождения импульса от синусового узла и до посыла импульса из АV узла в желудочки составляет 160 мс. (при ЧСС 60-70) и на долю сегмента P-Q в этом случае приходится от 60 мс. Для практического анализа ЭКГ при различных ЧСС правильно оценивать не абсолютное время сегмента P-Q, а его процентное соотношение к интервалу P-Q которое в норме составляет 30 % и более от общего интервала P-Q. На ЭКГ период сокращения предсердий и замедления проведения импульса в АV узле выглядит в виде зубца Р и сегмента P-Q. С точки зрения физиологии интервал P-Q не должен быть меньше 120 мс., что и нашло свое отражение в нормативах ЭКГ, регламентирующих норму и патологию [3] этого показателя. Однако с точки зрения оценки риска развития кардиологической патологии, наиболее рациональным является оценка процентного соотношения сегмента P-Q к интервалу P-Q и его снижение ниже 30 % выходит за рамки физиологии.
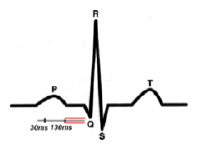
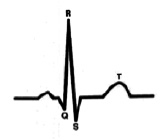
На рис. 5 ЭКГ при ЧСС 60 в минуту. Интервал P-Q 185мс., зубец P 100мс., сегмент P-Q 85 мс. Конфликта внутрисердечной гемодинамики – нет.
На рис. 6 ЭКГ при ЧСС 120 в минуту. Сокращение времени интервала P-Q до 115мс., зубца P до 70мс., сегмента P-Q до 45мс. Конфликта внутрисердечной гемодинамики – нет.
Внутрисердечный гемодинамический конфликт состоит в том, что опорожнению предсердий противостоит начинающееся сокращение желудочков, что в итоге приводит к уменьшению ударного объема крови в желудочках и перерастяжение стенок предсердий избыточным объемом крови (рис. 8, рис. 9).
1. Перерастяжение камер предсердий в свою очередь приводит к активизации эктопических очагов водителя ритма и нарушению ритма сердца.
2. Недостаток поступления крови и кислорода к тканям организма во время увеличенной потребности (физическая нагрузка) приводит к гипоксии и нарушению клеточного метаболизма, что в свою очередь приводит к нарушению работы АV узла выражающееся в нарушениях ритма и проводимости.
Отсюда ясно, что когда сокращение предсердий начнет, накладывается на сокращение желудочков, это неизбежно приведет к срыву внутрисердечной гемодинамики и сбоям в работе сердца.
В оценке укороченного P-Q необходимо учитывать не столько время интервала P-Q, сколько наличие сегмента P-Q и его процентное соотношение к интервалу P-Q, чтобы определить несет ли в себе последний риск кардиальных нарушений.
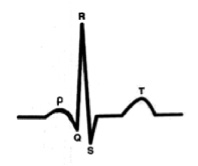
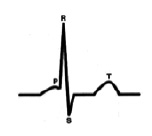
На рис. 10 интервал P-Q 115 мс, зубец P 70 мс, сегмент P-Q 45 мс – (39.1 %)
Несмотря на укороченный интервал P-Q физиологические параметры соотношения сегмента P-Q к интервалу P-Q в норме. Возможности сердца к учащению ЧСС в бесконфликтном гемодинамическом режиме в норме, что и находит свое отражение в безсимптомности выявляемого на практике укороченного интервала P-Q.
К примеру (рис. 11) если при наличии интервала P-Q равного 114 мс и ширина Р составляет – 66мс, то на долю сегмента P-Q приходится 48 мс (или 44 %) тогда эти показатели больше характеризуют индивидуальные величины нормальной ЭКГ, а не феномена укорочения P-Q, и не несут под собой клинических тревог, что актуально особенно в детской практике [1].
С позиции клиники и рисков развития сердечной патологии ведущим показателем является не укорочение интервала P-Q, а укорочение – исчезновение сегмента P-Q (менее 30мс или нарушение его процентного соотношения к интервалу P-Q менее 30 %), как показателя риска возможного внутрисердечного гемодинамического конфликта с выходом в различные клинические симптомы кардиального неблагополучия.
Показатели интервала и сегмента P-Q не являются статическими величинами и постоянно меняются, реагируя на потребности организма, являясь частью природного механизма регуляции сердечного ритма. И этим механизмом является ускорение-замедление проведения импульса в АV соединении. Любое воздействие на организм, приводящее к изменению клеточного метаболизма может привести к изменению работы АV узла и повлиять на процессы торможения и проведения, что и находит свое отражение в динамике этих показателей при наблюдении.
1. Элементы электрокардиограммы – зубец Р, интервал P-Q, сегмент P-Q не обходимо анализировать и с позиций внутрисердечной гемодинамики, так как ее нарушения лежат в основе запуска серьезных нарушений работы сердца.
2. Главным критерием, обуславливающим симптомы кардиологических нарушений, является не сам укороченный интервал P-Q, а нарушение физиологического соотношения интервала P-Q и сегмента P-Q. Исчезновение сегмента P-Q, запускает механизм гемодинамического внутрисердечного конфликта.
3. Укорочение интервала P-Q при нормальном его соотношении к сегменту P-Q не несет в себе клинических тревог синдрома CLC, однако. В этом случае требуется определение пороговой ЧСС, при которой возникает конфликт внутрисердечной гемодинамики.
4. Представителем механизма регуляции внутрисердечной гемодинамики является АV узел, (соединение).
5. Основные причины, вмешивающиеся в механизм замедления проведения электрического импульса к желудочкам сердца, лежат в функциональном, метаболическом поле, приводящие к временному нарушению функционирования АV соединения, что реализуется в разнообразные нарушения ритма.
Синдром укороченного интервала PQ на ЭКГ: что это, симптомы, лечение и возможные последствия
Кардиальные патологии представлены крупной категорией диагнозов. Они отражены в международном классификаторе, используются практикующими врачами для описания конкретных ситуаций.
Однако названное состояние самостоятельным диагнозом не считается, также не признается оно полноценным заболеванием. О чем в таком случае речь?
Синдром укороченного PQ — это ускорение передачи биоэлектрического импульса от синусового узла к желудочкам. Названное отклонение находка на электрокардиографии, но не отдельное патологическое состояние.
Показатель может отклоняться в две стороны, говоря условно:
Указывает на наличие дополнительных пучков, которые обеспечивают неадекватно быстрое движение сигнала. Обычно на фоне врожденных патологий.
Симптомы присутствуют не всегда, лечение требуется также не во всех случаях. Нужно исходить из конкретной ситуации.
Механизм развития отклонения
В основе развития синдрома лежит врожденное нарушение структур сердечнососудистой системы.
Онтогенез плода сопровождается пороками спонтанно, в результате влияния негативных факторов окружающей среды на организм будущей матери или как итог аномалий хромосомного плана.
Обнаружить синдром можно как в ранний период жизни ребенка, еще в младенчестве, так и много позже.
Проблема не всегда дает знать о себе симптомами в начале. Возможно вялое, латентное течение в перспективе многих лет.
Суть отклонения всегда примерно одинакова у детей и взрослых. Электрические импульсы от естественного водителя ритма (синусового узла) передаются по специальным волокнам, к узлу атривентрикулярному, где происходит небольшая задержка, затем сигнал по пучку Гиса направляется к желудочкам.
Возможно развитие дополнительных проводящих путей (Махейма или Кента при синдроме WPW, и Джеймса на фоне CLC расстройства).
Клиническая картина не всегда яркая, выраженная. Да и не во всех случаях явно присутствует.
До определенного момента организм может компенсировать расстройство. Потом наступит дисфункция. Тогда дадут знать о себе и симптомы.
Без лечения постепенно растет вероятность органических изменений в структуре миокарда, остановки сердца и гибели больного в этой связи.
Вероятность не возьмется оценивать ни один врач, прогнозы туманные, течение непредсказуемое. Это может произойти через месяц, год и более.
В случае укорочения интервала PQ на ЭКГ обнаруживается пароксизмальная, опасная тахикардия.
Республиканский научно-практический центр спортивной медицины
Президент Узбекистана Ислам Каримов подписал Постановление «О создании Республиканского научно-практического центра спортивной медицины при Национальном Олимпийском комитете Республики Узбекистан»
Ссылки
Отличие синдрома от феномена
Грань между двумя этими понятиями довольно тонкая, по крайней мере, для пациента, который не имеет глубоких медицинских познаний. В обоих случаях речь идет о находках, полученных в процессе проведения электрокардиографии.
Синдром представляет собой сочетание двух моментов:
Феномен укороченного PQ представлен только изменениями на электрокардиографии. Симптомов, клинической картины нет. Потому и патологическим процессом рассматриваемое состояние не является. По крайней мере, до определенного момента.
Как было сказано, грань тонкая. Феномен может стать синдромом. Наоборот же такая связь не работает.
Использование подобной терминологии нередко путает пациентов. Чтобы уточнить, что конкретно имеет место, рекомендуется обратиться к кардиологу для уточнения расстройства и расшифровки электрокардиограммы.
Чем отличается синдром и феномен?
Многие пациенты, увидев в заключении ЭКГ понятия феномена или синдрома CLC, могут озадачиться, что же из этих диагнозов страшнее. Феномен CLC, при условии правильного образа жизни и регулярного наблюдения у кардиолога, большой опасности для здоровья не представляет, так как феномен – это наличие признаков укорочения PQ по кардиограмме, но без клинических проявлений пароксизмальной тахикардии.
Синдром CLC, в свою очередь – это критерии по ЭКГ, сопровождающиеся пароксизмальными тахикардиями, чаще наджелудочковыми, и могущие стать причиной внезапной сердечной смерти (в относительно редких случаях). Обычно у пациентов с синдромом укороченного PQ развивается наджелудочковая тахикардия, которая довольно успешно может быть купирована еще на этапе скорой медицинской помощи.
Симптомы
Клиническая картина зависит от конкретного заболевания, его тяжести, возраста, пола, образа жизни и множества прочих факторов.
Как было отмечено ранее, короткий PQ интервал — не диагноз. Это всего лишь объективный показатель на кардиограмме.
Изменения представлены двумя расстройствами, которые отражены в международном классификаторе.
Это синдром Вольфа-Паркинсона-Уайта (или ВПВ, сокращено) или Клерка-Леви-Кристеско (CLC). Оба имеют врожденную природу, но могут проявиться не сразу, а в течение определенного времени.
Существует три возрастных пика: первый приходится на младенческие годы, второй — на пубертатный период, с 13 до 18 лет. Последний определяется 40-50 годами.
При развитии синдрома Вольфа-Паркинсона-Уайта речь идет о типичной клинике:
Синдром Клерка-Леви-Кристеско сопровождается несколько иными симптомами. Хотя происхождение патологического процесса и схожее.
Принципиального отличия в клинике не отмечается. Все также обнаруживаются боли в грудной клетке, тахикардия, одышка, тошнота, потеря сознания и прочие явления.
Ключевой момент — длительность эпизода. На фоне CLC синдрома продолжительность минимальна, не свыше 10-15 минут. ВПВ может протекать по нескольку часов.
Дифференцировать два диагноза можно только по результатам ЭКГ.
Синдром удлиненного и укороченного интервала QT в клинической практике
Среди причин удлинения и укорочения интервала QT выделяют врожденные и приобретенные факторы. Основной причиной заболевания является наследственная каналопатия, обусловленная мутацией ряда генов, кодирующих белки трансмембранных калиевых и натриевых ионных каналов. Синдром удлиненного интервала (СУДИ) QT имеет достаточно долгую историю изучения, насчитывающую более 100 лет. Возможно, первым описанием наследственного СУДИ QT является работа T. Messner и соавт., опубликованная в 1856 г. [1]. Мощным толчком для изучения электрофизиологии сердца явилось внедрение в медицинскую практику методики регистрации ЭКГ, разработанной нидерландским физиологом В. Эйндховеном в 1903 г. Но только в 1957 г. A. Jervell и F. Lange-Nielsen диагностировали клинико-электрокардиографический «синдром длинного QT» у четырех членов одной семьи, страдавших врожденной невральной глухотой, частыми приступами потери сознания и имевших стойкое удлинение интервала QT на ЭКГ, положивший начало современному этапу изучения СУДИ QT. Вскоре P. Romano (1963) и D. Ward (1964) представили наблюдения аналогичного синдрома, но без врожденной глухоты. При этом у родственников больных также обнаруживалось удлинение интервала QT, но приступов потери сознания не отмечалось [1]. Аритмогенный потенциал укороченного интервала QT был впервые отмечен I. Gussak и соавт. в 2000 г. при описании клинического случая внезапной сердечной смерти одной молодой женщины и семьи, в которой наблюдалось несколько случаев раннего возникновения фибрилляции предсердий (ФП) у ее членов. Ни у кого из обследованных не имелось структурных изменений в сердце, но отмечалось отчетливое уменьшение продолжительности интервала QT на ЭКГ (QTC варьировал от 248 до 300 мс) [2].
Электрофизиология сердечной клетки и связь с продолжительностью интервала QT Интервал QT ЭКГ отражает суммарную продолжительность деполяризации и реполяризации кардиомиоцитов желудочков. На уровне отдельной клетки интервал QT соответствует продолжительности трансмембранного потенциала действия (ТМПД), обусловленного трансмембранным током ионов по натриевым, кальциевым и калиевым каналам. Известно пять последовательных фаз ТМПД: Фаза 0 (деполяризация) характеризуется массивным током ионов натрия внутрь клетки (INa). Фаза 1 (начальная быстрая реполяризация) характеризуется прекращением тока ионов натрия и преходящим быстрым током ионов калия из клетки (It0). Фаза 2 (плато) характеризуется медленным током ионов кальция внутрь клетки через кальциевые каналы L-типа (ICa-L) и продолжающимся истечением ионов калия наружу (IK). Фаза 3 (конечная быстрая реполяризация) характеризуется током ионов калия наружу клетки (IKr, IKs) c формированием трансмембранного потенциала покоя (ТМПП). Фаза 4 (деполяризация) характеризуется поддержанием ТМПП за счет активного поступления ионов калия внутрь клетки (IK1). На микроструктурном уровне трансмембранные ионные каналы представляют собой сложные структурные образования, состоящие из специфических белковых комплексов. Дисфункция этих белковых каналов может обусловливать ускорение или замедление трансмембранных ионных потоков в различные фазы ТМПД, что может приводить к удлинению или укорочению продолжительности ТМПД и интервала QT. Основной причиной дисфункции трансмембранных ионных каналов является мутация генов, кодирующих их белки. Мутации могут затрагивать все типы каналов, а также их сочетания, что обусловливает существование большого количества клинических форм синдрома удлиненного и укороченного интервала QT. В настоящее время структура и генетика трансмембранных ионных каналов изучены в полной мере, что делает доступной медикаментозную коррекцию их нарушений. Подробная литература по данному вопросу представлена в обзоре S. Nachimuthu и соавт. [3].
Методика измерения и оценки интервала QT Интервал QT измеряется на ЭКГ от начала зубца Q (в случае его отсутствия – от начала зубца R) до конца зубца Т. Несмотря на кажущуюся простоту, измерение и оценка интервала QT представляют собой достаточно трудную задачу и являются одним из наиболее сложных моментов при анализе ЭКГ. Наибольшие сложности составляет: 1) определение начала комплекса QRS и окончания зубца Т; 2) выбор отведений, в которых предпочтительно измерять интервал QT; 3) необходимость корректировки продолжительности интервала QT для ЧСС, пола и продолжительности комплекса QRS [4].
По данным ряда исследований, у здоровых людей в разных отведениях продолжительность интервала QT может варьировать в пределах 50–65 мс. Согласно Рекомендациям по стандартизации и интерпретации ЭКГ Американской сердечной ассоциации 2009 г. [4], при измерении интервала QT в отдельных отведениях для анализа следует выбирать отведение с наибольшим интервалом QT (обычно отведение V2 или V3). В большинстве случаев окончание зубца Т определяется в момент возврата конечной части зубца Т на изолинию. В случае «двугорбого» зубца Т с одинаковыми по амплитуде вершинами окончание зубца Т рекомендуют определять по окончанию второй вершины [5]. Если зубцы Т и U накладываются друг на друга, то интервал QT рекомендуется измерять в отведениях без зубца U (часто это отведения aVR или aVL) или определять окончание зубца Т в месте пересечения изолинии с линией, проведенной по касательной вдоль нисходящей части зубца Т (необходимо учитывать, что последний способ может занижать значения интервала QT) [4] (рис. 1). При ручном способе измерения продолжительность интервала QT рекомендуется определять как среднее значение нескольких измерений (как минимум 3–5 сердечных цикла) [5]. В последние годы во многих современных электрокардиографах появилась возможность автоматизированного анализа ЭКГ, включая определение продолжительности интервала QT. Используемые при автоматическом анализе суперпозиция и усреднение нескольких отведений позволяют более точно определять начало и конец интервала QT, вследствие чего автоматически измеренный интервал QT часто длиннее, чем интервал QT при ручном способе измерения. Поэтому в случае выявления удлинения интервала QT при автоматизированном анализе рекомендуется перепроверять результаты ручным способом [4]. Известно, что продолжительность интервала QT имеет отчетливую взаимосвязь с ЧСС (интервалом RR): при уменьшении ЧСС интервал QT увеличивается, а при увеличении ЧСС – уменьшается. Данная особенность свидетельствует о необходимости коррекции продолжительности интервала QT в зависимости от ЧСС. Для этой цели предложен ряд формул, использующих экспоненциальный, линейный или логарифмический методы [5]. Следует отметить, что в диапазоне ЧСС от 60 до 90 уд./мин. большинство формул обеспечивают сопоставимые результаты коррекции и являются взаимозаменяемыми.
Одна из первых формул для коррекции интервала QT в зависимости от ЧСС была предложена H.C. Bazett в 1920 г., и до настоящего времени она остается основной формулой для определения корригированного интервала QT (QTc) как в научных исследованиях, так и в клинической практике. Большинство электрокардиографов при автоматизированном анализе используют именно формулу Bazett. В формуле Bazett используется экспоненциальный метод определения QTc (QTc=QT/RR1/2). К недостаткам формулы Bazett можно отнести возможность ошибочной коррекции при слишком высокой или низкой ЧСС. Формулы, использующие линейный метод коррекции (Framingham, Hodges, Rautaharju), позволяют уменьшить ошибки экспоненциального метода и могут использоваться как при высокой, так и низкой ЧСС. Наиболее известной из них является формула Framingham (QTc=QT + 0,154 х (1 – RR)), а наиболее точной, но более сложной – формула Rautaharju. Подробно с различными методами коррекции интервала QT для ЧСС можно ознакомиться в обзоре I. Goldenberg и соавт. [5].
Следует отметить, что ручное определение QTc для каждого индивидуального пациента – достаточно трудоемкий процесс, отнимающий много времени. Поэтому в клинической практике для быстрого определения пациентов группы риска возникновения тахикардии torsades de pointes (TdP) можно использовать номограмму зависимости QT от ЧСС [3]. Поскольку интервал QT может увеличиваться при нарушениях внутрижелудочкового проведения, для оценки продолжительности реполяризации у больных с блокадами ножек пучка Гиса рекомендуется использовать либо продолжительность интервала JT (от начала сегмента ST до конца зубца Т), либо формулы коррекции, учитывающие одновременно ЧСС и продолжительность комплекса QRS [4]. К сожалению, эти методы анализа до настоящего времени не имеют общепризнанных нормативов и весьма ограниченно используются в клинической практике.
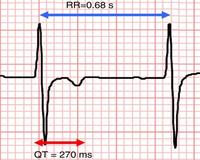
Интервал QT: удлиненный, нормальный, укороченный В 2009 г. S. Viskin [6], используя данные популяционных и генетических исследований, разработал «шкалу QT», ранжирующую весь непрерывный спектр интервалов QT от очень коротких до очень длинных, раздельно для мужчин и женщин. В соответствии с данной шкалой нормальной продолжительностью интервала QT считаются значения QTc 360–389 мс для мужчин и 370–399 мс – для женщин; при QTc, равном 390–449 мс для мужчин и 400–459 мс – для женщин, интервал QT расценивался как возможно удлиненный; при QTc, равном 450–469 мс для мужчин и 460–479 мс – для женщин, как удлиненный; при QTc, равном или больше 470 мс для мужчин и 480 мс – для женщин, как выраженно удлиненный; при QTc, равном 359–329 мс для мужчин и 369–339 мс – для женщин, как укороченный, при QTc, равном или меньше 330 мс для мужчин и 340 мс – для женщин, как выраженно укороченный. Одними из первых и наиболее известных критериев диагностики СУДИ QT являются критерии P.J. Schwartz и соавт. 1985 г., которые впоследствии неоднократно дополнялись и обновлялись (табл. 1). В соответствии с этими критериями лица, набирающие 1 балл, имеют низкую вероятность СУДИ QT, от 2 до 3 баллов – промежуточную вероятность, 4 балла и более – высокую вероятность СУДИ QT [7]. В 2011 г. M.H Gollob и соавт. [2] предложили критерии диагностики синдрома укороченного интервала (СУКИ) QT, построенные на тех же принципах, что и критерии СУДИ QT (табл. 2). В соответствии с этими критериями при общем количестве баллов 4 или более определяется высокая вероятность СУКИ QT, при наличии 2 баллов или менее – низкая вероятность, в случае, если сумма баллов составляет 3 балла, то вероятность СУКИ QT оценивается как промежуточная.
Cиндром удлиненного интервала QT Увеличение продолжительности реполяризации часто приводит к возникновению на мембране кардиомиоцитов желудочков интенсивных осцилляций, носящих название потенциалов ранней постдеполяризации, что в сочетании с выраженной гетерогенностью продолжительности потенциалов действия обусловливает возникновение в миокарде желудочков очагов повторного возбуждения и желудочковой тахикардии [3]. Наиболее характерным клиническим проявлением СУДИ QT является полиморфная желудочковая тахикардия torsades de pointes (TdP) (двунаправленная, «пируэтная» тахикардия). TdP характеризуется выраженным удлинением интервала QT в последнем предшествующем тахикардии синусовом сокращении, прогрессирующим изменением полярности комплексов QRS, визуально имитирующим их вращение вокруг изолинии, постоянным изменением амплитуды комплексов QRS, высокой ЧСС от 150 до 300 импульсов в мин и выраженной нерегулярностью интервалов RR (рис. 2). Для TdP характерно возникновение приступа после паузы, обусловленной брадикардией или экстрасистолией. Типичной для TdP является так называемая SLS (short-long-short) последовательность, характеризующаяся начальной суправентрикулярной экстрасистолой, приводящей к укорочению интервала RR (short-цикл), последующей длинной постэкстрасистолической паузой перед очередным синусовым комплексом (long-цикл) и повторной желудочковой экстрасистолой (short-цикл), являющейся началом пароксизма TdP. У больных СУДИ QT возникновение TdP нередко провоцируется интенсивной адренергической стимуляцией [8]. Приступы TdP у больных СУДИ QT обычно протекают кратковременно, купируются спонтанно и поэтому длительное время могут оставаться незамеченными. Однако эти приступы имеют тенденцию группироваться в повторяющиеся последовательности с короткими межприступными интервалами, обусловливая возникновение сердцебиений, головокружений, обмороков, предобморочных состояний и внезапной смерти вследствие фибрилляции желудочков (ФЖ).
В последние десятилетия достигнуты значительные успехи в определении генетических предпосылок возникновения СУДИ QT. Идентифицированы мутации в десяти генах, обусловливающие удлинение интервала QT. Тем не менее, подавляющее большинство клинически значимых случаев СУДИ QT связаны с мутациями в трех генах, проявляющимися тремя генетическими подтипами (LQT1, LQT2 и LQT3), которые имеют характерные клинические особенности и характеризуются определенной морфологией ЭКГ [9]. Для LQT1 характерны широкие волны Т на ЭКГ покоя, отсутствие паузы перед началом тахиаритмии, отсутствие укорочения интервала QT при физической нагрузке, высокая эффективность β-адреноблокаторов (БАБ). Развитие тахиаритмии при LQT1 провоцируется физическим и психическим стрессом, плаванием, нырянием. LQT2 отличается низкоамплитудными, зазубренными зубцами Т на ЭКГ покоя, наличием паузы перед началом тахиаритмии, нормальным укорочением интервала QT при физической нагрузке и меньшей, по сравнению с LQT1, эффективностью БАБ. Развитие тахиаритмии при LQT2 провоцируется физическим и психическим стрессом, внезапными громкими звуками. LQT3 характеризуется удлиненным изоэлектричным сегментом ST, узкими и высокими волнами Т на ЭКГ покоя, чрезмерным укорочением интервала QT при физической нагрузке. Эффективность БАБ не определена. Тахиаритмия чаще возникает в покое, во время сна.
Диагностика наследственного СУДИ QT основывается на выявлении характерных изменений ЭКГ, анализе клинических данных и семейного анамнеза в соответствии с критериями P.J. Schwartz и соавт. [7], а также на исключении приобретенных причин удлинения интервала QT. Заключительным этапом диагностики является генетическое тестирование, позволяющее выявить пораженный ген у 70–90% лиц с признаками наследственного СУДИ QT. Несмотря на свою высокую диагностическую значимость, генетическое тестирование не является панацеей и может давать как ложноположительные, так и ложноотрицательные результаты. Генетическое тестирование показано, главным образом, в двух случаях: 1) когда диагноз является вероятным и клинические данные указывают на поражение конкретного гена; 2) в семьях, в которых имеется пробанд с ранее установленным генетическим дефектом. В обоих случаях генетическое тестирование необходимо для уточнения диагноза, определения прогноза и выбора тактики долговременного лечения [9]. В последние годы было идентифицировано большое количество ненаследственных факторов, вызывающих удлинение интервала QT и TdP, в первую очередь это лекарственные средства, среди которых следует отметить антиаритмики класса Ia (хинидин, прокаинамид, дизопирамид) и класса III (дофетилид, ибутилид, соталол), нейролептики (галоперидол, дроперидол, тиоридазин, хлорпромазин), антидепрессанты (амитриптилин, дезипрамин, имипрамин, мапротилин, доксепин, флуоксетин), антибиотики группы хинолонов (левофлоксацин, моксифлоксацин) и макролидов (эритромицин, кларитромицин), противомалярийные средства (хинидин), противопротозойные средства (пентамидин), противогрибковые средства (азольная группа) и метадон [3]. В то же время прогностическое значение приобретенного удлинения интервала QT изучено недостаточно. Отмечается, что взаимосвязь между механизмом действия лекарственного агента и клиническими проявлениями СУДИ QT является нестрогой. В некоторых случаях даже выраженное удлинение интервала QT редко сопровождается развитием TdP (например, при использовании амиодарона), а в других – незначительное удлинение интервала QT может вызывать TdP [3].
Предполагается, что вероятность развития TdP увеличивается при сочетании нескольких факторов риска. К основным факторам риска приобретенного СУДИ QT относят электролитные нарушения (гипокалиемия, гипомагнезиемия, гипокальциемия), применение лекарственных средств, удлиняющих интервал QT, диуретиков и сердечных гликозидов, наличие сопутствующих заболеваний (печеночная и почечная недостаточность, брадикардия, сердечная недостаточность, гипертрофия левого желудочка, инфаркт миокарда, субарахноидальная геморрагия и другие формы поражения центральной нервной системы), диету с жидкими протеинами и другие формы голодания [3, 11]. Известно, что от 5 до 20% больных с лекарственно обусловленным TdP имеют мутации в генах, вызывающих СУДИ QT. В обычном состоянии эти пациенты характеризуются нормальным или пограничным QTc, но имеют склонность к удлинению интервала QT и развитию TdP при употреблении некоторых лекарств, под воздействием стресса или других факторов риска [3].
Синдром укороченного интервала QT СУКИ QT характеризуется наследственно обусловленным укорочением интервала QT, сопровождающимся высокой частотой возникновения ФП (24%) в виде постоянной или пароксизмальной форм, частыми обмороками, развитием полиморфной желудочковой тахикардии, ФЖ, остановки сердца и внезапной смерти. Могут также отмечаться депрессия сегмента PR, высокие в виде пиков зубцы Т без горизонтального уплощения сегмента ST, нарушения укорочения сегмента ST при увеличении ЧСС, парадоксальное укорочение интервала QT при брадикардии. ФП и ФЖ у больных СУКИ QT легко провоцируются программируемой электрокардиостимуляцией [11]. Электрофизиологической основой укорочения интервала QT является уменьшение продолжительности ТМПД вследствие снижения потоков деполяризации (INa, ICa), увеличения потоков реполяризации (Ito, IK1, IK-ATP, IACh, IKr, IKs) или их сочетания. Экспериментальные исследования показывают, что укорочение ТМПД при СУКИ QT отличается выраженной неоднородностью, сопровождающейся трансмуральной дисперсией реполяризации, являющейся субстратом для развития аритмий по механизму «reentry» [12].
В настоящее время описано пять генетических подтипов синдрома укороченного интервала QT (SQT1–5) с аутосомно-доминатной передачей, связанных с мутациями в пяти различных генах, кодирующих калиевые и кальциевые трансмембранные ионные каналы (IKr, IKs, IK1, ICa). Для SQT1 и SQT3–5 доказаны семейные случаи, SQT2 описан на примере единственного спорадического случая [12]. При SQT1 провоцирующим фактором нарушений сердечного ритма обычно является физическая нагрузка и громкие звуки, при SQT3 – внезапное ночное пробуждение [11]. Кроме наследственных форм укорочение интервала QT в клинической практике наиболее часто встречается при гиперкальциемии, обусловленной гиперпаратиреоидизмом, заболеваниями почек, остеолитическими формами рака, приемом тиазидных диуретиков, лития и витамина D. Среди других клинических ситуаций, ассоциирующихся с вторичным укорочение интервала QT, следует отметить синдром Бругада, синдром хронической усталости, гипертермию, синдром ранней реполяризации желудочков, ацидоз, влияние дигиталиса, атропина и катехоламинов [12, 13]. Вторичное укорочение интервала QT увеличивает риск аритмогенных событий [13].
Лечение Отсутствие многоцентровых рандомизированных контролируемых испытаний терапии синдромов удлиненного и укороченного интервала QT отражает как относительную редкость этих заболеваний, так и большое количество генетических типов, имеющих существенные различия по клиническим особенностям и тяжести течения. Пациенты с очень низким риском внезапной смерти (например, носители мутаций пожилого возраста с нормальной продолжительностью интервала QT) обычно не требуют лечения, но должны избегать приема лекарств, удлиняющих интервал QT [9].
Основу лечения пациентов с СУДИ QT составляют БАБ и имплантируемые кардиовертеры-дефибрилляторы (ИКД) [9]. Основным лечебным эффектом БАБ является препятствие учащению ЧСС при физической нагрузке и стрессе. Лечение БАБ больных с СУДИ QT проводится по общепринятым схемам с учетом всех возможных противопоказаний. Имеются данные, что терапия БАБ более эффективна у больных с LQT1, чем у больных с LQT2 и LQT3 [9]. Сопоставимый с БАБ лечебный эффект у больных СУДИ QT достигается при левосторонней шейной симпатэктомии (ЛШС) (ганглионэктомия звездчатого узла). Учитывая, что ЛШС является инвазивной операцией, она показана больным, имеющим противопоказания к БАБ [14].
ИКД широко применяются для профилактики жизнеугрожающих аритмий и внезапной смерти у больных с СУДИ QT. Основным контингентом для лечения ИКД являются: 1) лица, у которых симптомы развиваются в раннем возрасте до начала пубертатного периода; 2) больные с выраженно удлиненным интервалом QT (QTc>500 мс); 3) больные с повторными аритмогенными синкопе, возникающими на фоне лечения БАБ. Вопрос о более агрессивной тактике имплантации ИКД всем носителям мутантных генов, выявленным при семейном генетическом скрининге, остается дискуссионным [9]. Совместные рекомендации Северо-американского и Европейского обществ кардиологов по лечению и профилактике внезапной смерти при СУДИ QT представлены в таблице 3. Имплантация ИКД настоятельно рекомендуется всем больным с СУКИ QT для вторичной профилактики внезапной сердечной смерти, исключая случаи, когда имеются абсолютные противопоказания или отказ пациента. В то же время, использование ИКД для первичной профилактики внезапной смерти достоверно не доказано. Также весьма ограничены данные относительно фармакологического лечения СУКИ QT, относящиеся в основном к лечению SQT1. Одним из препаратов, подающих большие надежды, является гидрохинон, показавший устойчивое удлинение интервала QT и уменьшение эпизодов желудочковой тахикардии [12].
Заключение Удлинение и укорочение интервала QT нередко встречается в клинической практике и может являться причиной внезапной смерти больных. Своевременная диагностика позволяет выбрать оптимальную тактику лечения и действительно спасти жизнь таким пациентам. Поэтому знание методов диагностики и лечения синдромов удлиненного и укороченного интервала QT необходимо врачам всех специальностей в их повседневной работе.
Литература 1. Школьникова М.А. Первичный, наследственный синдром удлиненного интервала QT // Синдром удлиненного интервала QT / Под ред. М.А. Школьниковой. М.: Медпрактика, 2001. С. 9–45. 2. Gollob M.H., Redpath C.J., Roberts J.D. The Short QT Syndrome: Proposed Diagnostic Criteria // J. Am. Coll. Cardiol. 2011. Vol. 57. P. 802–812. 3. Nachimuthu S., Assar M.D., Schussler J.M. Drug-induced QT Interval Prolongation // Ther. Adv. in Drug Safe. 2012. Vol.3(5). P.241–253. 4. Rautaharju P.M., Surawicz B., Gettes L.S. AHA/ACCF/HRS Recommendations for the Standardization and Interpretation of the Electrocardiogram: Part IV: The ST Segment, T and U Waves, and the QT Interval: A Scientific Statement From the American Heart Association Electrocardiography and Arrhythmias Committee, Council on Clinical Cardiology; the American College of Cardiology Foundation; and the Heart Rhythm Society: Endorsed by the International Society for Computerized Electrocardiology // Circulation. 2009. Vol. 119. P.e241–e250. 5. Goldenberg I., Moss A.J., Zareba W. QT Interval: How to Measure It and What Is «Normal» // J. Cardiovasc. Electrophysiol. Vol.17. P. 333–336. 6. Viskin S. The QT interval: Too long, too short or just right // Heart Rhythm. 2009. Vol. 6. №.5. P. 711–715. 7. Schwartz P.J. et al. Diagnostic criteria for the long QT syndrome. An update // Circulation. 1993. Vol. 88. P. 782–784. 8. Khan L.A. Long QT Syndrome: Diagnosis and Management // Amer. Heart J. 2002. Vol.143(1) 9. Roden D.M. Long-QT Syndrome // N. Engl. J. Med. 2008. Vol. 358. P.169–176. 10. Roden D.M., Viswanathan P.C. Genetics of acquired long QT syndrome // J. Clin. Invest. 2005. Vol. 115. P. 2025–2032. 11. Morita H., Wu J., Zipes D.P. The QT syndromes: long and short // Lancet. 2008. Vol. 372. P. 750–763. 12. Patel C., Yan G.-X., Antzelevitch C. Short QT Syndrome: From Bench to Bedside // Circ. Arrhythm. Electrophysiol. 2010. Vol.3. P.401–408. 13. Bjerregaard P., Nallapaneni H., Gussak I. Short QT interval in clinical practice // Journal of Electrocardiology. 2010. Vol. 43. P. 390–395. 14. The Cardiac Society of Australia and New Zealand (CSANZ). Guidelines for the diagnosis and management of Familial Long QT Syndrome 2011. https://www.csanz.edu.au/documents/guidelines/clinical_practice/Familial_Long_QT_Syndrome.pdf
Варианты течения
Во всех случаях описывают несколько вариантов клинического течения болезней.
Клиническая картина примерно всегда одна и та же. Но она неспецифична, что не дает докторам однозначно сказать о происхождении.
Причины
Факторы развития укороченного интервала всегда внутриутробные. То есть расстройство или предрасположенность к таковому возникает еще в период беременности матери.
Здесь уже возможно два варианта:
Далее все зависит от случая. Не всегда анатомический дефект проявляет себя сразу после рождения.
Ребенок может годами жить, казаться здоровым до определенного момента. Пока организм справляется — все нормально. А далее требуется триггерный фактор, который приведет к дисфункции и склонит чашу в другую сторону.
Перечень неполный. Также повышенный риск присутствует в ранние годы (до 3-х лет.), в период полового созревания и в позднем возрасте. Нужно внимательно смотреть за пациентами из групп опасности.
Диагностика
Основу обследования составляет электрокардиография. Это золотой стандарт в деле оценки рассматриваемых состояний.
Типичная картина, которая обнаруживается в ходе инструментальной методики:
Далеко не всегда рассматриваемые признаки присутствуют в полном объеме. Тогда можно говорить об усеченном расстройстве.
Клиническая картина также развивается не в 100% ситуаций даже на фоне присутствия «набора» отклонений на графике. В таком случае говорят про феномен укороченного PQ.
Но сразу отметать диагноз нельзя. Чтобы сказать об относительно безопасном течении расстройства, нужно наблюдать за пациентом хотя бы пару недель.
Прочие исследования используются реже, они не дают необходимой информации, потому как органических патологий, провоцирующих рассматриваемое состояние, не существует.
В основном требуется консультация кардиолога, опрос пациента или его родителей на предмет жалоб, сбор анамнеза. В целях установления вероятного триггерного фактора, проработки тактики терапии, вторичной профилактики, направленной на предотвращение рецидивов.
Принципиальной разницы у кого обнаружены отклонения от нормы нет. Укороченный интервал PQ у взрослых и у детей говорит об одном и том же.
Поправку делают только на возраст человека, чтобы определиться с нормой по частоты сердечных сокращений (у молодых пациентов показатель изначально выше, в младенчестве — существенно).
Прогноз
Определение прогноза для пациентов с синдромом CLC всегда затруднительно, так как заранее спрогнозировать возникновение тех или иных нарушений ритма, частоту и условия их возникновения, а также появление их осложнений, не представляется возможным.
Согласно статистическим данным, продолжительность жизни пациентов с синдромом укороченного PQ довольно высока, а пароксизмальные нарушения ритма чаще всего возникают в виде наджелудочковых, а не желудочковых тахикардий. Однако у пациентов с основной патологией сердца остается достаточно высоким риск внезапной сердечной смерти.
Прогноз относительно феномена укороченного PQ остается благоприятным, а качество и продолжительность жизни таких пациентов не страдают.
Лечение
Способы терапии консервативные и оперативные. Прежде чем прибегать к радикальным мерам проводят медикаментозную коррекцию.
Используются средства двух фармацевтических групп:
Внимание:
Нельзя применять антагонисты кальция и средства АТФ. Дабы не спровоцировать остановку сердца.
В рамках срочной симптоматической помощи врачи прибегают к электрокардиоверсии. Пропусканию тока в течение долей секунд для восстановления нормальной частоты сокращений сердца.
Это экстренная мера, направленная на спасение жизни пациенту и улучшение самочувствия.
Операция требуется в крайних случаях. То есть почти всегда, как ни странно. Таблетками скорректировать органическое нарушение невозможно.
Способ идентичен — радиочастотная абляция. Это малоинвазивное вмешательство, оно состоит во введении специального миниатюрного излучателя в кардиальные структуры и разрушение аномального проводящего пути бескровным методом.
Процедура безболезненная и практически не вызывает дискомфорта.
В дальнейшем все должно вернуться в норму и без каких-либо дополнительных мероприятий. Если только болезнь не спровоцировала прочие анатомические изменений со стороны сердца, головного мозга.
Прогноз и осложнения
Исход в 95% случаев при условии проведенного лечения благоприятный.
Без терапии негативный всегда. Результат — тяжелая инвалидность или гибель больного в перспективе нескольких лет. А бывает и быстрее.
Точно спрогнозировать, когда наступит роковой час невозможно. Справедливо сказанное для бессимптомного и яркого течения.
Среди последствий CLC или ВПВ синдромов выделяют инфаркт (острое нарушение питания кардиальных структур), остановку сердца также называемую асистолией, инсульт (отмирание нервных волокон в результате слабого питания).