Инцилофолограма что это в медицине
Что такое папилломавирусная инфекция (ВПЧ)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Борисова Э. В., гинеколога со стажем в 34 года.
Определение болезни. Причины заболевания
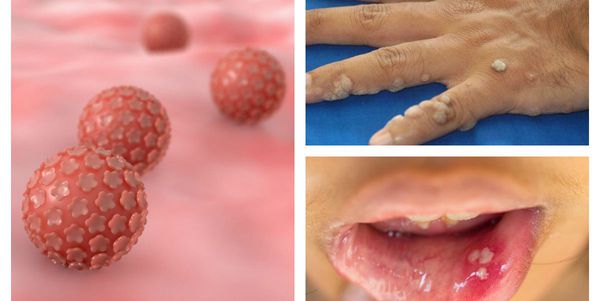
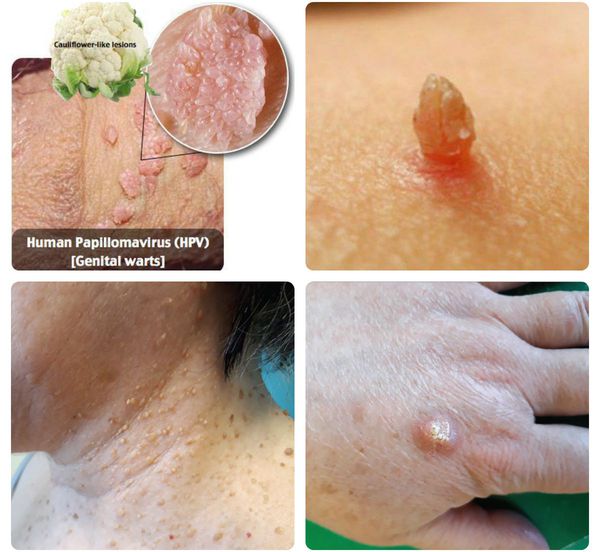
Папилломавирусная инфекция — это состояние, развивающееся при заражении какой-либо разновидностью вируса папилломы человека (ВПЧ). Возбудители данной группы могут существовать только в человеческом организме, поражая кожу и слизистые оболочки, приводя к появлению папиллом, бородавок, плоских и остроконечных кондилом. [1] [2] [4]
ВПЧ довольно широко распространён в человеческой популяции, особенно среди сексуально активных людей, а это свыше 80% всего населения. До недавнего времени вирусы этой группы считались относительно безобидными, вызывающими лишь косметические дефекты, но последние научные исследования показывают, что проблема гораздо серьёзнее. [9]
Чаще всего заражение происходит в молодом возрасте, как правило, с началом половой жизни, при этом возможно неоднократное инфицирование. Наиболее уязвимой группой в плане вероятности заражения ВПЧ и развития неблагоприятных последствий являются молодые женщины в возрасте 15-30 лет.
Помимо этого ВПЧ может перейти от инфицированной матери к ребёнку, например, при родах. Не исключается и контактно-бытовой способ передачи возбудителя, например, при соприкосновениях и даже при совместном использовании предметов личной гигиены.
К факторам риска, способствующим заражению ВПЧ, развитию хронической папилломавирусной инфекции и её переходу в предраковые состояния с потенциальным перерождением в злокачественную опухоль, относятся:
Симптомы папилломавирусной инфекции
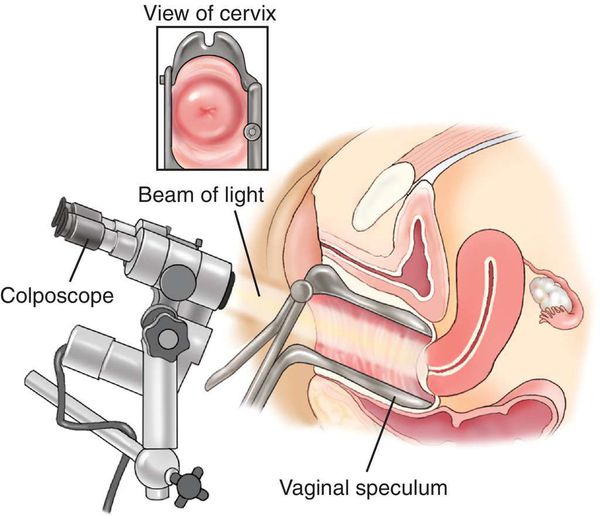
Далеко не всегда человек догадывается о наличии в своём организме папилломавирусной инфекции, оставаясь при этом источником заражения для потенциальных партнёров. [1] [2] Дело в том, что заболевание может долгое время протекать бессимптомно: вирус скрыто существует в организме от нескольких месяцев до нескольких лет, никак себя не проявляя. Кроме того, уже имеющиеся проявления инфекции не всегда доступны для наружного обзора. Например, если папилломы, бородавки и кондиломы на открытых участках тела и поверхности гениталий ещё можно заметить самостоятельно, то патологические изменения, локализующиеся на шейке матки, сможет обнаружить только специалист в ходе осмотра с применением соответствующих инструментов.
И всё же существует несколько симптомов, которые прямо или косвенно могут указывать на наличие папилломавирусной инфекции и её неблагоприятных последствий. [3] К ним относятся:
Наиболее тревожными признаками заболевания являются:
Патогенез папилломавирусной инфекции
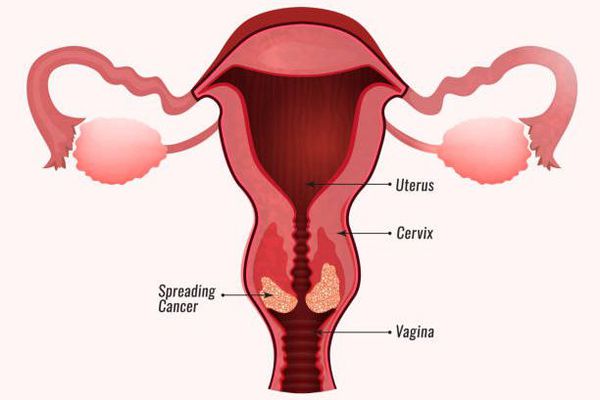
Заражение папилломавирусной инфекцией происходит при попадании вирусных частиц на кожу или слизистую оболочку. [1] [2] Излюбленная локализация инфекции на теле женщины — промежность, большие и малые половые губы, вульва, влагалище и шейка матки, у мужчин — половой член. Может также произойти поражение слизистой полости рта, пищевода, мочевого пузыря, трахеи, конъюнктивы и других органов и тканей.
Заражению способствуют микротравмы и потёртости. Особенно благоприятные для инфицирования условия создаются при половом акте. В 60–80% случаев достаточно однократного сексуального контакта с больным папилломавирусной инфекцией или бессимптомным носителем ВПЧ. К развитию заболевания может привести попадание в организм буквально единичных вирусных частиц.
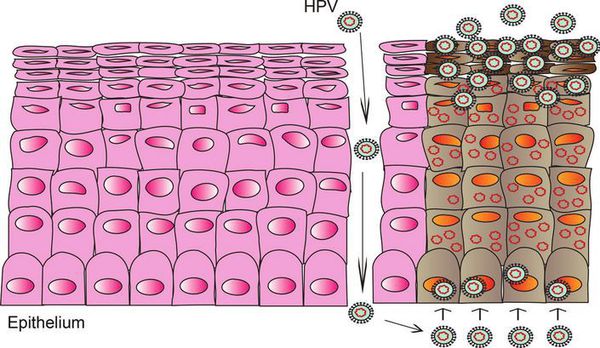
При наличии предрасполагающих факторов (микроповреждения, слабого иммунитета и других) возбудитель проникает в эпителиальную ткань до её базального слоя. Там он прикрепляется к оболочке незрелой клетки и внедряется сначала в её цитоплазму, а затем и в ядро, где повреждает генетический аппарат. После этого начинается деление клеток с изменённым геномом, что приводит к появлению в месте внедрения вируса генитальных кондилом (образований, которые постепенно разрастаются), а, например, на шейке матки — к развитию диспластических процессов различной степени тяжести (дисплазия шейки матки).
В случае ВПЧ высокого онкогенного риска определённые гены в вирусной ДНК кодируют синтез специфических белков-онкопротеинов (Е6 и Е7), которые подавляют противораковую защиту клеток. Под действием онкопротеинов нарушается стабильность генома клеток, стимулируется их размножение и снижается способность к дифференцировке — всё это со временем может привести к онкопатологии. [12]
Формирование новых полноценных вирусных частиц, способных инфицировать другого человека, происходит уже не в базальном, а в самых поверхностных слоях поражённого эпителия. Возбудитель может содержаться в слущивающихся отмирающих клетках, которые отделаются слизистой оболочкой. Таким образом они переходят к новому хозяину при тесном (сексуальном или бытовом) контакте.
Классификация и стадии развития папилломавирусной инфекции
По способности индуцировать развитие злокачественных новообразований ВПЧ подразделяют на четыре группы: [8]
Максимально опасными считаются 16-й и 18-й типы: на их долю приходится до 70% случаев рака шейки матки. [7] [8]
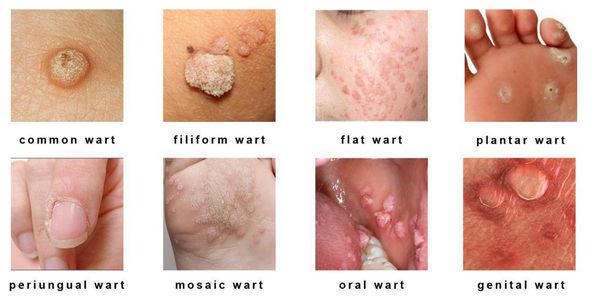
Клинические формы папилломавирусной инфекции: [5]
Латентная инфекция может переходить в субклиническую и манифестную форму в случае возникновения предрасполагающих условий (факторов риска), но чаще всего она протекает бессимптомно, не манифестируя.
Клинические проявления папилломавирусной инфекции:
Разновидности поражений:
Осложнения папилломавирусной инфекции
Основными наиболее опасными осложнениями папилломавирусной инфекции являются злокачественные новообразования. Но возможны и другие серьёзные последствия:
Диагностика папилломавирусной инфекции
Основные цели диагностических мероприятий: [3]
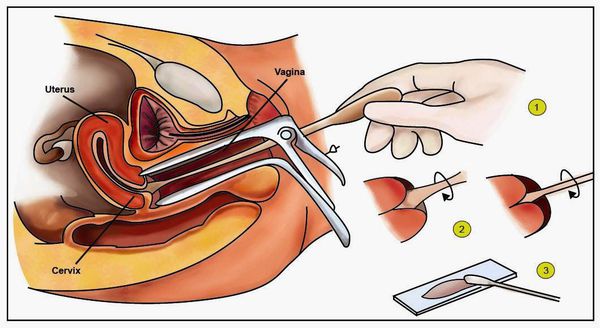
Для выявления папилломавирусной инфекции на сегодняшний день существует целый комплекс диагностических процедур:
Целесообразно дополнительное обследование пациента на наличие других инфекций, передающихся половым путём, так как папилломавирус в 90% случаев с ними сочетается, и это может осложнять течение заболевания.
Лечение папилломавирусной инфекции
Лечение папилломавирусной инфекции должно быть комплексным и включать следующие составляющие: [3] [5]
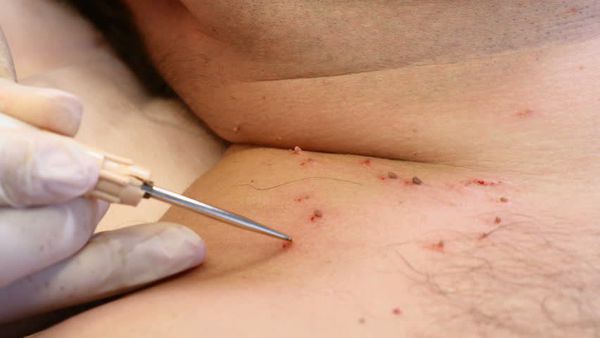
Деструктивные методы делятся на две основные группы:
Лечение сопутствующих половых инфекций проводят до начала деструктивной терапии на фоне адекватной иммунокоррекции.
Удаление видимых проявлений папилломавирусной инфекции должно сочетаться с противовирусной терапией — как с общей, так и с применением препаратов местного действия после удаления кондилом.
Следует помнить, что успешно проведённое лечение не исключает развитие рецидивов в дальнейшем, особенно у пациентов с нарушениями иммунитета. Поэтому за ними устанавливается динамическое наблюдение в течение как минимум 1-2 лет.
Прогноз. Профилактика
В 90% случаев здоровая иммунная система человека справляется с папилломавирусной инфекцией самостоятельно за период от полугода до двух лет с момента инфицирования, после чего происходит полное выздоровление с исчезновением вируса из организма. При этом не формируется напряжённого пожизненного иммунитета, то есть человек может заразиться повторно.
В других случаях, при наличии предрасполагающих факторов, заболевание приобретает хроническую форму, склонную к длительному скрытому течению с периодическими рецидивами и возможным развитием тяжёлых осложнений.
От момента попадания вируса в организм до развития предраковых состояний и тем более возникновения рака может пройти достаточно много времени, иногда десятки лет. Поэтому регулярные профилактические обследования, своевременное выявление и лечение предраковых состояний — вполне реальный и эффективный способ избежать самого неблагоприятного варианта развития событий. [13] С этой целью Всемирная организация здравоохранения рекомендует всем женщинам старше 30 лет при первичном скрининге проходить не только “рутинное” цитологическое исследование, но и делать тест на наличие ВПЧ. [10]
Регулярное посещение гинеколога (при отсутствии каких-либо жалоб — раз в год) с проведением теста Папаниколау позволяет своевременно обнаружить начальные признаки дисплазии и предпринять все необходимые меры для предотвращения прогрессирования процесса и его перехода в онкологическое заболевание.
Использование методов барьерной контрацепции хоть и не полностью защищает от инфицирования, но несколько снижает его вероятность.
Главным методом первичной профилактики папилломавирусной инфекции считается вакцинация. [11] Современные вакцины разработаны с целью защиты от наиболее опасных, высокоонкогенных штаммов ВПЧ, ответственных за 70-80% случаев развития рака шейки матки. Стандартный курс, состоящий из трёх прививок, даёт вполне надёжную защиту.
Целесообразно вакцинировать детей (девочек, а для сдерживания распространения инфекции и мальчиков) с 9-10 до 17 лет, а также молодых женщин (18-25 лет) до вступления в половую жизнь, так как вакцина предотвращает заражение, но не является средством лечения уже развившейся инфекции. Если пациентка уже живёт половой жизнью, то перед вакцинацией ей необходимо пройти исследование на наличие папилломавирусной инфекции. Однако даже при выявлении одного из штаммов, входящих в состав вакцины, проводить вакцинирование всё равно можно, так как это не является противопоказанием.
Гипервентиляционный синдром и дисфункциональное дыхание
Клинические особенности, диагностические критерии гипервентиляционного синдрома (ГВС) и дисфункционального дыхания (ДД) недостаточно знакомы широкому кругу врачей [1, 2, 3]. К одной из исторических вех, связанной с понятиями о функциональных нарушениях
Клинические особенности, диагностические критерии гипервентиляционного синдрома (ГВС) и дисфункционального дыхания (ДД) недостаточно знакомы широкому кругу врачей [1, 2, 3]. К одной из исторических вех, связанной с понятиями о функциональных нарушениях дыхания, относят 1871 год, когда Да Коста (Da Costa Jacob, 1833–1900), американский врач, принимавший участие в Гражданской войне США, применил термин «гипервентиляционый синдром» (ГВС) у пациентов с так называемым «солдатским сердцем». С тех пор для характеристики дыхательных расстройств предлагались различные альтернативные определения: «дыхательный невроз», «нейрореспираторная дистония», «респираторный синдром», «респираторная дискинезия», «идиопатическая гипервентиляция», «нейрореспираторный синдром», «неустойчивое дыхание» и др. Однако указанные термины не получили широкого признания. Они являются достаточно общими и не отражают особенностей нарушений дыхания у конкретного больного [4]. Перечисленные определения нередко связывают с понятием «непонятная одышка» (unexplained dyspnea).
ГВС встречается в 6–11% от числа пациентов общей практики. Соотношение мужчин и женщин составляет 1:4, 1:5; чаще наблюдается в 30–40 лет, но возможно развитие в других возрастных группах, включая детей и пожилых. L. Lum (1987) подчеркивал, что «каждый врач в течение недели может встретить хотя бы одного больного с ГВС». Врачи различных специальностей — невропатологи, кардиологи, пульмонологи, психиатры — могут наблюдать у своих пациентов явления гипервентиляции. Острое течение ГВС встречается значительно реже, чем хроническое, и составляет лишь 1–2% от общего числа больных [2, 6, 7].
Причины развития ГВС довольно многочисленны. Это неврологические и психические расстройства, вегетативные нарушения, болезни органов дыхания, некоторые заболевания сердечно-сосудистой системы, органов пищеварения, экзогенные и эндогенные интоксикации, лекарственные средства (салицилаты, метилксантины, β-агонисты, прогестерон) и др. Считается, что в 5% случаев ГВС имеет только органическую природу, в 60% случаев — только психогенную, в остальных — комбинации этих причин [6].
Важной особенностью развития ГВС является то обстоятельство, что если причины, являющиеся триггерными, устраняются, то гипервентиляция, которая уже не соответствует требованиям конкретной ситуации, сохраняется, сохраняется и гипокапния. Происходит стабилизация гипокапнических нарушений газообмена и формируется «порочный круг» ГВС, который начинает циркулировать автономно, и симптомы могут персистировать достаточно долго — феномен «махового колеса». Эти изменения реакции дыхания указывают на уязвимую систему контроля дыхания, которая не способна поддержать нормальное парциальное давление углекислого газа в крови (РСО2) и кислотно-щелочной гомеостаз [8, 9, 10, 11].
В основе развития клинических проявлений ГВС лежат гипокапнические нарушения газообмена [2, 3, 10]. Среди множества клинических проявлений ГВС одышка является ведущей жалобой и встречается практически в 100% случаев. Одышка может быть единственным клиническим проявлением, но чаще сочетается с другими симптомами.
Основные клинические проявления ГВС
Респираторные: одышка, вздохи, зевота, сухой кашель.
Общие: снижение трудоспособности, слабость, утомляемость, субфебрилитет.
Кардиальные: кардиалгия, экстрасистолия, тахикардия.
Психоэмоциональные: тревога, беспокойство, бессонница.
Гастроэнтерологические: дисфагия, боли в эпигастрии, сухость во рту, аэрофагия, запоры.
Неврологические: головокружение, обмороки, парестезии, тетания (редко).
Мышечные: мышечная боль, тремор.
Диагностика ГВС в первую очередь опирается на знание врачей самых различных специальностей об особенностях клинической картины ГВС. ГВС должен устанавливаться только после проведения дифференциальной диагностики с другими заболеваниями, протекающими с синдромом одышки. Полиморфизм клинических проявлений ГВС вызывает диагностические проблемы. Назначаются многочисленные обследования, дорогостоящие, ненужные, а иногда и опасные для больного. L. Lum (1987), обсуждая диагностические проблемы, называет среди врачебных ошибок бесполезные абдоминальные операции, операции на позвоночнике и других органах, инвазивные исследования, проводимые не без риска, и, что еще хуже, такие диагнозы, как эпилепсия и инфаркт миокарда. Взаимосвязи гипокапнии и ассоциированных с ней симптомов являются чрезвычайно сложными. Многие врачи при регистрации у больных низких значений РСО2 автоматически устанавливают диагноз ГВС, что является неправильным. Известно, что явления гипокапнии могут быть у больных рестриктивными легочными процессами, при лихорадочных состояниях, сердечной патологии, однако при этом «классических» гипокапнических жалоб может и не быть. И наоборот, так называемые гипокапнические жалобы, например тревога, одышка, парестезии и др., встречаются у пациентов с нормокапнией.
В практической медицине больной с ГВС — это пациент, предъявляющий жалобы на одышку, которая не соответствует данным объективного осмотра, показателям клинико-инструментальных исследований дыхания, с диспропорциональной, непонятной одышкой, субъективное восприятие которой является довольно тягостным. К сожалению, при отсутствии достоверных объяснений одышки больные обычно направляются для консультаций в различные лечебные учреждения. В конечном итоге они и формируют основной контингент альтернативной медицины, различных псевдоспециалистов «по тренировке правильного дыхания».
Исследование функции внешнего дыхания, имеющее важное значение в дифференциальной диагностике одышки, не помогает в верификации функциональных нарушений дыхания. Основным подтверждением ГВС служит выявление гипокапнических нарушений газообмена. Снижение РСО2 — прямое свидетельство альвеолярной гипервентиляции. Однако исходная гипокапния у больных с ГВС встречается не так часто. Поэтому в тех случаях, когда у пациента с предположительным ГВС в условиях покоя определяются нормальные значения углекислоты, рекомендуется определение изменений уровня СО2 при различных провокационных тестах. К «золотому стандарту» диагностики ГВС относят пробу с произвольной гипервентиляцией.
Департаментом пульмонологии университета г. Наймиген (Голландия) разработан Наймигенский опросник (Nijmegen questionnaire) для выявления физиологических показателей дизрегуляции вентиляции, сопоставимых с ГВС (табл.). Анкета содержит 16 пунктов, которые оцениваются по 5-балльной шкале (0 — никогда, 4 — очень часто). Минимальные и максимальные достижимые числа — 0 и 64 соответственно.
Данный опросник нашел свое применение прежде всего для скрининг-диагностики ГВС. Существует положение, согласно которому использование данного опросника позволяет корректно предсказывать ГВС в 90% от всех случаев [2, 12].
В последние годы в клиническую практику начинает внедряться понятие «дисфункциональное дыхание» (ДД). Приоритет внедрения термина принадлежит Ван Диксхорну (J. van Dixhoorn), который привел его в работе Hyperventilation and dysfunctional breathing (1997). Основанием для этого явилось понимание, что при функциональных нарушениях дыхания возможны различные изменения паттерна дыхания и значений РCO2, а не только гипокапнические расстройства, характерные для ГВС. ДД может проявляться также быстрым, аритмичным, поверхностным дыханием, частыми вздохами, преобладанием грудного типа дыхания.
Одной из сложных и дискуссионных проблем в пульмонологии является понимание взаимоотношений ГВС, ДД и бронхиальной астмы (БА) [15–18]. С. И. Овчаренко и др. (2002) у 22 из 80 больных БА выявили нарушения дыхания, соответствующие критериям ГВС. Сведений относительно встречаемости дисфункциональных нарушений дыхания при астме немного. Установлено, что среди лиц с диагнозом БА и по крайней мере с одним предписанием антиастматического препарата 29% имеют клинические признаки ДД [19]. Указывается, что ДД может усиливать симптомы БА и приводить к избыточному назначению лекарств.
Достаточно сложным является понимание механизмов развития дисфункциональных расстройств дыхания при БА; существует ряд предположений. К достаточно обоснованным факторам развития гипервентиляции относят тревожные расстройства. Использование больными бронходилататоров (β-2-агонисты, теофиллин), которые обладают эффектами стимуляции дыхания, также относят к факторам развития гипервентиляции. Обсуждается роль изменений перцепции одышки при БА. Анализ существующих проблем взаимосвязи ДД и БА провел M. Morgan (2002), представив следующие ключевые положения:
В зависимости от установления особенностей ДД должна осуществляться и программа лечения больных. При выявлении ГВС релаксирующие методы дыхательной гимнастики проводятся под руководством опытных инструкторов, назначаются β-адреноблокаторы, бензодиазепины [5, 22, 23]. При явлениях гиповентиляции — массаж дыхательных мышц, использование дыхательных тренажеров. Выявление ГВС при БА указывает на необходимость применения методов коррекции функциональных нарушений дыхания. Релаксирующие дыхательные упражнения за счет неспецифических механизмов дыхательного тренинга улучшают качество жизни у этих больных.
По вопросам литературы обращайтесь в редакцию.
В. Н. Абросимов, доктор медицинских наук, профессор
Рязанский ГМУ им. акад. И. П. Павлова, Рязань
Гинекологический мазок «на флору»: на что смотреть, и как понять
Большинству женщин мазок «на флору» знаком, как самый «простой» гинекологический анализ. Однако исследование куда «полезнее», чем может казаться. И всего несколько (а то и одно) отклонений способны подсветить значимые проблемы, еще до появления каких-либо симптомов. Так как же понять полученные результаты? Рассказываем по пунктам.
1. Эпителий
Как известно, любой живой объект в природе имеет ограниченный срок жизни, по истечении которого он погибает «от старости».
Эпителий в гинекологическом мазке – это и есть слущенные «старые» клетки слизистой оболочки влагалища, цервикального или уретры (в зависимости от оцениваемого локуса). Которые могут присутствовать в материале в умеренных количествах.
Превышение нормативных пределов («много» или «обильно») может указывать на:
Уменьшение или отсутствие эпителия в мазке – на атрофические изменения, недостаток эстрадиола или избыток андрогенов.
Кроме того, ввиду зависимости эпителия от уровня половых гормонов, его количество в материале может сильно меняться в зависимости от дня цикла, начиная с единичного «в поле зрения» в самом начале – до умеренного и даже большого количества ближе к овуляции и во время нее.
А появление в мазке так называемых «ключевых клеток» (эпителий, «облепленный» мелкими кокковыми бактериями) – является маркером бактериального вагиноза.
2. Лейкоциты
«Норма» лейкоцитов в мазке также сильно зависит от стадии цикла и уровня половых гормонов, а также исследуемого локуса.
Так, за «максимум» для:
Повышение показателя – очевидно, свидетельствует о воспалении, а полное отсутствие может иметь место в норме в самом начале цикла.
Слизь
Результат «отсутствует», «мало» или «умеренно» для этого показателя является нормой, что тоже связано с индивидуальными особенностями гормонального фона и циклом.
А вот «много» слизи в мазке – может свидетельствовать о том, что мазок взят в середине цикла, дисбиотических изменениях или избытке эстрогенов. Поэтому требует внимания специалиста или, как минимум, контроля в динамике.
Флора
Преобладающей флорой женских половых путей в норме у женщин репродуктивного возраста, как известно, являются лактобактерии (или палочки Дедерлейна). Количество которых может быть от умеренного до обильного, в том зависимости, в том числе, от фазы менструального цикла.
Патологические элементы
Присутствия мицелия грибов, трихомонад, диплококков (в том числе и возбудитель гонореи), лептотрикса, мобилункуса и прочих патогенных микроорганизмов в нормальном мазке не допускается, даже в минимальном количестве. А их выявление – серьезный повод незамедлительно обратиться за лечением.
Идиопатические интерстициальные пневмонии
Рассмотрены интерстициальные заболеваний легких (ИЗЛ) с точки зрения классификации и терминологии, а также клинические формы и диагностические критерии идиопатических интерстициальных пневмоний (ИИП), идиопатического легочного фиброза и других ИЗЛ. Рассмо
Interstitial pulmonary diseases (IPD) were considered from the point of view of classification and terminology, and also clinical forms and diagnostic criteria of idiopathic interstitial pneumonia (IIP), idiopathic pulmonary fibrosis and other IPD. Approaches to the IIP treatment in patients were examined.
В группу интерстициальных заболеваний легких (ИЗЛ) включают несколько десятков отдельных нозологических форм, отличающихся по этиологии, особенностям патогенеза и морфологической картине, имеющих различную клинику и прогноз. Терминологические и классификационные подходы к этим заболеваниям неоднократно менялись, дополнительно затрудняя и без того непростую диагностическую работу с данной категорией пациентов. Даже сегодня, несмотря на наличие общепринятой классификации ИЗЛ, термин «интерстициальная пневмония» ассоциируется у врача скорее с вирусной инфекцией, чем с заболеванием, требующим обязательной морфологической верификации и имеющим довольно серьезный прогноз [1].
Напомним основные определения.
Пневмония — группа острых инфекционных (преимущественно бактериальных) заболеваний, характеризующихся очаговым поражением респираторных отделов легких с обязательным наличием внутриальвеолярной экссудации. Из рубрики «пневмония» исключены заболевания, вызванные физическими (лучевой пневмонит) или химическими («бензиновая» пневмония) факторами, а также имеющими аллергическое («эозинофильная пневмония») или сосудистое (инфаркт легкого вследствие ТЭЛА) происхождение. Воспалительные процессы в легких при кори, краснухе, гриппе и др. рассматриваются не в рубрике «пневмония», а в рамках соответствующих нозологических форм [2].
Пневмонит (альвеолит) — воспалительный процесс, часто иммунного, неинфекционного характера, затрагивающий преимущественно паренхиматозный интерстиций (альвеолярные стенки) и экстраальвеолярную соединительную ткань легких без обязательной внутриальвеолярной экссудации. Ряд авторов разграничивает понятия «пневмонит» и «альвеолит», предполагая, что при альвеолите воспалительный процесс локализуется преимущественно в альвеолах, а при пневмоните воспаление затрагивает и другие структуры паренхимы легких, однако практического значения такое разделение не имеет, и термины часто используются как синонимы [3].
Термин «пневмонит» отражает не конкретную нозологическую форму, а особенности патологического процесса. Поражение легких по типу пневмонита (альвеолита) может развиваться при самых разных заболеваниях: идиопатических интерстициальных пневмониях, лекарственных поражениях легких, системных заболеваниях соединительной ткани, гиперчувствительном пневмоните, саркоидозе и др. Следует учесть, что при каждом из этих заболеваний пневмонит является обязательным, но далеко не единственным проявлением поражения легких. Причины, клинические проявления, направления лечения и прогноз при этих заболеваниях различны, поэтому при выявлении признаков пневмонита такое большое значение имеют морфологическая верификация и дальнейшая нозологическая диагностика.
С современных позиций ИЗЛ представляют собой гетерогенную группу заболеваний, общими чертами которых являются поражение интерстициальной ткани легких по типу продуктивного пневмонита с последующим формированием фиброза, прогрессирующая одышка при нагрузке, непродуктивный кашель, крепитация, диффузные изменения при рентгенографии и компьютерной томографии легких, рестриктивные вентиляционные нарушения, снижение диффузионной способности легких и нарастающая дыхательная недостаточность [4].
В настоящее время в большинстве стран, в том числе и в России, используется классификация ИЗЛ, принятая Согласительной комиссии Американского торакального общества и Европейского респираторного общества (ATS/ERS, 2002 г.) [5]. Согласно этой классификации выделяют четыре группы ИЗЛ: ИЗЛ известной этиологии, гранулематозы, идиопатические интерстициальные пневмонии, другие ИЗЛ (рис.).
Идиопатические интерстициальные пневмонии (ИИП) — типичные представители группы ИЗЛ неизвестной этиологии, имеющие много сходных клинических, рентгенологических и функциональных признаков, но принципиально разную морфологическую картину, обусловливающую особенности клиники, ответ на терапию и прогноз. Принципом построения клинико-патологической классификации ATS/ERS является соответствие каждой клинической форме ИИП определенного гистологического варианта ИИП (табл. 1).
Клинические особенности больных с различными видами ИИП приведены в табл. 2.
Идиопатический легочный фиброз
Идиопатический легочный фиброз (ИЛФ) является одним из наиболее часто встречающихся заболеваний из группы ИИП. Синонимом ИЛФ являются «идиопатический фиброзирующий альвеолит» — термин, традиционно используемый в нашей стране.
Заболевание чаще всего встречается у пациентов в возрасте старше 50 лет. Основными жалобами больных являются нарастающая одышка и непродуктивный кашель. Начало болезни, как правило, незаметное, болезнь прогрессирует довольно медленно, пациенты успевают адаптироваться к своей одышке и на момент обращения имеют анамнез заболевания длительностью до 1–3 лет. Лихорадка и кровохарканье для больных ИФЛ не характерны. Другими симптомами могут быть общая слабость, артралгии, миалгии, изменение ногтевых фаланг в виде «барабанных палочек». Типичным аускультативным феноменом при ИЛФ является инспираторная крепитация, которую сравнивают с «треском целлофана». По мере прогрессирования заболевания появляются признаки дыхательной недостаточности и легочного сердца, снижение массы тела вплоть до кахексии. Данные лабораторного обследования неспецифичны. ИЛФ относится к рестриктивным легочным заболеваниям, поэтому характерными функциональными особенностями заболевания является снижение статических легочных объемов, выявляемое при бодиплетизмографии. Одним из ранних признаков заболевания является снижение DLCO. Спирометрический показатель FEV1/FVC находится в пределах нормы или повышен.
Наиболее частыми рентгенографическими признаками ИЛФ являются двусторонние изменения ретикулярного характера, более выраженные в нижних отделах легких. На ранних этапах развития заболевания может наблюдаться лишь некоторое уменьшение объема легочных полей и понижение прозрачности легких по типу «матового стекла». При прогрессировании заболевания ретикулярный паттерн становится более грубым, тяжистым, появляются округлые кистозные просветления, отражающие формирование «сотового легкого». Для уточнения рентгенологической картины целесообразно проведение мультиспиральной компьютерной томографии органов грудной клетки.
Поскольку возможности диагностики ИИП ограничены, а данные обследования не всегда специфичны, «золотым» диагностическим стандартом всех ИИП является биопсия легких: открытая либо торакоскопическая. Особая необходимость в выполнении биопсии возникает в случаях наличия не вполне типичной клинической и/или рентгенологической картины, возрасте пациента менее 50 лет, наличии системных признаков заболевании, быстром прогрессировании заболевания. Необходимым условием является преобладание пользы от постановки правильного диагноза над риском хирургической манипуляции.
Существует диагностический подход, позволяющий с большой вероятностью установить диагноз ИЛФ в тех случаях, когда проведении биопсии невозможно. Для этого необходимо, чтобы у пациента имелись четыре из четырех больших критериев и хотя бы три из четырех малых критериев.
Большие критерии
Малые критерии
Современная терапия ИЛФ построена, в основном, на противовоспалительной терапии (кортикостероиды и цитостатики (ЦС)), т. е. препаратах, способных воздействовать на воспалительные и иммунологические звенья развития заболевания. Базой такого подхода служит положение, что хроническое воспаление предшествует и неизбежно ведет к фиброзу и что агрессивное подавление воспаления может блокировать последующее формирование фиброзных изменений.
Широко используются три режима противовоспалительной терапии: монотерапия глюкокортикостероидами (ГКС), комбинация ГКС с азатиоприном и комбинация ГКС с Циклофосфаном. ATS/ERS рекомендует комбинированные режимы как более предпочтительные [6]. Терапия проводится, как минимум, в течение 6 месяцев. Обязательно тщательное мониторирование побочных эффектов терапии. При назначении цитостатиков мониторинг больных должен включать общий анализ крови еженедельно в течение первого месяца, затем один раз каждые 2–4 недели; при терапии Циклофосфаном требуется еженедельный анализ мочи на гематурию.
В случае выбора монотерапии ГКС начальная суточная доза преднизолона составляет 1 мг/кг идеального веса в сутки (максимум до 80 мг/сут). Через 4 недели проводится оценка переносимости такой терапии. Если произошло улучшение или стабилизация функциональных показателей, то в течение последующих 3 месяцев суточную дозу преднизолона уменьшают. При отсутствии ответа на стероиды добавляют азатиоприн [7].
Альтернативным подходом, сфокусированным на снижении избыточной депозиции матрикса в легких или ускорении распада коллагена, является антифибротическая терапия. К числу антифиброзных препаратов относятся D-пеницилламин, колхицин, интерферон гамма-1 b, пирфенидон.
Доказано повышение эффективности терапии при добавлении к противовоспалительным препаратам N-ацетилцистеина в дозе 600 мг 3 раза в сутки. В настоящее время ведущие эксперты при лечении ИЛФ отдают предпочтение схеме, включающей преднизолон, азатиоприн и N-ацетилцистеин [8].
Кроме медикаментозной терапии, как и при других заболеваниях легких, при развитии гипоксемии используется терапия кислородом. При развитии легочной гипертензии, кроме кислородотерапии, возможно использование вазодилататоров. Развитие инфекций трахеобронхиального дерева требуют использования антибактериальных и противогрибковых препаратов. Всем больным ИЛФ рекомендована регулярная вакцинация противогриппозными и антипневмококковыми вакцинами.
Другие идиопатические интерстициальные пневмонии (не-ИЛФ)
Неспецифическая интерстициальная пневмония (НИП) наряду с ИЛФ является одной из наиболее часто встречаемых форм ИИП. НИП может быть идиопатической, именно эта форма входит в группу ИИП. Однако морфологическая картина, соответствующая паттерну НИП, бывает и при поражении легких у больных с СЗСТ, гиперчувствительном пневмоните, радиационном пневмоните и т. д.
Клинические, лабораторные и функциональные показатели при НИП неспецифичны. Рентгенография грудной клетки чаще всего выявляет двусторонние изменения по типу «матового стекла» и ретикулярные изменения в нижних отделах легких.
Прогноз больных НИП более благоприятный, чем при ИЛФ. Клиническое течение и выживаемость больных зависят от выраженности легочного фиброза. Десятилетняя выживаемость при НИП составляет около 35%. Спонтанные случаи выздоровления без лечения при НИП неизвестны, терапия ГКС без или с добавлением цитостатиков приводит к улучшению или стабилизации приблизительно у 75% больных [9].
Криптогенная организующаяся пневмония
Синонимами криптогенной организующейся пневмонии (КОП) являются термины «облитерирующий бронхиолит с организующейся пневмонией» и «пролиферативный бронхиолит». КОП имеет четкие клинико-морфологические отличия от «изолированного» облитерирующего бронхиолита: наряду с поражением бронхиол наблюдается вовлечение в воспалительный процесс альвеол с наличием в их просвете организованного экссудата. КОП в большинстве случаев является идиопатическим, т. е. причина остается неустановленной. Среди установленных причин наибольше значение имеют СЗСТ (ревматоидный артрит и др.), осложнения лекарственной терапии (амиодарон, препараты золота и др.).
Заболевание чаще всего развивается у людей в возрасте 50–60 лет, мужчины и женщины болеют одинаково часто. КОП характеризуется острым или подострым течением, клиническая картина часто напоминает бактериальную пневмонию. Средняя продолжительность симптомов до момента постановки диагноза составляет 2–6 мес. Рутинные лабораторные тесты выявляют лейкоцитоз периферической крови (50%), повышение СОЭ и C-реактивного белка (70–80%).
Типичным рентгенологическим признаком КОП является наличие пятнистых, двусторонних (реже односторонних) плотных очагов консолидации субплевральной локализации. При КОП описана миграция легочных инфильтратов, чаще всего от нижних к верхним отделам. Дифференциальный диагноз КОП, кроме бактериальной пневмонии, проводят с хронической эозинофильной пневмонией, бронхоальвеолярным раком и лимфомой легких.
Спонтанное улучшение при КОП описано, но бывает редко. Терапия выбора при КОП — пероральные ГКС. Клиническое улучшение наступает уже через 1–3 суток от начала приема первой дозы, рентгенологические изменения обычно исчезают через несколько недель, общая длительность терапии ГКС составляет от 6 до 12 мес. При снижении дозы ГКС рецидивы заболевания возникают довольно часто, в такой ситуации вновь увеличивают дозу стероидов. Прогноз при КОП обычно благоприятный, большинство больных полностью излечивается при приеме ГКС. Однако в редких случаях наблюдается плохой ответ на стероиды и неуклонно прогрессирующее течение КОП. У таких больных рекомендовано использование цитостатиков [10].
Десквамативная интерстициальная пневмония
Десквамативная интерстициальная пневмония (ДИП) является довольно редким заболеванием из группы ИИП. Среди всех больных ДИП более 90% являлись курильщиками. Кроме того, описаны редкие случаи ДИП, ассоциированной с другими состояниями — СЗСТ, реакциями на лекарственные препараты, экспозицией к факторам внешней среды.
Клиническая картина заболевания типична для ИИП. Лабораторные, функциональные и рентгенологические показатели при ДИП не дают дополнительной информации.
При наличии сомнительной картины для исключения более агрессивных форм ИЗЛ рекомендовано проведение биопсии легких.
Отказ от курения является первым шагом лечения ДИП, так как показано, что данное мероприятие часто приводит к обратному развитию заболевания. Для большинства больных ДИП основным лечением является терапия преднизолоном в дозе 40–60 мг/сут. Начальная доза преднизолона обычно назначается на период 1–2 месяца, а затем дозу препарата постепенно снижают на протяжении 6–9 мес. На фоне терапии ГКС клиническое улучшение или стабилизация течения заболевания наблюдается приблизительно у двух третей больных ДИП. Значение цитостатиков при данной форме ИИП пока не ясно. 5- и 10-летняя выживаемость при ДИП составляет 95,2 и 69,6% соответственно [9].
Респираторный бронхиолит, ассоциированный с интерстициальным заболеванием легких
Респираторный бронхиолит, ассоциированный с интерстициальным заболеванием легких (РБ-ИЗЛ), — заболевание из группы ИИП, при котором респираторный бронхиолит сочетается с поражением альвеол и легочного интерстиция.
Данное заболевание встречается у курильщиков со стажем курения более 30 пачек/лет. Средний возраст больных колеблется от 30 до 40 лет. Клиническая картина и данные лабораторно-инструментального обследования типичны для ИИЛ.
Часто прекращение курения приводит к полному разрешению заболевания, в ряде случаев могут потребоваться небольшие дозы ГКС. Прогноз при РБ-ИЗЛ более благоприятный, чем при ИЛФ, но все-таки данное заболевание в ряде случаев может иметь неуклонно прогрессирующее течение и стать причиной смерти больных [11].
Лимфоцитарная интерстициальная пневмония
Лимфоцитарная интерстициальная пневмония (ЛИП) является одним из наиболее редко встречающихся заболеваний из группы ИИП. Как следует из названия, в основе заболевания лежит распространенная гомогенная лимфоцитарная инфильтрация легочного интерстиция. Морфологический диагноз ЛИП очень сложен, так как сходную гистологическую картину имеют некоторые заболевания, ассоциированные с массивной лимфоцитарной инфильтрацией ткани легких: псевдолимфома, первичная лимфома, лимфоматозный гранулематоз и др.
ЛИП встречается чаще всего у женщин, обычно в возрасте 40–60 лет. Большинство больных ЛИП — некурящие. Начало заболевания чаще всего незаметное, постепенное. Рентгенологическая картина ЛИП неспецифична.
Для постановки диагноза ЛИП во всех случаях требуется проведение открытой биопсии легких. Основу терапии ЛИП составляют ГКС. Дозы и длительность терапии приблизительно такие же, как и при других клеточных формах ИИП, например ДИП. На фоне противовоспалительной терапии улучшение или стабилизация заболевания отмечается у большинства больных (около 80%), хотя у небольшой группы их наблюдается медленное, но неуклонное прогрессирование заболевания. Кроме ГКС, у больных ЛИП применялись попытки терапии азатиоприном, циклофосфамидом, метотрексатом и циклоспорином [12].
Острая интерстициальная пневмония
Первые упоминания ОИП относятся к 1935 г., когда Hamman и Rich описали четырех больных с быстропрогрессирующей дыхательной недостаточностью, приведшей к смерти пациентов в течение 6 месяцев от начала болезни. На аутопсии был обнаружен выраженный распространенный фиброз легких [13]. Длительное время синдромом Хаммена–Рича назывались и заболевания с хроническим течением (в первую очередь ИЛФ), однако в настоящее время к синдрому Хаммена–Рича можно отнести только ОИП [14].
В современных руководствах ОИП рассматривается как заболевание, характеризующееся прогрессирующей дыхательной недостаточностью, приводящей в большинстве случаев к летальному исходу. Клиническая картина напоминает острый респираторный дистресс-синдром (ОРДС), однако при ОИП неизвестна причина заболевания и отсутствует вовлечение в процесс других систем организма (полиорганная недостаточность). В настоящее время в мировой литературе описано около 150 случаев ОИП, что связано не столько с редкостью заболевания, сколько со сложностью его диагностики [15].
Для ОИП характерно очень быстрое нарастание симптомов заболевания. Период от появления первых симптомов до обращения за медицинской помощью у большинства больных составляет не более 3 недель и очень редко превышает 2 месяца. Заболевание может развиться в любом возрасте и встречается одинаково часто у мужчин и женщин. Наиболее частыми симптомами ОИП являются непродуктивный кашель и диспноэ, лихорадка, миалгии, головная боль, слабость. При осмотре обращает на себя внимание тахипноэ, тахикардия, цианоз. При аускультации выслушивают крепитацию, реже — сухие свистящие хрипы.
Функциональные тесты неспецифичны и выявляют картину, характерную для других ИИП, однако полноценное функциональное исследование удается провести далеко не всегда. Характерным признаком ОИП является выраженная гипоксемия, часто рефрактерная к кислородотерапии, поэтому большинство больных, описанных в литературе, требовали проведения механической вентиляции легких.
Рентгенологическая картина при ОИП выявляет двусторонние пятнистые ретикулонодулярные тени, распространяющиеся практически на все легочные поля, за исключением реберно-диафрагмальных синусов, и плотные инфильтраты (консолидация). Типичными находками компьютерной томографии легких являются участки пониженной прозрачности паренхимы по типу «матового стекла», дилатация бронхов и нарушение легочной архитектоники. Изменения по типу «матового стекла» чаще всего имеют пятнистое распространение («географическая карта»).
Для морфологической верификации диагноза возможно проведение открытой или торакоскопической биопсии легких. Однако, к сожалению, из-за крайней тяжести больных с ОИП проведение данной диагностической процедуры чаще всего бывает невозможно. Все описанные в литературе морфологические изменения ОИП основаны на данных аутопсии или открытой биопсии легких, выполненной во время проведения больным ИВЛ.
Заболевание характеризуется фульминантным течением, прогноз плохой, летальность больных ОИП крайне высока и составляет, в среднем, 70% [16]. Дифференциальный диагноз ОИП чаще всего проводится с двусторонней бактериальной пневмонией или ОРДС. При ОРДС, как правило, известна причина (сепсис, травма, шок и т. д.); кроме того, ОРДС чаще всего бывает одной из составных частей полиорганной недостаточности.
Эффективной терапии ОИП в настоящее время не существует. Обязательными компонентами терапии ОИП являются кислородотерапия и респираторная поддержка.
Литература
М. В. Вершинина, кандидат медицинских наук, доцент
ГБОУ ВПО ОмГМА Минздравсоцразвития России, Омск

.gif)
_575.gif)