Инвазивная терапия что это
Инвазивная терапия что это
Проблема поражения легких при вирусной инфекции, вызванной COVID-19 является вызовом для всего медицинского сообщества, и особенно для врачей анестезиологов-реаниматологов. Связано это с тем, что больные, нуждающиеся в реанимационной помощи, по поводу развивающейся дыхательной недостаточности обладают целым рядом специфических особенностей. Больные, поступающие в ОРИТ с тяжелой дыхательной недостаточностью, как правило, старше 65 лет, страдают сопутствующей соматической патологией (диабет, ишемическая болезнь сердца, цереброваскулярная болезнь, неврологическая патология, гипертоническая болезнь, онкологические заболевания, гематологические заболевания, хронические вирусные заболевания, нарушения в системе свертывания крови). Все эти факторы говорят о том, что больные поступающие в отделение реанимации по показаниям относятся к категории тяжелых или крайне тяжелых пациентов. Фактически такие пациенты имеют ОРДС от легкой степени тяжести до тяжелой.
В терапии классического ОРДС принято использовать ступенчатый подход к выбору респираторной терапии. Простая схема выглядит следующим образом: низкопоточная кислородотерапия – высокопоточная кислородотерапия или НИМВЛ – инвазивная ИВЛ. Выбор того или иного метода респираторной терапии основан на степени тяжести ОРДС. Существует много утвержденных шкал для оценки тяжести ОРДС. На наш взгляд в клинической практике можно считать удобной и применимой «Берлинскую дефиницую ОРДС».
Общемировая практика свидетельствует о крайне большом проценте летальных исходов связанных с вирусной инфекцией вызванной COVID-19 при использовании инвазивной ИВЛ (до 85-90%). На наш взгляд данный факт связан не с самим методом искусственной вентиляции легких, а с крайне тяжелым состоянием пациентов и особенностями течения заболевания COVID-19.
Тяжесть пациентов, которым проводится инвазивная ИВЛ обусловлена большим объемом поражения легочной ткани (как правило более 75%), а также возникающей суперинфекцией при проведении длительной искусственной вентиляции.
Собственный опыт показывает, что процесс репарации легочной ткани при COVID происходит к 10-14 дню заболевания. С этим связана необходимость длительной искусственной вентиляции легких. В анестезиологии-реаниматологии одним из критериев перевода на спонтанное дыхание и экстубации служит стойкое сохранение индекса оксигенации более 200 мм рт. ст. при условии, что используются невысокие значения ПДКВ (не более 5-6 см. вод. ст.), низкие значения поддерживающего инспираторного давления (не более 15 см. вод. ст.), сохраняются стабильные показатели податливости легочной ткани (статический комплайнс более 50 мл/мбар), имеется достаточное инспираторное усилие пациента ( p 0.1 более 2.)
Достижение адекватных параметров газообмена, легочной механики и адекватного спонтанного дыхания является сложной задачей, при условии ограниченной дыхательной поверхности легких.
При этом задача поддержания адекватных параметров вентиляции усугубляется присоединением вторичной бактериальной инфекции легких, что увеличивает объем поражения легочной ткани. Известно, что при проведении инвазинвой ИВЛ более 2 суток возникает крайне высокий риск возникновения нозокомиальной пневмонии. Кроме того, у больных с COVID и «цитокиновым штормом» применяются ингибиторы интерлейкина, которые являются выраженными иммунодепрессантами, что в несколько раз увеличивает риск возникновения вторичной бактериальной пневмонии.
В условиях субтотального или тотального поражения дыхательной поверхности легких процент успеха терапии дыхательной недостаточности является крайне низким.
Собственный опыт показывает, что выживаемость пациентов на инвазивной ИВЛ составляет 15.3 % на текущий момент времени.
Алгоритм безопасности и успешности ИВЛ включает:
В связи с тем, что процент выживаемости пациентов при использовании инвазивной ИВЛ остается крайне низким возрастает интерес к использованию неинвазивной искусственной вентиляции легких. Неинвазивную ИВЛ по современным представлениям целесообразно использовать при ОРДС легкой степени тяжести. В условиях пандемии и дефицита реанимационных коек процент пациентов с тяжелой формой ОРДС преобладает над легкой формой.
Тем не менее, в нашей клинической практике у 23% пациентов ОРИТ в качестве стартовой терапии ДН и ОРДС применялась неинвазивная масочная вентиляция (НИМВЛ). К применению НИМВЛ есть ряд ограничений: больной должен быть в ясном сознании, должен сотрудничать с персоналом. Допустимо использовать легкую седацию с целью обеспечения максимального комфорта пациента.
Критериями неэффективности НИМВЛ являются сохранение индекса оксигенации ниже 100 мм рт.ст., отсутствие герметичности дыхательного контура, возбуждение и дезориентация пациента, невозможность синхронизации пациента с респиратором, травмы головы и шеи, отсутствие сознания, отсутствие собственного дыхания. ЧДД более 35/мин.
В нашей практике успешность НИМВЛ составила 11.1 %. Зав. ОАИР: к.м.н. Груздев К.А.
Искусственная вентиляция легких (ИВЛ): инвазивная и неинвазивная респираторная поддержка
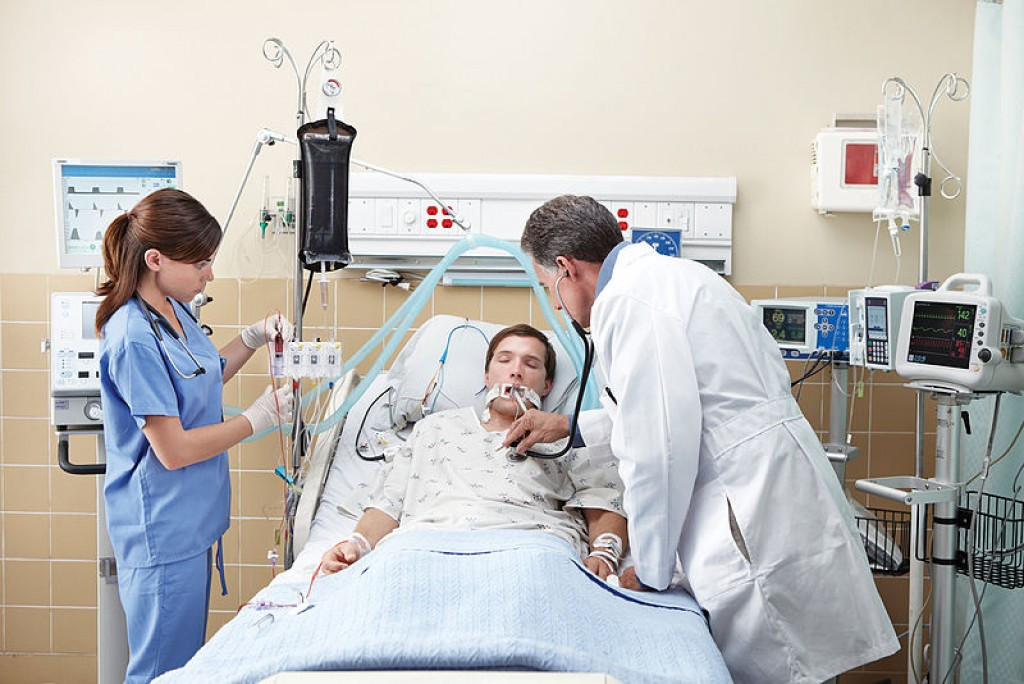
К искусственной вентиляции легких (ИВЛ) прибегают для оказания помощи пациентам с острой или хронической дыхательной недостаточностью, когда больной не может самостоятельно вдыхать необходимый для полноценного функционирования организма объем кислорода и выдыхать углекислый газ. Необходимость в ИВЛ возникает при отсутствии естественного дыхания или при его серьезных нарушениях, а также во время хирургических операций под общим наркозом.
Что такое ИВЛ?
Искусственная вентиляция в общем виде представляет собой вдувание газовой смеси в легкие пациента. Процедуру можно проводить вручную, обеспечивая пассивный вдох и выдох путем ритмичных сжиманий и разжиманий легких или с помощью реанимационного мешка типа Амбу. Более распространенной формой респираторной поддержки является аппаратная ИВЛ, при которой доставка кислорода в легкие осуществляется с помощью специального медицинского оборудования.
Показания к искусственной вентиляции легких
Искусственная вентиляция легких проводится при острой или хронической дыхательной недостаточности, вызванной следующими заболеваниями или состояниями:
Инвазивная вентиляция легких
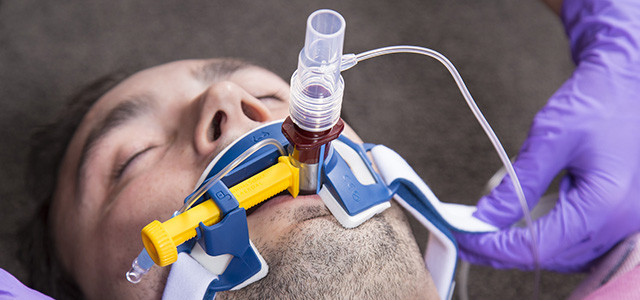
Эндотрахеальная трубка вводится в трахею через рот или через нос и подсоединяется к аппарату ИВЛ
При инвазивной респираторной поддержке аппарат ИВЛ обеспечивает принудительную прокачку легких кислородом и полностью берет на себя функцию дыхания. Газовая смесь подается через эндотрахеальную трубку, помещенную в трахею через рот или нос. В особо критических случаях проводится трахеостомия – хирургическая операция по рассечению передней стенки трахеи для введения трахеостомической трубки непосредственно в ее просвет.
Инвазивная вентиляция обладает высокой эффективностью, но применяется лишь случае невозможности помочь больному более щадящим способом, т.е. без инвазивного вмешательства.
Кому и когда необходима инвазивная ИВЛ?
Подключенный к аппарату ИВЛ человек не может ни говорить, ни принимать пищу. Интубация доставляет не только неудобства, но и болезненные ощущения. Ввиду этого пациента, как правило, вводят в медикаментозную кому. Процедура проводится только в условиях стационара под наблюдением специалистов.
Инвазивная вентиляция легких отличается высокой эффективностью, однако интубация предполагает введение пациента в медикаментозную кому. Кроме того, процедура сопряжена с рисками.
Традиционно инвазивную респираторную поддержку применяют в следующих случаях:
Как работает аппарат инвазивной ИВЛ?
Принцип работы приборов для инвазивной ИВЛ можно описать следующим образом.
Особенности оборудования для инвазивной вентиляции
Оборудование для инвазивной вентиляции легких имеет ряд характерных особенностей.
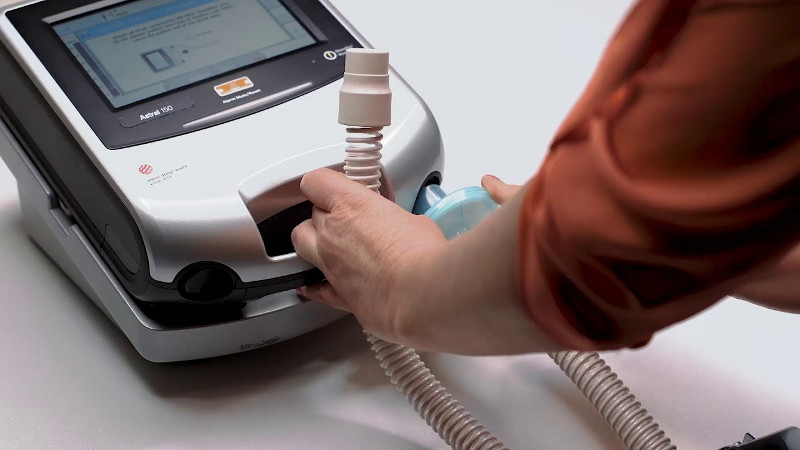
Неинвазивная вентиляция легких
За последние два десятилетия заметно возросло использование оборудования неинвазивной искусственной вентиляции легких. НИВЛ стала общепризнанным и широко распространенным инструментом терапии острой и хронической дыхательной недостаточности как в лечебном учреждении, так и в домашних условиях.
Одним из ведущих производителей медицинских респираторных устройств является австралийская компания ResMed
НИВЛ — что это?
Неинвазивная вентиляция легких относится к искусственной респираторной поддержке без инвазивного доступа (т.е. без эндотрахеальной или трахеостомической трубки) с использованием различных известных вспомогательных режимов вентиляции.
Оборудование подает воздух в интерфейс пациента через дыхательный контур. Для обеспечения НИВЛ используются различные интерфейсы – носовая или рото-носовая маска, шлем, мундштук. В отличие от инвазивного метода, человек продолжает дышать самостоятельно, но получает аппаратную поддержку на вдохе.
Когда применяется неинвазивная вентиляция легких?
Ключом к успешному использованию неинвазивной вентиляции легких является признание ее возможностей и ограничений, а также тщательный отбор пациентов (уточнение диагноза и оценка состояния больного). Показаниями для НИВЛ являются следующие критерии:
Инвазивная терапия что это
ФГБУ «РНЦХ им. акад. Б.В. Петровского» РАМН
ФГБНУ «Российский научный центр хирургии им. акад. Б.В. Петровского»
Российский научный центр хирургии им. акад. Б.В. Петровского РАМН, Москва
Локальная инвазивная терапия хронической боли
Журнал: Журнал неврологии и психиатрии им. С.С. Корсакова. 2014;114(4): 57-62
Медведева Л. А., Загорулько О. И., Гнездилов А. В. Локальная инвазивная терапия хронической боли. Журнал неврологии и психиатрии им. С.С. Корсакова. 2014;114(4):57-62.
Medvedeva L A, Zagorulko O I, Gnezdilov A V. Local invasive treatment of chronic pain. Zhurnal Nevrologii i Psikhiatrii imeni S.S. Korsakova. 2014;114(4):57-62.
ФГБУ «РНЦХ им. акад. Б.В. Петровского» РАМН
Проведен анализ применения методов инвазивной локальной терапии хронической боли по данным периодических научных изданий. Рассмотрено 14 работ, в том числе результаты метаанализа и систематических обзоров. Применение методов регионарной анестезии, выполняемых анестезиологами, входящими в штат клиник боли, демонстрирует эффективность различных типов перидуральных инъекций местных анестетиков со стероидами с высокой степенью доказательности у пациентов с корешковыми болевыми синдромами на уровне шейного и поясничного отделов позвоночника. Лечебные блокады затылочного нерва являются эффективным методом лечения цервикогенной и кластерной головной боли, а также невралгий затылочного нерва. Имеются четкие указания на эффективность методов локальной инъекционной терапии и в случаях первичных хронических цефалгий (мигрени и головной боли напряжения). Подчеркивается возможность прерывания потока болевой периферической ноцицептивной информации и, вследствие этого, разрыва порочного круга боли. Освещаются вопросы эффективности применяемых локальных инъекций по триггерным точкам при лечении хронической боли.
ФГБУ «РНЦХ им. акад. Б.В. Петровского» РАМН
ФГБНУ «Российский научный центр хирургии им. акад. Б.В. Петровского»
Российский научный центр хирургии им. акад. Б.В. Петровского РАМН, Москва
В 2003 г. Европейская федерация по изучению боли (EFIC) провела масштабное исследование распространенности хронической боли в Европе с участием 46 000 человек из 16 стран. Оказалось, что 20% взрослого населения страдают от хронической боли, причем 35% пациентов испытывают боль ежедневно. В среднем продолжительность хронической боли составляет 7 лет, каждый 5-й пациент испытывает хроническую боль в течение 20 и более лет. У 19% она серьезно влияет на качество жизни и работоспособность, 16% опрошенных сообщили, что иногда боль вызывает у них появление суицидальных мыслей. Почти треть пациентов считают, что их лечащий врач не знает, как справиться с этой болью, а около 40% не получали адекватного обезболивания. Только 2% опрошенных пациентов когда-либо наблюдались специалистом по лечению боли [2]. Отечественные исследования по распространенности хронической боли также представляют очень высокие показатели. Так, даже без учета болей онкологического генеза, до 40% взрослого населения России отмечают постоянные боли, причем речь идет о пациентах трудоспособного возраста [3]. По данным Российского эпидемиологического исследования распространенности нейропатической боли, распространенность хронических болевых синдромов варьирует от 13,8 до 56,7%, составляя в среднем 34,3 случая на 100 человек, при этом более 40%, страдающих хронической болью, указывают на серьезное снижение качества жизни из-за этого [4].
Хронический болевой синдром включает в себя неоднородную группу заболеваний, объединенных общностью патофизиологических реакций, формирующих стойкие болевые ощущения, которые часто остаются уже вне связи с первоначально вызвавшим их процессом. Формирование хронического болевого синдрома зависит в большей степени от комплекса патофизиологических факторов, чем от характера и интенсивности периферического ноцицептивного воздействия [6, 7]. Хроническая боль часто приобретает статус самостоятельной болезни («боль-болезнь»), когда боль является единственным симптомом и отмечается на протяжении длительного периода времени, причем в ряде случаев причина, вызвавшая эту боль, может не выявляться. Отсутствие понятной органической причины, неверная трактовка найденных при обследовании изменений, недооценка соматического и психического статуса, длительное употребление анальгетиков затрудняют диагностику и выбор правильной тактики лечения пациентов с хронической болью.
Терапия боли предполагает комплексное применение лекарственных средств из групп нестероидных противовоспалительных препаратов (НПВП), центральных миорелаксантов, а также адъювантных анальгетиков (противоэпилептические препараты и антидепрессанты). Однако для поддержания должного уровня трудовой и социальной активности пациента с хронической болью, эти средства либо недостаточно эффективны (НПВП и миорелаксанты), либо могут иметь отсроченное действие и сопровождаться возникновением побочных эффектов, вызывать некоторые ограничения (вождение автомобиля, выполнение точных заданий, употребление алкоголя и др.) в повседневной жизни. В этой связи представляется актуальным поиск адекватных методов комплексной терапии хронической боли, которые будут оказывать лечебный эффект в ближайший период времени, позволят уменьшить количество и длительность применяемых лекарственных средств, а также повысят качество жизни пациентов.
Инвазивные методы лечения хронической боли представляют собой важный и действенный метод воздействия при дегенеративно-дистрофических поражениях позвоночника, миофасциальном болевом синдроме, цефалгиях, патологии опорно-двигательного аппарата, нейропатиях и других заболеваниях. Наиболее часто для лечения хронических болевых синдромов применяются лечебные блокады, инъекции местных анестетиков и кортикостероидов в триггерные точки, фармакопунктура и другие методы рефлекторных воздействий (классическая корпоральная, электроимпульсная рефлексотерапия, микроиглотерапия).
Применение местной анестезии включает сегментарную и локальную терапию, воздействие на область поражения, блокаду путей проведения боли. В основе сегментарной терапии лежит эффект перекрестного влияния вследствие переключения нервных волокон при внутрикожном введении анестетика в определенный дерматом. Локальную терапию проводят непосредственно в зоне поражения. Лечение области поражения подразумевает применение методов местной анестезии в области измененной реакции ткани или в отраженных зонах. Проводниковая анестезия представляет собой введение растворов анестетиков по ходу нервного ствола.
В настоящее время активно применяются методы инъекционной терапии местными анестетиками в сочетании с глюкокортикоидами для лечения хронической боли. Эффектами местных анестетиков являются устранение потока болевой импульсации, подавление воспаления, периферическая вазоконстрикция, противоаллергическое действие. Применение кортикостероидов обосновано их способностью угнетать синтез провоспалительных цитокинов, простагландинов, фосфолипаз и молекул адгезии. Кортикостероиды ограничивают такие проявления воспаления, как расширение сосудов, отек, приток нейтрофилов и моноцитов в очаг воспаления, рост числа тромбобластов и фибробластов, оказывая тем самым антипролиферативный эффект. В этой связи особое значение приобретает препарат дипроспан, который состоит из двух солей бетаметазона. Натрий-фосфатная его соль обладает высокой растворимостью, быстро гидролизуется и всасывается, что обеспечивает наступление эффекта в течение нескольких часов. Бетаметазона ацетат (или бетаметазона пропионат), напротив, характеризуется слабой растворимостью, медленным гидролизом и всасыванием. Комбинация этих веществ обеспечивает быстрое наступление эффекта и длительное действие препарата (до 30-35 дней); общая длительность эффекта может достигать 6 нед. Это отличает дипроспан от других пролонгированных препаратов (кеналог или депомедрол), длительность эффекта которых составляет около 3 нед. Важной особенностью дипроспана является его низкая концентрация и малая величина кристаллов, что повышает безопасность применения.
Клиники боли в странах ЕЭС и Северной Америки имеют в штате сотрудников врачей-анестезиологов, которые технически точно выполняют наиболее сложные центральные лечебные блокады. В России, где все чаще упоминается о необходимости мультидисциплинарного подхода к лечению боли, на практике лечением хронической боли занимаются неврологи, которые в редких случаях владеют такими методиками и имеют возможности выполнения наиболее технически простых периферических блокад.
В период с 1998 по 2005 годы в США наблюдалось увеличение числа лечебных эпидуральных блокад с 807 735 до 1 776 153 с тенденцией к неуклонному росту с каждым годом. Данные результаты неоднозначны, так, с одной стороны, увеличение распространенности хронической боли в популяции, а также достижения научно-технического прогресса объясняют востребованность такого лечения, с другой стороны, необходимость проведения повторных блокад, на которую указывают большинство исследований, свидетельствует об их недостаточной эффективности.
Результаты метаанализа 43 клинических исследований, проведенных в период до 2012 г. (включавших 3641 пациента) показали эффективность перидурального введения кортикостероидов для лечения пациентов с болью в спине и шее в краткосрочном периоде (до 12 нед) [12].
Был проведен систематический обзор исследований, посвященных оценке эффективности перидурального введения местных анестетиков с кортикостероидами (эпидурально, трансфораминально и каудально) при лечении корешковых болевых синдромов на уровне шейного и поясничного отделов позвоночника [11]. Анализировались ближайшие (до 6 нед) и отдаленные (6 нед и более) результаты. Доказана высокая эффективность применения трансфораминальных инъекций местных анестетиков и кортикостероидов для краткосрочного уменьшения боли и умеренная долгосрочная эффективность при поясничных радикулопатиях. Умеренными были и доказательства эффективности перидуральных инъекций местных анестетиков с кортикостероидами на шейном уровне. Наилучшие результаты были получены при хронической корешковой боли поясничной локализации при применении каудальных блокад.
Проведено проспективное рандомизированное двойное слепое контролируемое исследование, включавшее 55 пациентов, направленных на хирургическое лечение по поводу пояснично-крестцовой радикулопатии, с подтвержденной компрессией корешка по результатам визуализации [13]. Пациентам первой группы (27 человек) проводились интракорешковые лечебные блокады с использованием только бупивакаина, вторая группа (28 пациентов) получала аналогичные блокады с применением бупивакаина и малых доз бетаметазона. Период наблюдения составил 28 мес после проведенного лечения с применением курса лечебных блокад (от 3 до 5 процедур). Лечение считали неэффективным, если пациент прибегал к хирургическому лечению (решение принимал сам пациент на любом из этапов лечения). В первой группе у 18 больных было проведено хирургическое вмешательство, тогда как во второй группе оно понадобилось только 8 пациентам. Полученные данные показывают более высокую эффективность применения лечебных корешковых блокад с местными анестетиками и малыми дозами кортикостероидов (p
Инвазивные процедуры у пациентов при антикоагулянтной и антиагрегантной терапии
Врачи-стоматологи все чаще сталкиваются с пациентами пожилого возраста, которые принимают антикоагулянты или антиагреганты. Применение препаратов «разжижающих» кровь является важным звеном первичной и вторичной профилактики таких сердечно-сосудистых осложнений как инфаркт миокарда, ишемический инсульт и острый коронарный синдром. Большинство исследований и мета-анализов подтверждают повышение риска кровотечений во время хирургических вмешательств на фоне приема антикоагулянтов/антиагрегантов.
При планировании хирургических манипуляций, оперирующим врачам приходится соизмерять индивидуальный риск периоперационных кровотечений и тромботических осложнений у таких пациентов. С одной стороны, прекращение антикоагулянтной и антиагрегантной терапии приводит к увеличению риска тромбоэмболических осложнений, с другой стороны, на фоне приема антикоагулянтов и антиагрегантов высока вероятность периоперационных геморрагических осложнений.
Полезно будет вспомнить физиологические механизмы гемостаза для того, чтобы понять механизм действия назначаемой таким больным антиагрегантной или антикоагулянтной терапии.
Физиология гемостаза
Различают клеточные и плазменные факторы свертывания крови. К клеточным факторам относятся тромбоциты, a к плазменным — белки и ферменты, участвующие в процессе коагуляции крови. Плазменные факторы свертывания синтезируются в печени и циркулируют в крови в неактивной форме.
Остановка кровотечения происходит в 3 этапа и участвуют в нем как сосуды и тромбоциты, так и плазменные факторы свертывания:
Первичный гемостаз (сосудисто-тромбоцитарный)
При повреждении сосудистой стенки происходит обнажение субэндотелиальных структур (коллагеновых волокон и базальной мембраны), что приводит к немедленной активации тромбоцитов. Активированные тромбоциты присоединяются к повреждённым тканям и друг другу, формируя агрегаты, преграждающие путь к потере крови. Появляется рыхлая тромбоцитарная пробка.
Вторичный гемостаз (коагуляционный)
Сформировавшаяся тромбоцитарная пробка (без последующего образования фибрина) способна лишь временно остановить кровотечение, и если не произойдет уплотнение тромбоцитарного тромба с помощью нерастворимого фибрина, то такой тромб через несколько часов распадетс. Одновременно с активацией тромбоцитов происходит активация плазменных факторов свертывания (вторичный гемостаз). Цель: стабилизация первичной тромбоцитарной пробки за счёт образования сетей фибрина и образование плотного и стабильного фибринового сгустка.
Клиническое значение:
Антиагрегантные препараты (препараты нарушающие первичный гемостаз)
Ацетилсалициловая кислота (АСК)
Египетские папирусы, которые датируются приблизительно 1550 годами до н. э., упоминают использование отвара из листьев ивы белой при многих заболеваниях. Гиппократ назначал экстракт коры ивы при головной боли и лихорадке. Ива — первый источник аспирина. Ацетилсалициловая кислота, активный ингредиент Аспирина, была синтезирована из коры ивы Эдвардом Стоуном в 1897 году. Век лекарства короче, чем век человека и многие из них быстро устаревают. Но Аспирин не только не устарел за последнюю сотню лет, он еще и продемонстрировал новые качества. Кажется, он лечит все болезни — от простуды до инсульта.
Ацетилсалициловая кислота (АСК) в течение многих лет является золотым стандартом антиагрегантной терапии. Аспирин в низких дозах (40-100 мг) необратимо блокирует действие фермента циклооксигеназы-1 в тромбоцитах с последующим уменьшением образования тромбоксана А2, являющегося мощным вазоконстриктором и проагрегантом. Поскольку АСК блокирует ЦОГ-1 необратимо, антиагрегантный эффект сохраняется на протяжении жизненного цикла тромбоцита (7–10 дней). Способность необратимо блокировать ЦОГ-1 тромбоцитов выгодно отличает АСК от других нестероидных противовоспалительных препаратов, антиагрегантное действие которых является кратковременным [1]. Учитывая вышесказанное, хотел бы обратить внимание на следующий клинический момент.
Что происходит, когда стоматолог назначает НПВП пациенту принимающему Аспирин? Данные эпидемиологических исследований свидетельствуют о том, что приём препаратов из группы НПВС может отменить или существенно уменьшить кардиопротективный эффект аспирина.
Почему? Аспирин и НПВП конкурируют за один и тот же субстрат – ЦОГ 1. Следовательно, при параллельном назначении часть тромбоцитов будет обратимо связана с НПВП, а другая часть — необратимо с ацетилсалициловой кислотой. Через несколько часов тромбоциты, которые были временно инактивированы препаратами НПВП, восстановят свою функцию и пациент останется без кардиопротективного действия.
Какие анальгетики противопоказаны, а какие являются препаратом выбора у таких пациентов можно подробно узнать из моих лекций.
В исследовании RISK ( Research on Instability in Coronary artery disease ) при назначении АСК в дозе 75 мг/сут больным нестабильной стенокардией, риск развития инфаркта миокарда уменьшился на 50% [2]. В другом исследовании у больных острым ИМ эффективность АСК (160 мг/сут) оказалась сопоставимой с эффективностью тромболитической терапии [3].
Многие пациенты получают двойную антитромбоцитарную терапию (Аспирин + Клопидогрел). При остром коронарном синдроме, а также после чрескожного коронарного вмешательства (ЧКВ) или установки стента, АСК, как правило, назначается в комбинации с Клопидогрелом. Согласно многочисленным исследованиям, прекращение антитромбоцитарной терапии у пациентов с активным стентом коррелирует с 90-кратным увеличением риска тромбоза стента [4]. В литературе также задокументированы тромбоэмболические осложнения со смертельным исходом на фоне самовольной отмены стоматологом приема антикоагулянтных/антитромбоцитарных препаратов перед хирургической манипуляцией. Риск кровотечений на фоне двойной антитромбоцитарной терапии во время хирургических вмешательств резко возрастает.
Клопидогрел (Плавикс)
Агрегация тромбоцитов — это процесс, который потребляет энергию. Эту энергию получают тромбоциты от специального энергоносителя клеток, аденозиндифасфата (АДФ). Для этого аденозиндифасфату необходимо прикрепиться к специальному месту связывания (рецептору).
Клопидогрел необратимо изменяет АДФ-рецепторы тромбоцита, в связи с чем, тромбоциты остаются нефункциональными на протяжении всей жизни, а восстановление нормальной функции происходит по мере обновления тромбоцитов (приблизительно через 7 дней).
Блокаторы АДФ-рецепторов используют, при непереносимости АСК или если Аспирин не действует в достаточной степени. По сравнению с АСК, пациенты, принимающие Клопидогрел, более склонны к кровотечениям и образованию гематом.
Антикоагулянты (препараты нарушающие вторичный гемостаз)
Варфарин
Помимо антиагрегантов на процесс тромбообразования могут влиять антикоагулянты — препараты, препятствующие активации плазменных факторов свертывания. Исследования, выполненные до широкого внедрения антикоагулянтной терапии, продемонстрировали высокую частоту тромбообразования (до 50%) в полости левого желудочка в постинфарктном периоде [5]. Причиной возникновения тромбов является не активация тромбоцитов, а локальное нарушение сократимости миокарда (нарушение реологических свойств крови), что в свою очередь активирует плазменные факторы свертывания. Простыми словами, тромбоциты здесь ни при чем, и антиагреганты не помогут. Показания к антикоагулянтной терапии: профилактика артериальных и венозных эмболий кардиогенного происхождения у больных с мерцательной аритмией ( atrial fibrillation ), после протезирования клапанов сердца, после обширного трансмурального ИМ у больных с пристеночным тромбозом левого желудочка и т. д.
Витамин К играет важную роль в продукции многих плазменных факторов свертывания. Варфарин блокирует в печени синтез витамин К-зависимых факторов свёртывания крови, а именно, факторов II, VII, IX и X. Концентрация этих компонентов в крови снижается и процесс свёртываемости замедляется.
Варфарин имеет узкое терапевтическое окно и требует индивидуального подбора дозы. Довольно трудно поддерживать оптимальный уровень препарата в крови при длительном амбулаторном лечении. Он взаимодействует со многими лекарствами. Большая группа фармакологических препаратов может усиливать или ослаблять действие Варфарина. Взаимодействие Варфарина с овощами зеленого цвета, содержащими большое количество витамина К, снижает его эффективность. Все это диктует необходимость регулярного мониторинга антикоагулянтов, что крайне затрудняет их применение на территориях, где такой мониторинг не организован или некачествен.
Для контроля за действием непрямых антикоагулянтов обычно используют INR (International Normalized Ratio), или международное нормализованное отношение (MHO). Интервал рекомендуемого INR (МНО) у больных с ССЗ варьируется в зависимости от заболевания, но все сердечные заболевания находятся в пределах 2-3,5. INR (МНО), выходящее за пределы рекомендуемого уровня, резко увеличивает риск геморрагических осложнений.
Препараты антикоагулянты нового поколения
Ривароксабан (Ксарелто), Апиксабан (Эликвис) и Дабигатран (Прадакса)
Несмотря на то, что Варфарин является популярным пероральным антикоагулянтом на протяжении более 50 лет, он имеет множество ограничений, таких как: высокая индивидуальная чувствительность и непредсказуемость антикоагулянтного эффекта, лекарственные взаимодействия, узкий терапевтический диапазон, необходимость подбора дозы и постоянного контроля МНО. Все это резко снижает приверженность к лечению и увеличивает риск тяжелых геморрагических осложнений.
Поэтому в последние годы FDA были одобрены новые антикоагулянты, которые более безопасны и имеют широкий терапевтический диапазон по сравнению с их предшественниками.
Уйти от проблемы контроля МНО сегодня позволяет новое поколение антикоагулянтов, которые успешно заменяют собой Варфарин во многих ситуациях (кардиологии, профилактике и лечении тромбозов глубоких вен конечностей, в терапии и профилактике инсультов). Речь идет о трех основных препаратах: Ривароксабан (Ксарелто), Апиксабан (Эликвис) и Дабигатран (Прадакса).
Ингибиторы фактора Xa (Эликвис и Ксарелто) связываются непосредственно с активным сайтом фактора Ха, что приводит к блокированию общего пути коагуляции. Это приводит к уменьшению образования тромбина, что, в свою очередь, ингибирует образование сгустка и активацию тромбоцитов.
Прямые ингибиторы тромбина (Прадакса) специфически и обратимо связываются с активным центром тромбина. За счет ингибирования тромбина происходит уменьшение образования фибринового сгустка и агрегации тромбоцитов.
Стандартным тестом для мониторинга пациентов «на Варфарине» является протромбиновое время или МНО, в то время как стандартным тестом мониторинга пациентов принимающих гепарин является активированное частичное тромбопластиновое время или АЧТВ. К сожалению, на сегодняшний день нет лабораторных тестов для мониторинга больных принимающих НОАК. В настоящее время рутинный лабораторный контроль у пациентов, принимающих новые оральные антикоагулянты (НОАК) не принят, вследствие доказанной эффективности фиксированных доз. Поэтому реальную степень гипокоагуляции у таких больных определить практически невозможно, что крайне усложняет тактику ведения при хирургических манипуляциях в полости рта. НОАК разрабатывались как удобная для врача и пациента альтернатива антагонистам витамина К (АВК), не требующая регулярного посещения лабораторий.
Стоматологический прием
Факторы, влияющие на принятие решений:
К оперативным вмешательствам в полости рта с наиболее высоким риском возможного кровотечения относятся:
Оценка риска тромбоэмболии (зависит от заболевания и требует консультации с лечащим врачом).
Стратификация риска в периоперационном периоде
По степени риска и объему все хирургические вмешательства можно разделить на 3 группы:
Пациент, принимающий антиагреганты
Монотерапия
Последние исследования показали, что базовых хирургических навыков и локальных мер по остановке кровотечения достаточно, чтобы справится с кровотечением. Антиагрегантная монотерапия не представляет собой серьезного риска во время или после хирургических манипуляций.
Рекомендации [6]: категорически не рекомендуется прерывать приём пероральных антиагрегантов при амбулаторных стоматологических вмешательствах, включая хирургические манипуляции.
Двойная антитромбоцитарная терапия после имплантации стентов у пациентов со стабильной ИБС или при остром коронарном синдроме (ОКС)
Кардиологи рекомендуют прием двойной антитромбоцитарной терапии как минимум в течение шести недель после имплантации металлического (неактивного) стента, и в течение 12 месяцев после эпизода ОКС или имплантации стента с лекарственным прикрытием (активного стента).
Рекомендации [7]: дентоальвеолярные хирургические вмешательства с низким риском не требуют каких-либо изменений в плане лечения.
Дентоальвеолярные хирургические вмешательства со средним риском кровотечения требуют консультации кардиолога по поводу временной отмены одного из препаратов перед хирургической процедурой (монотерапия не представляет серьезного риска). Если нет возможности отменить один из препаратов, можно выполнить хирургическую манипуляцию поэтапно: разделить хирургическую манипуляцию со средним риском кровотечения на несколько меньших по объему вмешательств.
Дентоальвеолярные хирургические вмешательства с высоким риском кровотечения требуют консультации кардиолога по поводу временной отмены одного из препаратов перед хирургической процедурой. Если нет возможности отменить один из препаратов, следует отсрочить большие хирургические операции на 1 год.
Антикоагулянтная терапия в анамнезе
Рекомендации [6]: мониторинг INR (МНО) 24-48 часов перед хирургической процедурой. Если 2 INR (МНО)
Если INR (МНО) > 3,5 или INR (МНО).
Когда лучше всего проводить оперативные вмешательства?
Рекомендуется, как и для низкомолекулярных гепаринов, соблюдать минимальный интервал времени в 12 часов после последней дозы (таблетка вечером, операция на следующее утро).
Если всё-таки планируется обширная хирургическая манипуляция (к примеру, установка более 5 имплантатов с проведением двустороннего синус-лифтинга), тогда прием НОАК может быть прекращен за 24-48 часов до операции (с разрешения лечащего врача!) После хирургического вмешательства прием НОАК можно возобновить через 6-12 часов [8].
Финкельштейн Андрей, врач-стоматолог, специалист, научный сотрудник в Университетской клинике Гамбург-Эппендорф (Германия ), практикующий врач в Rabin Medical Center (Израиль, Петах-Тиква), Израиль, Тель-Авив,
Finkelshteyn A., DMD, оral medicine specialist, researcher at the University Hospital Hamburg-Eppendorf (Germany), practitioner at the Rabin Medical Center (Israel, Petah Tikva), Israel, Tel-Aviv
Invasive dental procedures in patients receiving antiplatelet or anticoagulation drug therapy. Clinical Practice Guidelines.
Аннотация. Врач-стоматолог все чаще сталкивается с растущим числом пациентов пожилого возраста, которые принимают антикоагулянты или антиагреганты. Применение препаратов «разжижающих» кровь является важным звеном первичной и вторичной профилактики таких сердечно-сосудистых осложнений как инфаркт миокарда, ишемический инсульт и острый коронарный синдром. Большинство исследований и мета-анализов подтверждают повышение риска кровотечений во время хирургических вмешательств на фоне приема антикоагулянтов/антиагрегантов. При планировании хирургических манипуляций, оперирующим врачам приходится соизмерять индивидуальный риск периоперационных кровотечений и тромботических осложнений у таких пациентов. С одной стороны, прекращение антикоагулянтной и антиагрегантной терапии приводит к увеличению риска тромбоэмболических осложнений. С другой стороны, на фоне приема антикоагулянтов и антиагрегантов повышена вероятность периоперационных геморрагических осложнений.
Annotation. The dentist is increasingly faced with a growing number of elderly patients who are taking anticoagulants or antiplatelet agents. The use of blood thinners is an important element in the primary and secondary prevention of cardiovascular complications such as myocardial infarction, ischemic stroke, and acute coronary syndrome. Most studies and meta-analyzes confirm an increased risk of bleeding during surgical interventions while taking anticoagulants / antiplatelet agents. When planning surgical procedures, operating doctors have to measure the individual risk of perioperative bleeding and thrombotic complications in such patients. On the one hand, the cessation of anticoagulant and antiplatelet therapy leads to an increased risk of thromboembolic complications. On the other hand, while taking anticoagulants and antiplatelet agents, the likelihood of perioperative hemorrhagic complications is increased.
Ключевые слова: Аспирин, Клопидогрел, Варфарин, новые оральные антикоагулянты, инвазивные стоматологические процедуры, кровотечение, клинические рекомендации.
Keyword : Aspirin, Clopidogrel, Warfarin, new oral anticoagulants, invasive dental procedures, bleeding, clinical guidelines.
Список литературы