Инвазия сосудов что такое
Что такое сосудистая эмболизация?
Это рентгенохирургическая процедура, которая используется и в онкологии для ухудшения кровоснабжения опухолевых тканей. Злокачественное новообразование формирует вокруг себя сеть сосудов, по которым к нему поступает кислород и питательные вещества, необходимые для размножения клеток опухоли. Эмболизация, то есть закупорка, перекрытие таких сосудов оставляет новообразование без притока крови, что ведет к постепенной остановке его роста за счет отмирания злокачественных клеток.
Как проводят эту процедуру?
Эмболизация – это малоинвазивный, то есть не связанный с масштабными хирургическими вмешательствами, метод лечения. Иногда он может даже послужить альтернативой традиционной операции.
Доступ к области, в которой находится опухоль, врачи получают через крупные сосуды человеческого тела, расположенные по соседству. Через очень небольшой разрез в тот или иной сосуд вводят катетер и медленно перемещают его к новообразованию. Вся эта процедура проходит под контролем рентгеноскопии – врач видит, куда и насколько он продвигает катетер.
По достижении сосуда, питающего опухоль, через катетер вводят эмбол – вещество или устройство, которые призваны закупорить сосуд, остановить кровообращение в нем. После этого делают несколько ангиографических снимков для того, чтобы удостовериться, что операция прошла успешно, и эмбол установлен именно там, где требовалось. Чаще всего такие вмешательства проходят под местной анестезией, но иногда, например, при эмболизации опухолей в печени, используют и общий наркоз.
Какие есть типы эмболизирующих материалов?
Наиболее эффективным способом сосудистой эмболизации в современной онкологии считается химиоэмболизация с использованием микросфер. Микросферы представляют собой полимерные частицы шарообразной формы и диаметром от 50 до 200 мкм. Их диаметр также можно подбирать в зависимости от ожидаемого размера сосудов, питающих опухоль. После введения эти частицы «застревают» в просвете сосудов, вызывая их необратимую эмболизацию. Кроме того, перед вмешательством микросферы также насыщают препаратами для химиотерапии. После закупорки сосуда они начинают высвобождать эти цитостатические лекарственные вещества и могут поддерживать их терапевтическую концентрацию до месяца.
При каких онкозаболеваниях показана сосудистая эмболизация?
Эмболизацию с использованием микросфер и одновременным применением препаратов для химиотерапии назначают при:
Каковы преимущества сосудистой эмболизации?
Как проходит сосудистая эмболизация в клинике «Анадолу»?
Специалисты нашего медицинского центра используют самые современные эмболизационные материалы, а потому этот метод онкологического лечения дает отличные результаты. Кроме того, очень многое зависит от профессионализма врачей, проводящих данную процедуру. В клинике «Анадолу» сосудистую эмболизацию выполняет целая команда высококвалифицированных специалистов: хирург-онколог, химиотерапевт, сосудистый хирург, а также интервенционный радиолог, который обеспечивает контроль введения катетера.
Инвазия сосудов что такое
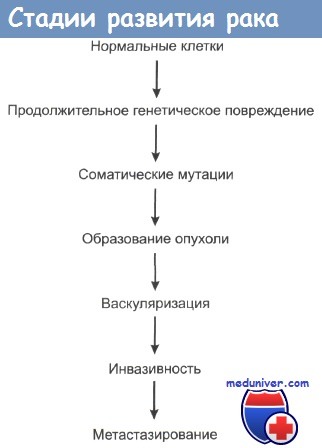
Можно сказать, что раковые клетки в определенной степени не реагируют на механизмы, контролирующие рост и развитие нормальной ткани. При пролиферации нормальной ткани непосредственный контакт клетки со своими соседями обычно служит сигналом к прекращению размножения. Это контактное торможение отсутствует в опухолевых тканях.
При подкожном введении раковых клеток иммунодефицитным мышам происходит рост и развитие опухоли, что никогда не случается при введении здоровых клеток. Раковые клетки отличаются от здоровых по составу мембранных гликопротеинов, по микропотенциалам на клеточной мембране, а также характеризуются повышенным содержанием сиаловой кислоты. Локомоторный клеточный аппарат (микротрубочки и микрофиламенты) раковых клеток деградирует, клетка теряет присущие ей формы, отмечается миграция цитоплазмы раковой клетки в зону контакта со здоровыми клетками.
Одновременно раковые клетки становятся локально инвазивными, хотя биохимические основы этого свойства до сих пор четко не выявлены. Опухолевые клетки часто демонстрируют пониженную адгезивность в сравнении с нормальными клетками. Важным моментом механизма инвазии является секреция определенных ферментов. Некоторые ферменты играют ключевую роль в протеолизе внутриклеточного матрикса, который всегда сопровождает инвазию раковых клеток. К таким ферментам относится семейство матричных металлопротеиназ (ММП), которое включает в себя колллагеназы, желатиназы и стромолизины.
Эти ферменты экскретируются в неактивной форме. Последующий разрыв сульфгидрильной группы и присоединение атома металла (чаще всего цинка) приводят к изменению конформации фермента и переводят его в активное состояние. Тканевые ингибиторы металлопротеиназ (ТИМП) прекращают действие этих ферментов. Некоторые типы тканей изначально обладают повышенной устойчивостью к инвазии. Это, например, компактная костная ткань, ткани крупных сосудов и хрящевая ткань. Предположительно способность к инвазии у опухолевых клеток появляется в результате трансформации нормальных процессов реконструкции и восстановления здоровых тканей. Тем не менее к настоящему моменту неизвестно, какие конкретно изменения генетической структуры раковых клеток ответственны за инвазивный рост.
По мере роста опухоли она выделяет в кровь ангиогенные факторы, которые стимулируют прорастание опухоли кровеносными сосудами и формирование сети капилляров. Сосудистая система кровоснабжения опухоли может стать мишенью для различных видов противораковой терапии. Опухоль стимулирует пролиферацию эндотелиальных клеток, выделяя ангиогенные цитокины, такие как эндотелиальный фактор роста сосудов (ЭФРС), ТФР и факторы роста фибробластов. Эндотелиальные же клетки в свою очередь могут стимулировать рост клеток опухоли. В одном грамме опухолевой ткани может находиться до 10-20 млн эндотелиальных клеток, которые не являются неопластическими.
Антигены нормальных эндотелиальных клеток, включая и профакторы свертываемости крови, могут быть разрегулированы в активно пролиферирующей под действием опухоли эндотелиальной ткани. В дополнение к действию цитокинов, гипоксия, развивающаяся в сети опухолевого кровоснабжения, может стимулировать выбросы ЭФРС и других факторов. В ходе ангиогенеза эндотелиальные клетки внедряются в строму опухоли, активно делятся там с образованием зачатков новых капилляров, которые затем развиваются в сосудистую систему опухоли. Как и в случае инвазии опухолевых клеток, этот процесс идет с участием продуцируемых эндотелием ММП и их естественных ингибиторов.
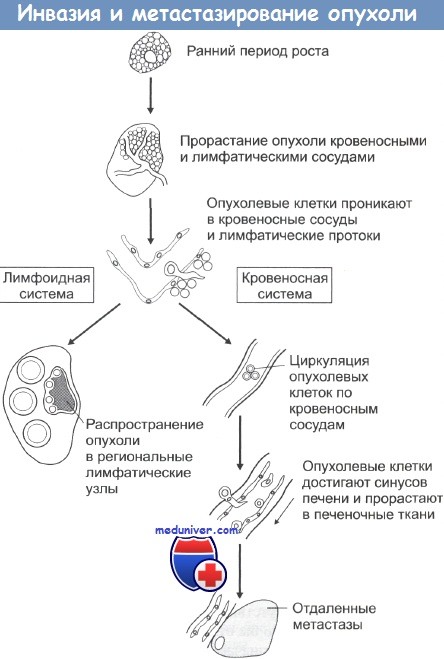
При локальной инвазии рака опухолевые клетки могут попадать в сосудистую систему и давать начало метастазам. Последовательность событий при метастазировании показана на рисунке. Распространение раковых клеток по лимфатической системе, что особенно характерно при карциномах, происходит при попадании опухолевых клеток в лимфатические протоки с последующим оседанием их в местах разветвления протоков и в ближайших лимфатических узлах. Вслед за этим обычно происходит инфильтрация опухолевыми клетками и отдаленных лимфоузлов. Распространение через кровяное русло проходит при проникновении раковых клеток в кровеносные сосуды рядом с местом первичной локализации опухоли либо через грудные протоки. Подхваченные током крови раковые клетки затем захватываются ближайшими капиллярными сетями, чаще всего сетями печени и легких, и оседают в них. При оценке направлений метастазирования очень важно учитывать первичную локализацию опухоли.
Например, опухоли пищеварительного тракта обычно метастазируют через воротную вену в печень. Опухоли также могут метастазировать непосредственно сквозь прилегающие ткани. Так возникающие в брюшной полости новообразования могут очень быстро рассеяться по всему внутрибрюшинному пространству, а клетки рака легкого могут мигрировать через плевру. Некоторые опухоли метастазируют в определенные органы и ткани, другие — бессистемно. Саркомы, например, почти всегда метастазируют в легкие, рак молочной железы поражает также ткани осевого скелета. Тем не менее биологических механизмов, объясняющих такую избирательность, пока не найдено.
Региональные лимфоузлы могут осуществлять барьерную функцию, предотвращая распространение метастазов за пределы области первичной локализации опухоли. До сих пор четко не выяснено, каким образом и за счет каких специфических иммунных механизмов лимфатические узлы создают барьер на пути распространения опухоли.
Проникая в кровеносное русло в районе первичной опухоли, раковые клетки затем могут достигать других органов и тканей. Для того чтобы дать начало новым очагам опухоли, эти клетки на новом месте должны, во-первых, проникнуть в ткани через эндотелий капилляров, а во-вторых, выжить при атаках местных иммунных систем защиты, таких как фагоцитирующие клетки и так называемые естественные киллеры (ЕК).
Способность к инвазированию и расселению в отдаленных органах и тканях у различных видов опухолей сильно варьирует. Эта способность, по-видимому, определяется степенью экспрессии того участка генома, который и обусловливает злокачественный рост клеток. Действительно, со временем почти все раковые опухоли накапливают все больше и больше генетических изменений в своих клетках и приобретают способности к инвазии и метастазированию. Но даже при клиническом обнаружении опухоли метастазы и инвазия могут проявиться лишь спустя несколько лет. Типичным примером является карцинома низкой степени злокачественности. Следует отметить, что даже однотипные виды рака с одинаковой степенью дифференцированности опухолевых клеток по-разному метастазируют у разных больных.
Все это говорит о необходимости поиска молекулярных маркеров, которые смогли бы предсказывать исход течения онкологического заболевания более точно, чем диагностика по гистологическому типу опухоли (хотя последний метод в настоящее время является наиболее точным из всех возможных). Кроме того, даже конкретная опухоль может быть в значительной степени гетерогенной и состоять из клеток, различных по своему метастатическому потенциалу, что было показано на клонированных субпопуляциях, выделенных из одной опухоли. Биологические причины такой вариабельности в настоящее время неизвестны.
Совершенно ясно, что для успешного лечения онкологических пациентов необходимо проводить масштабные исследования в области нахождения механизмов тканевой инвазии, метастатического роста и поиска биологических причин гетерогенности опухолей. Отсутствие гомогенности в опухолях, сходство опухолевых клеток со здоровыми клетками породившей ее ткани, и отсутствие четкого единичного критерия, по которому можно было бы отличить раковую клетку от здоровой, — все это вместе означает, что наши рассуждения о противоопухолевом иммунитете или о механизмах действия лекарственных цитостатических препаратов должны приниматься с изрядной долей скептицизма, особенно если они базируются на экспериментах с гомогенными опухолевыми культурами.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Программы лечения рака
Виды рака могут классифицироваться в зависимости от местонахождения опухоли, её размеров, причины возникновения и др. На развитие опухолевого процесса в организме могут влиять различные факторы, от неправильного питания до генетической наследственности. Все виды рака требуют определенной схемы лечения, что позволяет сохранить нормальное течение жизни.
Виды рака характеризуются отличием клеточного строения опухоли, динамикой развития, а также уровнем выживания во время лечения.
Онкологические заболевания могут возникать во всех системах и органах организма. Классификация видов онкологических заболеваний происходит в зависимости от места локализации опухоли и множества других факторов. Так процесс развития злокачественной опухоли может происходить в желудочно-кишечном тракте, мочеполовой системе, верхних дыхательных путях и грудной клетке, коже, скелете и мягких тканях, кровеносной и лимфатической системе, головном и спинном мозге. Рак представляет собой активное прогрессирующее патологическое разрастание атипичных клеток, заменяющих нормальные ткани.
Многие виды рака легко диагностируются на ранних стадиях, что позволяет победить онкологическое заболевание результативно и эффективно. В латентный период, когда симптомы и признаки рака еще не проявились у больного, но размножение раковых клеток уже происходит, выявляется форма и вид онкологического заболевания.
Все виды рака проявляются симптоматикой в зависимости от местонахождения опухоли и ее стадии. Болевые синдромы проявляется в месте роста онкологии, а также ухудшается общее состояние организма, незначительно повышается температура, снижается аппетит. Важным условием в эффективном лечении является ее выявление на ранних стадиях, когда раковые клетки еще не попали в кровь и лимфу.
Стадии развития онкологического заболевания
Что же такое метастазы?
Диагностика заболевания методом компьютерной томографии помогает обнаружить вид онкологического заболевания и образование метастазов в организме и подобрать эффективное лечение для улучшения картины заболевания.
Виды раковых заболеваний
Виды рака определяются в зависимости от множества факторов. Онкологическое заболевание классифицируется по нескольким критериям:
Виды рака разделяются по месту нахождения опухоли. То есть органе или системе, где он развивается.
Также виды онкологических заболеваний разделяются по типу ткани. Раковые клетки активно размножаются в мышечной, эпителиальной, костной, сосудистой, нервной и соединительной ткани. Развитие злокачественного образования в нескольких видах тканей называется сложным.
По строению клеток опухоли различают:
По принципу деления раковых клеток разделяют виды клинического, морфологического и гистологического рака.
Факторы риска
Все виды рака возникают в организме под действием определенных факторов. Развитие онкологического заболевания в основном зависит от образа жизни. Неправильное питание некачественными продуктами с большим содержанием канцерогенов вызывают развитие злокачественных опухолей. Чрезмерное употребление алкоголя и курение также является фактором возникновения рака, а также работа на вредных производствах и предприятиях, где происходит накопление организмом ядовитых веществ.
Также на наличие в организме раковых клеток влияет наследственность. Патологические процессы в клетках могут происходить после их мутации во внутриутробном периоде и во время развития организма. Так некоторые виды рака развиваются у новорожденных детей вместе с ростом тканей организма.
Плохая экология и высокий уровень радиации также являются причинами возникновения рака.
Диагностика онкологических заболеваний
Раннее диагностирование заболевания позволяет подобрать эффективное лечение и повысить шансы на выздоровление и сохранение нормального течения жизни больного. Успешный метод лечения возможен только после обнаружения раковой опухоли и определения вида онкологического заболевания.
Диагностика лечения начинается с консультации специалиста и оценки симптомов заболевания, после чего назначается ряд исследований. Виды рака определяются после ультразвукового исследования и взятия биопсии. Полноценный подход к диагностике заболевания с учетом возраста, сопутствующих недугов и факторов риска помогает исключить ложные симптомы.
Методы лечения онкологических заболеваний
В зависимости от вида онкологического заболевания подбираются методы лечения. Наиболее эффективным является комбинированный или комплексный подход к избавлению от недуга.
От вида онкологического заболевания назначается дополнительное лечение, такое как, лучевая терапия и прием химиопрепаратов.
Успешный исход лечения, может быть достигнут, если пациент настроен на лечение и соблюдение врачебных рекомендаций, профилактическим мерам и наблюдению у врача-онколога. Ранняя диагностика онкологического заболевания позволяет избежать усугубления состояния, восстановлению нормального течения жизни, а также избежанию возможности рецидива.
Профилактика онкологических заболеваний
Виды рака должны контролироваться на протяжении всей жизни с использованием скрининговых исследований. Из-за скрытого течения онкологического заболевания симптомы могут проявиться уже в запущенной стадии, когда лечение может быть малоэффективно. Поэтому профилактические обследования и внимательный подход к опасным симптомам помогут сохранить здоровье на долгие годы, а если болезнь все-таки наступила, особенно, если учтены все факторы риска, то это позволит подобрать правильный метод лечения для любого вида онкологического заболевания.
Инвазивный рак
Независимо от вида и степени онкологии, следует отметить, что это крайне тяжелое заболевание. Причем его течение и развитие крайне сложно предугадать. Оно имеет определенные особенности.
«Инвазивный рак» – таким термином специалисты называют вид онкологии, при котором ткани, подвергшиеся мутации, распространяются за границы пораженной области на здоровые части тела. Начальная стадия инвазивного рака проявляется как развивающаяся опухоль. Этот процесс подразумевает проникновение измененных онкологией клеток в ткани на глубину до 6 мм за пределами пораженного участка.
Практика показывает, что больше всего шансов на эффективное лечение болезни наблюдается в момент стадии микроинвазии. Раковые опухоли имеют одинаковую природу происхождения с инвазивной карциномой.
Какие виды инвазивного рака существуют
Сегодня врачи-онкологи выделяют три разновидности инвазивного рака.
Первая. Карцинома протоковая. Данная патология возникает у женщин. Измененные клетки атакуют проток, по которому во время лактации течет молоко. Такой вид заболевания является наиболее распространенным и считается чрезвычайно опасным. Аномальные клетки в случае возникновения такой карциномы быстро проникают в лимфоток или системные кровотоки. Такая онкология проявляется в изменении формы женских сосков, приводя их деформации. Чаще всего с подобной проблемой сталкиваются женщины от 55 лет. Есть три стадии протокового карцинома:
Вторая. Рак протоковый преинвазивный. В этой стадии патология еще не может распространяться на ткани других органов, однако есть высокий шанс того что рак перейдет в инвазивную форму.
Третья. Рак дальковый инвазивный. Такой вид онкологии развивается из частей клеточных желез. Этот вид заболевания встречается в 10-16% случаев. При таком раке возникает одна или несколько опухолей. Еще стоит отметить, что данный тип рака крайне сложно диагностируется, так как при его развитии нет внешних факторов указывающих на заболевание.
Неспецифированные формы инвазивной онкологии
Данная форма заболевания отличается тем, что ее сложно отнести к конкретному виду: пртоковой карциноме или дольковому раку. Сегодня специалисты выделяют следующие виды неспецифированного рака:
Общим свойством всех выше перечисленных патологий является их гормонозависомость. Рак имеет эстрогены и рецепторы, поэтому его можно эффективно лечить с помощью специальной гормональной терапии. Однако если болезнь изначально образовалась в предменопаузе, то это значит, что она не имеет рецепторов и нужно применять другие средства борьбы.
Специалисты считают, что при развитии инвазивного рака, медуллярный вид опухолей лучше подается терапии и лечению, чем дольковая карцинома, протоковый рак или онкология Педжета.
Симптомы заболевания
В зависимости от того, на какой стадии находится инвазивный рак молочной железы, или инвазивный рак неспецифического типа, их симптомы могут проявляться по-разному. До того момента пока рак не выходит за границы своей изначальной структуры многие женщины в принципе не обращают на него внимание. Некоторые могут жаловаться на дискомфорт в момент касания молочных желез. Признаки морфологического типа на ранних стадиях инвазивного рака диагностировать крайне сложно. Только после того как опухоль начнет расти, появятся явные симптомы в виде:
Когда обращаться к специалисту
Инвазивный рак, как понятно из всего вышесказанного, очень сложно определить на первых стадиях. Однако женщины должны знать при появлении первых симптомов им следует идти к специалисту.
Сегодня диагностировать инвазивный рак молочной железы или инвазивный рак неспецифического типа могут опытные специалисты онкоцентра София, который расположен в центре Москвы.
Стадии заболевания
Врачи выделяют несколько стадий инвазивного рака.
Инвазивный рак шейки матки как развивается болезнь
Рак матки по статистике находится на втором месте по распространенности после рака молочных желез. Данное заболевание может иметь как неинвазивную так инвазивную форму. При этом переход от одного этапа болезни к другому может происходить очень долго.
В основном инвазивный рак шейки матки, как и инвазивный плоскоклеточный рак, встречается у женщин старше 40 лет. Фактором развития заболевания могут быть разные обстоятельства, в том числе он может развитья на фоне других болезней, например:
Какая бы ни была причина возникновения инвазивного плоскоклеточного рака или другого типа онкологии в онкоцентре София всегда готовы помочь людям с их проблемами. Здесь проводят эффективное лечение инвазивного рака.
Симптомы инвазивного рака матки
Среди симптомов данного заболевания доктора отмечают следующие факторы:
Все эти признаки повод пойти к врачу. В онкоцентре София квалифицированные специалисты проведут необходимые обследования, применяя самое современное диагностическое оборудование. В случае выявления патологии здесь предложат лучшее лечение инвазивного рака. Также специалисты смогут сделать прогноз по инвазивному раку для конкретного пациента. Найти центр можно в центральном округе Москвы.
Диагностирование рака
Сегодня диагностирование онкологии находится на очень высоком уровне. Благодаря современным технологиям врачи могут выявлять болезнь на ранних стадиях и проводить терапию. Среди средств, которые применяют специалисты, следует отметить:
А также многие другие аппараты.
Онкоцентр София располагается в ЦАО Москвы по адресу: 2-й Тверской-Ямской переулок, дом 10, метро «Маяковская». Записаться на прием можно через форму обратной связи или по телефону +7 (495) 995-00-34.
Инвазия сосудов что такое
Адренокортикальный рак (АКР) представляет собой редкую злокачественную опухоль. Распространенность заболевания составляет 1—2 наблюдения на 1 000 000 населения [1, 3, 8, 11]. Характерной чертой АКР является агрессивное течение, склонность к раннему рецидивирующему течению и отдаленной диссеминации после хирургического лечения.
Типичное звено в процессе роста опухоли — инвазия в магистральные венозные сосуды: при правосторонней локализации — распространение опухолевого тромба в нижнюю полую вену, при левосторонней локализации — в левую почечную вену.
Согласно современной классификации АКР с инвазией в венозное русло даже при отсутствии отдаленных метастазов и метастатического поражения регионарных лимфоузлов относится к IV стадии заболевания [3, 7]. С классической позиции онкологии на последней стадии онкологического процесса хирургическая помощь является паллиативной, ее оказывают при крайней необходимости, предпочтение отдают различным вариантам лекарственного лечения и лучевой терапии.
Отдельной проблемой для нашей страны является отсутствие в силу ряда административных причин полноценной адъювантной терапии, основанной на применении митотана (орто-пара ДДТ), что по сути не оставляет нашим согражданам альтернативы хирургическому лечению [5, 10, 13].
Учитывая изложенное, при современном уровне развития медицины мы рассматриваем местную инвазию опухоли как признак относительной нерезектабельности и при функциональной переносимости операции считаем оправданным проведение радикального хирургического вмешательства.
В силу перечисленных выше обстоятельств полезно поделиться опытом хирургического лечения АКР с инвазией в магистральные вены.
Материал и методы
За последние годы в отделении лечен 31 пациент с АКР, в том числе у 3 (9,6%) имелась инвазия опухоли в магистральные венозные сосуды: у 1 при правосторонней локализации опухоли — в нижнюю полую вену, у 2 при левосторонней локализации опухоли — в левую почечную вену [4].
Больная Е., 52 лет, находилась на лечении в октябре 2008 г. Госпитализирована с жалобами на прибавку в массе тела на 15 кг за последний год, перераспределение жировой ткани с преимущественным отложением на лице, животе, избыточный рост волос на лице, груди, снижение тембра голоса, повышение артериального давления до 220/100 мм рт.ст., тянущие боли в пояснице. Из анамнеза: считает себя больной с 2006 г., когда отметила избыточный рост волос на лице, груди, животе, бедрах и снижение тембра голоса. В 2007 г. наблюдала ухудшение состояния: увеличение проявлений слабости, апатии, раздражительности. В 2008 г. на приеме у невропатолога зафиксировано артериальное давление 220/100 мм рт.ст., в связи с чем больная экстренно госпитализирована. Данные УЗИ брюшной полости: в проекции левого надпочечника образование низкой эхогенности размером 73×54×46 мм. После лечения артериальной гипертензии госпитализирована для лечения в хирургический стационар.
УЗИ органов брюшной полости: в проекции левого надпочечника определяется образование размером 57×67 мм неправильной формы, с неровными контурами, пониженной эхогенности с единичными мелкими сосудами.
KT органов брюшной полости с внутривенным контрастированием: в левом надпочечнике солидное многоузловое образование с неровными, нечеткими, бугристыми контурами, неоднородной структуры, размером 76×50×85 мм, нижний полюс образования интимно прилежит к верхнему полюсу почки (рис. 1).

12.11 — операция. В области верхнего полюса левой почки округлое новообразование размером 80×50×60 мм. От новообразования отходит крупный сосуд диаметром 20 мм (возможно, центральная вена), впадающий в левую почечную вену. Связи опухоли с почкой не выявлено. Для уточнения анатомических взаимоотношений опухоли и почечных сосудов выполнено интраоперационное УЗИ, при котором в просвете центральной вены надпочечника обнаружено пристеночное образование без признаков кровотока, распространяющееся далее по левой почечной вене до уровня впадения в нижнюю полую вену. После удаления основного опухолевого узла установлено, что культя центральной вены левого надпочечника заполнена опухолевыми массами, левая почечная вена содержит опухолевый тромб размером 50×20×20 мм. Опухолевый тромб удален. Продольный дефект стенки левой почечной вены длиной 25 мм ушит непрерывным швом (рис. 2). Кровопотеря составила 600 мл.

Макропрепарат: опухоль размером 80×50×60 мм, плотной консистенции, в капсуле, на разрезе охряно-желтого цвета с полями черного цвета. Опухолевый тромб серого цвета размером 50×30×30 мм с гладкой поверхностью (рис. 3).

При ретроспективном тщательном изучении данных КТ найдены признаки инвазии опухоли в левую почечную вену.
Послеоперационный период протекал без осложнений. Пациентка выписана на 10-е сутки после операции. Плановое гистологическое исследование: опухоль имеет строение адренокортикальной карциномы с очагами некроза. В отсутствие адъювантной терапии митотаном проводили иммунотерапию полиоксидонием 6 мг внутримышечно 1 раз в 3 дня — 10 инъекций, интервал между курсами 3—4 нед. В послеоперационном периоде проводили наблюдение под контролем эндокринолога и онколога по месту жительства, КТ-контроль осуществляли через 6 мес. Безрецидивный период составил 18 мес, в дальнейшем трижды оперирована по поводу местного рецидива. Продолжительность жизни с момента первой операции составила 58 мес, далее связь с пациенткой была утеряна.
Больная Г., 57 лет, находилась на лечении в марте 2010 г. Госпитализирована с жалобами на чувство тяжести в левой поясничной области, эпизоды повышения артериального давления до 220/120 мм рт.ст., сопровождающиеся головной болью, тошнотой, головокружением, ощущением жара и усиленным потоотделением, тревогой. Из анамнеза: в течение нескольких лет до госпитализации находилась под амбулаторным наблюдением по поводу множественных кист почек, артериальной гипертензии. При очередном динамическом УЗИ почек в феврале 2010 г. выявлена опухоль левого надпочечника диаметром около 100 мм, в связи с чем больная госпитализирована для дальнейшего обследования и оперативного лечения.
Гормональный профиль в пределах нормы. УЗИ органов брюшной полости: в проекции левого надпочечника гипоэхогенное образование размером 130×97 мм неоднородной структуры с кальцинатами.
КТ органов брюшной полости: в проекции левого надпочечника определяется образование размером 127×179×100 мм неправильной формы, с четкими неровными контурами, неоднородной структуры, мягкотканной плотности в нативную фазу, с включениями кальция размером до 4×8 мм, неоднородным накоплением контрастного вещества. Образование оттесняет дистально и кзади левую почку, фронтально и проксимально хвост поджелудочной железы и селезенку. Определяется расширенная до 18 мм центральная вена левого надпочечника, впадающая в левую почечную вену. В просвете надпочечниковой вены имеется распространение образования с утолщением стенки до 8 мм, при этом свободный просвет 8 мм; эти изменения распространяются до места впадения в почечную вену.
30.03.10 — операция: левосторонняя адреналэктомия, удаление опухолевого тромба из левой почечной вены. В области верхнего полюса левой почки обнаружено новообразование размером 200×150×150 мм. При дальнейшей ревизии выявлено, что центральная вена надпочечника, впадающая в левую почечную вену, расширена до 10—15 мм, ее просвет обтурирован опухолевыми массами. После удаления опухоли установлено, что культя центральной вены левого надпочечника заполнена опухолевыми массами, левая почечная вена содержит опухолевый тромб. Размер тромба 70×10×8 мм. Опухолевый тромб удален из продольного разреза левой почечной вены, дефект левой почечной вены ушит непрерывным швом. Кровопотеря 1500 мл.
Макропрепарат: опухоль левого надпочечника размером 210×150×150 мм, неправильной продолговатой формы, плотной консистенции, в капсуле, на разрезе неоднородной структуры, охряно-желтого цвета. Опухолевый тромб аналогичной структуры и цвета размером 70×10×8 мм. Послеоперационный период протекал без осложнений. Пациентка выписана на 14-е сутки после операции. Гистологическое и иммуногистохимическое исследование: адренокортикальный рак.
Больная Ж., 57 лет, находилась в отделении в марте 2012 г. Госпитализирована с жалобами на тупую боль в правом подреберье, повышение АД до180/100 мм рт. ст., на изменение внешности, увеличение массы тела на 8 кг за предшествующие 6 мес, одышку при незначительной физической нагрузке, отечность нижних конечностей. Из анамнеза: в марте 2011 г. при амбулаторном обследовании во время УЗИ органов брюшной полости в проекции правого надпочечника выявлено новообразование неоднородной структуры с ровными контурами 70×64×54 мм. Хирургического лечения предложено не было. При контрольном ультразвуковом обследовании в декабре 2011 г. отмечено увеличение новообразования до 131×104×97 мм. Выполнена МРТ: в проекции правого надпочечника выявлено массивное многоузловое новообразование размером 115×126×153 мм, тканевой интенсивности, с относительно четкими бугристыми контурами, без достоверных признаков инвазии псевдокапсулы при нативном исследовании. Опухоль деформирует и смещает медиально прилежащие отделы нижней полой вены. Пациентка госпитализирована в хирургическое отделение. При осмотре обращало на себя внимание изменение внешнего вида: центрипетальное ожирение, гиперемия кожи лица, пастозность обеих стоп и голеней. УЗИ органов брюшной полости: в проекции правого надпочечника определяется объемное образование размером 137×103×158 мм, округлой формы, неоднородной структуры, с низкой степенью васкуляризации.
КТ органов брюшной полости: в проекции правого надпочечника определяется образование размером 147×128×150 мм с довольно четкими неровными контурами, неоднородной структуры, с небольшими участками обызвествления, неравномерно накапливающее контрастный препарат. Образование нижней поверхностью прилежит к правой почке, смещая ее книзу, переднемедиальной поверхностью — к нижней полой вене, оттесняет ее кпереди, прорастая ее на протяженном участке, выше уровня образования в просвете нижней полой вены определяется опухолевый тромб, распространяющийся до правого предсердия, протяженность тромба около 56 мм. Образование прилежит к правой и левой почечным венам, просвет их сужен, нельзя исключить инвазию (рис. 4). Верхней и латеральной поверхностью образование плотно прилежит к правой доле печени, граница на отдельных участках неровная, нечеткая (вероятно, за счет инвазии).

ЭхоКГ: опухолевый тромб в полости правого предсердия не определяется, в связи с чем от использования искусственного кровообращения во время операции решено воздержаться.
20.03.12 — операция: правосторонняя адреналэктомия, тромбэктомия из нижней полой вены. Обнаружена опухоль правого надпочечника, имеющая толстую капсулу с расширенными извитыми сосудами, ее содержимым являются распадающиеся опухолевые массы. Опухоль на значительном протяжении спаяна со стенкой нижней полой вены, центральная надпочечниковая вена обтурирована опухолевыми массами. После бокового отжатия произведен разрез нижней полой вены длиной 30 мм, при этом отмечен слабый ретроградный кровоток. Произведено удаление тромботических масс, после чего отмечен активный ретроградный кровоток. При контрольном интраоперационном УЗИ тромбов в просвете не выявлено. Венотомическое отверстие ушито боковым обвивным швом. Кровопотеря 4000 мл, использовали аппарат cell-saver. Послеоперационный период протекал без осложнений. Пациентка выписана на 13-е сутки после операции.
Макропрепарат: правый надпочечник с опухолью размером 150×130×150 мм в капсуле, плотноэластической консистенции, на разрезе неоднородной структуры, охряно-желтого цвета. Гистологическое исследование: умеренно дифференцированный рак коры надпочечника с множественными фокусами некрозов.
Обсуждение
Инвазия в магистральные венозные сосуды АКР является довольно частой проблемой и требует от клиницистов повышенной настороженности при диагностике такой формы заболевания на дооперационном этапе. Обязательным условием точной диагностики сосудистой инвазии является проведение спиральной или мультиспиральной КТ с внутривенным контрастированием. В то же время нет необходимости в использовании флебографии.
Данные КТ позволяют на дооперационном этапе спланировать ход предстоящей операции, включив в операционную бригаду сосудистого хирурга. Предвидя объем кровопотери, целесообразно использовать аппаратную реинфузию крови во время операции. Объем операции будет заключаться в удалении опухоли с опухолевым тромбом. При этом инвазия опухоли в магистральные сосуды не влияет на продолжительность жизни больного [6, 12].
В целом современные возможности предоперационной подготовки, анестезиологического обеспечения и хирургической техники позволяют успешно решать проблему местно-распространенных форм АКР, дополняя в ряде наблюдений расширенную онкологическую операцию сложным реконструктивным этапом, добиваясь при этом хороших непосредственных результатов. Так, по нашему опыту и данным литературы, даже при I—II стадиях заболевания рецидивы и диссеминацию АКР в течение первого года после хирургического лечения наблюдали более чем у половины пациентов. В то же время имеется опыт многолетнего наблюдения и лечения пациентов с АКР, изначально оперированных по поводу III и IV стадий заболевания [2, 4, 9].
Несмотря на то что у больных АКР с инвазией в магистральные венозные сосуды имеет место IV стадия онкологического процесса, считаем нецелесообразным отказывать им в оперативном лечении. По нашему мнению, эти операции обоснованы с нескольких позиций: 1) максимально радикальное удаление опухоли позволяет надеяться на лучший эффект адъювантной терапии, при этом возможно использование менее токсичных доз химиопрепаратов; 2) при отсутствии адъювантной терапии, на что до сих пор обречены наши сограждане, это единственная надежда на продление жизни; 3) проведение операции позволяет избавить пациента от риска внезапной смерти, связанной с тромбоэмболией легочной артерии.
Продолжительность жизни наблюдавшихся нами пациенток, составившая 6, 13 и более 58 мес при отсутствии современной адъювантной терапии, еще раз подтверждает приведенные выше тезисы.
Таким образом, хирургическое вмешательство при адренокортикальном раке с инвазией в магистральные венозные сосуды остается основным методом лечения, позволяющим продлить жизнь пациентов.