Ишемия головного мозга у новорожденного что это такое
Что делать, если у новорожденного церебральная ишемия 1 степени? Есть ли лечение этой болезни?
Факторы риска
Также существуют многочисленные факторы риска развития церебральной ишемии у новорожденных, среди которых невропатологи и гинекологи-акушеры отмечают:
Факторами риска мозговой ишемии у младенцев также признаны врожденные патологии крови, связанные с мутациями генов протромбина, тромбоцитарных факторов свертывания крови V и VIII, гомоцистеина плазмы крови, а также ДВС-синдром и полицитемия.
Как лечат осложнения
Энцефалопатические проявления тяжёлой и средней формы зачастую заканчиваются стойкой мозговой симптоматикой. Она может проявиться в лёгкой мере либо малыш станет инвалидом. При любом прогнозе энцефалопатических изменений на применение лекарственных препаратов существуют ограничения:
Чтобы малыш, имеющий ишемические осложнения, правильно развивался, надо с ним регулярно заниматься:
Осложнения и последствия
Развитие у новорожденных ишемии головного мозга вызывает индуцированное дефицитом кислорода повреждение его клеток и обусловливает очень серьезные, часто необратимые неврологические последствия и осложнения, которые коррелируются с топографией поражений.
Как показали исследования, ишемии мозга у новорожденных более подвержены пирамидные клетки гиппокампа, клетки Пуркинье в мозжечке, ретикулярные нейроны перироландической области коры головного мозга и вентролатеральной части таламуса, клетки базальных ганглиев, нервные волокна кортикоспинального тракта, ядра среднего мозга, а также нейроны неокортекса и ствола мозга.
У доношенных новорожденных страдают, в первую очередь, кора головного мозга и глубокие ядра, у недоношенных отмечают диффузное разрушение клеток белого вещества полушарий, что обусловливает хроническую инвалидность у выживших детей.
А при глобальной ишемии клеток ствола мозга (в котором сосредоточены центы регуляции дыхания и работы сердца) происходит их тотальная гибель и практически неизбежный летальный исход.
Негативные последствия и осложнения перинатальной и неонатальной ишемии мозга 2-3 степени у детей раннего возраста проявляются эпилепсией, односторонней потерей зрения, задержкой психомоторного развития, двигательными и когнитивными нарушениями, в том числе, детским церебральным параличом. Во многих случаях их выраженность в полной мере может быть оценена к трем годам ребенка.
-я степень
В этом случае происходит неявное появление неврологических нарушений. При 1 степени церебральной ишемии пациенты отмечают появление:
Однако данные симптомы не являются специфическими. Из-за этого своевременно диагностировать появление 1 степени церебральной ишемии очень сложно. Многие связывают все эти симптомы с переутомлением, поэтому редко обращаются за медицинской помощью. Однако нужно понимать, что данная стадия патологии поддается самому быстрому и эффективному лечению.
Ишемия головного мозга у новорожденного что это такое
Гипоксически-ишемическая энцефалопатия (ГИЭ) встречается примерно у 1-6 из 1000 живорожденных и является самой важной проблемой неонатальной неврологии (Levene et al., 1985, Volpe, 2001, Ferriero, 2004). Гипоксически-ишемическая энцефалопатия (ГИЭ) относится к серьезным состояниям, при котором 15-20% пострадавших детей умирает в течение неонатального периода, а у 25% развиваются стойкие неврологические последствия (Volpe, 2008). Более двадцати лет назад было отмечено завышенное значение перинатальной гипоксии в этиологии задержки умственного развития и церебрального паралича (Freeman и Nelson, 1988, Вах и Nelson, 1993).
Badawi et al. (1998) обнаружили, что многие новорожденные подвергались антенатальным факторам риска, таким как лечение материнского бесплодия или заболеваний щитовидной железы, тогда как другие имели и анте-, и интранатальные факторы риска. Хотя не исключается возможность наличия пренатальных факторов риска, вероятно повышающих чувствительность ребенка к проблемам родового периода, в проспективном исследовании результатов MPT Cowan et al. (2003) было отмечено, что у большинства новорожденных (n=351) с неонатальной энцефалопатией повреждение мозга возникало в момент рождения или незадолго до этого.
Определение гипоксически-ишемической энцефалопатии (ГИЭ) сложное и роль асфиксии в родах трудно точно установить, так что и сам термин ставится под сомнение; вместо него предлагается неопределенное понятие «неонатальная энцефалопатия» (Nelson и Leviton, 1991, Leviton и Nelson, 1992, Badawi et al, 1998). Диагноз ГИЭ не должен устанавливаться без серьезной клинической основы и тщательного анализа альтернативных вариантов, потому что они могут играть роль в терапии и этиологии.
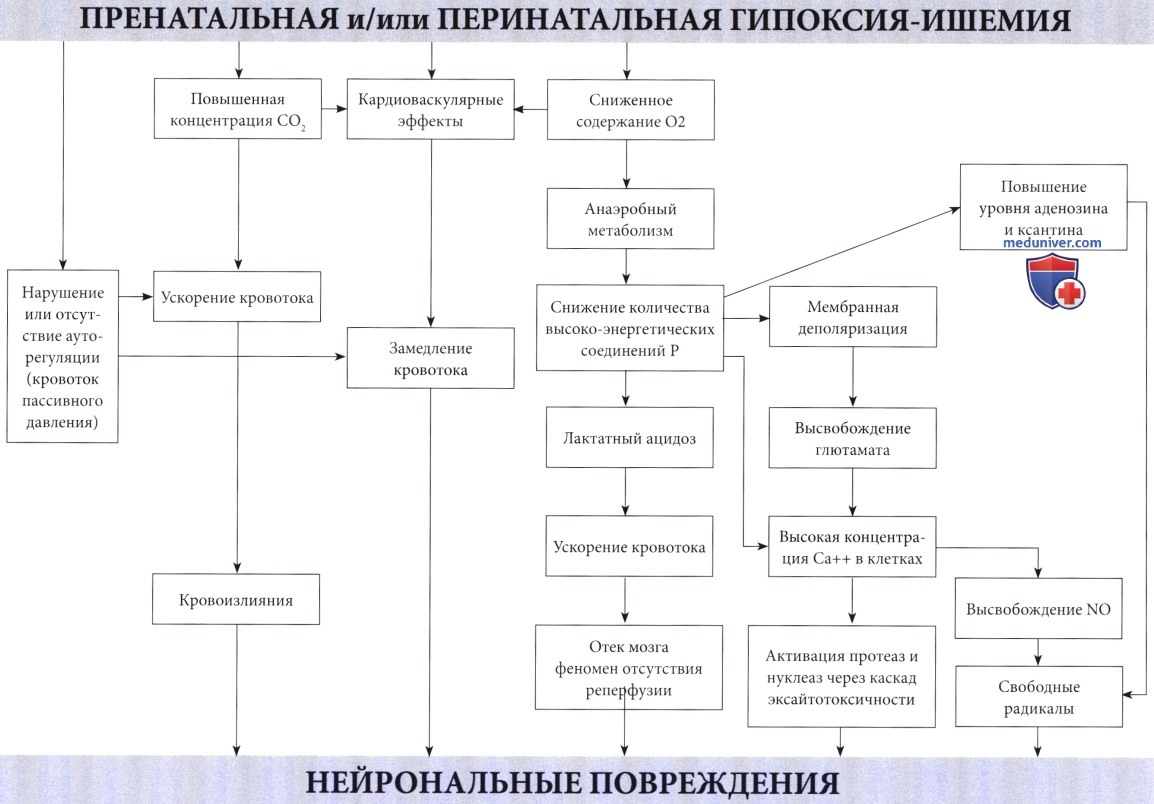
Патофизиология. Недостаточное поступление кислорода, вызывающее развитие гипоксической-ишемической энцефалопатии (ГИЭ), может возникнуть по двум механизмам: гипоксемия, т.е. ограниченный доступ кислорода в кровь; и ишемия, т.е. сниженная перфузия головного мозга. В большинстве случаев оба механизма связаны с асфиксией в виде гипоксии, сопровождающейся гиперкарбией (Altman et al., 1993). Обычно присутствующий при гипоксии ацидоз в значительной степени связан с повышенным образованием лактата. Преобразование глюкозы в молочную кислоту менее эффективно, чем окисление в цикле Кребса и митохондриальной системе транспорта электронов.
В результате окисления каждой молекулы глюкозы, переработанной в анаэробных условиях, образуется только две молекулы аденозина дифосфата (АДФ) по сравнению с 38 молекулами при аэробных условиях. Несмотря на значительное повышение скорости гликолиза и усиление мозгового кровотока из-за ацидоза и гиперкапнии (Laptook et al., 1988), потребности ткани мозга в кислороде не могут быть удовлетворены. Повышенная скорость гликолиза приводит к падению уровня глюкозы в мозге. Предупреждение этого состояния предварительным введением глюкозы повышает выработку АТФ и улучшает выживаемость (Vannucci и Yager, 1992). Однако избыточный уровень глюкозы в то же время приводит к повышенному образованию лактата, вредного для мозговой ткани взрослого, но, по-видимому, полезного для ЦНС новорожденного (Hattori и Wasterlain, 1990).
В итоге, в результате нехватки кислорода в клетках мозга снижается количество фосфокреатина и АТФ, конечных акцепторов электронов. Эти изменения были продемонстрированы у новорожденных с использованием фосфорной МРС (магнитно-резонансная спектроскопия) (Younkin et al., 1988, Laptook et al., 1989). Падение уровня высокоэнергетических соединений фосфата наблюдалось даже при стабилизации кардиопульмональной функции (Hope et al., 1984). В экспериментах на животных снижение уровня АТФ более чем на 30% происходило за 6 минут (Raichle, 1983). Также было отмечено накопление лактата, сохранявшееся в течение длительного периода времени (Groenendaal et al, 1994, Robertson et al., 1999).
Нейрональные повреждения являются следствием различных комбинаций кровоизлияний и некрозов.
Последние связаны с каскадом событий, инициированных высвобождением глютамата, приводящим к массивному входу кальция в клетки.
Образование оксида азота (NO), вероятно, также является важным фактором.
В действительности, нарушению мозговой функции предшествует сбой в энергетическом метаболизме (см. Volpe, 2001). При угрозе перебоев организм отвечает угнетением нейрональной активности по неопределенному механизму, но при длительной гипоксии этого недостаточно.
Однако мозг новорожденного чрезвычайно устойчив к гипоксии. При экспериментах на плодах обезьян потребовалось снижение сатурации кислорода на 90% в течение не менее 25 минут, чтобы вызвать повреждение ткани мозга. В результате, любой, достаточно тяжелый для повреждения мозга эпизод асфиксии вызывает нарушения и других органов, особенно сердца, и при таких условиях ишемия постоянна.
Ишемия оказывает влияние, подобное асфиксии (Painter, 1989). Процесс гликолиза ускоряется, но поглощению глюкозы препятствует нарушение кровотока, соответственно запасы высокоэнергетических фосфатов истощаются, и накапливается лактат.
Влияние гиперлактатемии многопланово. Первоначально оно благотворно, поскольку повышает приток крови к мозгу, но затем становится вредным, так как хотя бы отчасти влияет на отек мозга, который в свою очередь может сдавить капиллярное русло и вызвать ишемию (Myers, 1972). В то же время он нарушает ауторегуляцию церебрального кровообращения, приводя к мозговому кровотоку пассивного давления (Lou, 1988), что делает мозг более чувствительным к изменениям системного давления крови. Сочетание отека мозга и системной недостаточности кровообращения, вероятно, играет существенную роль в происхождении гипоксического повреждения ЦНС. Гипоксия обычно повышает долю сердечного выброса, предназначенную для головного мозга.
По мере усиления степени гипоксии наблюдается уменьшение сердечного выброса с последующей неспособностью поддерживать артериальное давление на необходимом уровне. Но показатели частоты сердечных сокращений и артериального давления остаются неизменными до тех пор, пока артериальная сатурация не снизится более, чем на 65%, а затем также линейно снижаются. Это снижение может поддерживаться на протяжении часов без развития энцефалопатии, если содержание кислорода в артериальной крови не упадет более, чем на 85% (Fenichel, 1997).
Механизм отека мозга и гипоксического повреждения у плодов до конца неясен. Levene et al. (1989) выявили хорошую корреляцию между высокой скоростью мозгового кровотока—предположительно отражающей церебральную гиперемию, которая, в свою очередь, может отвечать за повышение внутричерепного давления — и неблагоприятным течением. Lupton et al. (1988) показали, что отек в большей степени является следствием, чем причиной, нейрональных некрозов, объясняя, таким образом, ограниченную эффективность противоотечного лечения новорожденных с ГИЭ (Levene et al., 1987). Не было замечено различий в степени внутричерепной гипертензии у детей с ГИЭ в группе выживших и умерших (Goitein et al, 1983).
Последние данные подтверждают основную роль апоптоза в развитии гипоксически-ишемического повреждения мозга новорожденных, возможно, даже большую, чем некроз после повреждения. Во время неонатального поражения мозга токсичность возбуждающих медиаторов, оксидативный стресс и воспаление способствуют ускоренной гибели клеток, главным образом, посредством апоптоза или некроза, что зависит от области поражения и тяжести повреждения. В настоящее время известно, что ГИЭ состоит из двух последовательных стадий, с окончательным повреждением с отсрочкой на несколько часов во время второй из них, определяемой как вторичная недостаточность энергии. Тем не менее, профилактика возможна, как только появляется терапевтическое окно.
Механизмы повреждения и некроза клеток при гипоксии и ишемии не просто итог энергетической недостаточности. Это вторичные пусковые факторы каскада разрушительных событий при достижении критического уровня дефицита энергии. Такие события происходят в течение нескольких часов. Избыточная мембранная деполяризация и высвобождение возбуждающих аминокислотных нейротрансмиттеров, в первую очередь глютамата (Lipton и Rosenberg, 1994), приводит к массивному входу кальция через NMDA и АМРА мембранные рецепторы (Morley et al., 1994) и к накоплению кальция в цитозоле. Кальций, в свою очередь, активирует различные липазы, протеазы и нуклеазы с последующим разрушением основных клеточных белков. Свободные радикалы прямо или косвенно вызваны повышенным уровнем кальция в цитозоле (McCord, 1985) и оксида азота (Dawson et al., 1992), играющего главную роль в их образовании.
Этот каскад возбуждающих медиаторов в конечном счете приводит к повреждению мембраны, разрушению цитоскелета и, наконец, к дезинтеграции клетки.
Теоретически существует возможность предотвращения многих процессов, поэтому проводились исследования с различными средствами, в том числе блокаторами кальциевых каналов (Miller, 1993, Palmer и Vanucci, 1993); антагонистами возбуждающих аминокислот (Hattori et al., 1989), особенно магнезией (Marret et al., 1995, Nelson и Grether, 1995); ингибиторами синтеза оксида азота (Dawson et al., 1992); акцепторами свободных радикалов (Palmer и Vannucci, 1993) и веществами, подавляющими образование свободных радикалов типа аллопуринола (Palmer et al., 1990, van Bel et al., 1998, Benders et al., 2006).
Редактор: Искандер Милевски. Дата публикации: 25.11.2018
Церебральная ишемия у новорожденных: симптомы, последствия, лечение
Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Нарушение кровообращения в сосудистой системе головного мозга ребенка сразу после его рождения, вызывающее недостаток кислорода в крови (гипоксемию), определяется как церебральная ишемия у новорожденных. Код по МКБ-10 – P91.0.
Поскольку ишемия, гипоксемия и гипоксия (кислородное голодание) физиологически взаимосвязаны (притом что развитие гипоксии может быть и при нормальном церебральном кровотоке), критическое состояние дефицита кислорода для мозга новорожденных в неврологии считается клиническим синдромом и называется неонатальной гипоксически-ишемической энцефалопатией, развивающейся в течение 12-36 часов после родов.

Код по МКБ-10
Эпидемиология
В неонатальной неврологии и педиатрии эпидемиология клинических проявлений церебральной ишемии у новорожденных отдельно от синдрома гипоксически-ишемической энцефалопатии не фиксируется, поэтому оценка заболеваемости из-за отсутствия критериев их дифференциации проблематична.
Частота неонатальных энцефалопатий, связанных с уменьшением мозгового кровотока и гипоксией мозга, оценивается в 2,7-3,3% случаев на одну тысячу живорожденных детей. При этом 5% детей с младенческими патологиями мозга перенесли его перинатальный инсульт (диагностируется один случай на 4,5-5 тыс. младенцев с патологией церебральной гемодинамики).
Частота перинатальной асфиксии оценивается от одного до шести случаев на тысячу доношенных новорожденных и от двух до десяти случаев у недоношенных. Глобальная оценка имеет большие расхождения: по одним данным, асфиксия новорожденных ежегодно вызывает 840 тыс. или 23% случаев смерти новорожденных во всем мире, а согласно данным ВОЗ – не менее 4 млн., что составляет 38% всех летальных случаев среди детей в возрасте до пяти лет.
Эксперты американской Академии педиатрии пришли к выводу, что наилучшей оценкой частоты неонатальной патологии головного мозга являются данные по численности населения: в среднем три случая на каждую тысячу человек. Согласно мнению некоторых западных нейрофизиологов, те или иные последствия перенесенной при рождении гипоксически-ишемической энцефалопатии наблюдаются у 30% населения развитых стран и более чем у половины жителей развивающихся стран.

Причины церебральной ишемии у новорожденных
Мозг нуждается в постоянном притоке крови, несущей кислород; у младенцев мозг составляет до 10% массы тела, имеет разветвленную сосудистую систему и потребляет пятую часть кислорода, поступающего с кровью ко всем тканям организма. При снижении церебральной перфузии и оксигенации ткани мозга теряют источник поддержания жизни своих клеток, и известные на сегодняшний день причины церебральной ишемии у новорожденных достаточно многочисленны. Это может быть:

Факторы риска
Также существуют многочисленные факторы риска развития церебральной ишемии у новорожденных, среди которых невропатологи и гинекологи-акушеры отмечают:
Факторами риска мозговой ишемии у младенцев также признаны врожденные патологии крови, связанные с мутациями генов протромбина, тромбоцитарных факторов свертывания крови V и VIII, гомоцистеина плазмы крови, а также ДВС-синдром и полицитемия.

Патогенез
Церебральная ишемия у новорожденных нарушает метаболизм клеток головного мозга, что приводит к необратимому разрушению структуры нервной ткани и ее дисфункции. В первую очередь, патогенез развития деструктивных процессов связывают со стремительным падением уровня аденозинтрифосфата (АТФ) – главного поставщика энергии для всех биохимических процессов.
Для нормальной функции нейронов также важен баланс между внутриклеточной и внеклеточной концентрацией ионов, мигрирующих через их мембраны. При кислородном голодании мозга в нейронах нарушается трансмембранный градиент ионов калия (К+) и натрия (Na+), а внеклеточная концентрация К+ возрастает, приводя к прогрессирующей аноксидной деполяризации. Одновременно увеличивается приток ионов кальция (Ca2+), инициирующий высвобождение нейромедиатора глутамата, который воздействует на NMDA-рецепторы мозга; их чрезмерная стимуляция (эксайтотоксичность) приводит к морфологическим и структурным изменениям в головном мозге.
Также повышается активность гидролитических ферментов, которые расщепляют нуклеиновые кислоты клеток и вызывают их аутолиз. При этом основание нуклеиновых кислот – гипоксантин – трансформируется в мочевую кислоту, ускоряя образование свободных радикалов (активных форм кислорода и оксида азота) и других соединений, токсичных для мозга. Антиоксидантные защитные механизмы мозга новорожденных еще не полностью развиты, и совокупность перечисленных процессов крайне негативно действуют на его клетки: происходит глиоз нейронов, атрофия глиальных клеток и олигодендроцитов белого вещества.

Симптомы церебральной ишемии у новорожденных
Клинические симптомы церебральной ишемии у новорожденных и интенсивность их проявления определяются ее видом, степенью тяжести и локализацией зон некроза нейронов.
Виды ишемии включают фокальное или топографически ограниченное повреждение тканей головного мозга, а также глобальное, распространяющееся на многие церебрально-васкулярные структуры.
Первые признаки ишемии мозга при рождении ребенка можно выявить при проверке рефлексов врожденного спинального автоматизма. Но оценка их отклонений от нормы зависит от степени нарушения церебральной перфузии и физиологической зрелости новорожденного.

Стадии
Так, церебральная ишемия 1 степени у новорожденного (мягкая форма гипоксически-ишемической энцефалопатии) проявляется у доношенного младенца умеренным повышением мышечного тонуса и сухожильных рефлексов (хватательного, Моро и др.). К симптомам также относят избыточное беспокойство с частыми движениями конечностей, постгипоксический миоклонус (подергивания отдельных мышц на фоне мышечной ригидности), проблемы при прикладывании к груди, спонтанно возникающий плач, прерывистый сон.
Если ребенок появился на свет раньше срока, то, кроме снижения безусловных рефлексов (двигательного и сосательного), наблюдается ослабление общего мышечного тонуса в течение первых нескольких дней после рождения. Как правило, это временные аномалии, и, если состояние ЦНС младенца стабилизируется в течение нескольких дней, то ишемия практически не дает неврологических осложнений. Но все зависит от эндогенной регенеративной активности развивающегося мозга конкретного ребенка, а также от выработки церебральных нейротрофинов и факторов роста – эпидермального и инсулиноподобного.
Церебральная ишемия 2 степени у новорожденного (вызывающая умеренно тяжелую форму гипоксически-ишемической энцефалопатии) добавляет к списку уже названных симптомов судороги эпилептического типа; снижение артериального и повышение церебрального давления (наблюдается увеличение и заметное пульсирование родничка); вялость при кормлении и частые срыгивания; проблемы с кишечником; периоды нарушения сердечного ритма и апноэ (замирание дыхания во сне); лабильный цианоз и эффект «мраморной кожи» (из-за вегетососудистых нарушений). Острый период длится примерно в течение десяти суток. Кроме того, неонатологи отмечают возможность осложнений в виде водянки мозга (гидроцефалии), нарушения движений глаз – нистагма, перекоса отклонения глаз (косоглазия).
Если имеется церебральная ишемия 3 степени у новорожденного, то неонатальные рефлексы (сосания, глотания, хватания) отсутствуют, а приступы судорог частые и продолжительные (в течение 24-48 часов после родов). Затем судороги уменьшаются, сменяясь прогрессирующим снижением мышечного тонуса, состоянием ступора, увеличением отека тканей мозга.
В зависимости от локализации основных очагов ишемии мозга могут быть нарушения дыхательной функции (младенец часто требует аппаратной поддержки дыхания); изменения частоты сердечных сокращений; расширение зрачков (плохо реагирующих на свет) и отсутствие глазодвигательного сопряжения («глаза куклы»).
Данные проявления нарастают, что свидетельствует о развитии тяжелой гипоксически-ишемическая энцефалопатии, которая из-за кардиореспираторной недостаточности может завершиться летально.

Осложнения и последствия
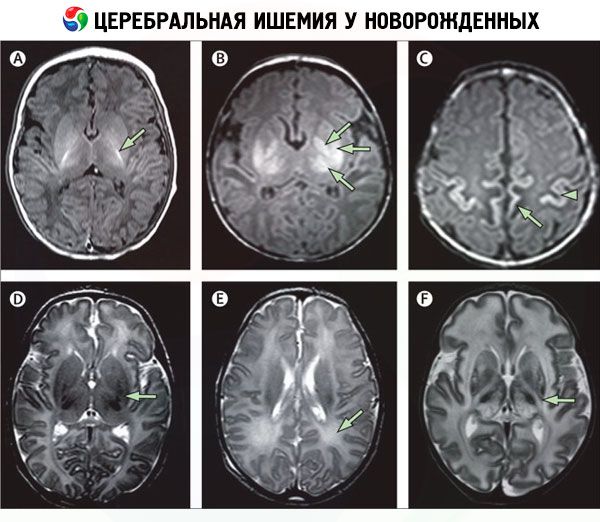
Развитие у новорожденных ишемии головного мозга вызывает индуцированное дефицитом кислорода повреждение его клеток и обусловливает очень серьезные, часто необратимые неврологические последствия и осложнения, которые коррелируются с топографией поражений.
Как показали исследования, ишемии мозга у новорожденных более подвержены пирамидные клетки гиппокампа, клетки Пуркинье в мозжечке, ретикулярные нейроны перироландической области коры головного мозга и вентролатеральной части таламуса, клетки базальных ганглиев, нервные волокна кортикоспинального тракта, ядра среднего мозга, а также нейроны неокортекса и ствола мозга.
У доношенных новорожденных страдают, в первую очередь, кора головного мозга и глубокие ядра, у недоношенных отмечают диффузное разрушение клеток белого вещества полушарий, что обусловливает хроническую инвалидность у выживших детей.
А при глобальной ишемии клеток ствола мозга (в котором сосредоточены центы регуляции дыхания и работы сердца) происходит их тотальная гибель и практически неизбежный летальный исход.
Негативные последствия и осложнения перинатальной и неонатальной ишемии мозга 2-3 степени у детей раннего возраста проявляются эпилепсией, односторонней потерей зрения, задержкой психомоторного развития, двигательными и когнитивными нарушениями, в том числе, детским церебральным параличом. Во многих случаях их выраженность в полной мере может быть оценена к трем годам ребенка.

Диагностика церебральной ишемии у новорожденных
Начальная диагностика церебральной ишемии у новорожденных осуществляется сразу после родов в ходе стандартного осмотра ребенка и определения так называемого неврологического статуса (по шкале Апгар) – путем проверки степени рефлекторной возбудимости и наличия у него определенных врожденных рефлексов (некоторые из них были упомянуты при описании симптомов данной патологии). Обязательно регистрируются показатели ЧСС и АД.
Инструментальная диагностика, особенно неровизуализация, позволяет выявить зоны ишемии головного мозга. С этой целью используют:
Лабораторные исследования включают общий клинический анализ крови, а также анализы крови на уровень электролитов, на протромбиновое время и уровень фибриногена, на гематокрит, на содержание газов в артериальной крови; анализ пуповинной или венозной крови на уровень рН (для выявления ацидоза). Также делается анализ мочи – на ее химический состав и осмоляльность.

Дифференциальная диагностика
Чтобы исключить наличие у младенца перинатального менингоэнцефалита, опухоли мозга, тирозинемии, гомоцистинурии, врожденного синдрома Зеллвегера, нарушения метаболизма пирувата, а также генетически обусловленных митохондриальных нейропатий, метилмалоновой или пропионовой ацидемия, проводится дифференциальная диагностика.
К кому обратиться?
Лечение церебральной ишемии у новорожденных
Во многих случаях на первых этапах лечение церебральной ишемии у новорожденных требует сердечно-легочной реанимации у новорожденных с искусственной вентиляцией легких и всеми мерами по восстановлению гемодинамики сосудистой системы головного мозга, поддержанию гемостаза, а также предупреждению гипертермии, гипо и гипергликемии.
Значительно снижает степень среднего и тяжелого ишемического повреждения клеток головного мозга младенцев контролируемая гипотермия: охлаждение тела на 72 часа до +33-33,5ºC с последующим постепенным доведением температуры до физиологической нормы. Такое лечение не применяется недоношенным детям, родившимся ранее 35-ти недель.
Медикаментозная терапия симптоматическая, например, при тонико-клонических судорогах чаще всего применяются лекарства-антиконвульсанты Дифенин (Фенитоин), Триметин (Триметадион) – дважды в день по 0,05 г (с систематическим мониторингом состава крови).
Для снижения мышечного гипертонуса после трех месяцев в/м может вводиться миорелаксант Толперизон (Мидокалм) – по 5-10 мг на килограмм массы тела (до трех раз в сутки). Препарат может вызвать побочные эффекты в виде тошноты и рвоты, кожных высыпаний и зуда, мышечной слабости, удушья и анафилактического шока.
Улучшению церебральной перфузии способствует капельное внутривенное введение Винпоцетина (дозировка рассчитывается по весу тела).
Для активизации функций головного мозга принято использовать нейропротекторные препараты и ноотропы: Пирацетам (Ноотропил, Нооцефал, Пирроксил, Динацел) – в сутки по 30-50 мг. Сироп Цераксон назначается по 0,5 мл два раза в течение дня. Следует иметь в виду, что этот препарат противопоказан при гипертонусе мышц, а его побочные действия включают аллергическую крапивницу, снижение АД и нарушения сердечного ритма.
При подавлении функций ЦНС применяют Глутан (глутаминовая кислота, Ацидулин) – трижды в сутки по 0,1 г (с контролем состава крови). А препараты-ноотропы гопантеновой кислоты (сироп Пантогам) улучшают оксигенацию тканей головного мозга и проявляют нейропротекторные свойства.
Парентерально применяются витамины В6 (пиридоксина гидрохлорид) и В12 (цианокобаламин) с раствором глюкозы.
Физиотерапевтическое лечение
При легкой степени церебральной ишемии у новорожденного ребенка обязательным является физиотерапевтическое лечение, в частности лечебный массаж, способствующий снижению мышечного гипертонуса. Однако при наличии эпилептического синдрома массаж не применяется.
Улучают состояние новорожденных с ишемией мозга водные процедуры в виде ванна с отваром цветков ромашки аптечной, перечной или лимонной мяты. Лечение травами – см. Успокоительные средства для детей