Изл легких что это
Интерстициальное заболевание легких
Интерстициальные заболевания легких – группа болезней, поражающих легочную ткань, преимущественно хронического характера. Возникают вследствие поражения альвеолярных мешочков. При отсутствии надлежащего лечения приводят к пневмофиброзу, повреждению альвеолярных стенок, эндотелии легочных капилляров альвеолиту.
Причины возникновения
Сегодня известны три группы причин, провоцирующих возникновение и развитие интерстициальных заболеваний. К ним относятся:
Симптоматика заболевания
Поскольку речь идет сразу о группе болезней легких, единую клиническую картину сформировать нельзя. Однако для всех из них характерно постепенное нарастание симптомов. Если у пациента, например, наблюдается дыхательная недостаточность, со временем она приведет к снижению выносливости. Легкое покашливание перерастет в непрекращающийся, сухой кашель. Также на поздних стадиях практически всегда происходит посинение губ и/или ступней и опухание пальцев рук.
Диагностика и лечение
Интерстициальные заболевания легких можно обнаружить при помощи КТ-сканирования или рентгенографии. На снимке отчетливо видно затемнение легких, наличие в них единичных мелких узелков или целой сетки. В особо запущенных случаях (например, при прогрессирующем пневмофиброзе) можно наблюдать полное или частичное разрушение альвеол и формирование кистозных образований. Из-за них легкие приобретают схожесть с медовыми сотами.
После того, как заболевание обнаружено, наступает очередь анализов. Врач отправляет пациента проверить содержание кислорода в крови и протестировать работу легких. В отдельных случаях, если КТ-сканирование не дает однозначных результатов, назначается биопсия. Хирургическим путем из легкого изымается ткань для анализа.
Лечение интерстициальных заболеваний зависит от степени их развития. При относительно легких болезнях (саркоидозе, аллергическом альвеолите экзогенной этиологии) назначают кус противовоспалительных препаратов и противорубцовую терапию. При пневмофиброзе и схожих с ним заболеваниях не обойтись без кислородной терапии и продолжительной реабилитации. В особо тяжелых случаях может потребоваться трансплантация легких.
С каким бы интерстициальным заболеванием легких вы ни столкнулись, пульмонолог медицинского центра «Гармония» сможет помочь. Наша клиника оснащена современным оборудованием, которое позволяет диагностировать болезни на самых ранних стадиях. А опытный врач подберет лечение, подходящее именно вам. Поэтому, если ощущаете, что самочувствие ухудшилось, не затягивайте с визитом. Запишитесь на прием по телефону или через онлайн-форму.
АНЦА-ассоциированные интерстициальные заболевания легких: актуальные вопросы диагностики и лечения
В течение последних лет появляются данные о связи интерстициальных заболеваний легких (ИЗЛ) и АНЦА-ассоциированных васкулитов (ААВ), особенно у пациентов с микроскопическим полиангиитом с наличием антител к миелопероксидазе (МПО-АНЦА). В части случаев ИЗЛ является единственным или ведущим проявлением заболевания, определяющим объем терапии и прогноз жизни больного с ААВ. В статье обсуждаются современные концепции патогенеза, подходы к диагностике и лечению АНЦА-ассоциированных ИЗЛ, а также дальнейшие направления изучения данной аутоиммунной патологии.
Интерстициальные заболевания легких (ИЗЛ) характеризуются развитием про грессирующего диффузного воспалительного и/или фиброзирующего поражения легких и сходными клиникорентгенологическими проявлениями и гистологической картиной. В соответствии с классификацией, принятой Американским торакальным и Европейским респираторным обществами в 2013 г., к ИЗЛ относят более 200 заболеваний, как с установленной этиологией, так и идиопатических [1].
Антинейтрофильные цитоплазматические антитела (АНЦА) являются серологическим маркером АНЦА-ассоциированных васкулитов (ААВ), в том числе микроскопического полиангиита (МПА), гранулематоза с полиангиитом (ГПА) и эозинофильного гранулематоза с полиангиитом (ЭГПА) [2]. Поражение легких – одно из частых проявлений ААВ [3]: у 85-90% пациентов ГПА 4 и 25-55% с МПА 8 имеются отклонения при компьютерной томографии органов грудной клетки (КТ). При ЭГПА клинически значимые изменения в легких (за исключением бронхиальной астмы) встречаются реже [10]. Наиболее клинически значимыми вариантами поражения легких при ААВ, ассоциированными с неблагоприятным исходом, можно считать диффузное альвеолярное кровотечение (ДАК) и узловые образования различных размеров, в том числе с зонами распада [11].
В течение нескольких лет появляются данные о связи ИЗЛ и ААВ, особенно ассоциированным с антителами к миелопероксидазе (МПО-АНЦА) [11]. В части случаев при ААВ наблюдается изолированное поражение легких; кроме того, у небольшой части пациентов с идиопатическими интерстициальными пневмониями наличие АНЦА (чаще МПО-АНЦА, чем антитела к протеиназе-3 (ПР3-АНЦА)) не сопровождается симптомами системного васкулита или предшествует его развитию [12].
В настоящее время имеется ограниченное количество информации относительно подходов к диагностике и лечению АНЦА-ассоциированных интерстициальных заболеваний легких (АНЦА-ИЗЛ), что объясняется их относительной редкостью [12]. В то же время, наличие интерстициального поражения легких при ААВ может негативно влиять на прогноз заболевания и повышать риск летального исхода, что подчеркивает необходимость поиска его оптимального лечения. В статье представлен современный взгляд на классификацию АНЦА-ИЗЛ, а также обсуждаются вопросы патогенеза, диагностики, лечения и направления дальнейшего изучения данной патологии.
Эпидемиология и классификация
ИЗЛ встречаются чаще у пациентов с МПА (до 45%) и реже у пациентов с ГПА (менее 5%); при ЭГПА описаны лишь единичные случаи развития интерстициального поражения легких [13,14]. При АНЦА-ИЗЛ отмечается значительное преобладание МПО-АНЦА (46-71%) по сравнению с ПР3АНЦА (0-29%) [13,15-20].
Распространенность ИЗЛ при ААВ зависит от географического региона: в Европе она составляет 2-3%, что существенно ниже по сравнению со странами Азии (2839%) [21,22]. Это может быть отчасти связано с большей частотой выявления МПО-АНЦА в азиатской популяции [11].
Возрастная структура АНЦА-ИЗЛ несколько отличается от таковой в общей группе ААВ. АНЦА-ИЗЛ, как правило, развиваются у пациентов старше 65 лет, хотя единичные случаи описаны даже у детей [11]. В ряде исследований средний возраст на момент диагностики МПА-ассоциированного ИЗЛ (МПА-ИЗЛ) превышал таковой для общей когорты пациентов с МПА (66 и 55 лет, соответственно) и был сопоставим с возрастом пациентов в дебюте идиопатического легочного фиброза (ИЛФ) [7,8]. В нескольких сериях клинических случаев МПА-ИЗЛ наблюдалось незначительное преобладание мужчин (60-65%), однако это отмечалось не во всех наблюдениях [15,23]. Многофакторный анализ в одном из исследований, включавших 62 пациента с ААВ-ИЗЛ, показал, что мужской пол и возраст старше 65 лет были независимыми предикторами развития легочного поражения [24].
Среди АНЦА-ИЗЛ можно выделить три основные группы. Первая включает пациентов с развернутой клинической картиной МПА, развившейся до поражения легких (8-21%); во вторую входят пациенты с ИЗЛ, дебютировавшим одновременно с системным васкулитом (36-67%); третья объединяет АНЦА-позитивных пациентов с ИЗЛ без признаков поражения других органов (14-85%) [11,17,25]. Последний клинический сценарий представляет особый диагностический интерес в связи с возможностью развития в последующем ААВ в срок от нескольких месяцев до 12 лет [11]. В одном исследовании на момент установления диагноза ИЛФ у 4,0% из 504 пациентов определялись МПОАНЦА, у 3,2% – ПР3-АНЦА. В течение последующих 5 лет сероконверсия произошла еще у 11% исходно АНЦА-негативных пациентов, а у одной четверти больных с МПО-АНЦА развился МПА [25]. Наличие других типов аутоантител, в частности ревматоидного фактора (РФ), повышение СОЭ >40 мм/ч, эозинофилия лаважной жидкости и большой объем поражения легочной ткани по данным КТ служили прогностическими факторами АНЦА-сероконверсии [26].
Патогенез
К настоящему времени предложены несколько потенциальных механизмов развития АНЦА-ИЗЛ. Согласно одной из гипотез, формирование интерстициального легочного фиброза при ААВ может быть следствием рецидивирующих эпизодов ДАК [27]. В пользу данной концепции свидетельствует наличие гистологических признаков острого и/или хронического кровотечения более чем у половины пациентов с АНЦА-ИЗЛ [28]. Важно отметить, что у большинства из них отсутствуют анамнестические данные о ДАК, что указывает на вероятное развитие субклинических эпизодов кровотечений [28,29]. Еще одним подтверждением данной гипотезы являются обнаружение в ткани легких значительного количества сидерофагов – гистологических маркеров хронического альвеолярного кровотечения – у пациентов с АНЦА-ИЗЛ и отсутствие данного признака у пациентов с ИЗЛ в рамках других системных аутоиммунных заболеваний, таких как воспалительные миопатии и системная склеродермия [30].
Согласно второй гипотезе, МПО-АНЦА (но не ПР3АНЦА) могут сами по себе играть роль в патогенезе ИЗЛ [31]. В одном исследовании было показано, что активация нейтрофилов антителами к МПО приводила к выработке большого количества окислительных соединений. К ним, в частности, относится гипохлорит-анион, способный стимулировать пролиферацию фибробластов in vitro. Кроме того, МПО-АНЦА могут способствовать повреждению легочной ткани путем локального высвобождения протеолитических ферментов активированными нейтрофилами. Некоторые из этих ферментов, в частности эластаза, могут вызывать развитие легочного фиброза в опытах на животных [32].
Повреждение, вызванное внеклеточными нейтрофильными ловушками, выделяющимися АНЦА-активированными нейтрофилами при их гибели путем нетоза, также может также вносить вклад в легочный патологический процесс. Внеклеточные нейтрофильные ловушки обладают способностью активировать легочные фибробласты и стимулировать их дифференцировку в миофибробласты – один из основных типов клеток, активно вовлеченных в развитие интерстициального легочного фиброза [33].
Еще одна концепция патогенеза АНЦА-ИЗЛ согласуется с фактом развития ИЗЛ до дебюта ААВ и основывается на том, что наличие ИЗЛ само по себе предрасполагает к появления МПО-АНЦА [24]. У пациентов с ИЛФ в лаважной жидкости в большинстве случаев увеличено количество нейтрофилов [34]. При активации нейтрофилы начинают экспрессировать МПО на своей плазматической мембране, что при наличии тканевого воспаления может запускать развитие аутоиммунной реакции и приводить к секреции МПО-АНЦА, а затем и развитию ААВ. В пользу данной гипотезы свидетельствуют появление МПО-АНЦА и развитие МПА у части пациентов с ИЛФ. В этой связи представляет интерес тот факт, что при ААВ, как и при ИЛФ, одним из факторов риска развития ИЗЛ является курение (частота его составила 59% и 23% у пациентов с МПА, у которых отмечалось и отсутствовало ИЗЛ, соответственно) [25].
В то же время, несмотря на ряд сходств, некоторые механизмы развития ИЛФ не играют значимой роли в патогенезе поражения легких при ААВ. В частности, ключевая роль апоптоза альвеолярных эпителиоцитов вследствие длительного воздействия повреждающих факторов, а также эпителиально-мезенхимального перехода не была подтверждена при АНЦА-ассоциированном интерстициальном легочном фиброзе. И наоборот, роль нейтрофилов и системы комплемента в развитии ИЛФ представляется незначительной по сравнению с таковой при АНЦА-ИЗЛ [35].
Клиническаякартина
Основными симптомами у пациентов с АНЦА-ИЗЛ является одышка (50-73%) и малопродуктивный кашель (21-60%) [36,37]. Кровохарканье (5%) и конституциональные проявления, такие как лихорадка (31%) и снижение массы тела (5%), наблюдаются реже [36]. В ранее опубликованных исследованиях не было выявлено достоверной корреляции между титром АНЦА и тяжестью ИЗЛ [36]. В ряде наблюдений клинические проявления у пациентов с фиброзирующими ИЗЛ и наличием АНЦА не отличались от таковых при ИЛФ [36,37].
В то же время, у пациентов с МПА-ИЗЛ в дебюте обычно преобладают конституциональные симптомы (около 80% случаев) – недомогание (31-63%), лихорадка (52-90%) и снижение массы тела (52-58%), а также внелегочные проявления основного заболевания (70100%) [38,39]. Легочные симптомы включают в себя прогрессирующую одышку (30-100%), кровохарканье (21-49%) и кашель (23-84%) [29,38,39]. Следует отметить, что у пациентов с МПА-ИЗЛ реже выявляют признаки системного воспаления, что выражается в более низком уровне СОЭ, более высоком уровне гемоглобина, и, что важно, в меньшей частоте таких проявлений васкулита, как ДАК, поражение периферической нервной системы и почек [29,40].
Диагностика
Повышение уровня СОЭ и содержания С-реактивного белка (СРБ) в дебюте заболевания у пациентов с МПАИЗЛ отмечается в 95% и 73-79% случаев, соответственно [17]. Более чем у 60% из них выявляют также изменения в общем анализе мочи [25]. В то же время, значительное повышение уровня воспалительных маркеров редко встречается при изолированном АНЦАИЗЛ. При сравнении данной группы с ИЛФ в большинстве исследований различий по уровню СРБ не обнаружено [36,37]. При исследовании сывороточных маркеров легочного повреждения у пациентов с ААВ повышение уровня Krebs von der Lungen (KL)-6 ассоциировалось с наличием ИЗЛ [41]. При ААВ-ИЗЛ отмечается четкая корреляция между наличием МПО-АНЦА и ИЗЛ; у пациентов с ПР3-АНЦА развитие ИЗЛ наблюдается значительно реже [24]. Кроме того при наличии ПР3-АНЦА у пациентов с ИЛФ ни в одном случае не было отмечено развития ААВ [25].
При АНЦА-ИЗЛ чаще всего развиваются вентиляционные нарушения рестриктивного типа – снижение форсированной жизненной емкости легких (ФЖЕЛ) и диффузионной способности легких (DLCO), хотя примерно в трети случаев наблюдается умеренная бронхообструкция [15,36,38]. В динамике отмечается тенденция к дальнейшему снижению вентиляционных параметров по мере прогрессирования ИЗЛ. В одном исследовании у больных с ААВ-ИЗЛ в течение 5 лет отмечалось снижение жизненной емкости легких и (ЖЕЛ) и DLCO на 23% и 46%, соответственно, по сравнению с исходными значениями [42].
При исследовании бронхоальвеолярной лаважной жидкости (БАЛЖ) у пациентов с АНЦА-ИЗЛ выявляют нейтрофилию (40-87%), реже – лимфоцитоз и эозинофилию (20% и 26%, соответственно) [15,36]. Признаки острого или хронического альвеолярного кровотечения обнаруживают в половине случаев [15]. По данным ряда авторов, при АНЦА-ИЗЛ количество нейтрофилов и эозинофилов в БАЛЖ было выше, чем при ИЛФ, однако эти результаты подтверждаются не всеми исследованиями [15,37,43].
Основными изменениями на КТ, ассоциированными с ААВ, являются уплотнение по типу «матового стекла» (23-100%), ретикулярные изменения (41-77%), утолщение междолькового интерстиция (41-71%), зоны консолидации (0-78%) и «сотового легкого» (23-100%). Реже выявляют узловые образования в паренхиме (0-45%) и кисты (27%) [22,39,42]. Может наблюдаться поражение дыхательных путей в форме бронхиолита (55%), утолщения стенок бронхов (44%) и бронхоэктазов (32100%). У большинства пациентов (50-100%) изменения в легких носят симметричный характер [38,42,44].
Согласно международным классификационным критериям идиопатических интерстициальных пневмоний, наиболее частым КТ-паттерном ААВ-ИЗЛ, как при наличии МПО-АНЦА, так и ПР3-АНЦА, является обычная интерстициальная пневмония (ОИП; 38-63%), характеризующаяся ретикулярными изменениями, преимущественно в задних и нижних отделах легких, в сочетании с формированием зон «сотового легкого» и уменьшением объема нижних долей. Несколько реже отмечается неспецифическая интерстициальная пневмония (НСИП; 7-31%) и десквамативная интерстициальная пневмония (14%) (рис. 1). У части пациентов (преимущественно курящих мужчин) описано развитие интерстициального фиброза в сочетании с эмфиземой легких (до 21%) [6,38,39].
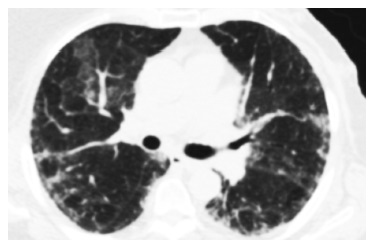
Следует отметить, что в 4-40% случаев изменения в легких при АНЦА-ИЗЛ не соответствуют какому-либо конкретному паттерну интерстициальной пневмонии [36]. В спорных случаях для определения показаний к иммуносупрессивной терапии и ее объема требуется гистологическое подтверждения диагноза. В связи с невозможностью проведения видео-ассоциированной торакоскопической биопсии легкого у части пациентов из-за выраженных вентиляционных нарушений и дыхательной недостаточности может быть также рассмотрено выполнение криобиопсии легкого [24].
Как и в случае рентгенологической картины, основным гистологическим паттерном АНЦА-ИЗЛ является ОИП (46-100%), на втором месте по частоте находится НСИП (7-31%) [36,37]. Следует отметить, что несмотря на невысокую распространенность НСИП, в части случаев при основном паттерне ОИП у пациентов также выявляли отдельные зоны с НСИП-подобной гистологической картиной. Кроме того, в отличие от ОИПИЛФ, при АНЦА-ОИП чаще наблюдаются признаки интерстициального воспаления, поражения мелких дыхательных путей, а также лимфоидные фолликулы [36]. Интересно, что признаки активного васкулита редко определяются в биоптатах легкого у пациентов с АНЦА-ИЗЛ [37].
ИЗЛ при ААВ следует дифференцировать с ДАК – одним из наиболее опасных проявлений системного васкулита [11]. Для КТ-картины ДАК в острой стадии характерно наличие диффузно расположенных зон матового стекла, которые в ряде случаев могут занимать большую часть объема легочной паренхимы, с визуализирующимися заполненными сегментарными и субсегментарными бронхами. Скопления крови в полости альвеол могут также формировать различные по размеру зоны консолидации. В подостром периоде (через 2-3 дня после эпизода кровотечения) для ДАК характерно утолщение междолькового и внутридолькового интерстиция, в ряде случаев – на фоне сохраняющегося уплотнения по типу матового стекла (КТ-симптом «булыжной мостовой»). В исходе ДАК в легких могут формироваться множественные нечеткие центрилобулярные очаги, соответствующие интраальвеолярным скоплениям сидерофагов; вследствие обильных рецидивирующих ДАК может развиться грубый интерстициальный легочный фиброз [6,11].
С учетом активной комбинированной иммуносупрессивной терапии, проводимой большинству пациентов с ААВ, в круг дифференциального диагноза следует включать инфекционные осложнения, в первую очередь, обусловленные оппортунистическими микроорганизмами. Так, пневмония, вызванная Pneumocystis jiroveci, характеризуется появлением обширных зон матового стекла в легочной ткани и может имитировать обострение ИЗЛ (рис. 2) [45].
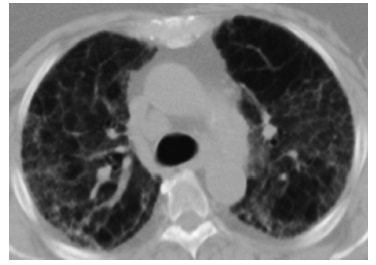
Лекарственное поражение легких, особенно при длительном приеме и высокой кумулятивной дозе цитостатических препаратов, также должно рассматриваться в качестве причины развития ИЗЛ у пациентов с ААВ [11].
Лечение и прогноз
Согласно современным клиническим рекомендациям, лечение ААВ включает индукцию ремиссии с использованием высокоактивных иммуносупрессивных препаратов (высоких доз ГКС в сочетании с циклофосфамидом или ритуксимабом) с последующим переходом на прием поддерживающей терапии для предотвращения рецидива [46]. В то же время, стандартные протоколы терапии не учитывают особенности клинической картины заболевания в отдельных подгруппах пациентов, в том числе при АНЦА-ИЗЛ. Использование иммуносупрессивной терапии при интерстициальном поражении легких в рамках ААВ отчасти основывается на ее доказанной эффективности при ААВ и ИЗЛ, ассоциированных с рядом системных заболеваний соединительной ткани, в частности системной склеродермией и воспалительными миопатиями [11].
Тем не менее, полученные к настоящему моменту данные об эффективности иммуносупрессивной терапии при лечении ААВ-ИЗЛ носят противоречивый характер. С одной стороны, в ряде работ была выявлена клиническая или рентгенологическая положительная динамика у 80% пациентов с ААВ-ИЗЛ, получавших иммуносупрессивную терапию [36]. В исследовании С. Comarmond и соавт. 3-летняя выживаемость пациентов, получавших комбинированную терапию ГКС в сочетании с циклофосфамидом, составила 94% и превышала таковую у больных, которым проводилась монотерапия глюкокортикостероидами – 65% [17]. Имеются указания на зависимость эффективности иммуносупрессивной терапии от паттерна легочного поражения: у пациентов с КТ-картиной НСИП чаще отмечается положительная динамика легочного поражения в ответ на иммуносупрессивную терапию, тогда как у пациентов с ОИП чаще наблюдается прогрессирование ИЗЛ, несмотря на проводимое лечение, что позволяет провести аналогию с ИЛФ [11].
Нерешенным остается вопрос об эффективности иммуносупрессивной терапии при изолированных АНЦА-ИЗЛ, так как большая часть информации была получена из ретроспективных исследований в неоднородных выборках [12]. В ряде исследований было показано, что прогноз при АНЦА-ИЗЛ достоверно не отличается от такового при ИЛФ (средняя выживаемость – 2,5 и 3,5 года с момента установления диагноза, соответственно), вне зависимости от объема проводимой иммуносупрессивной терапии [47]. И наоборот, другие работы продемонстрировали, что выживаемость пациентов с АНЦА-ИЗЛ занимает промежуточное положение между ИЛФ и ААВ без поражения легких [40]. На основании имеющихся данных в 2019 г. группой исследователей из клиники Мэйо (Рочестер, США) была предложена эмпирическая схема лечения МПО-АНЦА-ассоциированного ИЗЛ (табл. 1) [12].
| КТ-паттерн поражения легких | Клинико-лабораторная картина | Лечение |
|---|---|---|
| Примечание: ГКС – глюкокортикостероиды, ММФ – микофенолата мофетил, АЗА – азатиоприн | ||
| ОИП | Изолированное наличие МПО-АНЦА | Наблюдение + ежемесячное проведение общего анализа мочи для исключения гематурии |
| МПО-АНЦА + повышение уровня воспалительных маркеров | Наблюдение + ежемесячное проведение общего анализа мочи для исключения гематури | |
| МПО-АНЦА и МПА | Стандартная терапия МПА | |
| НСИП | Изолированное наличие МПО-АНЦА | ГКС + ММФ/АЗА |
| МПО-АНЦА + повышение уровня воспалительных маркеров | ГКС + ММФ/АЗА | |
| МПО-АНЦА и МПА | Стандартная терапия МПА | |
В будущем для лечения АНЦА-ИЗЛ могут быть использованы антифибротические лекарственные препараты, такие как пирфенидон и нинтеданиб, замедляющие прогрессирование и улучшающие выживаемость пациентов с ИЛФ. Данное предположение основано на том, что в 2019 г. завершено клиническое исследование, продемонстрировавшее эффективность антифибротической терапии у пациентов с фиброзирующими интерстициальными заболеваниями легких, не соответствующими ИЛФ, включая поражение легких в рамках системных заболеваний соединительной ткани [48]. В настоящее время Французской группой по изучению васкулитов проводится открытое исследование эффективности антифибротической терапии у пациентов с ААВ-ИЗЛ (NCT03385668) [24].
Поражение легких может вносить негативный вклад в долгосрочный прогноз пациентов с МПА. Так, в рядеисследований было выявлено повышение смертности в 2-4 раза в подгруппе пациентов ААВ-ИЗЛ по сравнению таковой у больных ААВ без поражения легких [24]. Средняя продолжительность жизни после установления диагноза ААВ-ИЗЛ составляет 3,5-6 лет при уровне 5-летней выживаемости 29-60%, что лишь незначительно превышает соответствующие значения при ИЛФ [36,37]. Основными причинами смерти при ААВ-ИЗЛ являются инфекционные осложнения, обострение ИЗЛ, а также прогрессирующее поражение легких с развитием терминальной дыхательной недостаточности [11].
В то же время в других исследованиях не было выявлено достоверных отличий между выживаемостью пациентов с ААВ и ААВ-ИЗЛ. Одной из вероятных причин этого может быть относительно короткий период наблюдения [24]. Вместе с тем, в когорте из 504 пациентов с ИЛФ 5- и 10-летняя смертность у АНЦАпозитивных пациентов была достоверно выше (61,3% и 85,7%), чем у АНЦА-негативных (37,6% и 70,5%). В данном исследовании, наличие ПР3-АНЦА (по сравнению с МПО-АНЦА), возраст более 65 лет, а также исходное значение DLCO менее 70% были ассоциированы с повышенной смертностью [25].
Заключение
ИЗЛ является одним из вариантов поражения легких при ААВ, оказывающим негативное влияние на течение и прогноз заболевания. У части пациентов ИЗЛ является первым проявлением болезни, развивающимся до появления других симптомов системного васкулита. Таким образом, исследование уровня АНЦА должно проводиться всем пациентам с идиопатическими интерстициальными пневмониями в рамках дифференциального диагноза.
Обсуждая подходы к терапии и тактику дальнейшего наблюдения, АНЦА-ИЗЛ можно разделить на две основные группы. К первой относятся интерстициальные поражения легких при наличии развернутой картины системного васкулита (как правило, МПА), требующего проведения стандартной иммуносупрессивной терапии и наблюдения ревматологами. Вторую составляют случаи ИИП, установленной в качестве первичного диагноза и сочетающейся с АНЦА. У таких пациентов важно оценить уровень воспалительных маркеров, а также провести активный поиск внелегочных, в том числе субклинических, проявлений ААВ, в частности, поражения почек, нервной системы, кожи, дыхательных путей, суставов. При наличии классификационных критериев ААВ необходимо проводить стандартную иммуносупрессивную терапию. Если данные в пользу ААВ отсутствуют, то назначение иммуносупрессивной терапии зависит от КТ-паттерна поражения легких. В части случаев обсуждается использование антифибротических препаратов.
Учитывая относительную редкость патологии, для получения достоверных данных об ее распространен ности в различных регионах, эффективности иммуносупрессивной и антифибротической терапии, определения оптимальной тактики ведения больных с АНЦА-ИЗЛ, требуется создание международных регистров пациентов и проведение проспективных рандомизированных клинических исследований. Кроме того, для сопоставления АНЦА-ИЗЛ с другими вариантами аутоиммунных поражений легких представляется обоснованным включение АНЦА в серологические критерии интерстициальной пневмонии с аутоиммунными признаками [49].