Изопринозин или виферон что лучше
«Эффективное лечение ВПЧ» — ложь или правда?
Ольга Золоткова СПИД.ЦЕНТР
Вирус папилломы человека — самая распространенная вирусная инфекция, по данным ВОЗ. Она появляется у подавляющего большинства людей, ведущих сексуальную жизнь. Причем российские врачи, в частности гинекологи, регулярно рекомендуют пациентам проверяться на ВПЧ, аргументируя это так: если вирус найдут, то он «эффективно лечится». СПИД.ЦЕНТР объясняет, можно ли вылечить этот вирус на самом деле.
ВПЧ есть у всех?
Особенность этого вируса в том, что он высококонтагиозен, то есть передается как половым путем, так и при простом кожном контакте. Поэтому плохая новость: презервативы совершенно не гарантируют защиту от него. Им инфицируются большинство взрослых и многие дети, но это нестрашно и почти всегда проходит бесследно. В 90—98 % случаев через 1—2 года организм справиться с вирусом сам, в подобных случаях инфекция называется транзиторной.
Но есть и опасности, например, если ВПЧ долгое время находится в женском организме, риск рака шейки матки повышается. По данным ВОЗ, два типа ВПЧ (16 и 18) вызывают до 70 % всех случаев рака шейки матки. Вирус папилломы человека выявляется при скрининге рака шейки матки.
Однако в то же время нет и не может быть термина «ВПЧ-положительный статус» — сегодня вирус обнаруживается, а через несколько месяцев его уже нет. До сих пор лекарства от ВПЧ еще не изобрели, при том что вакцины от некоторых типов давно существуют.
Обзор противовирусных и иммуномодулирующих «лекарств»
В России и странах СНГ гинекологи назначают противовирусную терапию ВПЧ. Схемы лечения громоздкие и дорогостоящие: пациентке вручают список из нескольких препаратов.
по теме
Лечение
«Химия» и жизнь: мифы о раке
Важно понимать, что ни по одному вышеперечисленному препарату нет серьезных и полных исследований — рандомизированных двойных слепых плацебо-контролируемых испытаний. Рекламно-хвалебные публикации и исследования с нерепрезентативными выборками размещены только на сайтах производителей и русскоязычных ресурсах. Кроме стран СНГ, эти средства нигде не зарегистрированы и не применяются.
Многие российские гинекологи утверждают, что препараты с недоказанной эффективностью успешно лечат ВПЧ: анализ на вирус после одного или нескольких курсов становится отрицательным. Но такой результат — не заслуга лечения, он означает, что инфекция была транзиторной и устранилась бы сама, даже без ненужной лекарственной и денежной нагрузки.
Мировая практика
Центр по контролю заболеваний США пишет, что специфическая терапия ВПЧ не рекомендуется. ВОЗ в информационном бюллетене говорит только о необходимости лечения последствий, которые может вызвать ВПЧ: рака шейки матки, анальных или генитальных бородавок. У мужчин онкогенные типы ВПЧ способны провоцировать рак прямой кишки и полового члена.
В современном мире медикаментозной терапии не существует, но большое внимание уделяется вакцинации.
Вакцинация от ВПЧ
Две вакцины прошли клинические испытания и зарегистрированы на рынке:
Препараты очень дорогие (цена одной инъекции составляет около 6 000 — 10 000 рублей), поэтому массовую вакцинацию могут себе позволить только развитые страны.
В идеале должны быть вакцинированы все подростки в возрасте 11—12 лет независимо от пола (два раза в течение полугода) и взрослые до 26 лет (три раза после 14 лет в течение полугода). В российской инструкции к вакцинам рекомендуется трехкратная вакцинация в любом возрасте.
Отдельно стоит упомянуть, что Американский альянс иммунологов рекомендует прививаться от ВПЧ при ВИЧ. Об эффективности вакцинации ВИЧ-положительных девушек говорят ВОЗ, клинические исследования Канадского института исследований здоровья и другие публикации.
Когда нужно сдавать тест на ВПЧ?
Анализ на ВПЧ назначается женщинам после 30 лет при аномальных результатах цитологии или гистологии. Просто так проводить его бессмысленно и затратно. Результаты ПАП-теста вместе с анализом на ВПЧ помогают выбрать правильный интервал до повторного цитологического исследования или кольпоскопии.
Положительный анализ на ВПЧ не означает рак, он лишь позволяет сделать приблизительный прогноз; к тому же вирус — не единственный фактор риска рака шейки матки.
Тест на ВПЧ не должен использоваться массово — это дополнительный (и дорогостоящий) метод скрининга.
Итог:
Доказанной противовирусной терапии ВПЧ не существует, как и лекарств, укрепляющих иммунитет.
Лечат не ВПЧ, а его последствия: предраковые состояния и рак шейки матки, новообразования на коже и слизистых. Лечение не медикаментозное, а хирургическое: лазер, криодеструкция, операция.
Сдавать анализ на ВПЧ всем подряд не нужно.
Часто болеющие дети: оптимизация программы лечения
Э.Н. Симованьян, В.Б. Денисенко, А.В. Григорян
ГОУ ВПО «Ростовский государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию», Ростов-на-Дону, РФ
Обследованы 78 часто болеющих детей в возрасте от 3 до 6 лет с хронической Эпштейна-Барр вирусной инфекцией. Микст-инфекция вируса Эпштейна-Барр с цитомегаловирусом и/или вирусом простого герпеса характеризовалась высокой частотой факторов риска в антенатальном и постнатальном периодах, бактериально-грибковых микст-инфекций, поражения нижних дыхательных путей и легких, проявлений лимфопролиферативного, церебрального и гастроинтестинального синдромов, глубокими нарушениями Т-клеточного, В-клеточного звеньев иммунитета, метаболизма нейтрофилов. У пациентов с хронической Эпштейна-Барр моноинфекцией обнаружены поражение верхних дыхательных путей, выраженные кардиальный и артралгический синдромы, активация В-клеточного звена иммунитета. Лечение с использованием инозина пранобекс (изопринозина) и рекомбинантного интерферона α2b (виферона) приводило к торможению репликации герпесвирусов, модуляции показателей клеточного и гуморального иммунного ответа, нормализации метаболической активности нейтрофилов, уменьшению частоты респираторных инфекций и симптомов хронической Эпштейна-Барр вирусной инфекции.
Материалы и методы исследования
Результаты и их обсуждение
При герпесвирусной микст-инфекции изменения иммунного статуса затрагивали, прежде всего, клеточное звено. На фоне умеренного увеличения количества CD8- и HLA DR-лимфоцитов отмечалось значительное снижение содержания Т-хелперов, клеток с маркерами ранней активации (CD25) и повышение экспрессии CD95-рецептора. Со стороны В-клеточного звена регистрировались умеренное снижение содержания CD20, увеличение IgA, IgM, IgG и ЦИК. Наблюдалось значительное угнетение метаболической активности нейтрофилов и ее резервных возможностей.
Побочные эффекты при использовании инозина пранобекс (изопринозина) отсутствовали.
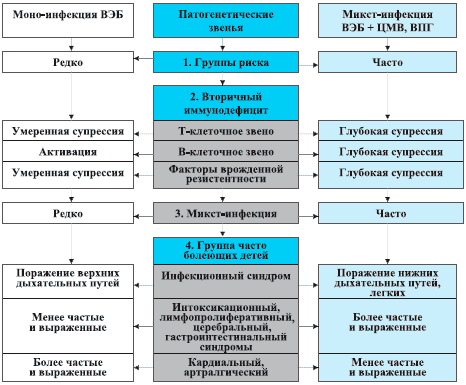
Рис. 1. Иммунопатогенез формирования группы часто болеющих детей с хроническими герпесвирусными инфекциями.
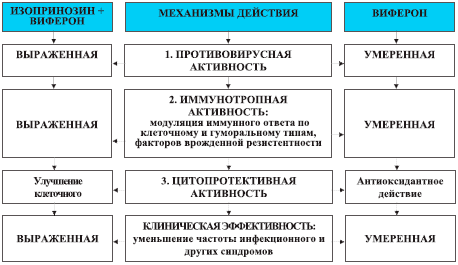
Рис. 2. Механизмы этиопатогенетического действия комбинации инозина пранобекс (изопринозина) и рекомбинантного интерферона- α2b (виферона) у часто болеющих детей с хроническими герпесвирусными инфекциями.
Выводы
1. В формировании группы ЧБД важную роль играют хронические герпесвирусные инфекции, которые приводят к развитию вторичного ИДС с преимущественным повреждением В-клеточного звена при моноинфекции ВЭБ или с сочетанным нарушением иммунного статуса при микст-инфекции (ВЭБ + ЦМВ, ВПГ).
2. Прогрессирование иммуносупрессии ведет к возникновению полиорганной патологии, которая включает инфекционный, интоксикационный, лимфопролиферативный, церебральный, гастроинтестинальный, кардиальный, артралгический синдромы и выражена в большей степени при микст-инфекции.
3. Сочетанное пролонгированное назначение инозина пранобекс (изопринозина) и рекомбинантного ИФНα2b (виферона) приводит к торможению репликации герпесвирусов, восстановлению нарушенных показателей иммунного статуса, уменьшению частоты инфекционного синдрома и других клинических проявлений.
4. Высокая эффективность предложенной программы терапии позволяет рекомендовать ее включение в стандарт лечения и реабилитации ЧБД с хроническими герпесвирусными инфекциями.
Сравнение эффективности противовирусных препаратов для лечения вируса Эпштейна-Барра у часто болеющих детей школьного возраста
Тверской государственный медицинский университет
Введение. Вирус Эпштейна-Барра (ВЭБ) является одним из самых распространённых вирусов человека. В США примерно у половины всех пятилетних детей и от 90 до 95% взрослых есть доказательства перенесённой инфекции [1].
Клинические проявления ВЭБ разнообразны: хроническая активная ВЭБ-инфекция по типу хронического инфекционного мононуклеоза; генерализованная форма хронической активной ВЭБ-инфекции с поражением центральной нервной системы (ЦНС), миокарда, почек и др.; ВЭБ-ассоциированный гемофагоцитарный синдром; стертые или атипичные формы ВЭБ-инфекции: длительный субфебрилитет неясного генеза, клиника вторичного иммунодефицита — рецидивирующие бактериальные, грибковые, часто микст-инфекции респираторного и желудочно-кишечного тракта, фурункулез и другие проявления [1, 2].
Описано влияние ВЭБ, как фактора способного вызвать иммунокомпроментацию и увеличить частоту респираторных заболеваний у детей [3].
В детском возрасте инфекционные заболевания верхних дыхательных путей являются наиболее распространенной причиной обращения к врачу первичного звена. При этом отдельно выделяют категорию часто болеющих детей (ЧБД), представляющую собой особую группу диспансерного наблюдения 3. Именно на детей данной диспансерной группы приходится до 75% всех обращений по поводу респираторных заболеваний [4].
Таким образом, изучение влияния носительства ВЭБ на частоту респираторных заболеваний у ЧБД является актуальной медико-социальной задачей.
Для лечения ВЭБ у часто болеющих детей активно используется назначение иммунокорректоров [4, 7]. Однако большинство исследований, посвященных этой теме, отличаются отсутствием групп сравнения, использованием некорректных статистических методов, нередко носят рекламный характер.
Нами не найдено работ, посвященных сравнительной оценке эффективности различных иммунокорригирующих препаратов, применяемых для лечения ВЭБ у часто болеющих детей школьного возраста, что и послужило основанием для данной работы.
Цель исследования. Оценить эффективность различных противовирусных препаратов, для лечения вируса Эпштейн-Барра у часто болеющих детей школьного возраста.
Все участники исследования были осмотрены врачом аллергологом-иммунологом. Все обследованные относили к диспансерной группе часто болеющих.
Дети были отнесены к группе ЧБД в соответствии с критериями, предложенными В.Ю. Альбицким в 2003 г., согласно которым к ЧБД относятся дети, переносящие 4 и более инфекционных заболеваний верхних дыхательных путей в год [4].
У всех было выявлено носительство ВЭБ методом полимеразно-цепной реакции (ПЦР) (мазок со слизистой зева).
Часто болеющие дети были разделены на 3 группы.
Группа 1 – получали препарат циклоферон в таблетках в возрастной дозировке – 34 ребенка: мальчиков 16 (47%), девочек – 18 (53%), средний возраст – 9,5±2,3 лет.
Группа 2 –получали изопринозин в таблетках, 10 дней в возрастной дозировке – 32 ребенка: мальчиков 15 (46.8%), девочек – 17 (53,2%), средний возраст – 9,9±1,9 лет.
Группа 3 – получали виферон в свечах, в возрастной дозировке – 33 ребенка: мальчиков 15 (45.5%), девочек – 18 (54,5%), средний возраст – 8,8±2,1 лет.
Контрольную группу составили 45 детей, болеющих эпизодически и не являющихся носителями ВЭБ: мальчиков 22 (48.9%), девочек – 23 (51,1%), средний возраст – 9,4±2,2 лет.
Статистически значимых различий по возрасту и полу в выделенных группах не было.
Критериями исключения из исследования явились невозможность или нежелание родителей ребенка дать информированное согласие на участие в исследовании, использование иммунокорригирующих препаратов в лечении обследуемых в течение последних 6 месяцев до начала исследования и наличие подтвержденного первичного иммунодефицита.
Для соблюдения принципа анонимности в соответствии с Хельсинской декларацией 1983 г. о правах пациента всем участникам исследования присваивался порядковый номер.
Лабораторное обследование проводилось до и через 25-30 дней после иммунокоррекции.
Проводилась оценка параметров иммунного статуса, определялось носительство ВЭБ на слизистых методом ПЦР.
Для оценки показателей иммунной системы использовались следующие лабораторные методы: 1) фенотипирование иммунокомпетентных клеток по кластерам дифференцировки (CD): CD3, CD4, CD8, CD16, CD19 на проточном цитофлюориметре «Coulter Epix XL» (США) с применением диагностических наборов фирмы «Immunotech» (Чехия); 2) определение концентрации сывороточных иммуноглобулинов (Ig): M, G, A на иммуноферментном анализаторе «Alisei Q.S.» (Италия), с использованием диагностических наборов фирмы Bender MedSystems (Австрия); 3) оценка функциональной активности нейтрофилов микроскопически по количеству (в %) диформазан-положительных нейтрофилов в спонтанном и стимулированном зимозаном тесте восстановления нитросинего тетразолия (НСТ-тест). Полученные лабораторные данные ЧБД сравнивали с нормальными параметрами, определенными при обследовании здоровых детей на территории Тверской области (контрольная группа – 45 человек, средний возраст 9.8±2.2)).
Носительство ВЭБ подтверждалось методом ПЦР. Выполнено на анализаторе: «Комплекс программно-аппаратный для проведения ПЦР реакций «БИОМС-01», с использованием набора реактивов, производства ЗАО «Вектор-Бест», Россия.
Для статистической обработки данных применяли пакеты программ Statistica 10 и StatGraphics Centurion 16.1. Использовались непараметрические методы оценки количественных признаков: критерий Мана-Уитни и критерий Уилкоксона. Изучаемые количественные показатели в работе представлены в виде M±m, где M – значение средней арифметической, а m – стандартное отклонение.
Полученные результаты и их обсуждение. Показатели иммунного статуса у ЧБД с носительством ВЭБ и у детей контрольной группы представлены в табл. 1.
Таблица 1. Показатели иммунного статуса у ЧБД с носительством ВЭБ и у детей контрольной группы
Иммуномодуляторы в терапии и профилактике респираторных и герпесвирусных инфекций
Вирусы гриппа и герпеса вызывают эпидемии и пандемии среди людей. Они поражают различные органы, могут персистировать в клетках нервной и иммунной систем, вызывая развитие вторичной иммунологической недостаточности. Развивается дисбаланс систем Ти В-клеточного иммунитета, нарушается синтез эндогенных интерферонов. Инозин пранобекс (Гроприносин ® ) обладает доказанной противовирусной и иммуномодулирующей активностью. В обзоре литературы обсуждается эффективность препарата в лечении и профилактике респираторных инфекций и герпеса у детей и взрослых.
Грипп и другие острые респираторные вирусные инфекции
Грипп и другие острые респираторные вирусные инфекции (ОРВИ) по социальной значимости и ущербу здоровью населения и экономике страны находятся на первом месте среди болезней человека. Ежегодно в России гриппом и ОРВИ заболевают до 40 млн человек, а экономические потери достигают 100 млрд руб. в год [1]. На территории нашей страны циркулируют три вируса гриппа: A(H1N1)pdm09, А(H3N2), грипп В. В структуре других респираторных вирусов преобладают вирусы парагриппа, риносинтициальные (РС) вирусы и аденовирусы. Вирус гриппа А(Н1N1)pdm обладает пневмотропностью и нейровирулентностью и низкой иммуногенной активностью, что объясняет возможность тяжелого течения инфекции у лиц с сохранным иммунитетом, длительное персистирование вируса гриппа в клетках респираторного тракта и поражение нервной системы. При гриппе А(H1N1)pdm описано поражение межреберных нервов, которое сопровождалось нарушением функции межреберных мышц, вызывавшим усугубление дыхательной недостаточности и нередко служившим причиной ранней интубации и искусственной вентиляции легких, а также смерти [2].
Более 250 различных РНК- и ДНК-содержащих вирусов вызывают ОРВИ, которые всегда сопровождаются воспалением различных отделов респираторного тракта и проявляются риносинуситом, фарингитом, ларингитом, трахеобронхитом, обострением бронхиальной астмы (БА) или хронической обструктивной болезни легких (ХОБЛ) Нередко регистрируются вирусно-вирусные или вирусно-бактериальные ассоциации, которе могут привести к более выраженному угнетению местного и общего иммунитета и развитию бактериальных суперинфекций, в том числе внебольничной пневмонии, которые удлиняют течение заболевания и являются основной причиной инвалидизации и смерти больных [3,4].
Тяжесть течения гриппа прямо связана с его вирулентностью, которая обусловливает разнообразие клинических форм инфекции. Грипп характеризуется уникальным меха низмом развития иммуносупрессии, обус лов ленной впервые описанной транскрип цией сегмента 3 вируса гриппа со второй открытой рамки считывания (“X-ORF») [6]. Экспериментально показано, что первичная гриппозная инфекция усиливает колонизацию пневмококками носоглотки мышей и способствует их дальнейшему распространению в легкие [4].
Вирусы являются обязательными внутриклеточными генетическими инфекционными агентами. Весь репликативный цикл вируса осуществляется с использованием метаболических и генетических ресурсов клеток, поэтому патогенез вирусных инфекций следует рассматривать на молекулярном и клеточном уровнях. Вместе с тем, инфекционный процесс, вызванный вирусами, развивается в пределах того или иного органа или ткани, так как большинство вирусов обладают достаточно высокой органной или тканевой тропностью. В связи с этим развитие внутритканевых процессов при вирусных инфекциях определяется, с одной стороны, цитопатическим действием вируса на клетки данной ткани и органа, а с другой стороны, реакцией внутритканевых и органных систем защиты. Понимание патогенеза вирусных инфекций важно для создания рациональных схем лечения, включающих сочетание противовирусной этиотропной химиотерапии, иммунотерапии и симптоматического лечения [7,10].
При тяжелых и осложненных формах гриппа и других ОРВИ отмечаются длительная транзиторная Т-клеточная иммуносупрессия, снижение функциональной активности натуральных киллеров, фагоцитарной и метаболической активности нейтрофилов периферической крови, продукции эндогенных интерферонов, накопление продуктов перекисного оксиления липидов (ПОЛ) [1,5,7]. Вирусы гриппа и герпеса оказывают супрессивное действие на клеточный иммунитет и систему интерферонов. Это во многом определяет возможность развития бактериальных осложнений, обострения хронических заболеваний органов дыхания и сердечно-сосудистой системы, затяжного течения инфекции и персистирования респираторных вирусов.
Доказано длительное бессимптомное персистирование вируса гриппа А в организме человека [3,8]. Использование нами (совместно с проф. А.А. Соми ни ной) полимеразной цепной реакции и иммуноферментной тест-системы с моноклональными антителами 1С6 к нуклеопротеиду вируса гриппа А позволило выявлять антигены сезонного вируса гриппа А(H1N1) в лейкоцитах крови и носовых секретах в течение от 3-х недель до 1,5-3 месяцев после перенесенного заболевания [9]. На основании этих данных можно сделать два важных вывода. Во-первых, больные острой гриппозной инфекцией эпидемиологически опасны не менее 2-3 недель. Во-вторых, результаты исследований обосновывают пересмотр нашей прежней тактики назначения ремантадина в первые 2-3 дня болезни. Считаем возможным использование у таких больных противогриппозных препаратов с прямым механизмом действия не только в первые дни, но и в период разгара заболевания (в более поздние сроки болезни) совместно с другими препаратами, обладающими противовирусной и иммуномодулирующей активностью, патогенетическими средствами [3]. Нередко, особенно при тяжелом гриппе, отмечаются лейкопения, лимфопения и нейтропения, наиболее выраженные в конце 1-й недели болезни.
Диагностика и прогнозирование тяжести течения гриппа и ОРВИ имеют важное значение для выбора тактики лечения больных. Интересный подход предложен в работе по проспективной оценке типа “ответа на возбудитель» и его ассоциации с тяжестью и длительностью заболевания у больных гриппом A H1N1pdm2009 (pH1N1) в период эпидемий 2009–2010 гг. и 2010–2011 гг. Авторы проводили изучение РНК транскриптома цельной периферической крови, различных иммунологических медиаторов в сыворотке крови и носовых смывах, а также количественную оценку числа копий бактериальной 16S рРНК в мазках из зева пациентов и здоровых людей [11]. По тяжести течения гриппа пациенты на момент госпитализации были разделены на три группы: 1-я – без дополнительного введения кислорода; 2-я – кислородная маска; 3-я – ИВЛ. У пациентов первых двух групп наблюдали доминирование “ответа на вирус» с активацией транскриптома ответа на интерфероны (ИФН) I и II типов. В то же время у пациентов третьей группы был выражен “ответ на бактерии» с преобладанием маркеров воспаления, клеточного стресса/апоптоза и активации нейтрофилов, независимо от наличия или отсутствия повышенной бактериальной обсемененности в образцах мазков из зева, что сопровождалось менее благоприятным течением, большей длительностью заболевания, а также смазанным “ответом на вирус» на ранних сроках заболевания.
Полагаем, что более благоприятное течение гриппа ассоциировано с ранней активацией “ответа на вирус» и усиленной экспрессией генов-мишеней ИФН I типа, что может обосновывать применение препаратов рекомбинантных человеческих ИФН и их индукторов при легком и среднетяжелом течении гриппа [11,12]. Следовательно, для лечения ОРВИ и герпесвирусных инфекций (ГВИ) необходимо применение препаратов, оказывающих влияние как на вирус, так и на иммунитет. Минздрав России в комплексной терапии гриппа рекомендует сочетанное использование специфических противогриппозных средств (ремантадин, осельтамивир и др.) либо препаратов с прямым механизмом действия совместно с индукторами интерферонов – препаратами с противовирусной и иммуномодулирующей активностью [13,14]. Следует отметить, что ингаляции занамивира могут вызывать бронхоспазм на фоне бронхообструктивных заболеваний (ХОБЛ, БА). В России и за рубежом разрабатываются новые препараты против гриппа [3,15].
Использование препаратов с разнонаправленным механизмом действия обеспечивает синергидный эффект, снижает риск развития осложнений и формирования резистентных штаммов вирусов. Такая тактика способствует восстановлению иммунного ответа, сокращению сроков болезни [7,14,16]. Эффективность имму но модуляторов в лечении и профилактике ОРВИ у взрослых и часто болеющих детей подтверждена в ряде клинических исследований [17,18,19].
Герпес
Наряду с гриппом и ОРВИ важной проблемой современного здравоохранения является высокая заболеваемость герпесвирусными инфекциями (ГВИ). Это обусловлено широкой распространенностью герпесвирусов (ГВ) среди людей и способностью поражать различные органы и системы человека, что позволяет рассматривать ГВИ как системное заболевание. ГВ могут вызывать латентную, острую, хроническую и медленную формы инфекции.
Семейство Herpesviridae включает 8 антигенных серотипов ДНК содержащих вирусов, вызывающих заболевания у людей. В 2012 г. 3,7 (67%) из 6 млрд населения Земли перенесли простой герпес с поражением различных органов [20]. ВОЗ объявила о пандемии ГВИ в мире, что подчеркивает медико-социальное значение проблемы [21]. ГВИ являются одной из СПИД-индикаторных инфекций [10,22]. Ухудшение экологии и социального положения людей, миграция населения и, как следствие этого, угнетение защитных сил организма способствовали существенному увеличению числа больных герпесом в России. Считают, что на территории России и СНГ различными формами ГВИ ежегодно страдают около 20 млн человек. Рецидивы герпеса встречаются у 2-15% больных, в том числе у 50% онкологических больных и пациентов старше 50 лет и 100% пациентов со СПИДом [23,24]. Анализ заболеваемости ГВИ в России и наши расчеты показывают, что в Санкт-Петербурге на 5 млн жителей у 15% взрослого населения (до 370000 человек) имеется герпетическое поражение кожи и слизистых оболочек. Генитальный герпес (ГГ) встречается у 230000 взрослого населения, заболевания нервной системы, обусловленные ГВ, – у 20000-23000, офтальмогерпес – у 8000. При этом в 1430% случаев длительно сохраняются остаточные явления (вплоть до инвалидизации), а летальность достигает 5-70% в зависимости от клинической формы поражения ЦНС. Герпетические и аденовирусные поражения глаз протекают наиболее тяжело и требуют длительного лечения [10,25].
Рецидивирующий ГГ развивается у сексуально активных людей молодого и среднего возраста, чаще в группах риска, в том числе у проституток, гомосексуалистов, а также лиц, имеющих многочисленных и случайных половых партнеров [26,27]. При ГГ рецидивы заболевания возникают в 50-75% случаев, что значительно выше частоты обострения при экстрагенитальной локализации инфекции. По нашим данным, ГГ в 76% случаев был обусловлен вирусом простого герпеса 2 типа (ВПГ)-2 и в 24% – ВПГ-1, причем моноинфекция, вызванная ГВ, наблюдалась лишь у 24-27% больных [10,28].
В Москве за последние годы заболеваемость ГГ увеличилась в 6 раз, а в Московской области – в 2 раза, причем в 30% случаев причиной его был ВПГ-1, который, в отличие от ВПГ-2, вызывает стертое течение инфекции [26,29]. Важно отметить, что бессимптомное (субклиническое) течение ГВИ представляет угрозу инфицирования полового партнера. В процессе репликации ВПГ может инфицировать половые клетки и нарушать сперматогенез, что в конечном счете проявляется нарушением генетического аппарата гамет. Не исключено также встраивание вирусной ДНК в геном гамет [23,30].
Большое значение имеют нейрогенный и гематогенный пути распространения ВПГ. ГВ не только персистируют, но и репродуцируются в клетках иммунной системы, обусловливая гибель или снижение функциональной активности этих клеток, что способствует развитию вторичных иммунодефицитных состояний (или вторичной иммунологической недостаточности), поддерживающих длительное персистирование вируса. При нарушении иммунного статуса ГВИ развивается чаще и характеризуется более тяжелым течением, что связано с недостаточностью иммунитета или избыточной иммунной реакцией. Таким образом, возникает своеобразный “порочный круг» [10,31].
Доказано, что при рецидивирующей ГВИ, обусловленной ВПГ-1/2, снижены общее число CD3+ и CD4+ клеток и иммунорегуляторный индекс, угнетена активность ЕК-клеток и антителозависимая клеточная цитотоксичность, а также способность лимфоцитов к синтезу эндогенных ИФН-α/β и ИФН-g. Т-клетки, в том числе Т клетки-памяти, ЕK-клетки и цитотоксические лимфоциты – основные участники противовирусных реакций, поэтому многие вирусы приобрели механизмы, позволяющие избегать распознавания их антигенов эффекторными клетками либо модулировать активность последних [10,32]. В фазе рецидива герпеса показано усиление окислительно-восстановительного потенциала нейтрофилов, повышение уровня циркулирующих иммунных комплексов и снижение содержания катионных белков, свидетельствующее об их активном вовлечении в защитные реакции организма [24,33,34].
В 2006-2008 гг. в РФ заболеваемость ветряной оспой у детей составила 58-28 на 100 тыс. детского населения [35]. По данным годовой статистики за 2010 г. можно говорить об эпидемии ветряной оспы в Санкт-Петер бурге и Ленинградской области: в Санкт-Петербурге заболеваемость среди детей до 14 лет составила 4709,7, в Ленинградской области среди детей до 17 лет – 3551,0 на 100 тыс. детей соответствующего возраста [35]. При ветряной оспе у детей в 27,5% случаев развиваются неврологические осложнения, среди которых 2,3% связано с поражением периферической, а 97,7% – центральной нервной системы (доля энцефалита достигает 70,5%). Ветряная оспа у детей протекает с системным дисбалансом иммунной системы со значительной продукцией как провоспалительных (интерлейкин [ИЛ]-1β, ИЛ-6, ИФН-g, ИФН-α, ИЛ-8), так и противовоспалительных (ИЛ-4 и ИЛ-10) цитокинов [36]. Ко-факторами формирования постгерпетической невралгии могут быть пожилой возраст (старше 60 лет), тяжелое течение болезни, локализация высыпаний в области головы, наличие сопутствующих заболеваний, наличие ДНК вируса ветряной оспы в крови на 4-й неделе болезни, снижение уровней sCD95 и sCD54 в 1,5-2 раза по сравнению с контрольными показателями [37].
В настоящее время вирус Эпштейна-Барр (ВЭБ) – один из самых распространенных ГВ у населения всего земного шара. ВЭБ представляет собой лимфотропный ДНС-содержащий вирус человека, особенностью которого является способность вызывать не гибель клеток, в которых происходит его репродукция, а, напротив, их патологическую пролиферацию. Обладает тропизмом к В-лимфоцитам и способен к длительному персистированию в них. ВЭБ может вызывать острую, или литическую (инфекционный мононуклеоз, гемофагоцитарный синдром, ассоциированный с ВЭБ, синдром ДжаноттиКрости), и непродуктивную (латентную) инфекцию. В сыворотке крови взрослых больных инфекционным мононуклеозом, обусловленным ВЭБ [38]:
Подробно молекулярные аспекты патогенеза ВЭБинфекции изложены ранее [39].
Таким образом, при ГВИ угнетены и разбалансированы системы Т- и В-клеточного иммунитета. Вместе с тем, наблюдается функциональная неполноценность системы неспецифической резистентности организма. Выявленные нарушения в иммунном гомеостазе регистрируются в фазе рецидива и ремиссии заболевания, тем самым во многом предопределяя и объясняя длительное персистирование в организме человека и рецидивирующее течение болезни. Вышеизложенные обстоятельства должны учитываться практическими врачами при лечении больных рецидивирующими ГВИ [10,23,34,40].
Перспективы лечении гриппа и герпеса
В лечении среднетяжелого и осложненного гриппа А(H1N1)pdm Минздрав России рекомендует сочетанное использование специфических противогриппозных средств либо препаратов с прямым механизмом действия совместно с индукторами интерферонов. Такой подход обеспечивает синергидный эффект, снижает риск формирования резистентных штаммов вирусов, развития осложнений. При этом восстанавливается эффективный иммунный ответ, сокращаются сроки выздоровления при остром заболевании и быстрее наступает клинико-иммунологическая ремиссия при хроническом его течении. В лечении гриппа и других ОРВИ и герпеса обосновано использование иммуномодуляторов, обладающих противовирусной и иммуномодулирующей активностью [1,13,41,42], которые могут ускорить разрешение воспалительного процесса, ограничить избыточную активацию Т-клеток и/или способствовать переходу на новый цитокиновый профиль, например, с Th-2 на Th-1 тип иммунного ответа у детей и лиц с аллергическими заболеваниями, что является оптимальным для выздоровления [43,44].
Считаем важной инициативу ВОЗ по борьбе с ОРВИ (BRaVe) [45], в которой указано, что “существующие фармакологические вмешательства представлены в основном вакцинами и противовирусными препаратами против гриппа». Поэтому необходимо “…расширение вариантов лечения ОРВИ с разработкой эффективных противовирусных препаратов для наиболее значимых патогенов и/или безопасных и эффективных модификаторов биологических реакций». Для реализации инициативы ВОЗ в отношении гриппа возможно применение стратегии “repurposing/host-directed therapy» (перенаправление поиска/терапия через метаболизм хозяина), которая предполагает использование одобренных по иным показаниям лицензированных препаратов, способных влиять на узловые белки клеток человека, особенно важных для реализации жизненного цикла вируса [45].
Определенные трудности связаны с лечением больных рецивирующими ГВИ. Мы придаем большое значение подбору оптимальных лекарственных форм и схем лечения, последующему диспансерному наблюдению. Клинический опыт применения противогерпетических химиопрепаратов (ацикловира, валацикловира, фамцикловира) показал, что, быстро купируя острые проявления инфекции, они не снижают частоту и тяжесть рецидивов герпеса. Поэтому для повышения эффективности лечения в схемы терапии необходимо включать иммунобиологические препараты (ИФН, индукторы ИФН, вакцины), способствующие коррекции иммунологического статуса больного, а также патогенетические средства, облегчающие состояние пациента [28,46,47,48]. Таким образом, больные с рецидивирующими ГВИ требуют лечения в остром (рецидив) и межрецидивном (ремиссия) периодах болезни. Изложенные выше общие принципы терапии предопределяют комплексный системный подход к лечению больных РГИ, объединенный в 4 взаимосвязанных между собой этапа [10,28]. Лечение мы проводим под тщательным клинико-иммунологическим контролем, подбирая индивидуальную терапию больному.
Иммуномодуляторы – лекарственные средства, обладающие иммунотропной активностью, которые в терапевтических дозах восстанавливают функции иммунной системы (эффективную иммунную защиту) [23,34]. Показанием для назначения иммуномодуляторов является наличие клинических признаков иммунной недостаточности (хронический инфекционно-воспалительный процесс, отсутствие эффекта от стандартной фармакотерапии). Иммуномодуляторы часто назначают вместе с этиотропной терапией, например, у часто и длительно болеющих пациентов. Иммуномодуляторы в этих случаях применяют с целью предупреждения развития постинфекционных осложнений. Назначение иммуномодуляторов предпочтительно больным, которые находятся в пролиферативной фазе иммунного ответа, либо по указанным выше показаниям [49,50].
Гроприносин® (инозин пранобекс компании “Гедеон Рихтер») – иммуностимулирующий препарат с противовирусной активностью, который представляет собой комплекс инозина с димепранолом и ацедобеном и зарегистрирован в странах Европы и Российской Федерации. Эффективность комплекса определяется присутствием инозина, второй компонент повышает его доступность для лимфоцитов [51,52,53]. Инозин пранобекс сочетает в себе свойства универсального иммуномодулятора с прямой противовирусной активностью в отношении широкого спектра ДНК- и РНКвирусов (гриппа А и В, парагриппа, риновирусов и аденовирусов, вирусов простого герпеса, ветряной оспы, инфекционного мононуклеоза). Выпускается в таблетках по 500 мг, которые назначают после еды 3-4 раза в сутки.
В зараженной вирусом клетке инозин пранобекс связывается с рибосомами и вызывает изменения их конфигурации. Клеточная РНК получает преимущества перед вирусной РНК в конкуренции за места связывания на рибосомах. Вирусная РНК транслируется неправильно или образуется нетранслируемая вирусная РНК. В итоге подавляется репликация вируса, а сниженная скорость транскрипции РНК лимфоцитов повышается. Иными словами, инозин пранобекс обладает двойным механизмом противовирусного действия: подавляет репликацию ДНК и РНК вирусов и активирует противовирусный иммунитет. Иммуномодулирующий эф фект при применении Гроприносина® проявляется активацией системы комплемента, синтеза эндогенного ИФН-α и усилением гуморального иммунного ответа (повышение синтеза антител). При наличии вторичного клеточного иммунодефицита отмечается тимозиноподобное действие препарата: усиление дифференцировки и пролиферации Т-лимфоцитов, регуляция соотношения субпопуляций хелперных и супрессорных клеток, повышение функциональной активности Т-лимфоцитов и синтеза интерлейкина-2, активация ЕК-клеток и фагоцитоза [20,52,53].
Доказана высокая безопасность Гроприносина®. Он не обладает антигенностью, не вызывает передозировку и гиперстимуляцию иммунитета (обеспечивает физиологичный иммунный ответ). Препарат не токсичен, хорошо переносится даже при длительных курсах терапии. Совместим с антибиотиками, ИФН и другими лекарственными препаратами. Поэтому назначение Гроприносина® возможно без каких-либо специальных иммунологических исследований. Его можно включать в схему лечения, основываясь на клинической симптоматике и применять у пациентов всех возрастных групп (у детей с 3-х лет).
Противопоказан при подагре, мочекаменной болезни, аритмии, гиперчувствительности к препарату, во время беременности и кормления грудью (безопасность применения не установлена).
Инозин пранобекс в лечении гриппа и ОРВИ. У взрослых применяют в дозе 50 мг/кг/сут (обычно по 1 г 3 раза в день) в течение 5-14 дней, для поддерживающего лечения – по 1 г 3 раза в сутки 3 раза в неделю в течение 4 недель. У детей в возрасте от 3 до 12 лет лечебная суточная доза составяет 50 мг/кг (в среднем 1 г на 10 кг массы тела 3 раза в день) в течение 5-7 дней. Возможны другие схемы использования Гроприносина® [14,54]. Схемы терапии инозином пранобексом часто и длительно болеющих ОРВИ и гриппом взрослых и детей представлены в табл. 1.
| Период | Режим приема | Суточная доза | Курс терапии | Рекомендуемая форма выпуска |
|---|---|---|---|---|
| Взрослые | ||||
| Острый | 2 табл. 3 раза в день | 3 г | 5-14 дней, до исчезновения симптомов | 5 дней – №30, 6-14 дней – №50 |
| Поддерживающий | 1 табл. 2 раза в день | 1 г | 5-10 дней, перерыв 8 дней, 2-3 курса | 5 дней – №30, 6-10 дней – №50 |
| Дети | ||||
| Острый | 50 мг/кг/сут в 3 приема | 50 мг/кг | 5-14 дней, до исчезновения симптомов | 5 дней – №20, 6-10 дней – №30 |
| Поддерживающий | 1 табл. 1 раз в день | 500 мг | 5-10 дней, перерыв 8 дней, 2-3 курса | 5 дней – №20, 6-10 дней – №30 |
В сравнительном исследовании у 58 часто болеющих детей с подтвержденной ГВИ инозин пранобекс по эффективности (77%) превосходил ацикловир (50%), умифеновир (33%) и меглюмина акридонацетат (30%). При лечении смешанных ГВИ в настоящее время препаратом выбора считают инозин пранобекс [55]. В проспективном сравнительном рандомизированном много центровом открытом наблюдательном исследовании ГОРИЗОНТ принимали участие 103 практикующих врача из 92 лечебных учреждений в 19 городах России. В исследование были включены 1047 пациентов, часто и длительно болеющих ОРВИ и/или ГВИ, у которых сравнивали эффективность Гроприносина® и общепринятой терапии [56]. Пациенты основной группы получали Гроприносин® в таблетках по 500 мг (схемы выбирали с учетом диагноза), контрольной – разные противовирусные препараты, в том числе ацикловир, валацикловир, имидазолил этанамид, умифеновир, ремантадин. В основной группе эффективность лечения была выше (97,7%), чем в контрольной (79,6%, р Гроприносин® в лечении и профилактике рецидивов герпеса. Многочисленными исследованиями отечественных и зарубежных авторов убедительно доказана высокая эффективность и безопасность инозина пранобекса в лечении и иммунореабилитации больных с рецидивирующим герпесом и папилломавирусными урогенитальными инфекциями [10,47,53,59-62]. При назначении Гроприносина® происходит быстрое купирование клинических проявлений герпеса (зуда, воспаления и отечности), достоверно уменьшается количество рецидивов и частота выделения ВПГ, устраняются иммунные нарушения, вызванные вирусной инфекцией, и “скрытые» иммунодефицитные состояния [59,61]. Инозин пранобекс, в отличие от других иммуномодуляторов, имеет наиболее высокий уровень доказательности исследований (уровень А) [53,60,61]. Препарат обладает определенными преимуществами по сравнению с интерферонами и их индукторами, полиоксидонием. Показано качество иммуномодуляции со стимуляцией преимущественно клеточного иммунитета. Инозин пранобекс (Гроприносин®) не обладает антигенностью и не вызывает аутоиммунных реакций.
Для купирования рецидива герпеса необходимо в самом начале обострения с учетом его тяжести назначать максимальную дозу препарата (3-4 г/сут в 3-4 приема взрослым), а не ограничиваться малыми дозами. Лечение продолжают до исчезновения высыпаний на коже (обычно 5-7 дней), а затем еще в течение 2 дней, т.е. в целом 7-9 дней. Для постоянного супрессивного лечения Гроприносин® применяют в дозе 3-4 г/сут в 3-4 приема в течение 5-7 дней, а затем по 1 г/сут (в один прием в первой половине дня). При тяжелом течении инфекции длительность поддерживающей терапии составляет 6-12 мес, при среднетяжелой – 3 мес, при легкой – 1 мес. Если во время приема иммуномодулирующей дозы возникает очередной рецидив ГВИ, пациенту вновь назначают максимальную дозу препарата.
П.С. Русакевич и соавт. [61] обследовали (кольпоскопия, гистологическое исследование, иммунограмма и др.) 232 женщины в возрасте 30,1±8,8 года с различной патологией шейки матки. У 121 из них выявили инфекцию, вызванную ВПГ или вирусом папилломы человека. Эти пациентки составили основную группу и дополнительно получали иммуномодулирующую терапию Гроприносином®. В контрольную группу вошли 30 пациенток с идентичной патологией шейки матки, которым назначали иммуномодулирующую терапию. В период ремиссии рецидивирующего ГГ назначали супрессивную терапию Гроприносином® по 1 г/сут в один прием на протяжении от 2 до 6-12 месяцев с обязательным удалением очага на шейке матки путем радиоволновой аблации/эксцизии. В отдельных случаях при наличии активности герпетической инфекции препарат применяли по 1 г 3 раза в день в течение 5–7 дней в виде монотерапии или в комбинации с противовирусными препаратами. Суммарная эффективность этапной терапии с использованием в качестве иммуномодулятора Гроприносина® составила 97,2±1,6% при ВПГ-инфекции, 83,8±3,4% − при инфекции, вызванных вирусом папилломы человека, и 78,2±1,6% − при сочетанных вирусных поражениях цервикса [61].
резистентности организма. Инозин пранобекс вызывает секрецию ИФН-α и стимулирует естественные механизмы иммунной защиты организма с восстановлением количества и активности Т-лимфоцитов, Т-хелперов, ЕК-клеток и макрофагов, что обосновывает его применение для для противорецидивной терапии ГВИ.
Мы также имеем положительный опыт использования Гроприносина® в сочетании с ацикловиром для купирования рецидивов ГГ [10]. Под наблюдением находились 55 женщин в возрасте 18-50 лет, у которых частота рецидивов ГГ составляла 4-5 в год. 35 женщин основной группы получали ацикловир по 200 мг 5 раз в сутки в течение 5 дней в сочетании с Гроприносином® по 0,5 г 2 раза в сутки в течение 10-12 дней, а 20 пациенток контрольной группы – только ацикловир по 200 мг 5 раз в сутки в течение 5 дней. На фоне сочетанной терапии продолжительность вирусовыделения и рецидива были достоверно короче, а сроки ремиссии – более продолжительными (5,2 мес и 1,7 мес в основной и контрольной группах, соответственно). Одновре менно с клиническим улучшением достоверно повышались число CD3+, CD4+, CD8+ Т-лимфоцитов, ЕК клеток, синтез ИФН-α и ИФН-g. В наших исследованиях показана высокая эффективность Гроприносина® в лечении рецидивирующего ГГ и ВЭБ-инфекции и иммунореабилитации таких больных [10].
Доказана противовирусная активность инозина пранобекса в отношении ВПГ, цитомегаловируса, ВЭБ [14,63,64]. Важно отметить, что наличие длительных периодов немотивированной слабости, повышение температуры тела, увеличение двух и более групп лимфатических узлов, дискомфорт в зеве служат показанием для обследования взрослых и детей на цитомегаловирус, ВЭБ и вирус герпеса человека 6 типа [10,14,63,65]. Косвенными признаками активности ГВИ являются относительный лимфоцитоз и моноцитоз.
Терапевтический эффект инозина пранобекса и ацикловира был изучен у 352 больных ветряной оспой и 284 пациентов опоясывающим герпесом [66]. Паци енты были распределены на 4 группы: 1) только паллиативное лечение; 2) паллиативное лечение + инозин пранобекс; 3) паллиативное лечение + ацикловир; 4) паллиативное лечение + инозин пранобекс + ацикловир. Комбинированная терапия инозина пранобексом и ацикловиром по эффективности превосходила монотерапию обоими препаратами. Авторы рекомендовали применять ацикловир при тяжелых формах ветряной оспы и герпеса зостер, сочетая его с инозином пранобексом и пассивной иммунотерапией на ранней стадии заболевания [66].
Мы наблюдали 80 больных в возрасте от 19 до 60 лет с воспалительными заболеваниями верхних дыхательных путей, в том числе острым и обострением хронического риносинусита (у 24), хроническим (де)компенсированным тонзиллитом (у 36) и хроническим фарингитом (у 20) [10]. Частота рецидивов составляла 4-8 раз в год, а длительность каждого рецидива – до 2-3 недель. С помощью полимеразной цепной реакции в реальном
времени в крови, слюне или мазке из ротоглотки у 70% пациентов выявили ВЭБ, у 40% – вирус герпеса человека 6 типа в сочетании со стрептококком группы А, что позволило диагностировать вирусно-бактериальную инфекцию. При наличии признаков острого или обострения хронического ринотонзиллофарингита назначали антибиотики и симптоматическую терапию на 5-6 дней. В последующем проводили лечение Гроприносином® по 1 г 3 раза в день и человеческим рекомбинантным интерфероном α-2b по 1 млн МЕ (одна свеча) 2 раза в течение в течение 10-14 дней, а затем иммунореабилитацию Гроприносином® в виде двух 30-дневных курсов по 0,5 г 2 раза в день с 7-8-дневным перерывом. На фоне комплексной терапии отмечены более быстрая положительная клиническая динамика, достоверное повышение показателей неспецифической резистентности организма (число CD4+ Т клеток, ЕК-клеток, синтез эндогенных ИФН). После завершения терапии наблюдалось значительное снижение частоты определения ВЭБ и вируса герпеса человека 6 типа (р
Заключение
Доказана высокая эффективность Гроприносина® (инозин пранобекс) в лечении и профилактике повторных ОРВИ, снижении частоты рецидивов ГВИ и ОРВИ в 2,5–3 раза и более у 85% пациентов [10,14]. Приме нение Гроприносина® сопровождалось быстрой локализацией очагов инфекции, уменьшением основных симптомов заболевания, снижением риска развития осложнений. Одновременно отмечались нормализация показателей иммунограммы (клеточные реакции, фагоцитоз) и восстановление синтеза эндогенных интерферонов, что предполагает активацию Тh1-типа иммунного ответа. Это доказывает, что Гроприносин® является эффективным иммуномодулятором с противовирусной активностью. Препарат хорошо переносится при длительном приеме и может применяться в сочетании с другими лекарственными средствами. Гропри носин® рекомендуется назначать для монотерапии или комбинированной терапии и профилактики (иммунореабилитации) респираторных вирусных инфекций и рецидивирующих ГВИ у детей и взрослых.