Изотоп это что в химии
Изотопы
Изото́п (от др.-греч. ισος — «равный», «одинаковый», и τόπος — «место») — разновидность атома (и ядра) какого-либо химического элемента, отличающаяся от других изотопов только количеством нейтронов в ядре. Название связано с тем, что все изотопы одного атома помещаются в одно и то же место (в одну клетку) таблицы Менделеева. Химические свойства атома зависят от строения электронной оболочки, которая, в свою очередь, определяется в основном зарядом ядра Z (то есть количеством протонов в нём), и почти не зависят от его массового числа A (то есть суммарного числа протонов Z и нейтронов N ). Все изотопы одного элемента имеют одинаковый заряд ядра, отличаясь лишь числом нейтронов. Обычно изотоп обозначается символом химического элемента, к которому он относится, с добавлением верхнего левого индекса, означающего массовое число (например, 12 C, 222 Rn). Можно также написать название элемента с добавлением через дефис массового числа (например, углерод-12, радон-222). Некоторые изотопы имеют традиционные собственные названия (например, дейтерий, актинон).
Пример изотопов: 16 8 O, 17 8 O, 18 8 O — три стабильных изотопа кислорода.
Содержание
Терминология
Основная позиция ИЮПАК состоит в том, что правильным термином в единственном числе для обозначения атомов (или ядер) одного химического элемента с одинаковой атомной массой является нуклид, а термин изотопы допускается применять для обозначения совокупности нуклидов одного элемента. Термин изотопы был предложен и применялся изначально во множественном числе, поскольку для сравнения необходимо минимум две разновидности атомов. В дальнейшем в практику широко вошло также употребление термина в единственном числе — изотоп. Кроме того, термин во множественном числе часто применяется для обозначения любой совокупности нуклидов, а не только одного элемента, что также некорректно. В настоящее время позиции международных научных организаций не приведены к единообразию и термин изотоп продолжает широко применяться, в том числе и в официальных материалах различных подразделений ИЮПАК и ИЮПАП. Это один из примеров того, как смысл термина, изначально в него заложенный, перестаёт соответствовать понятию, для обозначения которого этот термин используется (другой хрестоматийный пример — атом, который, в противоречии с названием, не является неделимым).
История открытия изотопов
Первое доказательство того, что вещества, имеющие одинаковое химическое поведение, могут иметь различные физические свойства, было получено при исследовании радиоактивных превращений атомов тяжёлых элементов. В 1906—1907 годах выяснилось, что продукт радиоактивного распада урана — ионий и продукт радиоактивного распада тория — радиоторий имеют те же химические свойства, что и торий, но отличаются от него атомной массой и характеристиками радиоактивного распада. Было обнаружено позднее, что у всех трёх продуктов одинаковы оптические и рентгеновские спектры. Такие вещества, идентичные по химическим свойствам, но различные по массе атомов и некоторым физическим свойствам, по предложению английского учёного Содди стали называть изотопами.
Изотопы в природе
Считается, что изотопный состав элементов на Земле одинаков во всех материалах. Некоторые физические процессы в природе приводят к нарушению изотопного состава элементов (природное фракционирование изотопов, характерное для лёгких элементов, а также изотопные сдвиги при распаде природных долгоживущих изотопов). Постепенное накопление в минералах ядер — продуктов распада некоторых долгоживущих нуклидов используется в ядерной геохронологии.
Применение изотопов человеком
Изотопы 60 Co и 137 Cs используются в стерилизации Υ-лучами (лучевая стерилизация) как один из методов физической стерилизации инструментов, перевязочного материала и прочего. Доза проникающей радиации должна быть весьма значительной — до 20-25 мкГр, что требует особых мер безопасности. В связи с этим лучевая стерилизация проводится в специальных помещениях и является заводским методом стерилизации (непосредственно в стационарах она не производится). [1]
Химические элементы
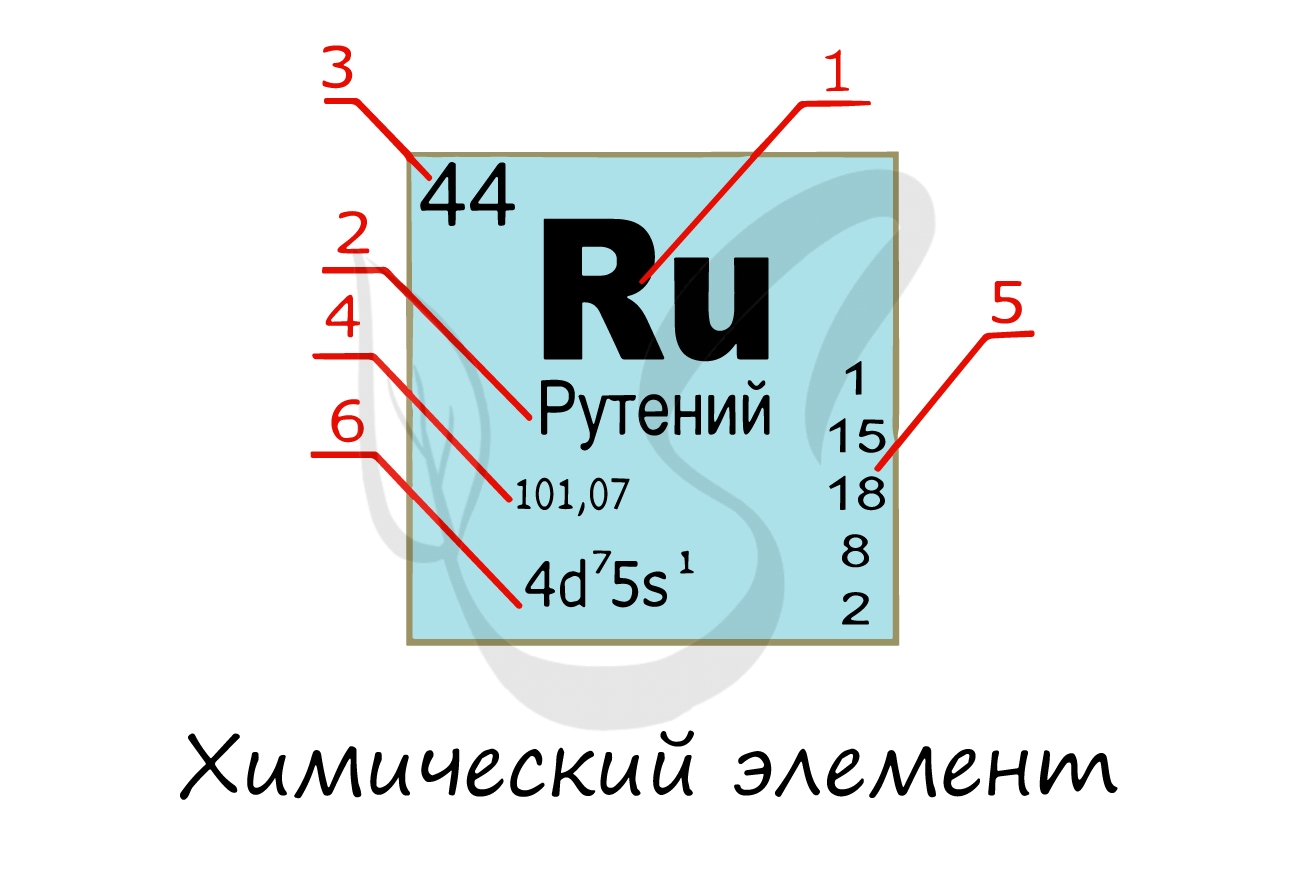
Химический элемент
Надо заметить, что на экзамене часто из карточки элемента скрывают распределение электронов и конфигурацию внешнего уровня. Тем не менее, если вы успешно освоили предыдущую тему, то для вас не составит труда написать электронную конфигурацию атома зная его порядковый номер в таблице Д.И. Менделеева (номер уж точно не тронут!))
Протоны, нейтроны и электроны
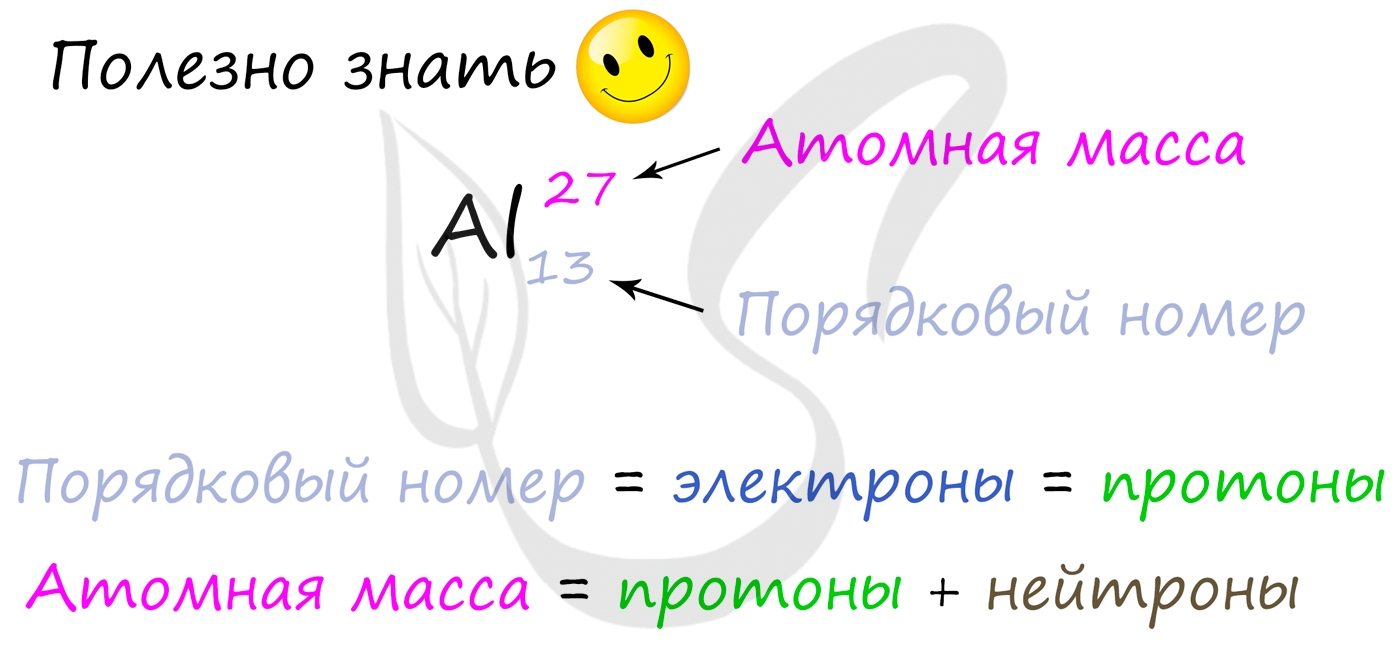
Вы уже знаете, что порядковый номер элемента в периодической таблице Д.И. Менделеева равен числу протонов, а число протонов равно числу электронов.
Для того чтобы найти число нейтронов в атоме алюминия, необходимо вычесть из атомной массы число протонов:
Получается, что в атоме алюминия 14 нейтронов. Посчитайте число нейтронов, электронов и протонов самостоятельно для атомов бериллия, кислорода, меди. Решение вы найдете ниже.
Если вы поняли суть и научились считать протоны, нейтроны и электроны, самое время приступать к следующей теме.
Изотопы
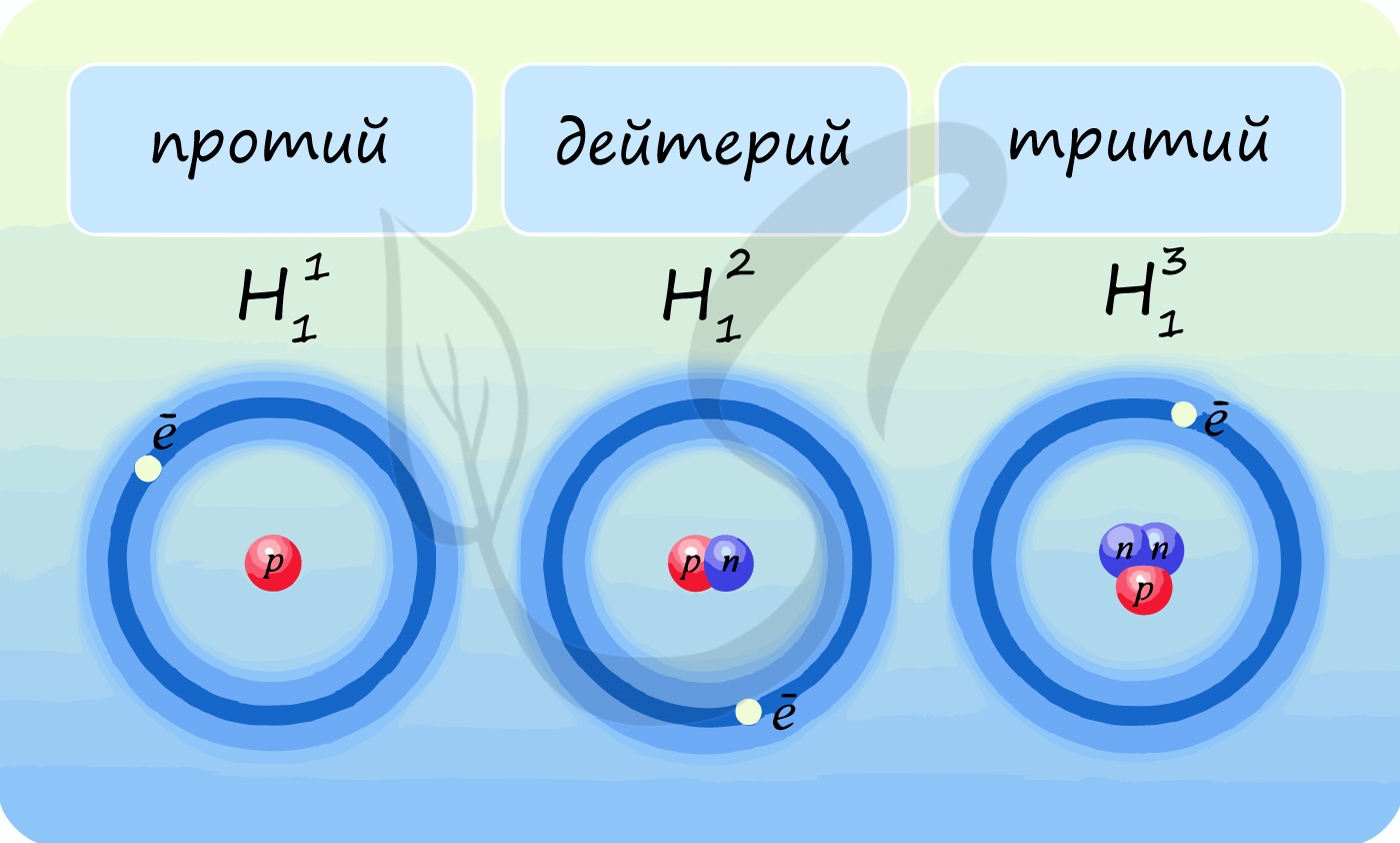
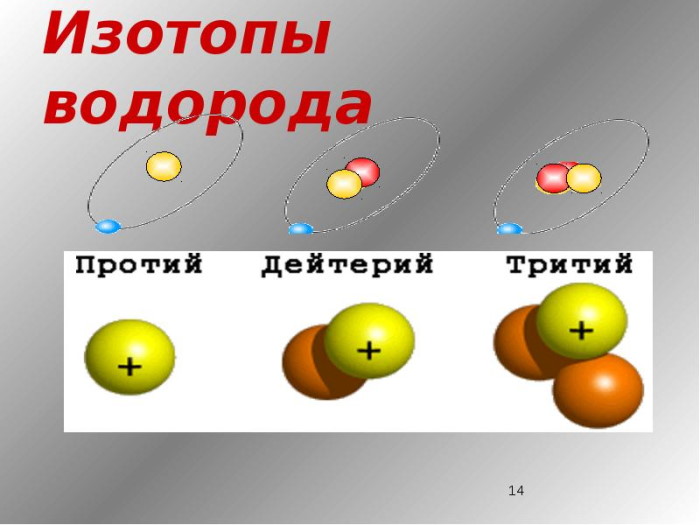
Лучше всего объяснить, что такое изотопы наглядным примером. Широко известны три изотопа водорода: протий, дейтерий и тритий.
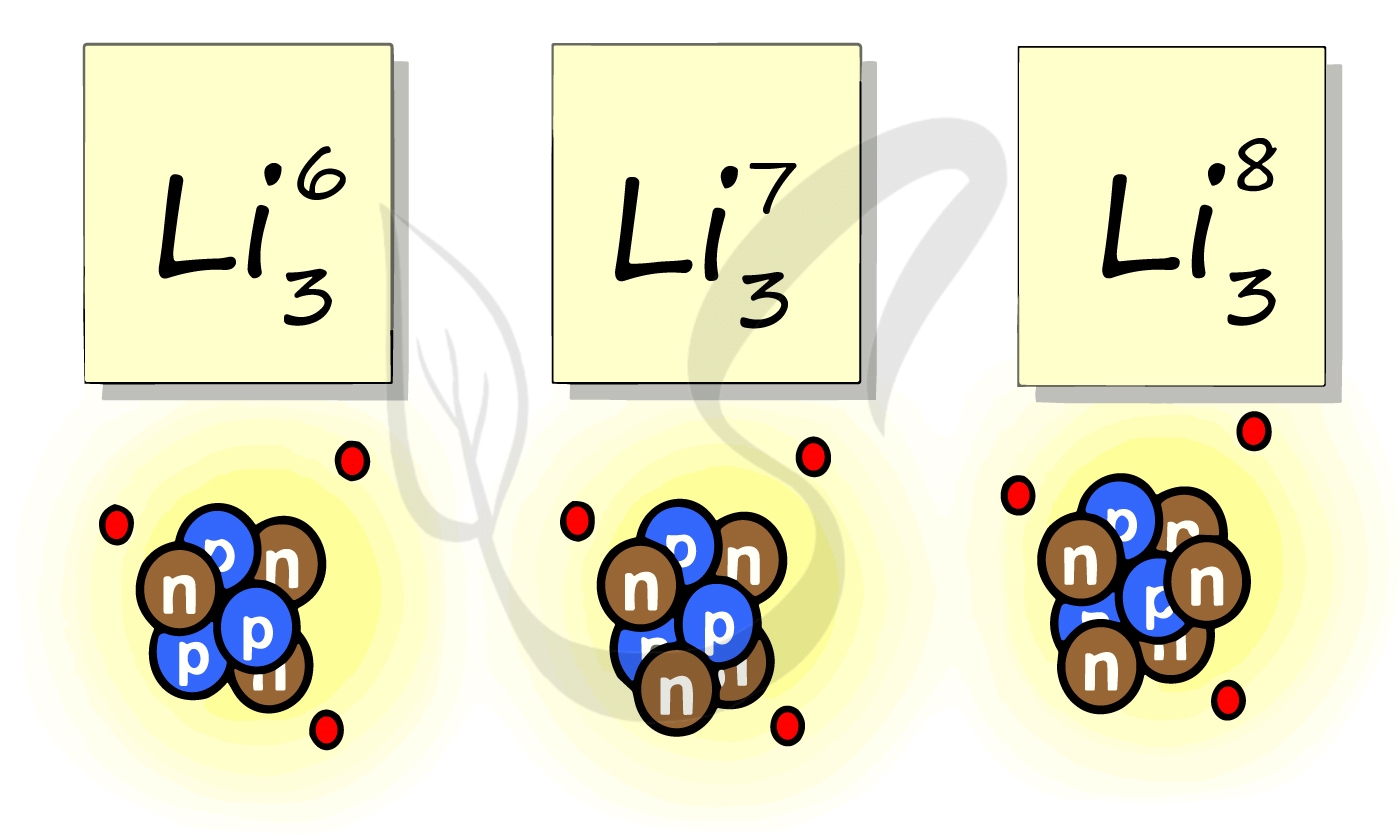
Рассмотрим пример с изотопами лития. Самостоятельно посчитайте количество нейтронов у каждого изотопа. Найдите тот, который включен в таблицу Д.И. Менделеева.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Описание изотопов: определение, состав, превращения
Что такое изотоп?
Изотопами называют видоизменные элементы периодической таблицы Менделеева, которые имеют один и тот же порядковый номер, но различную атомную массу. Название характеризует нахождение подобных структур в одной клеточке периодической таблицы с нормальными элементами (изо – равное, топ – положение, место – в переводе с английского). Состав изотопов представляет собой совокупность протонов, электронов и нейтронов (количество нейтронов обычно больше, чем в обычных элементах периодической таблицы).
Обозначения изотопов
Видоизмененные элементы периодической таблицы Менделеева обозначаются следующим образом: к символу химического элемента, к которому принадлежит изотоп, подписывается верхний левый индекс с обозначением массового числа. Так, например, изотоп кислорода, обладающий массовым числом равным восемнадцати атомных единиц, будет обозначаться следующим образом: 18 O. Имеется также другое обозначение подобных атомов (например, кислород – 18).
Изотопы водорода
Выделяют три видоизменённых атома водорода, обладающих разными массовыми числами:
протий (Н) – одна атомная единица массы;
дейтерий (D) – две атомные единицы массы;
тритий (Т) – три атомные единицы массы.
Отдельно необходимо выделить, видоизменённые атомы водорода, массовое число которого может колебаться в районе 4 – 7 а.е.м.
Изотопы урана
Изотопный ряд урана включает в себя изотопы, имеющие массу от 219 а.е.м. до 243 а.е.м. Элементы, обладающие наибольшей изотопной распространенностью – это уран – 235 и уран – 238.
Нуклиды
Нуклиды подразделяются на две больших категории:
Химический элемент периодической таблицы ртуть (гидраргирум) обладает наибольшей изотопной распространенностью стабильных нуклидов. Так, стабильные нуклиды ртути – это вещества изотопного ряда гидраргиума, обладающие атомной массой от 170 а.е.м. до 219 а.е.м.
Термин нуклид (в понятии радионуклид) был предложен в двадцатом веке американцем Трумэном Команом. Радионуклиды отличаются длительным периодом полураспада, который в большинстве случаев имеет значение порядка 5*10 8 лет. Таким образом, радионуклиды населяют Землю с момента ее зарождения как планеты. В зависимости от массового числа нуклиды могут подвергать различным видам превращения, обозначим некоторые из них:
альфа-распад (для большинства радионуклидов подобный вид распада не наблюдается и из-за большого периода полураспада);
нейтронный и двухнейтронный распады.
Изотопы галлия
электронный захват (наблюдается в 13% случаев);
позитронный распад (наблюдается в 87% случаев).
Превращения изотопов
Превращения изотопов могут протекать двумя способами:
при участии технологий, созданных человеком (используется в промышленности);
самопроизвольно (протекает в природе).
Выделяют следующие виды ядерных превращений, связанных со изменением атомной массы химических элементов: распад (альфа, бета, двойной бета, нейтронный, позитронный), электронный захват (происходит присоединение электрона, вследствие чего изменяется заряд и состав нуклида).
Применение радиоактивных изотопов
Изотопы химических элементов представляют собой элементы периодической таблицы Менделеева, обладающие нестабильными ядрами и свойством подвергаться различного ядерному распаду. В научной терминологии подобные атомы называют также радионуклидами. Радиоактивные изотопы применяются в различных сферах человеческой деятельности.
В сельском хозяйстве использования радиоизотопов необходимо для изучения особенностей роста, развития и функционирования корневых систем растений (такой способ изучения получил название – метод меченных атомов).
В авиастроительстве радионуклиды применяют для испытания авиационных конструкций на предмет износостойкости.
В сфере градостроительстве радиоактивные изотопы нашли свое применение как универсальные измерители плотности почвы.
В области коммунального хозяйства видоизмененные химические элементы, обладающие радиоактивной способностью, применяют в целях стерилизации постельного белья.
В текстильной промышленности радионуклиды используются для удаления электрических зарядов с поверхности одежды.
В машиностроительной отрасли радионуклиды используются для определения толщины металлического покрытия.
Особое место в этом списке занимает использование радиоактивных изотопов в химической промышленности и в сфере медицинских услуг. Так, получение различных полимерных соединений, которые составляют основу большинства современных предметов обихода, письменных принадлежностей, резиновых изделий того или иногда вида использования происходит при помощи взаимодействия y-излучения с различными химическими соединениями органической природы. В медицине радиоизотопы применяются в лечебных целях в рамках радиационной терапии (процедура, при которой под воздействием радионуклидов происходит разрушение любого типа живой ткани). Радиотерапия нашла свое применения в области лечения онкологических заболеваний (на данный момент, по эффективности радиотерапия уступает только химиотерапии, но зачастую данные способы лечения составляют две стадии одного процесса).
В заключении, стоит отметить, что научный прогресс в области получения новых видов изотопов тех или иных химических элементов не стоит на месте, поэтому возможно в будущем при помощи грамотного и целесообразного использования видоизмененных атомов можно будет лечить неизлечимые на данный момент заболеваний и строить космические корабли для покорения других планет и галактик.
Изотопы
Полезное
Смотреть что такое «Изотопы» в других словарях:
ИЗОТОПЫ — (от изо. и греческого topos место), разновидности химических элементов, у которых ядра атомов (нуклидов) отличаются числом нейтронов, но содержат одинаковое число протонов и поэтому занимают одно и то же место в периодической системе химических … Современная энциклопедия
Изотопы — (от изо. и греческого topos место), разновидности химических элементов, у которых ядра атомов (нуклидов) отличаются числом нейтронов, но содержат одинаковое число протонов и поэтому занимают одно и то же место в периодической системе химических … Иллюстрированный энциклопедический словарь
ИЗОТОПЫ — (от изо. и греч. topos место) разновидности химических элементов, у которых ядра атомов отличаются числом нейтронов, но содержат одинаковое число протонов и поэтому занимают одно и то же место в периодической системе элементов. Различают… … Большой Энциклопедический словарь
ИЗОТОПЫ — ИЗОТОПЫ, хим. элементы, расположенные в одной и той же клетке периодической системы и следовательно обладающие одинаковым атомным номером или порядко вым числом. При этом И. не должны, вообще говоря, обладать одинаковым атомным весом. Различные… … Большая медицинская энциклопедия
ИЗОТОПЫ — разновидности данного хим. элемента, различающиеся по массе ядер. Обладая одинаковыми зарядами ядер Z, но различаясь числом нейтронов, И. имеют одинаковое строение электронных оболочек, т. е. очень близкие хим. св ва, и занимают одно и то же… … Физическая энциклопедия
изотопы — атомы одного и того же хим. элемента, ядра которых содержат одинаковое число протонов, но различное число нейтронов; имеют разные атомные массы, обладают одними и теми же хим. свойствами, но различаются по своим физ. свойствам, в частности… … Словарь микробиологии
ИЗОТОПЫ — атомы хим. элемента, обладающие разными массовыми числами, но имеющие одинаковый заряд атомных ядер и поэтому занимающие одно место в периодической системе Менделеева. Атомы разных изотопов одного и того же хим. элемента отличаются по числу… … Геологическая энциклопедия
Изотопы — Isotopes нуклиды, имеющие одинаковый атомный номер, но различные атомные массы (например, уран 235 и уран 238). Термины атомной энергетики. Концерн Росэнергоатом, 2010 … Термины атомной энергетики
ИЗОТОПЫ — (от изо. и греч. topos место), элементы с одинаковым порядковым номером, но с разной атомной массой. Большинство радиоактивных изотопов, важных для экологии, обладают энергией от 0,1 до 5 Мэв (чем выше энергия радиоактивных изотопов, тем больше … Экологический словарь
изотопы — Нуклиды, имеющие одинаковый атомный номер, но различные атомные массы (например, уран 235 и уран 238). [http://pripyat.forumbb.ru/viewtopic.php?id=25] Тематики атомная энергетика в целом EN isotopes … Справочник технического переводчика
ИЗОТОПЫ — разновидности атомов данного хим. элемента, ядра которых содержат одинаковое число протонов, но различное число нейтронов. И. имеют разные атомные (см.) и одинаковое число электронов в атомной оболочке, что определяет их очень близкие физ. хим.… … Большая политехническая энциклопедия
изотопы
Полезное
Смотреть что такое «изотопы» в других словарях:
ИЗОТОПЫ — (от изо. и греческого topos место), разновидности химических элементов, у которых ядра атомов (нуклидов) отличаются числом нейтронов, но содержат одинаковое число протонов и поэтому занимают одно и то же место в периодической системе химических … Современная энциклопедия
Изотопы — (от изо. и греческого topos место), разновидности химических элементов, у которых ядра атомов (нуклидов) отличаются числом нейтронов, но содержат одинаковое число протонов и поэтому занимают одно и то же место в периодической системе химических … Иллюстрированный энциклопедический словарь
ИЗОТОПЫ — (от изо. и греч. topos место) разновидности химических элементов, у которых ядра атомов отличаются числом нейтронов, но содержат одинаковое число протонов и поэтому занимают одно и то же место в периодической системе элементов. Различают… … Большой Энциклопедический словарь
ИЗОТОПЫ — ИЗОТОПЫ, хим. элементы, расположенные в одной и той же клетке периодической системы и следовательно обладающие одинаковым атомным номером или порядко вым числом. При этом И. не должны, вообще говоря, обладать одинаковым атомным весом. Различные… … Большая медицинская энциклопедия
ИЗОТОПЫ — разновидности данного хим. элемента, различающиеся по массе ядер. Обладая одинаковыми зарядами ядер Z, но различаясь числом нейтронов, И. имеют одинаковое строение электронных оболочек, т. е. очень близкие хим. св ва, и занимают одно и то же… … Физическая энциклопедия
изотопы — атомы одного и того же хим. элемента, ядра которых содержат одинаковое число протонов, но различное число нейтронов; имеют разные атомные массы, обладают одними и теми же хим. свойствами, но различаются по своим физ. свойствам, в частности… … Словарь микробиологии
ИЗОТОПЫ — атомы хим. элемента, обладающие разными массовыми числами, но имеющие одинаковый заряд атомных ядер и поэтому занимающие одно место в периодической системе Менделеева. Атомы разных изотопов одного и того же хим. элемента отличаются по числу… … Геологическая энциклопедия
Изотопы — Isotopes нуклиды, имеющие одинаковый атомный номер, но различные атомные массы (например, уран 235 и уран 238). Термины атомной энергетики. Концерн Росэнергоатом, 2010 … Термины атомной энергетики
ИЗОТОПЫ — (от изо. и греч. topos место), элементы с одинаковым порядковым номером, но с разной атомной массой. Большинство радиоактивных изотопов, важных для экологии, обладают энергией от 0,1 до 5 Мэв (чем выше энергия радиоактивных изотопов, тем больше … Экологический словарь
изотопы — Нуклиды, имеющие одинаковый атомный номер, но различные атомные массы (например, уран 235 и уран 238). [http://pripyat.forumbb.ru/viewtopic.php?id=25] Тематики атомная энергетика в целом EN isotopes … Справочник технического переводчика
ИЗОТОПЫ — разновидности атомов данного хим. элемента, ядра которых содержат одинаковое число протонов, но различное число нейтронов. И. имеют разные атомные (см.) и одинаковое число электронов в атомной оболочке, что определяет их очень близкие физ. хим.… … Большая политехническая энциклопедия