Изотопы что это примеры
Урок 2. Изотопы элементов
В уроке 2 «Изотопы элементов» из курса «Химия для чайников» рассмотрим что такое изотопы элементов и как правильно их обозначают; кроме того мы научимся определять массовое число, дефект массы и энергию связи ядра. Данный урок полностью опирается на основы химии, изложенные в первом уроке, в котором мы рассмотрели строение атома и атомного ядра, поэтому настоятельно вам рекомендую его изучить от корки до корки.
Что такое изотоп?
Хотя все атомы одного элемента имеют одинаковое число протонов, эти атомы могут отличаться числом имеющихся у них нейтронов. Такие различные атомы одного и того же элемента называются изотопами. Количество протонов, а также количество электронов у изотопа и исходного элемента совпадает. По этой причине в природе существует гораздо больше химических элементов, чем указано в таблице Менделеева, которая систематизирует элементы по числу протонов (порядковый номер).
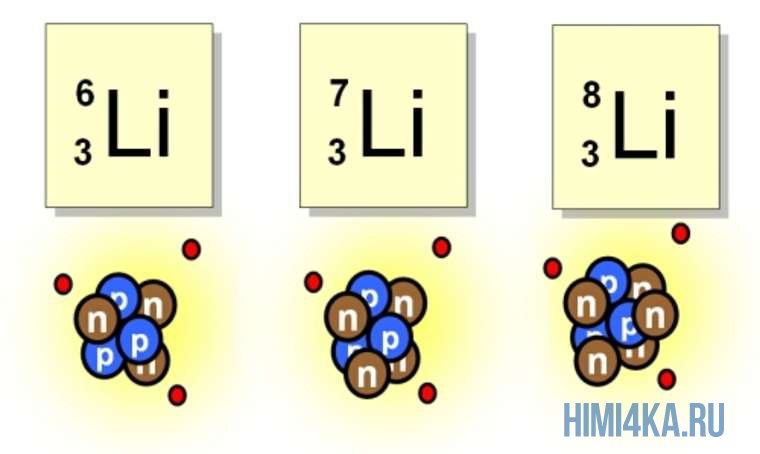
Например, все атомы Li имеют 3 протона, но в природе существуют изотопы, содержащие от 3 до 5 нейтронов. Для обозначения изотопа, слева от символа элемента подписывают нижним индексом его порядковый номер, а верхним — массовое число. Массовое число — это суммарное число нуклонов (протонов и нейтронов) в атомном ядре, численно близкое к атомной массе элемента. Нижний индекс, обозначающий порядковый номер элемента, указывать не обязательно, так как все атомы лития имеют в своем ядре по 3 протона. Также, обсуждая эти изотопы, можно пользоваться записью «литий-6» и «литий-8».
Пример 1. Сколько протонов, нейтронов и электронов содержится в атоме урана-238? Запишите символ этого изотопа.
Решение: Порядковый номер урана (см. таблицу Менделеева) равен 92, а массовое число изотопа равно 238 (по условию). Следовательно, он содержит 92 протона, 92 электрона и 238 — 92 = 146 нейтронов. Его символ 238 U.
Дефект массы и энергия связи ядра
Затронув тему изотопов, нельзя пройти мимо феномена дефект массы ядра. Когда из отдельных нуклонов образуется атомное ядро, часть их массы превращается в энергию. Другими словами, вот взяли вы щепотку протонов и нейтронов, хорошенько их смяли вместе, и получили ядро, но его масса будет меньше массы исходных компонентов. Это и есть дефект масс. Формула для расчета дефекта массы ядра:
где Mя – масса ядра, Z – число протонов в ядре, N – число нейтронов в ядре, mp – масса протона, mn – масса нейтрона.
Если к атому подвести энергию (которая эквивалентна дефекту масс), то можно разделить его ядро обратно на нуклоны. Эта энергия носит название энергия связи ядра. Формула для расчета энергии связи ядра:
где с — скорость света, ∆m — дефект массы ядра
Проверьте себя, как вы усвоили понятия дефект массы и энергия связи ядра, самостоятельно решив задачу пользуясь формулами выше.
Пример 2. Если образовать атом углерода-12 из субатомных частиц, какое значение будет иметь дефект масс?
Теперь нам известно, что каждый изотоп элемента характеризуется порядковым номером (суммарным числом протонов), массовым числом (суммарным числом протонов и нейтронов) и атомной массой (массой атома, выраженной в атомных единицах массы). Поскольку дефект массы при образовании атома очень мал, массовое число обычно совпадает с атомной массой изотопа, округленной до ближайшего целого числа. (Например, атомная масса хлора-37 равна 36,966, что после округления дает 37.) Если в природе встречается несколько изотопов одного элемента, то экспериментально наблюдаемая атомная масса (естественная атомная масса) равна средневзвешенному значению атомных масс отдельных изотопов. Это средневзвешенное значение определяется соответственно относительному содержанию изотопов в природе. Хлор существует в природе в виде смеси из 75,53% хлора-35 (атомная масса 34,97 а.е.м.) и 24,47% хлора-37 (36,97 а.е.м.), поэтому средневзвешенное значение масс этих изотопов равно
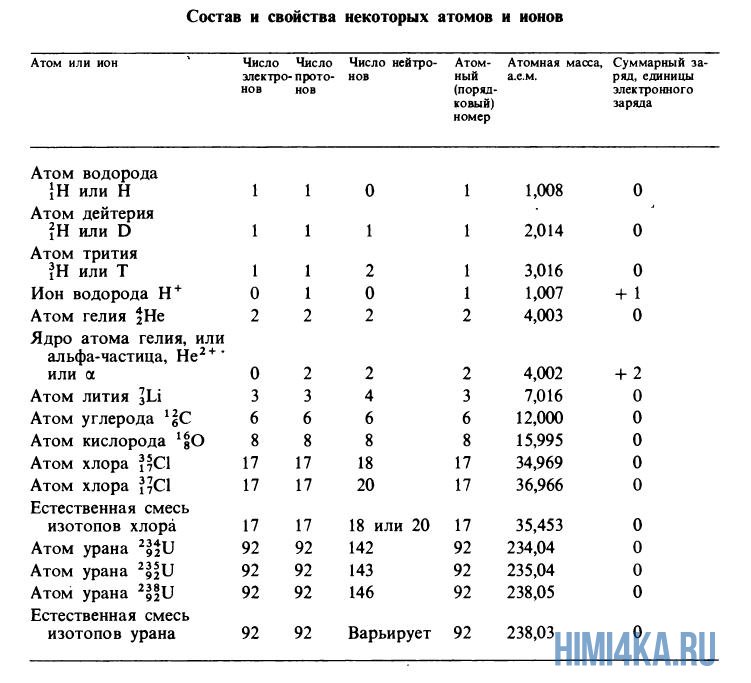
Атомные массы, указанные в таблице Менделеева представляют собой во всех случаях средневзвешенные значения атомных масс изотопов, встречающихся в природе, и именно этими значениями мы будем пользоваться в дальнейшем, за исключением тех случаев, когда будет обсуждаться какой-нибудь конкретный изотоп. Все изотопы одного элемента в химическом отношении ведут себя практически одинаково. На рисунке ниже изображены состав и свойства некоторые атомов, ионов и изотопов элементов.
Пример 3. Магний (Mg) в основном состоит из трех естественных изотопов: 78,70% всех атомов магния имеют атомную массу 23,985 а.е.м., 10,13% — 24,986 а.е.м. и 11,17% — 25,983 а.е.м. Сколько протонов и нейтронов содержится в каждом из этих трех изотопов? Чему равно средневзвешенное значение их атомных масс?
Решение: Все изотопы магния содержат по 12 протонов. Изотоп с атомной массой 23,985 а.е.м. имеет массовое число 24 (суммарное число протонов и нейтронов), следовательно, он имеет 24 — 12 = 12 нейтронов. Символ этого изотопа 24 Mg. Аналогично находим, что изотоп с атомным весом 24,986 а.е.м. имеет массовое число 25, содержит 13 нейтронов и имеет символ 25 Mg. Третий изотоп (25,983 а.е.м.) имеет массовое число 26, содержит 14 нейтронов и имеет символ 26 Mg. Средняя атомная масса магния находится следующим образом:
Надеюсь урок 2 «Изотопы элементов» помог вам понять что из себя представляют изотопы. Если у вас возникли вопросы, пишите их в комментарии.
Изотопы: что это такое и какие они бывают
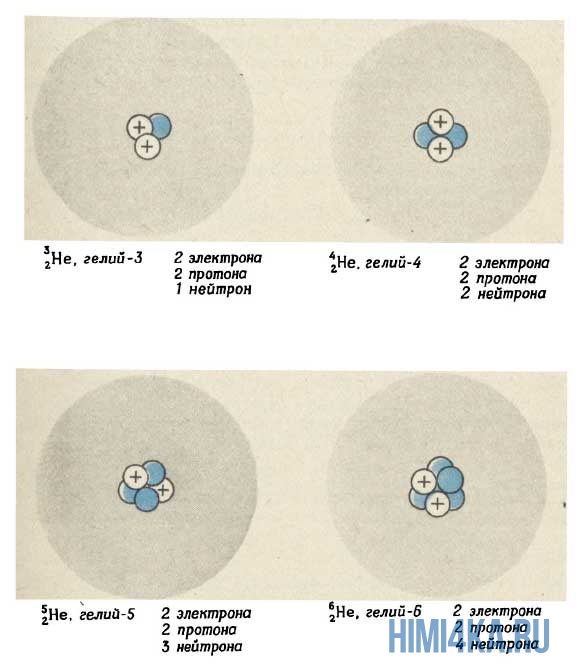
Изотопы – это атомы, которые имеют одинаковое количество протонов и электронов, но разное количество нейтронов. На уроках химии школьникам рассказывают, что каждый элемент имеет свой уникальный атом, состоящий из определенного количества протонов. Количество протонов определяет атомное число элемента. Каждый атом имеет такое же количество электронов, как протоны.
Также существуют изотоны и изобары. Изотопами называют ядра элементов, которые содержат разное количество протонов и одинаковое количество нейтронов. Изобары – атомы, в ядрах которых разное количество протонов и нейтронов, но их сумма одинакова.
Поскольку нейтроны не имеют электрического заряда, изменение количества нейтронов не влияет на химию элемента. Однако это меняет массу элемента. Изотопы идентифицируются по их массе, составляющей общее количество протонов и нейтронов.
Все элементы имеют ряд изотопов. Водород имеет наименьшее количество изотопов – только три. Цезий и Ксенон имеют наибольшее количество изотопов – 36. Более о количестве изотопов в каждом элементов, читайте в учебнике по химии за 8 класс А.М. Бутенко.
Как записывают изотопы
Вид атомов с определенным числом протонов и нейтронов в ядре называется нуклидом. Существуют два способа написания изотопов. Они оба используют массу атома, где масса = (количество протонов) + (количество нейтронов). Первый способ – поставить массу перед символом элемента: 4He, 14С, 235U. Другой способ – выписать элемент и записать массу после дефиса рядом с названием элемента: Гелий-4, Карбон-14, Уран-238.
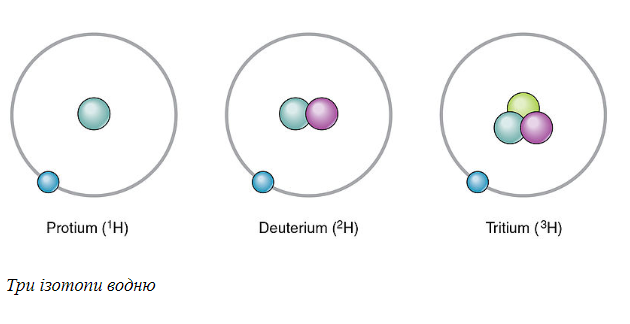
Водород является единственным элементом, где изотопам даны конкретные названия. Водород, который имеет нулевые нейтроны, называется протиумом. Водород с одним нейтроном называется дейтерием, с двумя – тритием. Дейтерий может образовывать воду с кислородом. Это называется «тяжелой водой», поскольку дейтерий имеет вдвое больше нормы водорода.
Изотопы бывают стабильные и нестабильные, природные и искусственные.
Когда изотоп нестабилен, он со временем приходит в упадок и превращается в другой изотоп или элемент. Нестабильные изотопы считаются радиоактивными – это все неестественные или техногенные элементы. Многие элементы существуют лишь в такой форме.
Большинство элементов, которые встречаются в природе, состоят из стабильных изотопов. Элементом с самыми стабильными изотопами есть олово, которое имеет десять различных устойчивых изотопов.
Природные изотопы распространены в природе. Искусственные в природе не встречаются, а образуются в результате ядерных реакций.
Интересные факты об изотопах:
Тяжелые изотопы, как правило, реагируют медленнее, чем более легкие того же элемента.
Известно 254 стабильных изотопов и 80 элементов, которые имеют по крайней мере один стабильный изотоп.
Двадцать шесть элементов имеют только один стабильный изотоп. Эти элементы называются моноизотопными.
Если в вашем учебнике не было такой информации, вы можете поискать ее в других учебных пособиях в разделе Учебники по химии за 8 класс.
Изотоп
Изото́пы (от греч. ισος — «равный», «одинаковый», и τόπος — «место») — разновидности атомов (и ядер) одного химического элемента с разным количеством нейтронов в ядре. Название связано с тем, что изотопы находятся в одном и том же месте (в одной клетке) таблицы Менделеева. Химические свойства атома зависят практически только от строения электронной оболочки, которая, в свою очередь, определяется в основном зарядом ядра Z (то есть количеством протонов в нём) и почти не зависит от его массового числа A (то есть суммарного числа протонов Z и нейтронов N). Все изотопы одного элемента имеют одинаковый заряд ядра, отличаясь лишь числом нейтронов. Обычно изотоп обозначается символом химического элемента, к которому он относится, с добавлением верхнего левого индекса, означающего массовое число (например, 12 C, 222 Rn). Можно также написать название элемента с добавлением через дефис массового числа (например, углерод-12, радон-222). Некоторые изотопы имеют традиционные собственные названия (например, дейтерий, актинон).
Содержание
Терминология
Основная позиция ИЮПАК состоит в том, что правильным термином в единственном числе для обозначения атомов (или ядер) одного химического элемента с одинаковой атомной массой является нуклид, а термин изотопы допускается применять для обозначения совокупности нуклидов одного элемента. Термин изотопы был предложен и применялся изначально во множественном числе, поскольку для сравнения необходимо минимум две разновидности атомов. В дальнейшем в практику широко вошло также употребление термина в единственном числе — изотоп. Кроме того, термин во множественном числе часто применяется для обозначения любой совокупности нуклидов, а не только одного элемента, что также некорректно. В настоящее время позиции международных научных организаций не приведены к единообразию и термин изотоп продолжает широко применяться, в том числе и в официальных материалах различных подразделений ИЮПАК и ИЮПАП. Это один из примеров того, как смысл термина, изначально в него заложенный, перестаёт соответствовать понятию, для обозначения которого этот термин используется (другой хрестоматийный пример — атом, который, в противоречии с названием, не является неделимым).
История открытия изотопов
Первое доказательство того, что вещества, имеющие одинаковое химическое поведение, могут иметь различные физические свойства, было получено при исследовании радиоактивных превращений атомов тяжёлых элементов. В 1906—07 выяснилось, что продукт радиоактивного распада урана — ионий и продукт радиоактивного распада тория — радиоторий, имеют те же химические свойства, что и торий, но отличаются от него атомной массой и характеристиками радиоактивного распада. Было обнаружено позднее, что у всех трёх продуктов одинаковы оптические и рентгеновские спектры. Такие вещества, идентичные по химическим свойствам, но различные по массе атомов и некоторым физическим свойствам, по предложению английского учёного Ф. Содди, стали называть изотопами.
Изотопы в природе
Считается, что изотопный состав элементов на Земле одинаков во всех материалах. Некоторые физические процессы в природе приводят к нарушению изотопного состава элементов (природное фракционирование изотопов, характерное для лёгких элементов, а также изотопные сдвиги при распаде природных долгоживущих изотопов). Постепенное накопление в минералах ядер — продуктов распада некоторых долгоживущих нуклидов используется в ядерной геохронологии.
Применение изотопов человеком
См. также
Нестабильные (менее суток): 4 H: Водород-4, 5 H: Водород-5, 6 H: Водород-6, 7 H: Водород-7
110 примеров изотопов
Содержание:
В периодической таблице 21 элемент, у которых есть только один природный изотоп в качестве своего элемента, такой как бериллий или натрий. С другой стороны, есть элементы, которые могут достигать 10 стабильных изотопов, например олово.
Есть также такие элементы, как уран, изотопы которого могут превращаться в стабильные или менее стабильные изотопы, излучающие излучение, поэтому мы называем их нестабильными.
Нестабильные изотопы используются для оценки возраста природных образцов, таких как углерод 13, поскольку зная скорость распада изотопа, связывающего его с уже распавшимися, можно узнать очень точный возраст. Таким образом известен возраст Земли.
Мы можем различать два типа изотопов: природные и искусственные. Природные изотопы встречаются в природе, а искусственные создаются в лаборатории путем бомбардировки субатомными частицами.
Избранные примеры изотопов
1-Углерод 14: это изотоп углерода с периодом полураспада 5730 лет, который используется в археологии для определения возраста горных пород и органического вещества.
3-Иридий 192: этот изотоп представляет собой искусственный изотоп, используемый для проверки герметичности трубок.
4-Уран 233: этот изотоп является искусственным, не встречается в природе и используется на атомных электростанциях.
5-Кобальт 60: используется при раке, поскольку он излучает более мощное излучение, чем радий, и дешевле.
6-Технеций 99: этот изотоп используется в медицине для поиска закупоренных кровеносных сосудов.
7-Radio 226: этот изотоп используется для лечения рака кожи.
8-Bromo 82: используется для проведения гидрографических исследований водных потоков или динамики озер.
10-Йод 131: радионуклид, который использовался в ядерных испытаниях, проведенных в 1945 году. Этот изотоп увеличивает риск рака, а также таких заболеваний, как щитовидная железа.
11-Мышьяк 73: используется для определения количества мышьяка, усвоенного организмом.
12-Мышьяк 74: используется для определения и локализации опухолей головного мозга.
13-Азот 15: используется в научных исследованиях для проведения теста спектроскопии ядерного магнитного резонанса. Он также используется в сельском хозяйстве.
14-Gold 198: используется для бурения нефтяных скважин.
15-Меркурий 147: используется для изготовления электролитических ячеек.
16-лантан 140: используется в промышленных котлах и печах
17-Phosphorus 32: используется в медицинских исследованиях костей, костей и костного мозга
18-Phosphorus 33: используется для распознавания ядер или нуклеотидов ДНК.
19-Скандий 46: этот изотоп используется в анализе почвы и отложений.
20-Фтор 18: он также известен как флудезоксиглюкоза и используется для исследования тканей организма.
Другие примеры изотопов
Ссылки
10 лучших приложений для просмотра сериалов онлайн
Изотопы
Изото́п (от др.-греч. ισος — «равный», «одинаковый», и τόπος — «место») — разновидность атома (и ядра) какого-либо химического элемента, отличающаяся от других изотопов только количеством нейтронов в ядре. Название связано с тем, что все изотопы одного атома помещаются в одно и то же место (в одну клетку) таблицы Менделеева. Химические свойства атома зависят от строения электронной оболочки, которая, в свою очередь, определяется в основном зарядом ядра Z (то есть количеством протонов в нём), и почти не зависят от его массового числа A (то есть суммарного числа протонов Z и нейтронов N ). Все изотопы одного элемента имеют одинаковый заряд ядра, отличаясь лишь числом нейтронов. Обычно изотоп обозначается символом химического элемента, к которому он относится, с добавлением верхнего левого индекса, означающего массовое число (например, 12 C, 222 Rn). Можно также написать название элемента с добавлением через дефис массового числа (например, углерод-12, радон-222). Некоторые изотопы имеют традиционные собственные названия (например, дейтерий, актинон).
Пример изотопов: 16 8 O, 17 8 O, 18 8 O — три стабильных изотопа кислорода.
Содержание
Терминология
Основная позиция ИЮПАК состоит в том, что правильным термином в единственном числе для обозначения атомов (или ядер) одного химического элемента с одинаковой атомной массой является нуклид, а термин изотопы допускается применять для обозначения совокупности нуклидов одного элемента. Термин изотопы был предложен и применялся изначально во множественном числе, поскольку для сравнения необходимо минимум две разновидности атомов. В дальнейшем в практику широко вошло также употребление термина в единственном числе — изотоп. Кроме того, термин во множественном числе часто применяется для обозначения любой совокупности нуклидов, а не только одного элемента, что также некорректно. В настоящее время позиции международных научных организаций не приведены к единообразию и термин изотоп продолжает широко применяться, в том числе и в официальных материалах различных подразделений ИЮПАК и ИЮПАП. Это один из примеров того, как смысл термина, изначально в него заложенный, перестаёт соответствовать понятию, для обозначения которого этот термин используется (другой хрестоматийный пример — атом, который, в противоречии с названием, не является неделимым).
История открытия изотопов
Первое доказательство того, что вещества, имеющие одинаковое химическое поведение, могут иметь различные физические свойства, было получено при исследовании радиоактивных превращений атомов тяжёлых элементов. В 1906—1907 годах выяснилось, что продукт радиоактивного распада урана — ионий и продукт радиоактивного распада тория — радиоторий имеют те же химические свойства, что и торий, но отличаются от него атомной массой и характеристиками радиоактивного распада. Было обнаружено позднее, что у всех трёх продуктов одинаковы оптические и рентгеновские спектры. Такие вещества, идентичные по химическим свойствам, но различные по массе атомов и некоторым физическим свойствам, по предложению английского учёного Содди стали называть изотопами.
Изотопы в природе
Считается, что изотопный состав элементов на Земле одинаков во всех материалах. Некоторые физические процессы в природе приводят к нарушению изотопного состава элементов (природное фракционирование изотопов, характерное для лёгких элементов, а также изотопные сдвиги при распаде природных долгоживущих изотопов). Постепенное накопление в минералах ядер — продуктов распада некоторых долгоживущих нуклидов используется в ядерной геохронологии.
Применение изотопов человеком
Изотопы 60 Co и 137 Cs используются в стерилизации Υ-лучами (лучевая стерилизация) как один из методов физической стерилизации инструментов, перевязочного материала и прочего. Доза проникающей радиации должна быть весьма значительной — до 20-25 мкГр, что требует особых мер безопасности. В связи с этим лучевая стерилизация проводится в специальных помещениях и является заводским методом стерилизации (непосредственно в стационарах она не производится). [1]