Изотопы что это такое простыми словами
Описание изотопов: определение, состав, превращения
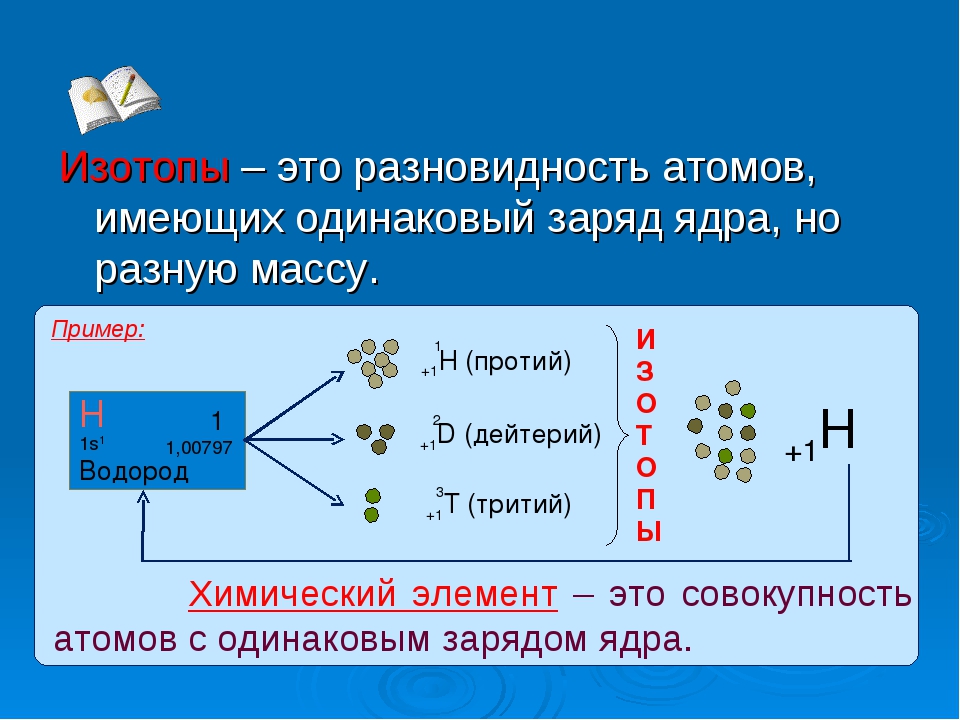
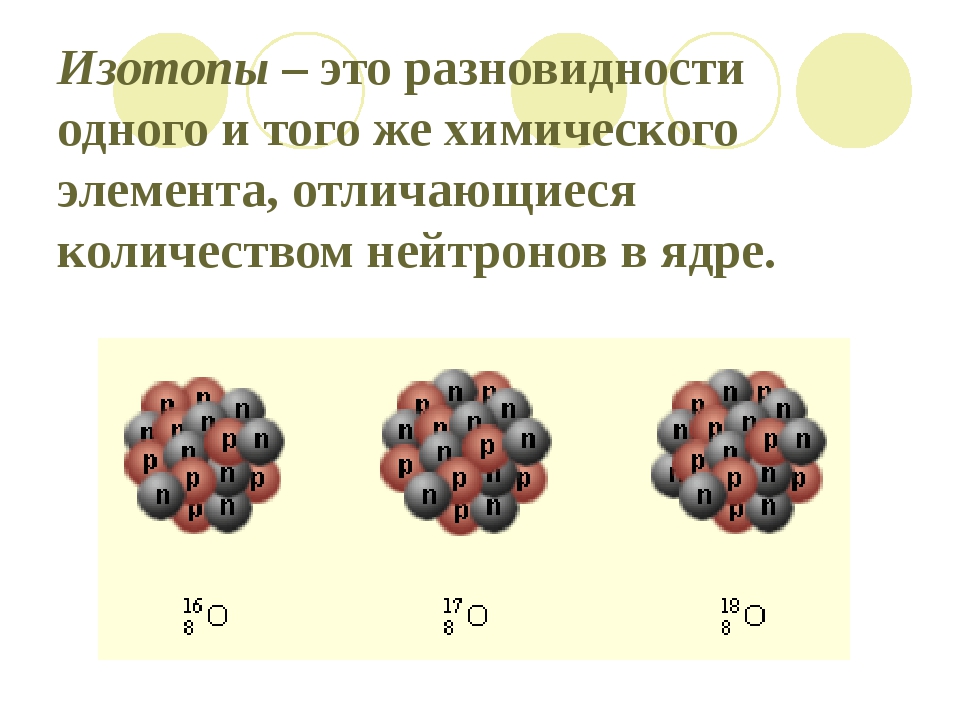
Что такое изотоп?
Изотопами называют видоизменные элементы периодической таблицы Менделеева, которые имеют один и тот же порядковый номер, но различную атомную массу. Название характеризует нахождение подобных структур в одной клеточке периодической таблицы с нормальными элементами (изо – равное, топ – положение, место – в переводе с английского). Состав изотопов представляет собой совокупность протонов, электронов и нейтронов (количество нейтронов обычно больше, чем в обычных элементах периодической таблицы).
Обозначения изотопов
Видоизмененные элементы периодической таблицы Менделеева обозначаются следующим образом: к символу химического элемента, к которому принадлежит изотоп, подписывается верхний левый индекс с обозначением массового числа. Так, например, изотоп кислорода, обладающий массовым числом равным восемнадцати атомных единиц, будет обозначаться следующим образом: 18 O. Имеется также другое обозначение подобных атомов (например, кислород – 18).
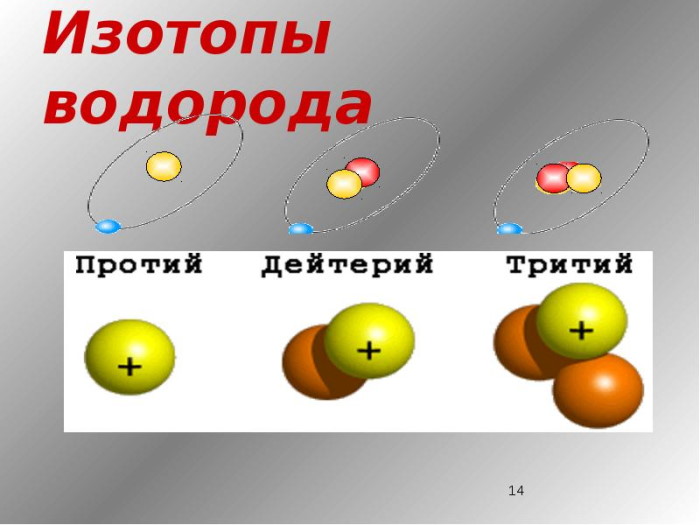
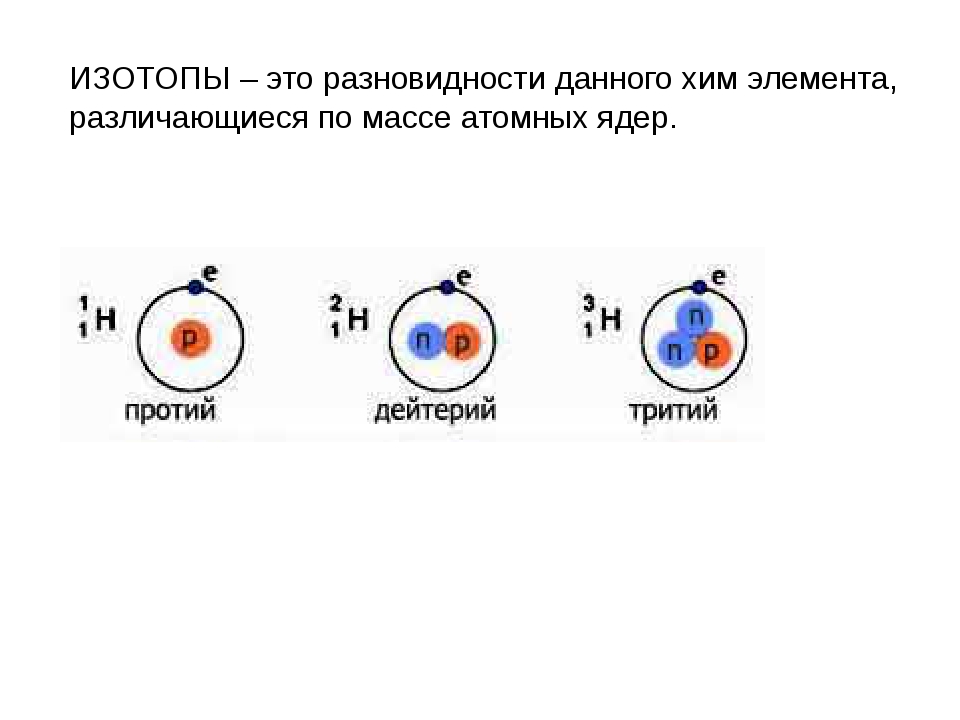
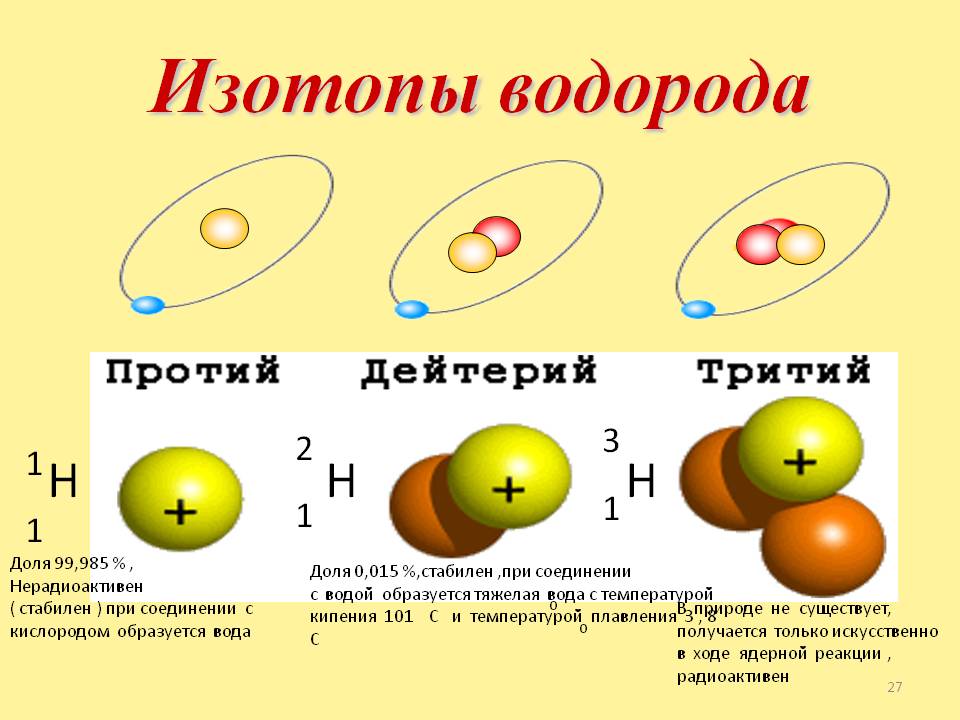
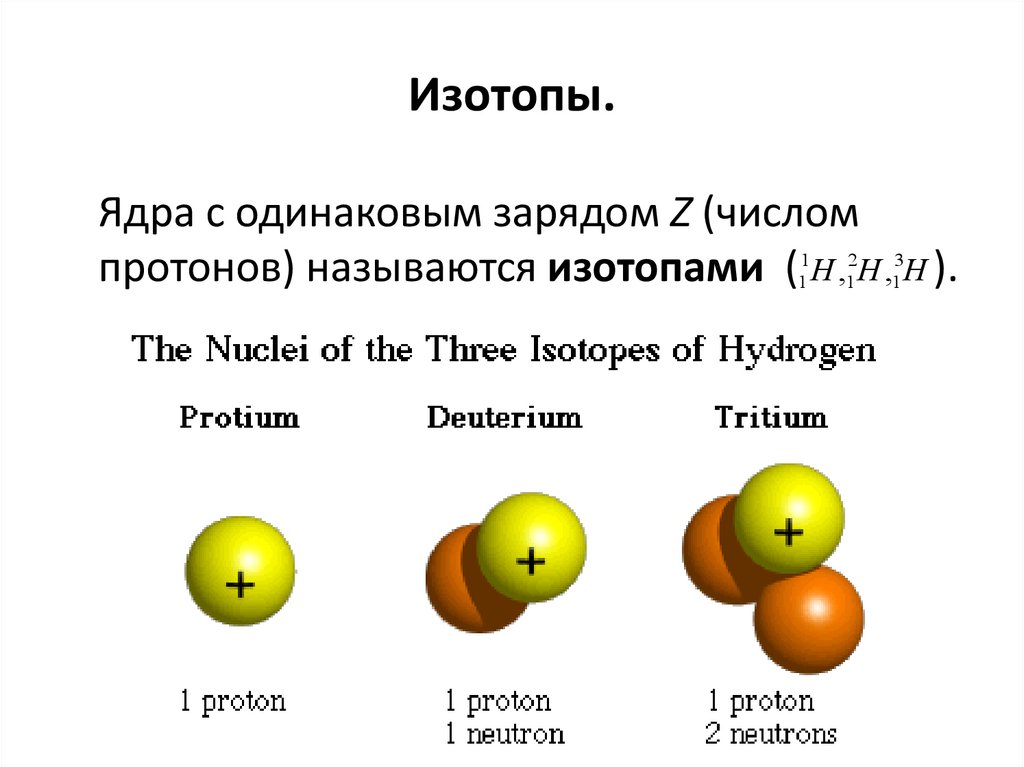
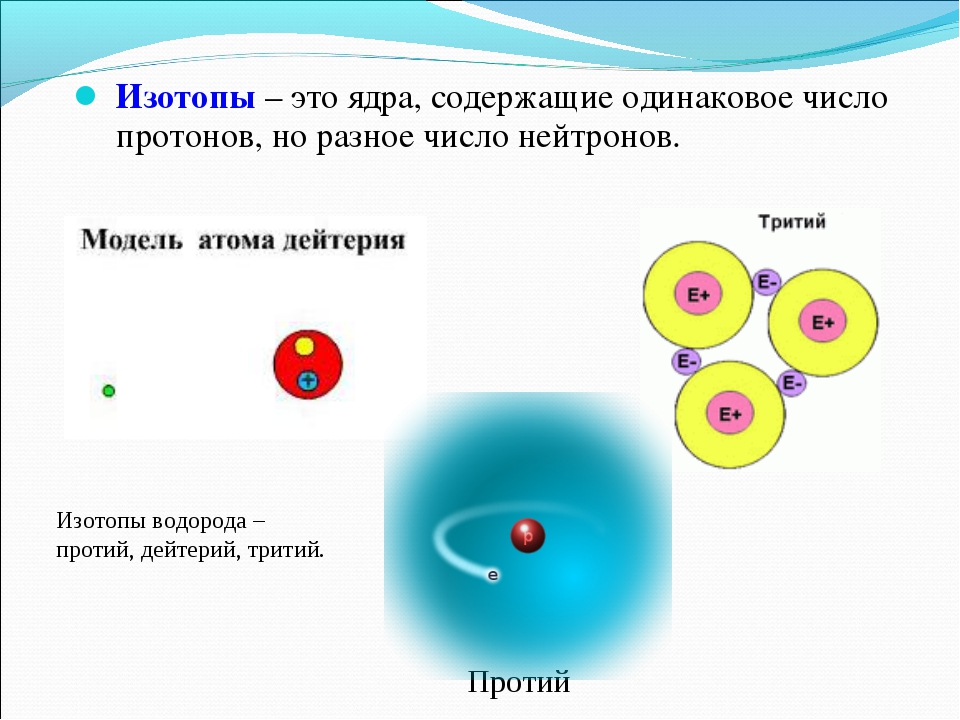
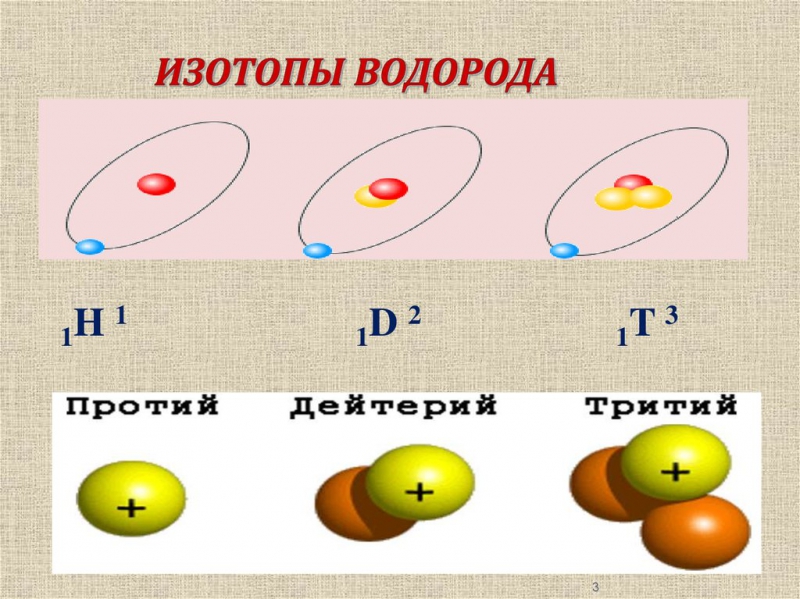
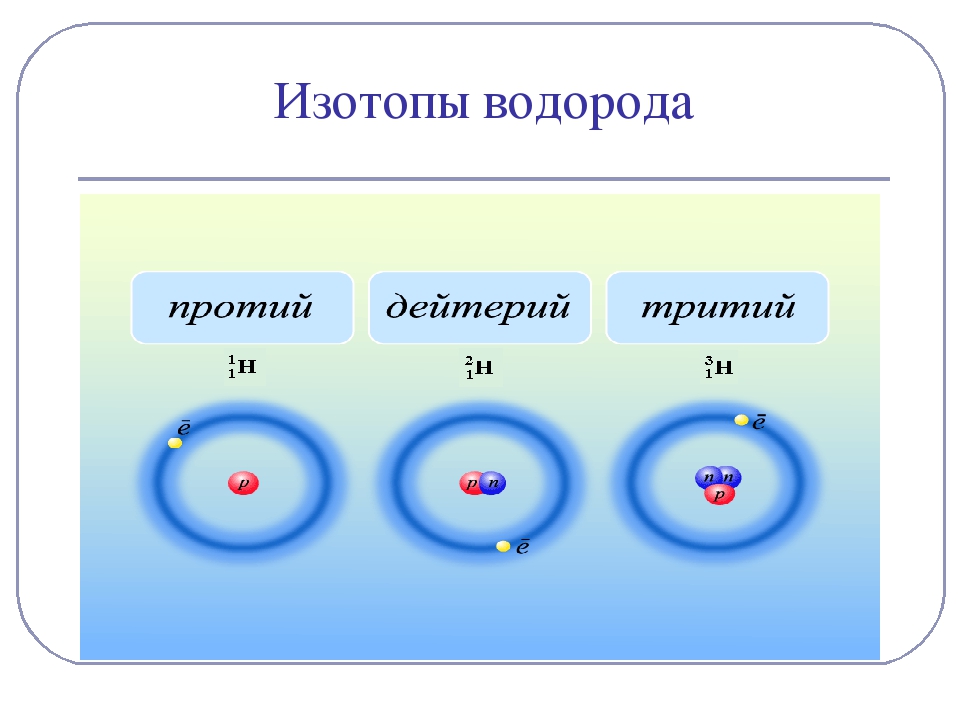
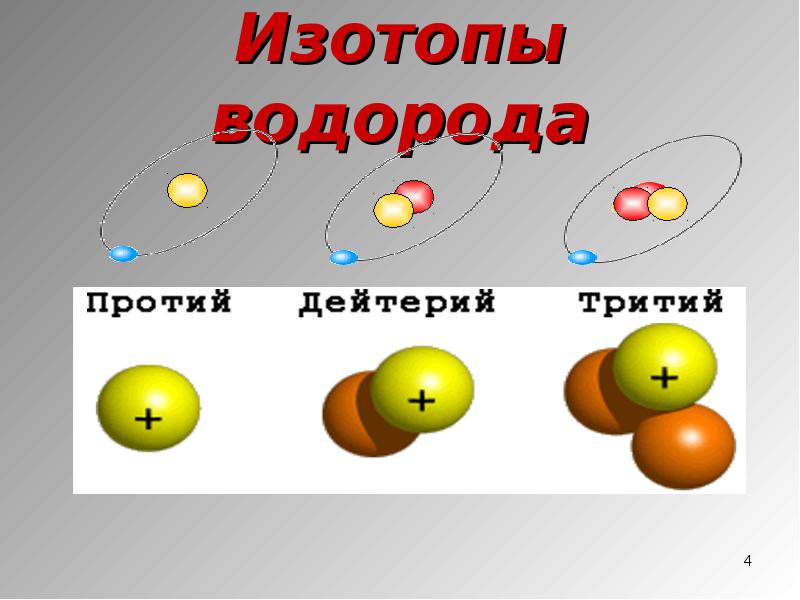
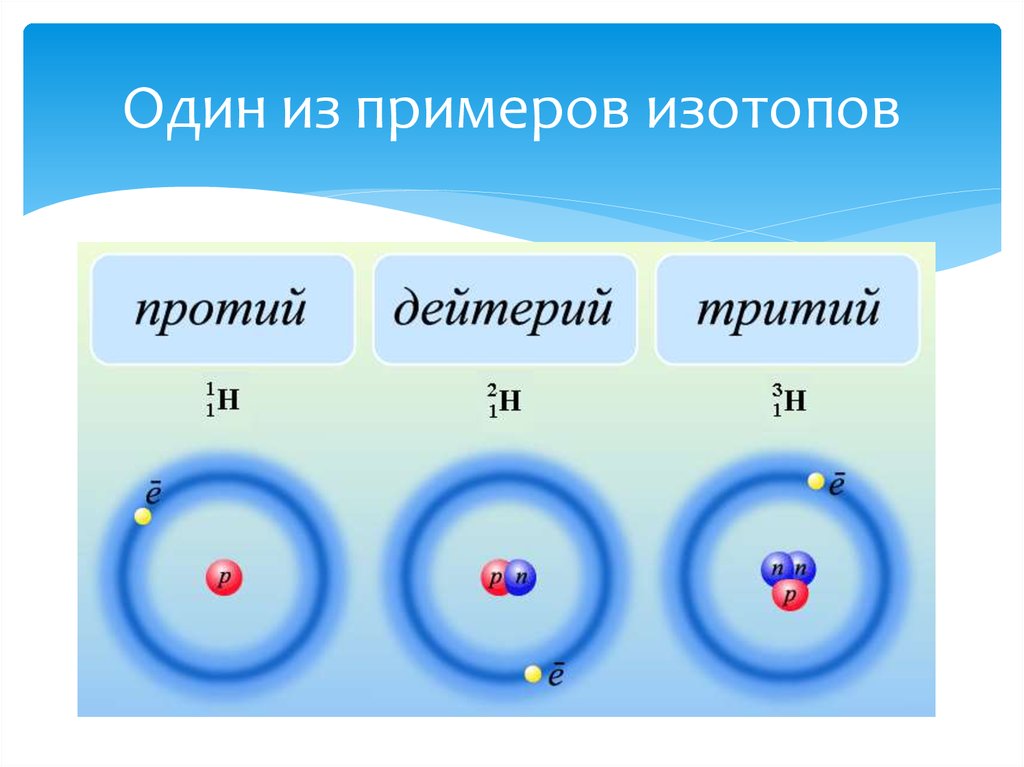
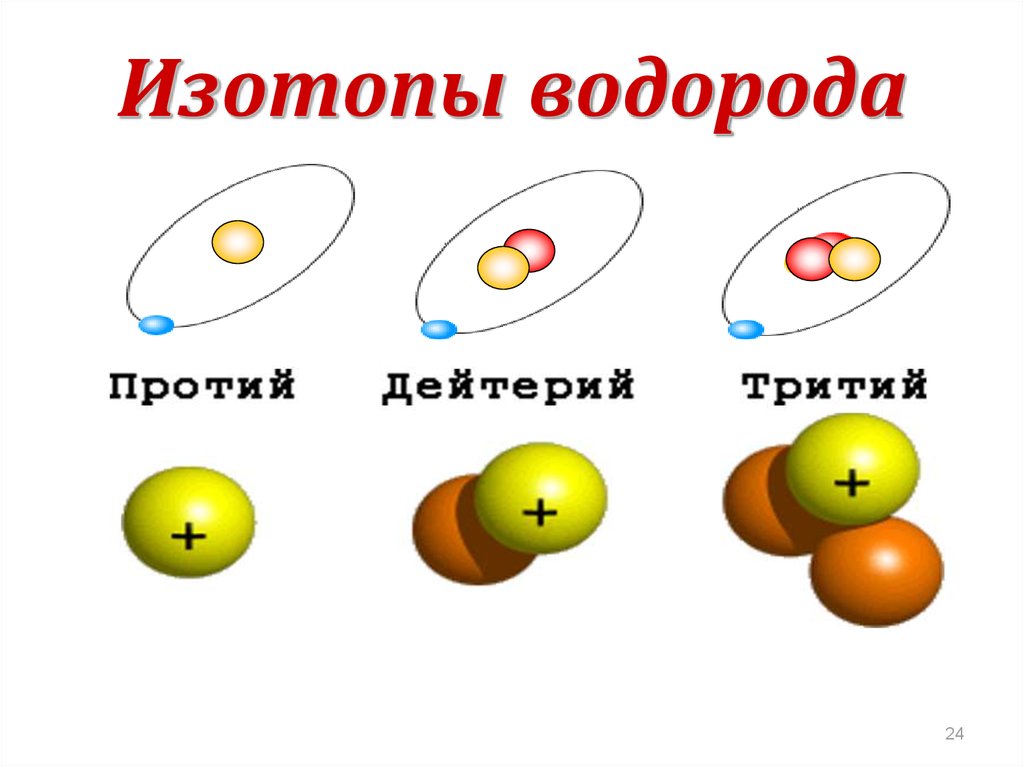
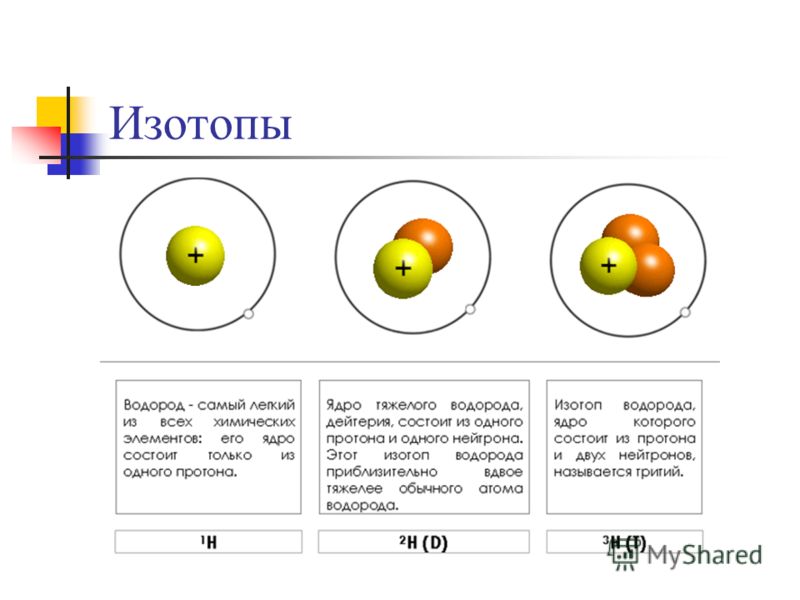
Изотопы водорода
Выделяют три видоизменённых атома водорода, обладающих разными массовыми числами:
протий (Н) – одна атомная единица массы;
дейтерий (D) – две атомные единицы массы;
тритий (Т) – три атомные единицы массы.
Отдельно необходимо выделить, видоизменённые атомы водорода, массовое число которого может колебаться в районе 4 – 7 а.е.м.
Изотопы урана
Изотопный ряд урана включает в себя изотопы, имеющие массу от 219 а.е.м. до 243 а.е.м. Элементы, обладающие наибольшей изотопной распространенностью – это уран – 235 и уран – 238.
Нуклиды
Нуклиды подразделяются на две больших категории:
Химический элемент периодической таблицы ртуть (гидраргирум) обладает наибольшей изотопной распространенностью стабильных нуклидов. Так, стабильные нуклиды ртути – это вещества изотопного ряда гидраргиума, обладающие атомной массой от 170 а.е.м. до 219 а.е.м.
Термин нуклид (в понятии радионуклид) был предложен в двадцатом веке американцем Трумэном Команом. Радионуклиды отличаются длительным периодом полураспада, который в большинстве случаев имеет значение порядка 5*10 8 лет. Таким образом, радионуклиды населяют Землю с момента ее зарождения как планеты. В зависимости от массового числа нуклиды могут подвергать различным видам превращения, обозначим некоторые из них:
альфа-распад (для большинства радионуклидов подобный вид распада не наблюдается и из-за большого периода полураспада);
нейтронный и двухнейтронный распады.
Изотопы галлия
электронный захват (наблюдается в 13% случаев);
позитронный распад (наблюдается в 87% случаев).
Превращения изотопов
Превращения изотопов могут протекать двумя способами:
при участии технологий, созданных человеком (используется в промышленности);
самопроизвольно (протекает в природе).
Выделяют следующие виды ядерных превращений, связанных со изменением атомной массы химических элементов: распад (альфа, бета, двойной бета, нейтронный, позитронный), электронный захват (происходит присоединение электрона, вследствие чего изменяется заряд и состав нуклида).
Применение радиоактивных изотопов
Изотопы химических элементов представляют собой элементы периодической таблицы Менделеева, обладающие нестабильными ядрами и свойством подвергаться различного ядерному распаду. В научной терминологии подобные атомы называют также радионуклидами. Радиоактивные изотопы применяются в различных сферах человеческой деятельности.
В сельском хозяйстве использования радиоизотопов необходимо для изучения особенностей роста, развития и функционирования корневых систем растений (такой способ изучения получил название – метод меченных атомов).
В авиастроительстве радионуклиды применяют для испытания авиационных конструкций на предмет износостойкости.
В сфере градостроительстве радиоактивные изотопы нашли свое применение как универсальные измерители плотности почвы.
В области коммунального хозяйства видоизмененные химические элементы, обладающие радиоактивной способностью, применяют в целях стерилизации постельного белья.
В текстильной промышленности радионуклиды используются для удаления электрических зарядов с поверхности одежды.
В машиностроительной отрасли радионуклиды используются для определения толщины металлического покрытия.
Особое место в этом списке занимает использование радиоактивных изотопов в химической промышленности и в сфере медицинских услуг. Так, получение различных полимерных соединений, которые составляют основу большинства современных предметов обихода, письменных принадлежностей, резиновых изделий того или иногда вида использования происходит при помощи взаимодействия y-излучения с различными химическими соединениями органической природы. В медицине радиоизотопы применяются в лечебных целях в рамках радиационной терапии (процедура, при которой под воздействием радионуклидов происходит разрушение любого типа живой ткани). Радиотерапия нашла свое применения в области лечения онкологических заболеваний (на данный момент, по эффективности радиотерапия уступает только химиотерапии, но зачастую данные способы лечения составляют две стадии одного процесса).
В заключении, стоит отметить, что научный прогресс в области получения новых видов изотопов тех или иных химических элементов не стоит на месте, поэтому возможно в будущем при помощи грамотного и целесообразного использования видоизмененных атомов можно будет лечить неизлечимые на данный момент заболеваний и строить космические корабли для покорения других планет и галактик.
изотопы
Полезное
Смотреть что такое «изотопы» в других словарях:
ИЗОТОПЫ — (от изо. и греческого topos место), разновидности химических элементов, у которых ядра атомов (нуклидов) отличаются числом нейтронов, но содержат одинаковое число протонов и поэтому занимают одно и то же место в периодической системе химических … Современная энциклопедия
Изотопы — (от изо. и греческого topos место), разновидности химических элементов, у которых ядра атомов (нуклидов) отличаются числом нейтронов, но содержат одинаковое число протонов и поэтому занимают одно и то же место в периодической системе химических … Иллюстрированный энциклопедический словарь
ИЗОТОПЫ — (от изо. и греч. topos место) разновидности химических элементов, у которых ядра атомов отличаются числом нейтронов, но содержат одинаковое число протонов и поэтому занимают одно и то же место в периодической системе элементов. Различают… … Большой Энциклопедический словарь
ИЗОТОПЫ — ИЗОТОПЫ, хим. элементы, расположенные в одной и той же клетке периодической системы и следовательно обладающие одинаковым атомным номером или порядко вым числом. При этом И. не должны, вообще говоря, обладать одинаковым атомным весом. Различные… … Большая медицинская энциклопедия
ИЗОТОПЫ — разновидности данного хим. элемента, различающиеся по массе ядер. Обладая одинаковыми зарядами ядер Z, но различаясь числом нейтронов, И. имеют одинаковое строение электронных оболочек, т. е. очень близкие хим. св ва, и занимают одно и то же… … Физическая энциклопедия
изотопы — атомы одного и того же хим. элемента, ядра которых содержат одинаковое число протонов, но различное число нейтронов; имеют разные атомные массы, обладают одними и теми же хим. свойствами, но различаются по своим физ. свойствам, в частности… … Словарь микробиологии
ИЗОТОПЫ — атомы хим. элемента, обладающие разными массовыми числами, но имеющие одинаковый заряд атомных ядер и поэтому занимающие одно место в периодической системе Менделеева. Атомы разных изотопов одного и того же хим. элемента отличаются по числу… … Геологическая энциклопедия
Изотопы — Isotopes нуклиды, имеющие одинаковый атомный номер, но различные атомные массы (например, уран 235 и уран 238). Термины атомной энергетики. Концерн Росэнергоатом, 2010 … Термины атомной энергетики
ИЗОТОПЫ — (от изо. и греч. topos место), элементы с одинаковым порядковым номером, но с разной атомной массой. Большинство радиоактивных изотопов, важных для экологии, обладают энергией от 0,1 до 5 Мэв (чем выше энергия радиоактивных изотопов, тем больше … Экологический словарь
изотопы — Нуклиды, имеющие одинаковый атомный номер, но различные атомные массы (например, уран 235 и уран 238). [http://pripyat.forumbb.ru/viewtopic.php?id=25] Тематики атомная энергетика в целом EN isotopes … Справочник технического переводчика
ИЗОТОПЫ — разновидности атомов данного хим. элемента, ядра которых содержат одинаковое число протонов, но различное число нейтронов. И. имеют разные атомные (см.) и одинаковое число электронов в атомной оболочке, что определяет их очень близкие физ. хим.… … Большая политехническая энциклопедия
Значение слова «изотопы»
[От греч. ’ίσος — равный и τόπος — место]
Источник (печатная версия): Словарь русского языка: В 4-х т. / РАН, Ин-т лингвистич. исследований; Под ред. А. П. Евгеньевой. — 4-е изд., стер. — М.: Рус. яз.; Полиграфресурсы, 1999; (электронная версия): Фундаментальная электронная библиотека
Делаем Карту слов лучше вместе

Спасибо! Я обязательно научусь отличать широко распространённые слова от узкоспециальных.
Насколько понятно значение слова цепляние (существительное):
Ассоциации к слову «изотоп»
Синонимы к слову «изотопы»
Предложения со словом «изотоп»
Сочетаемость слова «изотоп»
Какими бывают «изотопы»
Понятия со словом «изотопы»
Отправить комментарий
Дополнительно
Предложения со словом «изотоп»
Изменения могут выражаться в движении маятника, вибрации кристалла кварца или даже соотношении радиоактивных изотопов углерода в окаменелостях.
Оба изотопа урана – уран-235 и уран-238 подвергаются α-распаду – при самопроизвольном разрушении их ядер выделяется α-частица, которая представляет ничто иное, как ядро атома гелия.
Многие, правда, не знают, что вода содержит также небольшое количество тяжёлого водорода, то бишь изотопа водорода, иногда замещающего обычный водород в молекулах воды.
Изотопы
Вычисление порядкового номера изотопа
Теперь постараемся обобщить сведения, описанные ранее. Поняв, что такое изотопы в химии, пришло время выяснить, как можно использовать полученные знания. Рассмотрим это на конкретном примере. Допустим, известно, что некоторый химический элемент обладает массовым числом 181. При этом оболочка атома данного вещества содержит в себе 73 электрона. Как можно, воспользовавшись таблицей Менделеева, узнать название данного элемента, а также число протонов и нейтронов в составе его ядра?
Приступим к решению задачи. Определить наименование вещества можно, зная его порядковый номер, который соответствует количеству протонов. Так как число положительных и отрицательных зарядов в атоме равны, то оно составляет 73. Значит, это тантал. При том, общее количество нуклонов в сумме составляет 181, а значит, протонов у данного элемента 181 – 73 = 108. Достаточно просто.
Изотопы галлия
Элемент галлий в периодической системе имеет порядковый номер 71. В природе у этого вещества есть два изотопа — 69Ga и 71Ga. Как определить процентное соотношение разновидностей галлия?
Решение задач на изотопы по химии почти всегда связано с информаций, которую можно получить из таблицы Менделеева. В этот раз следует поступить аналогичным образом. Определим из указанного источника среднюю атомную массу. Она равна 69,72. Обозначив за x и y количественное соотношение первого и второго изотопа, примем сумму их равной 1. А значит, в виде уравнения это запишется: x + y = 1. Отсюда следует, что 69x + 71y = 69,72. Выразив y через x и подставив первое уравнение во второе, получаем, что x = 0,64, а y = 0,36. Это значит, что 69Ga содержится в природе 64 %, а процентное соотношение 71Ga составляет 34 %.
Обозначения
Изучая химию в 9 классе и изотопы, школьники узнают о принятых условных обозначениях. Буквой Z отмечается заряд ядра. Это цифра совпадает с количеством протонов и поэтому является их показателем. Сумма этих элементов с нейтронами, отмечаемыми значком N, составляет А – массовое число. Семейство изотопов одного вещества, как правило, обозначается значком того химического элемента, которых в таблице Менделеева наделяется порядковым номером, совпадающим с числом протонов в нём. Левый верхний индекс, добавляемый к указанному значку соответствует массовому числу. К примеру, 238U. Заряд элемента (в данном случае урана, отмеченного порядковым номером 92) обозначается похожим индексом снизу.
Зная эти данные, легко можно подсчитать количество нейтронов у данного изотопа. Оно равно массовому числу за вычетом порядкового номера: 238 – 92 = 146. Количество нейтронов могло бы быть меньше, от этого данный химический элемент не перестал бы оставаться ураном. Следует заметить, что чаще всего у других, более простых, веществ число протонов и нейтронов приблизительно совпадает. Подобные сведения помогают понять, что такое изотоп в химии.
Применение изотопов человеком
Нуклиды 60Co и 137Cs используются в стерилизации γ-лучами (лучевая стерилизация) как один из методов физической стерилизации инструментов, перевязочного материала и прочего. Доза проникающей радиации должна быть весьма значительной — до 20-25 кГр, что требует особых мер безопасности. В связи с этим лучевая стерилизация проводится в специальных помещениях и является заводским методом стерилизации (непосредственно в стационарах она не производится).
История открытия изотопов
Первое доказательство того, что вещества, имеющие одинаковое химическое поведение, могут иметь различные физические свойства, было получено при исследовании радиоактивных превращений атомов тяжёлых элементов. В 1906—1907 годах выяснилось, что продукт радиоактивного распада урана — ионий и продукт радиоактивного распада тория — радиоторий имеют те же химические свойства, что и торий, но отличаются от него атомной массой и характеристиками радиоактивного распада. Было обнаружено позднее, что у всех трёх продуктов одинаковы оптические и рентгеновские спектры. Такие вещества, идентичные по химическим свойствам, но различные по массе атомов и некоторым физическим свойствам, по предложению английского учёного Содди с 1910 г. стали называть изотопами.








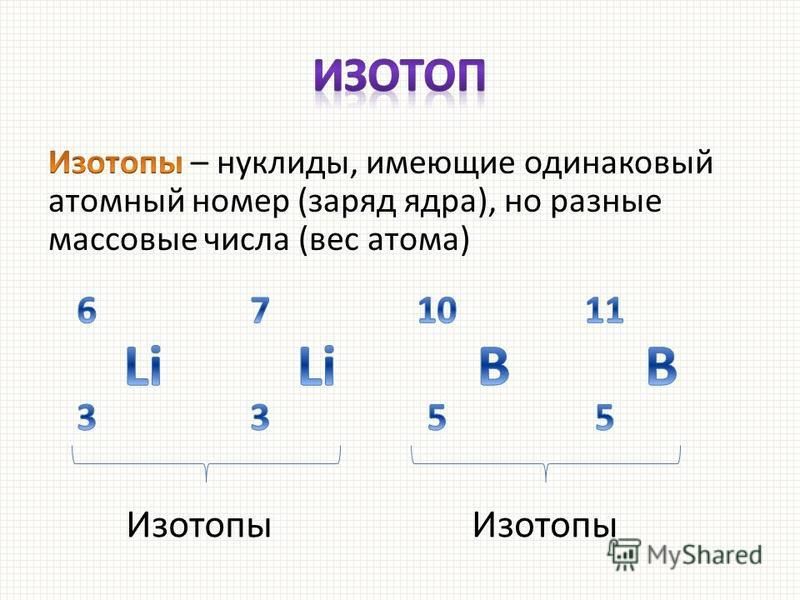
К началу 2016 года открыто 3211 изотопов всех элементов (без учёта изомеров), из них 431 (13 %) стабильных или околостабильных, 294 (9 %) изотопы трансурановых элементов, 1209 (38 %) нейтронно-избыточных и 1277 (40 %) протонно-избыточных (то есть отклоняющихся от линии бета-стабильности в сторону избытка нейтронов или протонов, соответственно). По количеству открытых изотопов первое место занимают США (1237), затем идут Германия (558), Великобритания (299), СССР/Россия (247) и Франция (217). Среди лабораторий мира первые пять мест по числу открытых изотопов занимают Национальная лаборатория им. Лоуренса в Беркли (638), Институт тяжёлых ионов в Дармштадте (438), Объединённый институт ядерных исследований в Дубне (221), Кавендишская лаборатория в Кембридже (218) и ЦЕРН (115). За 10 лет (2006—2015 годы включительно) в среднем физики открывали в год 23 нейтронно-избыточных и 3 протонно-избыточных изотопа, а также 4 изотопа трансурановых элементов. Общее количество учёных, являвшихся авторами или соавторами открытия какого-либо изотопа, составляет 3598 человек.
Тритий
Сложнее всех устроен тритий. Это сверхтяжёлый водород. В соответствии с определением изотопов в химии, он имеет зарядовое число 1, но массовое число 3. Его часто называют тритоном, потому что помимо одного протона, он имеет в составе ядра два нейтрона, то есть состоит из трёх элементов. Наименование этого элемента, открытого в 1934 году Резерфордом, Олифантом и Хартеком, было предложено ещё до его выявления.
Это неустойчивое вещество, проявляющее радиоактивные свойства. Ядро его обладает способностью расщепляться с выделение бета-частицы и электронного антинейтрино. Энергия распада данного вещества не очень велика и составляет 18,59 кэВ. Поэтому подобная радиация не является для человека слишком опасной. От неё способна защитить обыкновенная одежда и хирургические перчатки. А получаемый с пищей этот радиоактивный элемент быстро выводится из организма.
Примечания
Thoennessen M. (2016), 2015 Update of the Discoveries of Isotopes,
Превращения изотопов
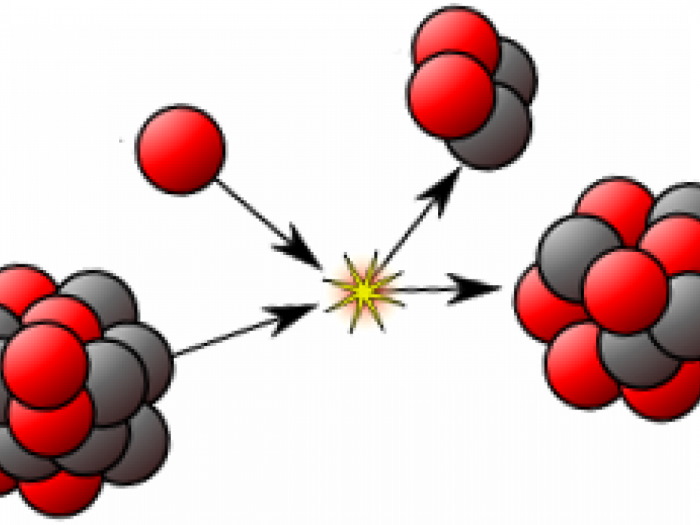
Радиоактивное расщепление изотопов с трансформацией их в другие элементы разделяется на три основных типа. Первым из них является альфа-распад. Он происходит с испусканием частицы, представляющей собой ядро атома гелия. То есть это образование, состоящие из совокупности пар нейтронов и протонов. Поскольку количество последних определяет зарядовое число и номер атома вещества в периодической системе, то в результате этого процесса происходит качественное превращение одного элемента в другой, а в таблице он сдвигается влево на две клетки. При этом массовое число элемента уменьшается на 4 единицы. Это мы знаем из разделов химии о строении атомов изотопов.
При потере ядром атома бета-частицы, по сути представляющей собой электрон, меняется его состав. Один из нейтронов трансформируется в протон. Это значит, что качественные характеристики вещества вновь меняются, а элемент сдвигается в таблице на одну клетку вправо, практически не теряя при этом в массе. Обычно подобное превращение сопряжено с электромагнитным гамма-излучением.
Применение изотопов.
Разнообразные изотопы химических элементов находят широкое применение в научных исследованиях, в различных областях промышленности и сельского хозяйства, в ядерной энергетике, современной биологии и медицине, в исследованиях окружающей среды и других областях. В научных исследованиях (например, в химическом анализе) требуются, как правило, небольшие количества редких изотопов различных элементов, исчисляемые граммами и даже миллиграммами в год. Вместе с тем, для ряда изотопов, широко используемых в ядерной энергетике, медицине и других отраслях, потребность в их производстве может составлять многие килограммы и даже тонны. Так, в связи с использованием тяжелой воды D2O в ядерных реакторах ее общемировое производство к началу 1990-х прошлого века составляло около 5000 т в год. Входящий в состав тяжелой воды изотоп водорода дейтерий, концентрация которого в природной смеси водорода составляет всего 0,015%, наряду с тритием станет в будущем, по мнению ученых, основным компонентом топлива энергетических термоядерных реакторов, работающих на основе реакций ядерного синтеза. В этом случае потребность в производстве изотопов водорода окажется огромной.
В научных исследованиях стабильные и радиоактивные изотопы широко применяются в качестве изотопных индикаторов (меток) при изучении самых различных процессов, происходящих в природе.
В сельском хозяйстве изотопы («меченые» атомы) применяются, например, для изучения процессов фотосинтеза, усвояемости удобрений и для определения эффективности использования растениями азота, фосфора, калия, микроэлементов и др. веществ.
Изотопные технологии находят широкое применение в медицине. Так в США, согласно статистическим данным, проводится более 36 тыс. медицинских процедур в день и около 100 млн. лабораторных тестов с использованием изотопов. Наиболее распространены процедуры, связанные с компьютерной томографией. Изотоп углерода C13, обогащенный до 99% (природное содержание около 1%), активно используется в так называемом «диагностическом контроле дыхания». Суть теста очень проста. Обогащенный изотоп вводится в пищу пациента и после участия в процессе обмена веществ в различных органах тела выделяется в виде выдыхаемого пациентом углекислого газа СО2, который собирается и анализируется с помощью спектрометра. Различие в скоростях процессов, связанных с выделением различных количеств углекислого газа, помеченных изотопом С13, позволяют судить о состоянии различных органов пациента. В США число пациентов, которые будут проходить этот тест, оценивается в 5 млн. человек в год. Сейчас для производства высоко обогащенного изотопа С13 в промышленных масштабах используются лазерные методы разделения.






Дефект массы и энергия связи ядра
Затронув тему изотопов, нельзя пройти мимо феномена дефект массы ядра. Когда из отдельных нуклонов образуется атомное ядро, часть их массы превращается в энергию. Другими словами, вот взяли вы щепотку протонов и нейтронов, хорошенько их смяли вместе, и получили ядро, но его масса будет меньше массы исходных компонентов. Это и есть дефект масс. Формула для расчета дефекта массы ядра:
где Mя– масса ядра, Z – число протонов в ядре, N – число нейтронов в ядре, mp– масса протона, mn– масса нейтрона.
Если к атому подвести энергию (которая эквивалентна дефекту масс), то можно разделить его ядро обратно на нуклоны. Эта энергия носит название энергия связи ядра. Формула для расчета энергии связи ядра:
где с — скорость света, ∆m — дефект массы ядра
Проверьте себя, как вы усвоили понятия дефект массы и энергия связи ядра, самостоятельно решив задачу пользуясь формулами выше.
Пример 2. Если образовать атом углерода-12 из субатомных частиц, какое значение будет иметь дефект масс?





Теперь нам известно, что каждый изотоп элемента характеризуется порядковым номером (суммарным числом протонов), массовым числом (суммарным числом протонов и нейтронов) и атомной массой (массой атома, выраженной в атомных единицах массы). Поскольку дефект массы при образовании атома очень мал, массовое число обычно совпадает с атомной массой изотопа, округленной до ближайшего целого числа. (Например, атомная масса хлора-37 равна 36,966, что после округления дает 37.) Если в природе встречается несколько изотопов одного элемента, то экспериментально наблюдаемая атомная масса (естественная атомная масса) равна средневзвешенному значению атомных масс отдельных изотопов. Это средневзвешенное значение определяется соответственно относительному содержанию изотопов в природе. Хлор существует в природе в виде смеси из 75,53% хлора-35 (атомная масса 34,97 а.е.м.) и 24,47% хлора-37 (36,97 а.е.м.), поэтому средневзвешенное значение масс этих изотопов равно
(0,7553·34,97 а.е.м.) + (0,2447·36,97 а.е.м.) = 35,46 а.е.м.
Атомные массы, указанные в таблице Менделеева представляют собой во всех случаях средневзвешенные значения атомных масс изотопов, встречающихся в природе, и именно этими значениями мы будем пользоваться в дальнейшем, за исключением тех случаев, когда будет обсуждаться какой-нибудь конкретный изотоп. Все изотопы одного элемента в химическом отношении ведут себя практически одинаково. На рисунке ниже изображены состав и свойства некоторые атомов, ионов и изотопов элементов.
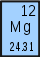
Пример 3. Магний (Mg) в основном состоит из трех естественных изотопов: 78,70% всех атомов магния имеют атомную массу 23,985 а.е.м., 10,13% — 24,986 а.е.м. и 11,17% — 25,983 а.е.м. Сколько протонов и нейтронов содержится в каждом из этих трех изотопов? Чему равно средневзвешенное значение их атомных масс?
Решение: Все изотопы магния содержат по 12 протонов. Изотоп с атомной массой 23,985 а.е.м. имеет массовое число 24 (суммарное число протонов и нейтронов), следовательно, он имеет 24 — 12 = 12 нейтронов. Символ этого изотопа 24Mg. Аналогично находим, что изотоп с атомным весом 24,986 а.е.м. имеет массовое число 25, содержит 13 нейтронов и имеет символ 25Mg. Третий изотоп (25,983 а.е.м.) имеет массовое число 26, содержит 14 нейтронов и имеет символ 26Mg. Средняя атомная масса магния находится следующим образом:
(0,7870·23,985 а.е.м.) + (0,1013·24,986 а.е.м.) + (0,1117·25,983 а.е.м.) = 24,31 а.е.м.
Надеюсь урок 2 «Изотопы элементов» помог вам понять что из себя представляют изотопы. Если у вас возникли вопросы, пишите их в комментарии.
Атом и его частицы
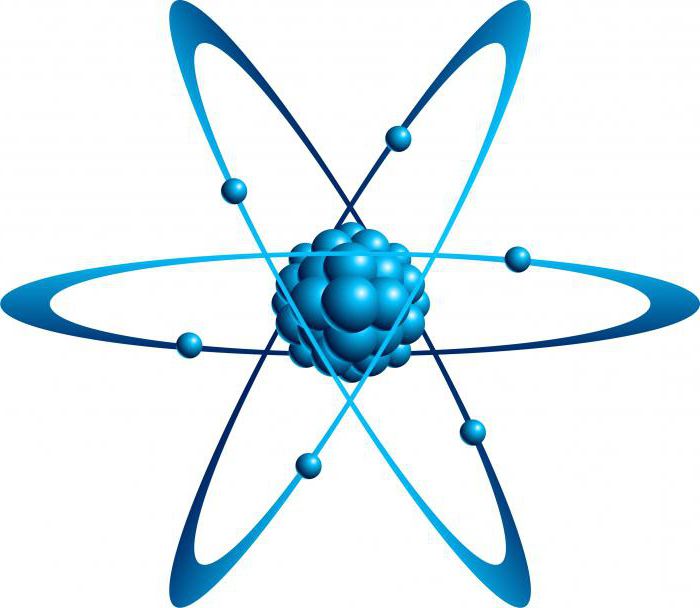
Исследуя структуру материи посредством бомбардировки альфа-частицами, Э. Резерфорд доказал в 1910 году, что основное пространство атома заполнено пустотой. И только в центре находится ядро. Вокруг него по орбиталям двигаются отрицательные электроны, составляя оболочку этой системы. Так была создана планетарная модель «кирпичиков» материи.
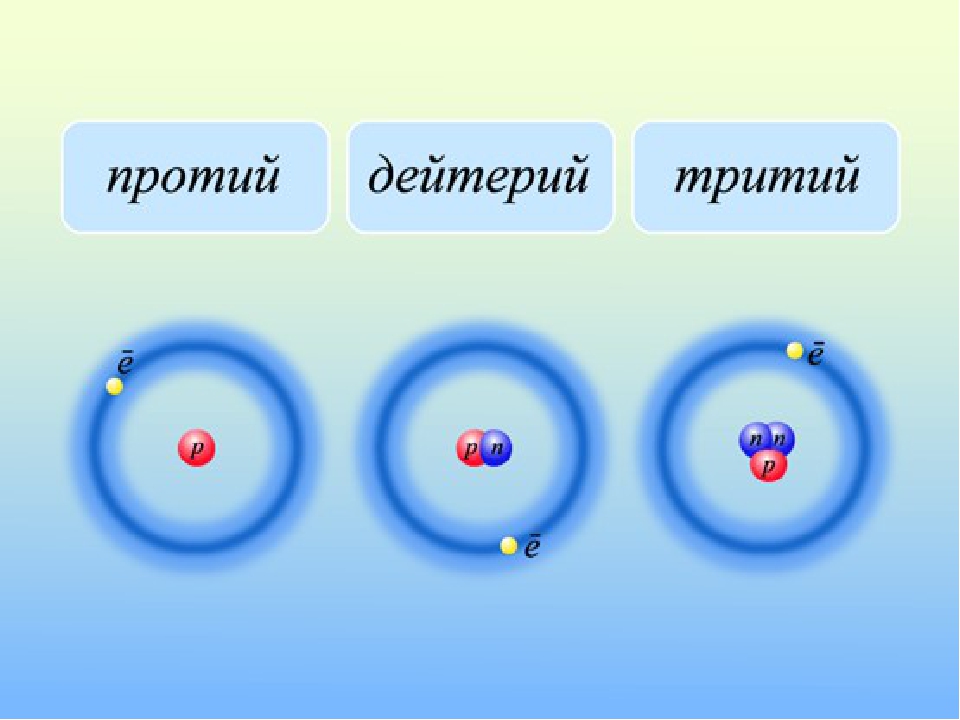




Что такое изотопы? Вспомните из курса химии, что ядро тоже имеет сложное строение. Оно состоит из положительных протонов и не имеющих заряда нейтронов. Количество первых определяет качественные характеристики химического элемента. Именно число протонов отличает вещества друг от друга, наделяя их ядра определённым зарядом. И по этому признаку им присваивается порядковый номер в таблице Менделеева. Но количество нейтронов у одного и того же химического элемента дифференцирует их на изотопы. Определение в химии данному понятию поэтому можно дать следующее. Это разновидности атомов, отличающиеся по составу ядра, обладающие одинаковым зарядом и порядковым номеров, но имеющие разные массовые числа, ввиду различий в количестве нейтронов.
Нуклиды
Не каждый из видов атома, характеризующихся собственным и строго определённым числом протонов и электронов, настолько стабилен, чтобы существовать хоть сколько-нибудь продолжительный период, достаточный для его изучения. Те из них, которые обладают относительной устойчивостью, называются нуклидами. Стабильные образования такого рода радиоактивному распаду не подвергаются. Нестабильные называются радионуклидами и тоже, в свою очередь, делятся на короткоживущие и долгожители. Как известно из уроков химии 11 класса о строении атомов изотопов, наибольшим числом радионуклидов обладают осмий и платина. По одному стабильному имеют кобальт и золото, а наибольшее количество устойчивых нуклидов у олова.
Методы разделения изотопов.
Для изучения свойств изотопов и особенно для их применения в научных и прикладных целях требуется их получение в более или менее заметных количествах. В обычных масс-спектрометрах достигается практически полное разделение изотопов, однако количество их ничтожно мало. Поэтому усилия ученых и инженеров были направлены на поиски других возможных методов разделения изотопов. В первую очередь были освоены физико-химические методы разделения, основанные на различиях в таких свойствах изотопов одного итого же элемента, как скорости испарения, константы равновесия, скорости химических реакций и т.п. Наиболее эффективными среди них оказались методы ректификации и изотопного обмена, которые нашли широкое применение в промышленном производстве изотопов легких элементов: водорода, лития, бора, углерода, кислорода и азота.
Другую группу методов образуют так называемые молекулярно-кинетические методы: газовая диффузия, термодиффузия, масс-диффузия (диффузия в потоке пара), центрифугирование. Методы газовой диффузии, основанные на различной скорости диффузии изотопных компонентов в высокодисперсных пористых средах, были использованы в годы второй мировой войны при организации промышленного производства разделения изотопов урана в США в рамках так называемого Манхэттенского проекта по созданию атомной бомбы. Для получения необходимых количеств урана, обогащенного до 90% легким изотопом 235U – главной «горючей» составляющей атомной бомбы, были построены заводы, занимавшие площади около четырех тысяч гектар. На создание атомного центра с заводами для получения обогащенного урана было ассигновано более 2-х млрд. долл. После войны в СССР были разработать и построены заводы по производству обогащенного урана для военных целей, также основанные на диффузионном методе разделения. В последние годы этот метод уступил место более эффективному и менее затратному методу центрифугирования. В этом методе эффект разделения изотопной смеси достигается за счет различного действия центробежных сил на компоненты изотопной смеси, заполняющей ротор центрифуги, который представляет собой тонкостенный и ограниченный сверху и снизу цилиндр, вращающийся с очень высокой скоростью в вакуумной камере. Сотни тысяч соединенных в каскады центрифуг, ротор каждой из которых совершает более тысячи оборотов в секунду, используются в настоящее время на современных разделительных производствах как в России, так и в других развитых странах мира. Центрифуги используются не только для получения обогащенного урана, необходимого для обеспечения работы ядерных реакторов атомных электростанций, но и для производства изотопов примерно тридцати химических элементов средней части периодической системы. Для разделения различных изотопов используются также установки электромагнитного разделения с мощными источниками ионов, в последние годы получили распространение также лазерные методы разделения.
Терминология
Первоначально изотопы также назывались изотопными элементами, а в настоящее время иногда называют изотопными нуклидами.
Основная позиция ИЮПАК состоит в том, что правильным термином в единственном числе для обозначения атомов одного химического элемента с одинаковой атомной массой является нуклид, а термин изотопы допускается применять для обозначения совокупности нуклидов одного элемента. Термин изотопы был предложен и применялся изначально во множественном числе, поскольку для сравнения необходимо минимум две разновидности атомов. В дальнейшем в практику широко вошло также употребление термина в единственном числе — изотоп. Кроме того, термин во множественном числе часто применяется для обозначения любой совокупности нуклидов, а не только одного элемента, что также некорректно. В настоящее время позиции международных научных организаций не приведены к единообразию и термин изотоп продолжает широко применяться, в том числе и в официальных материалах различных подразделений ИЮПАК и ИЮПАП. Это один из примеров того, как смысл термина, изначально в него заложенный, перестаёт соответствовать понятию, для обозначения которого этот термин используется (другой хрестоматийный пример — атом, который, в противоречии с названием, не является неделимым).
Использование радиоактивных изотопов
Всем прекрасно известно, какой вред живым организмам может нанести радиоактивное излучение. Однако свойства радиоактивных изотопов бывают для человека полезны. Они с успехом применяются во многих отраслях промышленности. С их помощью возможно обнаружить утечку в инженерных и строительных сооружениях, подземных трубопроводах и нефтепроводах, накопительных баках, теплообменниках на электростанциях.
Указанные свойства активно используются также в научных экспериментах. К примеру, муха цеце является переносчиком многих серьёзных заболеваний для человека, скота и домашних животных. В целях предотвращения подобного самцов этих насекомых стерилизуют посредством слабого радиоактивного излучения. Изотопы также бывают незаменимы при изучении механизмов некоторых химических реакций, ведь атомами данных элементов можно метить воду и другие вещества.







При биологических исследованиях часто также используются меченые изотопы. К примеру, именно таким образом было установлено, как фосфор влияет на почву, рост и развитие культурных растений. С успехом свойства изотопов применяются и в медицине, что позволило лечить раковые опухоли и другие тяжёлые заболевания, определять возраст биологических организмов.
Нуклоны
Индивидуальностью определённый элемент наделяет именно число протонов, а количество нейтронов на неё никаким образом не влияет. Но атомная масса составляется из этих двух указанных элементов, имеющих общее наименование «нуклоны», представляя собой их сумму. Однако этот показатель не зависит от числа электронов, формирующих отрицательно заряженную оболочку атома. Почему? Стоит только сравнить.
Доля массы протона в атоме велика и составляет приблизительно 1 а. е. м. или 1,672 621 898(21)·10-27кг. Нейтрон близок к показателям этой частицы (1,674 927 471(21)·10-27кг). А вот масса электрона в тысячи раз меньше, считается ничтожной и не учитывается. Вот почему, зная верхний индекс элемента в химии, состав ядра изотопов узнать несложно.