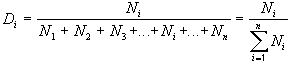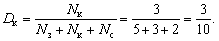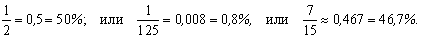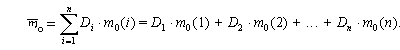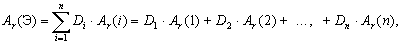Изотопы и нуклиды чем отличается
§10. Нуклиды и изотопы. Понятие о радиоактивности
Д. И. Менделеев, размещая химические элементы в периодической системе, вынужден был поставить некоторые из них не в порядке возрастания атомных масс.
В то время этому факту не было объяснения, и Д. И. Менделеев руководствовался только принципом периодичности, согласно которому эти элементы должны были занимать места в соответствии с химическими свойствами их атомов.
НУКЛИДЫ
Исследованиями начала XX веке было установлено, что атомы одного и того же элемента могут иметь разные массы. Это объясняется тем, что в их ядрах при одном и том же числе протонов может находиться разное число нейтронов. Общее число протонов (Z) и нейтронов (N) в ядре называется массовым числом атома (А):
Массовое число практически определяет массу ядра, а следовательно, и массу всего атома, так как масса электронов составляет ничтожную часть общей массы атома. Т.е. массовое число приблизительно равно относительной атомной массе элемента.
Заряд ядра атома Z (т. е. число протонов) и его массовое число A указывают числовыми индексами слева от символа химического элемента:
Вид атомов с определенным значением атомного номера и массового числа называется нуклидом. Т.е. нуклид – это химический элемент с указанием массового числа.
Например, углерод-12, или 12 С; кислород-16, или 16 O; сера-35, или 35 S. Число нейтронов N у любого нуклида легко подсчитать по разности
Еще один вопрос стоял перед учеными: почему относительные атомные массы большинства элементов не являются целочисленными величинами, хотя массовые числа их нуклидов выражаются целыми числами?
Открытие изотопов позволило дать ответ на этот вопрос.
ИЗОТОПЫ
В начале XX в. было доказано, что большинство химических элементов в природе существует в виде нескольких нуклидов. Так, природный литий (Z = 3), кроме нуклидов, в ядрах которых находится 4 нейтрона, имеет нуклиды с числим нейтронов 3. Массовые числа таких нуклидов равны соответственно 6 и 7: 3 6 Li и 3 7 Li.
Нуклиды такого типа назвали изотопами.
Изотопами называются нуклиды, имеющие одинаковый атомный номер (т.е. одинаковое число протонов в ядре), но различные массовые числа
Следовательно, нуклиды 3 6 Li и 3 7 Li — изотопы лития. Другими словами, изотопы — это разновидности атомов одного и того же эле мента, в ядрах которых содержится разное число нейтронов.
Следовательно, атомы данного химического элемента — это нуклиды с одинаковым зарядом ядра (атомным номером).
ОТНОСИТЕЛЬНАЯ АТОМНАЯ МАССА
В природе большинство химических элементов существуют в виде смеси нуклидов, каждый из которых характеризуется своим собственным значением массового числа. Поэтому относительная атомная масса данного элемента является усредненной величиной относительных атомных масс его нуклидов. Конечно, при этом учитывается содержание каждого нуклида в природной смеси.
Теперь понятно, почему относительная атомная масса калия меньше, чем аргона. У калия более 93 % его природных атомов имеет массовое число 39, а у аргона 99 % природной смеси приходится на долю нуклида аргон-40. Поэтому относительная атомная масса калия ближе к 39, а аргона — к 40. Однако заряд ядра атомов калия равен 19+, а аргона 18+, и поэтому в таблице они размещаются согласно этой главной характеристике химического элемента.
Относительная атомная масса элемента — физическая величина, которая показывает, во сколько раз средняя масса атомов данного химического элемента больше 1/12 части массы нуклида углерода-12 ( 12 С).
ЯВЛЕНИЕ РАДИОАКТИВНОСТИ
Все нуклиды можно разделить на два типа: стабильные и радиоактивные. Само название «стабильный» говорит об устойчивости данного нуклида, т. е. его способности существовать без изменения состава ядра сколь угодно долго. Стабильность этих нуклидов определяется прежде всего устойчивостью их ядер.
Устойчивость ядра зависит только от соотношения между числом протонов и нейтронов (для каждого элемента оно свое). Если это соотношение выходит за определенные пределы, ядро (а вместе с ним и атом) становится неустойчивым.
Оно самопроизвольно распадается, превращаясь в ядра атомов других элементов. При этом происходит испускание различных частиц. Это явление и есть радиоактивность.
Радиоактивностью называется самопроизвольное превращение неустойчивых атомных ядер в другие ядра, сопровождающееся испусканием различных частиц.
Изотопы и нуклиды чем отличается
Таким образом, атом представляет собой материальную систему, состоящую из ядра и электронной оболочки.
Атомы очень маленькие – так, по толщине бумажного листа укладываются сотни тысяч атомов. Размеры атомных ядер – еще в сто тысяч раз меньше размеров атомов.
Ядра атомов заряжены положительно, но состоят они не только из протонов. Ядра содержат еще и нейтральные частицы, открытые в 1932 году и названные нейтронами. Протоны и нейтроны вместе носят название нуклоны – то есть ядерные частицы.
Любой атом в целом электронейтрален, а это значит, что число электронов в электронной оболочке атома равно числу протонов в его ядре.
Нейтрон
1932
Джозеф Джон Томсон
Джеймс Чедвик
n o
значение

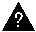
2.Во сколько раз (приближенно) масса любого нуклона больше массы электрона?
3.Определите, какую часть от массы атома составит масса его электронов, если в состав атома входят 8 протонов и 8 нейтронов. 4.Как вы думаете, удобно ли использовать единицы международной системы единиц измерений (СИ) для измерений масс атомов?
Между всеми заряженными частицами атома действуют электрические (электростатические) силы: электроны атома притягиваются к ядру и вместе с тем отталкиваются друг от друга. Действие заряженных частиц друг на друга передается электрическим полем.
Вам знакомо уже одно поле – гравитационное. Подробнее о том, что такое поля, и о некоторых их свойствах вы узнаете из курса физики.
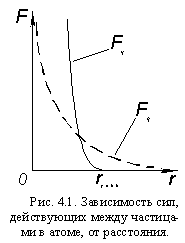
Все протоны в ядре заряжены положительно и за счет электрических сил отталкиваются друг от друга. Но ядра же существуют! Следовательно, в ядре, кроме электростатических сил отталкивания, действует еще какое-то взаимодействие между нуклонами, за счет сил которого они притягиваются друг к другу, причем это взаимодействие – значительно сильнее электростатического. Эти силы называются ядерными силами, взаимодействие – сильным взаимодействием, а поле, передающее это взаимодействие – сильным полем.
В отличие от электростатического, сильное взаимодействие ощущается только на коротких расстояниях – порядка размеров ядер. Но силы притяжения, вызванные этим взаимодействием (Fя). во много раз больше электростатических (Fэ). Отсюда – » прочность» ядер во много раз больше » прочности» атомов. Поэтому в химических явлениях изменяется только электронная оболочка, а ядра атомов остаются неизменными.
Атомное ядро – сложная положительно заряженная частица, состоящая из нуклонов, связанных между собой ядерными силами.
Плотность вещества ядер огромна: она примерно равна 100 миллионам тонн на кубический сантиметр, что несоизмеримо с плотностью любого химического вещества.

Для обозначения нуклидов используют символы элементов (вы помните, что они могут обозначать и один атом) с левыми индексами: верхний равен массовому числу, нижний – числу протонов. Примеры обозначения нуклидов:
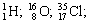
Так как заряд ядра определяется числом протонов, то химическим элементом можно назвать совокупность нуклидов с одинаковым числом протонов.Вспомнив сказанное в начале параграфа, мы можем уточнить один из важнейших химических законов.
При химических реакциях (и при физических взаимодействиях, не затрагивающих ядра) нуклиды не возникают, не исчезают и не превращаются друг в друга.
Итак, массовое число равно сумме числа протонов и числа нейтронов: А = Z + N. У нуклидов одного элемента заряд ядра одинаков (Z = const), а число нейтронов N? У нуклидов одного элемента число нейтронов в ядре может быть одинаковым, а может и отличаться. Поэтому и массовые числа нуклидов одного элемента могут быть разными. Примеры нуклидов одного элемента с разными массовыми числами – различные устойчивые нуклиды олова, характеристики которых приведены в табл. 12. У нуклидов с одинаковыми массовыми числами масса одинакова, а у нуклидов с разными массовыми числами – разная. Отсюда следует, что атомы одного элемента могут отличаться по массе.
Изотоп – совокупность нуклидов одного элемента с одинаковым массовым числом.
Следовательно, у нуклидов одного изотопа одинаковое число протонов (так как это один элемент), одинаковое число нейтронов (так как это один изотоп) и, естественно, одинаковая масса. Такие нуклиды совершенно одинаковы и потому принципиально неразличимы. (В физике под словом «изотоп» иногда подразумевают и одинт нуклид данного изотопа)
Нуклиды разных изотопов одного элемента отличаются массовыми числами, то есть числами
нейтронов, и массой.
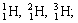 | 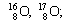 | 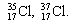 |
| Изотопы элемента водорода | Изотопы элемента кислорода | Изотопы элемента хлора |
Общее число известных ученым нуклидов приближается к 2000. Из них устойчивы, то есть существуют в природе, около 300. Элементов в настоящее время, включая искусственно полученные, известно 110.(Среди нуклидов физики выделяют изобары— нуклиды с одинаковой массой(независимо от заряда))
Многие элементы имеют по одному природному изотопу, например, Be, F, Nа, Al, P, Mn, Co, I, Au и некоторые другие. Но большинство элементов имеют по два, по три и более устойчивых изотопа.
Для описания состава атомных ядер иногда рассчитывают доли протонов или нейтронов в этих ядрах.
| Доля – отношение числа тех объектов, долю которых мы определяем, к общему числу объектов. |
где Di – доля интересующих нас объектов (например, седьмых),
N1 – число первых объектов,
N2 – число вторых объектов,
N3 – число третьих объектов,
Ni – число интересующих нас объектов (например, седьмых),
Nn – число последних по счету объектов.
Для сокращения записи формул в математике знаком 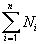
Пример. В коробке лежат 5 зеленых карандашей, 3 красных и 2 синих; требуется определить долю красных карандашей.
Доля может выражаться простой или десятичной дробью, а также в процентах, например:
Из количественных характеристик атома вам уже знакомы массовое число, число нейтронов в ядре, число протонов в ядре и заряд ядра.
Так как заряд протона равен элементарному положительному заряду, то число протонов в ядре (Z) и заряд этого ядра (qя), выраженный в элементарных электрических зарядах, численно равны. Поэтому, как и число протонов, заряд ядра обычно обозначают буквой Z.
Число протонов одинаково для всех нуклидов какого-либо элемента, поэтому оно может использоваться как характеристика этого элемента. В этом случае оно называется атомным номером.
| Атомный номер элемента – характеристика химического элемента, равная числу протонов в ядре любого нуклида этого элемента. |
Атомная единица массы с точностью, достаточной в химии, равна массе любого нуклона и близка к массе атома водорода, ядро которого состоит из одного протона. В 11-м классе из курса физики вы узнаете, почему она в действительности несколько меньше массы любой из этих частиц. Из соображений удобства измерений атомная единица массы определяется через массу нуклида самого распространенного изотопа углерода.
Обозначается атомная масса нуклида буквами Аr с указанием символа нуклида, например:
Аr( 16 O) – атомная масса нуклида 16 O,
Ar( 35 Cl) – атомная масса нуклида 35 Сl,
Ar( 27 Аl) – атомная масса нуклида 27 Аl.
Если у элемента есть несколько изотопов, то этот элемент состоит из нуклидов с разной массой. В природе изотопный состав элементов обычно постоянен, поэтому для каждого элемента можно посчитать среднюю массу атомов этого элемента (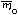
Атомная масса элемента – средняя масса атомов элемента в природной смеси изотопов этого элемента, выраженная в атомных единицах массы (дальтонах).
Так как атомная масса элемента и средняя масса атома этого элемента – одна и та же физическая величина, выраженная в разных единицах измерений, то и формула для вычисления атомной массы элемента аналогична формуле для вычисления средней массы атомов этого элемента:

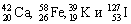
Какова доля протонов в ядре каждого из этих атомов?
2)Изотопами каких элементов являются нуклиды, содержащие в ядре

6)Принимая атомную массу нуклида численно равной массовому числу, рассчитайте атомные массы следующих элементов, если доли их изотопов в природной смеси (изотопный состав) составляют: а) 24 Mg – 0,796 25 Mg – 0,091 26 Mg – 0,113
б) 28 Si – 92,2 % 29 Si – 4,7 % 30 Si – 3,1 %
в) 63 Cu – 0,691 65 Cu – 0,309
7)Определите изотопный состав природного таллия (в долях соответствующих изотопов), если в природе встречаются изотопы таллий-207 и таллий-203, а атомная масса таллия равна 204,37 Дн.
8)Природный аргон состоит из трех изотопов. Доля нуклидов 36 Аr составляет 0,34%. Атомная масса аргона – 39,948 Дн. Определите, в каком соотношении встречаются в природе 38 Аr и 40 Аr.
9)Природный магний состоит из трех изотопов. Атомная масса магния – 24,305 Дн. Доля изотопа 25 Mg – 9,1%. Определите доли остальных двух изотопов магния с массовыми числами 24 и 26.
10)В земной коре (атмосфере, гидросфере и литосфере) атомы лития-7 встречаются примерно в 12,5 раз чаще, чем атомы лития-6. Определите атомную массу лития.
11)Атомная масса рубидия – 85,468 Дн. В природе встречаются 85 Rb и 87 Rb. Определите, во сколько раз легкого изотопа рубидия больше, чем тяжелого.


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
Изотопы и нуклиды чем отличается
Химическая природа атома задаётся электронным облаком, а его состав зависит только от заряда ядра, то есть от числа Z. Поэтому все атомы одной химической природы имеют одинаковый заряд ядра. Следовательно, химический элемент — это совокупность атомов с заданным значением заряда ядра Z. Именно поэтому число Z было названо атомным номером, так как в таблице Менделеева элементы упорядочены по возрастанию Z.
Если нуклиды отличаются массовым числом A, но имеют один и тот же атомный номер Z, то они имеют одинаковую химическую природу, принадлежат одному и тому же элементу и являются изотопами этого элемента. Чтобы обозначить конкретный изотоп, к химическому символу элемента приписывают слева вверху число A, например:
| Химический элемент водород | ||
| протий | дейтерий | тритий |
| 1 H | 2 H или D | 3 H или T |
| Z=1 | Z=1 | Z=1 |
| N=0 | N=1 | N=2 |
| A=1 | A=2 | A=3 |
Как видно из таблицы, природный водород существует в виде трёх изотопов, причём для дейтерия и трития есть даже собственные химические символы.
| Нуклиды: | |
| стабильные | радионуклиды |
| (всего около 250) | (их более 3000) |
Уравнения радиоактивного распада записываются подобно уравнениям химических реакций. Например, атом трития распадается на ион гелия-3, электрон и особую частицу, которая называется электронное антинейтрино:
3 H → 3 He + + e — + ν e
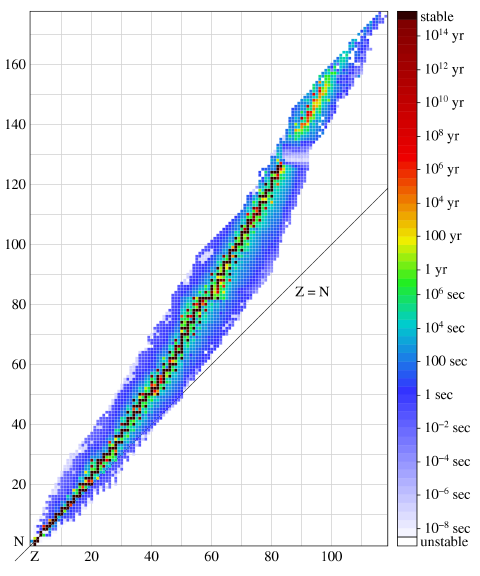
Большинство радионуклидов в природе не встречается и получено искусственно. Их устойчивость обычно характеризуется периодом полураспада t1/2 — интервалом времени, в течение которого вероятность распада ядра достигает 50%. Период полураспада может составлять от триллионных долей секунды до многих триллионов лет.
Интересно знать! Узкая цепочка наиболее стабильных нуклидов соответствует оптимальному соотношению нейтронов и протонов в ядре. Для заданного массового числа оно может быть выражено формулой
Для небольших значений массового числа A соотношение N/Z получается близким к единице, поэтому среди первых элементов распространены изотопы, у которых N = Z. Однако затем нейтронов становится больше, и, например, у стабильных изотопов свинца их число превышает число протонов примерно в полтора раза.
| Природный хлор | |
| 35 Cl | 37 Cl |
| m = 35 а.е.м. | m = 37 а.е.м. |
| 76% атомов Cl | 24% атомов Cl |
| mсредн. = 35·0,76 + 37·0,24 = 35,5 а.е.м. | |
Атомы разных изотопов имеют разные массы, но постоянство изотопного состава приводит к тому, что усреднённое значение массы атома данного элемента также постоянно. Именно это усреднённое по природным изотопам значение, выраженное в атомных единицах массы (а.е.м.), есть относительная атомная масса Ar данного элемента. В таблице Менделеева относительные атомные массы приведены для элементов, получаемых из природных источников.
Масса конкретного атома, выраженная в а.е.м., очень близка к его массовому числу A, так как масса одного нуклона примерно равна 1 а.е.м., а всего в атоме A нуклонов. Поэтому если в природе преобладает какой-то один изотоп данного элемента, то величина Ar этого элемента будет близка к массовому числу преобладающего изотопа. Именно поэтому относительные атомные массы многих элементов близки к целым числам. Однако не следует путать величины A и Ar : число A характеризует конкретный нуклид и указывает, сколько нуклонов в его ядре, а число Ar характеризует совокупность природных изотопов химического элемента и указывает усреднённое значение массы атома данного элемента в а.е.м.
Интересно знать! Точность величины Ar зависит от постоянства изотопного состава элемента. Натрий в природе представлен одним изотопом, поэтому никакой разбежки быть не может и Ar(Na) = 22,98976928 (все восемь знаков после запятой верны). Олово же представлено десятью изотопами; содержание каждого из них может варьироваться, поэтому Ar(Sn) = 118,710. Изотопы свинца постоянно образуются при радиоактивном распаде тяжёлых элементов, поэтому Ar(Pb) = 207,2. Для искусственно получаемых элементов величина Ar не имеет смысла, и в таких случаях вместо неё указывают в квадратных скобках массовое число самого долгоживущего из известных изотопов.
Нуклид
Слово « нуклид» было придумано Трумэном П. Кохманом в 1947 году. [2] [3] Кохман определил нуклид как «разновидность атома, характеризующаяся строением его ядра», содержащая определенное количество нейтронов и протонов. Таким образом, термин первоначально был сосредоточен на ядре.
Хотя слова нуклид и изотоп часто используются как синонимы, быть изотопами на самом деле является лишь одной связью между нуклидами. В следующей таблице перечислены некоторые другие отношения.
Нуклид и продукт его альфа-распада являются изодиаферами. [4]
но с разными энергетическими состояниями
См. Раздел « Обозначение изотопов» для объяснения обозначений, используемых для различных типов нуклидов или изотопов.
Самым долгоживущим ядерным изомером в неосновном состоянии является нуклид тантал-180m ( 180м 73Та ), период полураспада которого превышает 1000 триллионов лет. Этот нуклид существует изначально и никогда не наблюдался распада до основного состояния. (Напротив, нуклид тантал-180 в основном состоянии не встречается изначально, поскольку он распадается с периодом полураспада всего 8 часов до 180 Hf (86%) или 180 Вт (14%)).
Пример нуклидов, образованных в результате ядерных реакций, космогенных. 14
C
( радиоуглерод ), который образуется при бомбардировке космическими лучами других элементов, и нуклеогенный 239
Пу
который до сих пор создается нейтронной бомбардировкой естественного 238
U
в результате естественного деления урановых руд. Космогенные нуклиды могут быть стабильными или радиоактивными. Если они стабильны, их существование должно быть выведено на фоне стабильных нуклидов, поскольку каждый известный стабильный нуклид присутствует на Земле изначально.
Помимо 339 естественных нуклидов, более 3000 радионуклидов с различным периодом полураспада были искусственно произведены и охарактеризованы.