Известно что некоторые гормоны по своей химической природе являются липиды
Параграф 107. липидные гормоны
Автор текста – Анисимова Елена Сергеевна.
Авторские права защищены. Продавать текст нельзя.
Курсив НЕ НУЖНО зубрить.
Замечания и отзывы можно прислать по почте: exam_bch@mail.ru
https://vk.com/bch_5
ПАРАГРАФ 107.
«Липидные гормоны».
1) Представители липидных гормонов: …
2) 107. 1. Классификация стероидных гормонов.
Органы, синтезирующие липидные гормоны.
3) Стероиды коры надпочечников (кортикостероиды).
4) Стероиды половых желёз (гонадостероиды).
5) Мужские половые гормоны
6) Женские половые гормоны
7) 107. 2. Основные процессы синтеза стероидных гормонов.
8) Выведение стероидных гормонов.
9) 107. 3. Регуляция пучковой и сетчатой зон коры надпочечников.
10) 107. 4. Андрогены сетчатой зоны (АСЗ).
11) Применение анаболических стероидов в медицине.
107. 1. Классификация липидных гормонов.
Органы, синтезирующие липидные гормоны.
См. п.40-42, 91.
Липидные гормоны – это гормоны, относящиеся к классу липидов:
гидрофильных веществ, образующихся в организме (то есть эндогенного происхождения).
Представители липидных гормонов:
1) эйкозаноиды,
2) стероидные гормоны, в том числе кальцитриол,
3) реноат (ретиноевая кислота),
4) фактор активации тромбоцитов.
5) Йодтиронины образуются из тирозина,
липидами не считаются,
но по физическим свойствам тоже являются гидрофобными (липофильными) веществами
и относятся к гидрофобным (липофильным) гормонам – п.104.
ЭЙКОЗАНОИДЫ
(п.109) образуются из 20-углеродных цис-ПНЖК:
эйкозапентаеновой и арахидоновой кислот,
делятся на:
1) простаноиды (простагландины и тромбоксаны) и
2) лейкотриены,
основные функции эйкозаноидов:
1) участие в регуляции воспаления,
2) тонуса гладкой мускулатуры и т.д.
Образуются в разных клетках,
действуют на соседние клетки (паракринно)
и на те же, которые синтезируют (то есть аутокринно).
РЕТИНОАТ
– см.п.18. Образуется из витамина А, одна из активных форм ретинола.
КАЛЬЦИТРИОЛ
– п.19 и 114. Образуется из витамина Д,
который образуется из холестерина или поступает с пищей,
стероидный гормон (так как является производным холестерина).
Превращение витамина Д в кальцитриол происходит в ходе двух реакций:
первая протекает в печени, а вторая в почках.
ФАКТОР АКТИВАЦИИ ТРОМБОЦИТОВ –
относится к группе фосфолипидов,
участвует в регуляции тромбоцитов и свёртывании крови – п.40-42.
СТЕРОИДНЫЕ гормоны
(все, кроме кальцитриола) – это гормоны, которые образуются из холестерина.
Стероидные гормоны синтезируются в коре надпочечников
(в мозговом веществе синтезируется адреналин) и в половых железах.
Представители липидных гормонов:
Классификация стероидных гормонов.
Стероидные гормоны, которые синтезируются в коре надпочечников,
называются КОРТИКОСТЕРОИДАМИ,
а стероидные гормоны, которые синтезируются половыми железами (гонадами),
называются ГОНАДОСТЕРОИДАМИ.
Стероиды коры надпочечников (кортикостероиды).
Кортикостероиды, которые синтезируются клубочковой зоной коры надпочечников,
называются МИНЕРАЛОкортикостероидами – МКС,
поскольку участвуют в регуляции водно-минерального обмена.
Основной представитель МКС – АЛЬДОСТЕРОН.
Его синтез регулируется ангиотензином II. Подробнее – п.112.
Кортикостероиды, которые синтезируются пучковой зоной коры надпочечников,
называются ГЛЮКОкортикостероидами (ГКС),
поскольку ГКС участвуют в регуляции обмена ГЛЮКОЗЫ.
Кроме этого, ГКС имеют много других функций – см. п.108.
Основной представитель ГКС – КОРТИЗОЛ.
Кортикостероиды, которые синтезируются сетчатой зоной коры надпочечников,
называются АНДРОГЕНАМИ сетчатой зоны (АСЗ).
АСЗ – андростендион.
У женщин сетчатая зона коры надпочечников – единственный источник адрогенов,
поскольку у женщин нет других органов, которые синтезируют андрогены.
У мужчин основной андроген – тестостерон,
который синтезируется в яичках под влиянием гонадотропинов.
Стероиды половых желёз (гонадостероиды).
Гонадостероиды – это половые гормоны.
Половые гормоны делят на мужские и женские: андрогены и эстрогены.
Мужские половые гормоны называются мужскими потому,
что в мужском организме их намного больше, чем в женском.
Мужские половые гормоны есть и в женском организме,
но меньше, чем в мужском. И меньше, чем женских половых гормонов.
Мужские половые гормоны
называются андрогенами («создающими мужчину»),
поскольку именно благодаря андрогенам формируется мужской организм,
формируется и функционирует мужская репродуктивная система:
в эмбриогенезе образуется мужская репродуктивная система
(первичные половые признаки – «акушерский пол»),
в подростковом возрасте формируются мужские вторичные половые признаки,
поддерживается работа репродуктивной системы,
в том числе синтез андрогенов, образование сперматозоидов (сперматогенез).
Синтез андрогенов происходит в яичках (семенниках) у мужчин
и в сетчатой зоне коры надпочечников у женщин.
Синтез андрогенов в нужном количестве и их работа (наличие рецепторов)
возможны благодаря наличию в геноме мужчины (в ядрах клеток) Y-хромосомы (пол XY).
При нарушении в работе андрогенов может возникнуть женский фенотип
при наличии в геноме Y-хромосомы.
Женские половые гормоны
называются эстрогенами.
Именно благодаря эстрогенам
(а также благодаря низкой концентрации андрогенов)
формируется женский организм,
формируется и функционирует женская репродуктивная система
(в том числе при беременности),
в эмбриогенезе образуется женская репродуктивная система
(первичные половые признаки – «акушерский пол»),
в подростковом возрасте формируются женские вторичные половые признаки,
поддерживается работа репродуктивной системы,
в том числе синтез эстрогенов, созревание яйцеклеток.
Синтез эстрогенов происходит в яичниках, плаценте (при беременности).
Синтез эстрогенов в нужном количестве и их работа
возможны благодаря наличию в геноме женщины двух X хромосом (XX)
и отсутствию в геноме Y-хромосомы.
Необычное количество половых хромосом (не XX или XY),
мутации генов половых хромосом, которые приводят
к отклонениям в концентрации половых гормонов
или в работе рецепторов половых гормонов,
приводят к нарушению работы репродуктивной системы, бесплодию.
Избыток половых гормонов может приводить к «гормон-зависимым» опухолям.
Основные процессы синтеза стероидных гормонов.
Основные процессы синтеза стероидных гормонов – это
1) образование гидроксильной группы (ГИДРОКСИЛИРОВАНИЕ) и
2) укорочение бокового хвоста холестерина.
Для гидроксилирования необходимы витамины РР и С (аскорбат),
поэтому дефицит РР и аскорбата
может стать причиной дефицита стероидных гормонов
и его последствий, в том числе бесплодия.
Реакции синтеза стероидных гормонов катализируются ФЕРМЕНТАМИ
(например, гидроксилирование катализируется гидроксилазами).
Мутации в генах, катализирующих ферменты синтеза стероидных гормонов,
приводят к изменению скорости реакций синтеза (см. п.8 первичные энзимопатии),
изменение скорости реакций приводит к изменению концентрации метаболитов,
могут быть причиной дефицита стероидных гормонов
при отсутствии повреждений эндокринных желёз.
Выведение стероидных гормонов.
Стероидные гормоны подвергаются в ПЕЧЕНИ реакциям,
которые приводят к ИНАКТИВАЦИИ стероидных гормонов.
После этого инактивированные стероидные гормоны выводятся почками с мочой.
См. п.117 и 118, процессы КОНЬЮГАЦИИ.
107. 3. Регуляция пучковой и сетчатой зон коры надпочечников.
Повтор п.100.
Выработка МКС (альдостерона) клубочковой зоной коры надпочечников
регулируется ангиотензином II – п.112.
Выработка стероидных гормонов остальными зонами коры надпочечников
(то есть выработка ГКС пучковой зоной и выработка АСЗ сетчатой зоной),
регулируется гормоном аденогипофиза – КОРТИКОТРОПИНОМ (АКТГ).
При дефиците АКТГ синтез ГКС снижается.
Синтез АКТГ регулируется КОРТИКОЛИБЕРИНОМ,
вырабатываемым гипоталамусом.
ГКС снижают выработку кортикотропина и кортиколиберина по принципу отрицательной обратной связи.
Поэтому избыток ГКС может быть причиной сниженной концентрации АКТГ в крови.
Выработка половых гормонов регулируется
1) гормонами аденогипофиза – ГОНАДОТРОПИНАМИ – ФСГ и ЛГ.
2) А также пролактином и дофамином – п.105.2.
107. 4. Андрогены сетчатой зоны (АСЗ).
Эффекты АСЗ:
1) повышают синтез белка мышц,
2) то есть имеют сильный анаболический эффект (п.85),
3) повышают ВЫНОСЛИВОСТЬ,
4) способность переносить физические нагрузки,
5) повышают рост волос и имеют другие эффекты тестостерона.
Сетчатая зона является главным источником андрогенов у женщин.
У мужчин основным источником андрогенов (тестостерона) являются яички (семенники).
Применение анаболических стероидов в медицине.
Благодаря тому, что андрогены стимулируют синтез белка,
их применяют в ситуациях, когда нужно увеличить синтез белка в организме –
для ускорения деления клеток и заживления при:
1) при язвах,
2) при переломах,
3) после инфаркта и т.д.
Из липидов — в дирижеры клеточных реакций, или Как общаются клетки
Снимок конфокальной микроскопии эмбриональных фибробластов мыши, обработанных индуктором ферроптоза RSL3 (100 nM, 6h)
Авторы
Редакторы
Статья на конкурс «Био/Мол/Текст»: Задумывались ли вы когда-нибудь о том, что клетки общаются между собой? Ведь клеточный мир настолько многообразен и велик, что в нем без языка не обойтись! Всем известные гормоны — только один из диалектов такого «языка»! В этой статье мы расскажем о том, как липиды помогают клеткам «общаться». Почему такой, казалось бы, простой химический процесс, как окисление липидов, может приводить к гибели клетки? Как клетки понимают, когда пора заканчивать фазу воспаления и переходить к восстановлению? Что такое ферроптоз. Вы все еще читаете аннотацию? Давайте скорее окунемся в удивительный мир редокс-липидомики и взглянем на липиды по-новому!
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2020/2021.
Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.
Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Давно известно, что без липидов человеческий организм не может существовать. Эта обширная группа природных органических соединений, включающая жиры и жироподобные вещества, необходима для построения клеточных мембран и регуляции обмена веществ. Изучением липидов занимается липидомика, а появление раздела «редокс-липидомика» (окислительно-восстановительная липидомика, часть липидомики, занимающаяся характеристикой окисленных липидов) позволило по-новому взглянуть на роль продуктов окисления липидов и оценить их влияние на ключевые процессы, происходящие в клетках.
О липидах в составе клеточных мембран читайте в статье «Липидный фундамент жизни» [1]. — Ред.
В дополнение к природному липидому (совокупности всех липидов организма), существуют виды липидов, полученные в результате ферментативных и неферментативных модификаций (эпилипидом), что делает общую картину еще более сложной, поскольку их функции все еще в значительной степени неизвестны. Окисленные липиды представляют собой фракцию эпилипидома, которая привлекла большое внимание ученых из-за их роли в возникновении и развитии многих заболеваний человека. Однако основной проблемой редокс-липидомики остается отсутствие оптимальных вычислительных инструментов для надежной, точной и специфической идентификации уже открытых и еще неизвестных модифицированных липидов. В настоящее время жидкостная хроматография и масс-спектрометрия являются основными методами, позволяющими определить количество липидов в клетке, оценить их участие в ряде физиологических механизмов и даже изучить структуру продуктов окисления этих веществ [2].
Знакомство с липидами
Молекулы липидов чрезвычайно разнообразны, их насчитывают более миллиона вариантов [3]! Впечатляющее количество, по сравнению с 70 000 выявленных белков и 30 000 генов! Для удобства химики разделили все липиды на две большие группы:
К первой группе относятся простые липиды, состоящие исключительно из спирта и жирных кислот (воски, триацилглицеролы, эфиры холестерола), и сложные липиды, в состав которых входят и другие компоненты (фосфолипиды, гликолипиды, сфинголипиды). К неомыляемым липидам относится большая группа стероидов, включающая холестерин и его производные: стероидные гормоны, витамины, желчные кислоты.
Большая роль маленьких молекул
Липиды, содержащие полиненасыщенные жирные кислоты (ПНЖК — кислоты, содержащие две и более двойных связей), являются важными сигнальными молекулами, регулирующими многие метаболические процессы и клеточные реакции, включая воспаление. Для выполнения этих функций они подвергаются реакциям окисления, то есть присоединяют кислородсодержащие группы.
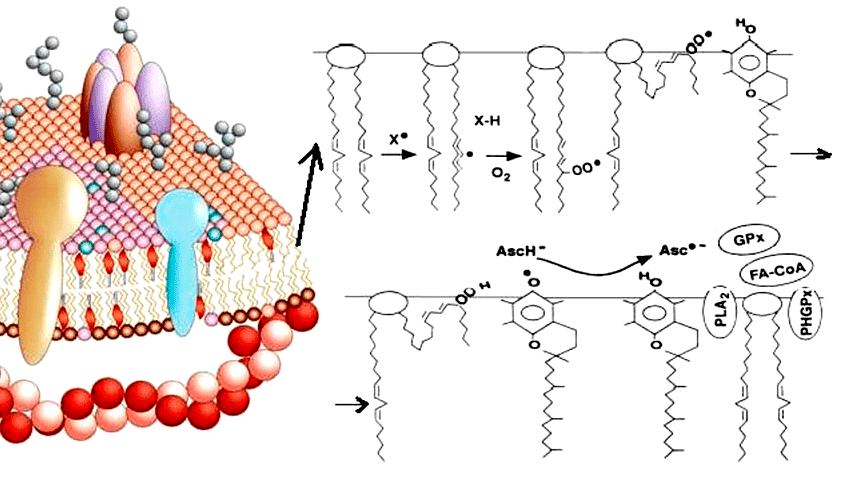
Окисление липидов происходит с помощью двух основных механизмов. Первый способ — неферментативное перекисное окисление. При этом липиды взаимодействуют с активными формами кислорода (АФК), в результате чего происходит накопление гидроперекисей липидов (LOOH) (рис. 1). В норме процессы перекисного окисления необходимы для поддержания структуры клеточных мембран, функционирования ионных каналов, рецепторов и ферментных систем. Их роль велика и в синтезе липидных медиаторов — биорегуляторов (простагландинов, тромбоксанов, лейкотриенов и др.). Однако неконтролируемое свободнорадикальное окисление липидов может приводить к изменению проницаемости мембраны, нарушению ее целостности, а это прямая угроза гибели клетки [3]!
Рисунок 1. Зарождение цепной реакции перекисного окисления липидов. Фосфолипиды клеточных мембран, взаимодействуя со свободными радикалами, превращаются в гидроперекиси липидов, что может влиять на функции мембраны клетки.
Второй путь окисления — ферментативные изменения, отличающиеся высокой селективностью и специфичностью. Ферментативное окисление происходит под действием металлопротеинов: липоксигеназы, циклооксигеназы, цитохрома Р450, пероксидазы. Продукты реакций окисления ПНЖК, выступая в качестве сигнальных молекул, координируют метаболизм и другие физиологические процессы, иными словами, управляют судьбой клетки [4]! Такие вещества носят название эйкозаноидов. Они принимают участие во многих важнейших процессах: росте мышечной ткани, реакциях иммунитета на токсины и патогены, выступают в роли нейромедиаторов и даже гормонов!
К сожалению, человеческий организм не научился синтезировать все необходимые ПНЖК. Возникает вопрос: можно ли их получить извне? Разумеется! Пищевыми источниками полиненасыщенных жирных кислот являются растительные масла, рыбий жир и препараты омега-3-жирных кислот. Таким образом, казалось бы невкусный рыбий жир — просто лакомство для наших клеток!
Из липидов — в дирижеры клеточных реакций
Исследования редокс-липидомики, проведенные при помощи масс-спектрометрии в сочетании с обращенно-фазовой хроматографией, выявили удивительный факт: липиды контролируют активность иммунной системы [4]! При попадании в организм чужеродных агентов, желающих нанести вред и повредить ткани, развивается воспаление, цель которого — устранить патоген. Иммунные клетки, встав на защиту организма, в зоне повреждения вырабатывают «провоспалительные» производные ПНЖК (лейкотриены, липоксины, гипоксины и т.д.), которые усиливают воспаление и таким образом избавляют организм от патогена (рис. 2).
Рисунок 2. Провоспалительные производные арахидоновой кислоты: простагландины, тромбоксаны и лейкотриены
рисунок авторов статьи
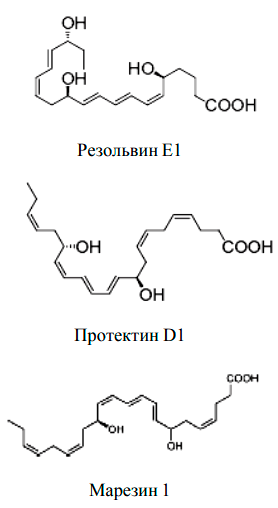
Рисунок 3. Противовоспалительные медиаторы: резолвины, протектины, марезины
Но воспаление — патологический процесс, и при удалении повреждающего фактора важно вовремя остановиться и прекратить воспалительный ответ. Здесь на помощь приходят противовоспалительные липидные медиаторы — резолвины, протектины, марезины (рис.3). Они останавливают образование «провоспалительных» медиаторов и обеспечивают защиту клеток от повреждающих факторов.
Кроме того, собственные поврежденные клетки, не способные восстановиться, для перехода воспаления в завершающую фазу и сохранения постоянства внутренней среды должны подвергнуться уничтожению, чему также способствуют липидные медиаторы. Как это возможно? Оказалось, что липидные молекулы фосфатидилсерина (фосфолипида клеточной мембраны) выставляются на мембрану поврежденных клеток и «помечают» их. Фосфатидилсерин на поверхности клеток является сигналом для их поглощения макрофагами и клетками микроглии [5]. В исследованиях также была продемонстрирована значимость этого медиатора: наличие даже одной молекулы фосфатидилсерина уже достаточно для активации фагоцитоза!
Две стороны одной медали
Оказалось, что роль липидов велика не только в уничтожении старых или поврежденных клеток, но и их компонентов, или органелл. Например, для удаления митохондрий, безвозвратно утративших свои функции, на поверхности ее внешней мембраны появляется кардиолипин — фосфолипид, который в норме присутствует только на внутренней мембране органелл. Именно он и служит сигналом митофагии, или уничтожения митохондрий [5]. Удаление исключительно ненужных организму структур без повреждения нормальных клеток требует точной передачи сигналов и имеет решающее значение для поддержания постоянства внутренней среды.
Однако данный процесс может стать опасным для организма. Чрезмерная митофагия описана при многих острых и хронических заболеваниях центральной нервной системы. Так, при болезни Паркинсона она может привести к гибели нейронов [6]. Контроль качества митохондрий с целью избежания излишнего уничтожения имеет центральное значение для функционирования и благополучия нейронов. Это открывает новые возможности для исследований в области лечения нейродегенеративных заболеваний!
Как липиды «помогают» клетке погибнуть?
Что же делать со старыми клетками, честно отслужившими свой срок? Безусловно, оставлять их на своем месте нельзя, иначе новым здоровым клеткам будет некуда деться. Остается один вариант — аккуратно разобрать и удалить из организма те из них, которые не способны более функционировать. Данный процесс носит названия апоптоза. Валериан Каган и его соавторы доказали, что для осуществления этого процесса необходимо окислить ПНЖК кардиолипина [7]. При необратимых изменениях в клетке знакомый нам кардиолипин образует комплекс с белком дыхательной цепи — цитохромом c — и превращает его в фермент пероксидазу. Пероксидаза тотчас окисляет ПНЖК кардиолипина, и он перемещается на внешнюю мембрану митохондрий, увеличивая ее проницаемость (рис.4). Это приводит к высвобождению других проапоптотических факторов клетки, действие которых приводит к клеточной гибели.
Рисунок 4. Окисление кардиолипина как фактор апоптоза. На рисунке представлена клеточная мембрана, состоящая из бислоя липидов, один из которых — кардиолипин (показан желтым цветом). При взаимодействии с белком цитохромом c (cyt c) кардиолипин превращает его в пероксидазу, которая, в свою очередь, окисляет ПНЖК кардиолипина (на рисунке — cardiolipin hydroperoxide, CL-OOH). Гидроперекись кардиолипина выходит на внешнюю мембрану митохондрии, изменяя ее проницаемость, что приводит к апоптозу.
Новый взгляд на клеточную смерть
Одним из важнейших достижений редокс-липидомики является открытие уникального варианта неапоптотической программируемой гибели клетки — ферроптоза [8]. По сравнению с другими формами этот путь клеточной гибели неповторим. В чем же его особенность? Оказалось, что, в отличие от апоптоза, при котором происходит аккуратная разборка клетки, ферроптоз приводит к клеточному коллапсу, в котором железо и АФК принимают активное участие. Давайте разберемся, как это происходит!
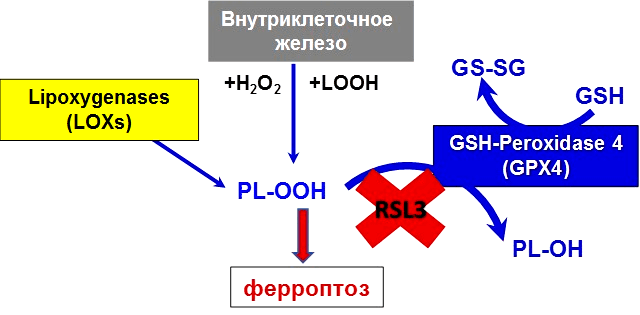
Ферроптоз назван так неспроста. Железо (Fe от лат. ferrum) — основной элемент, необходимый для осуществления ключевого звена данного пути гибели клетки: перекисного окисления липидов (рис. 5) [9], [10]. Перекисное окисление может происходить под действием свободного двухвалентного железа (через реакцию Фентона), а также посредством фермента липоксигеназы, содержащей железо.
Рисунок 5. Ионы железа в организме находятся под строгим метаболическим контролем. Нарушение баланса ионов железа в клетке и возникновение окислительного стресса приводит к цепной реакции окисления липидов и формированию избытка гидроперекисей. Накопление гидроперекисей липидов приводит к развитию ферроптоза. Гидроперекиси фосфолипидов (PL-OOH) образуются внутри клетки с участием различных форм низкомолекулярного внутриклеточного железа и железосодержащих ферментов. Активная GPX4 восстанавливает гидроперекиси липидов до спиртов. В случае ингибирования фермента, например, специфическим ингибитором RSL3, PL-OOH накапливаются в клетках, усиливая развитие окислительного стресса.
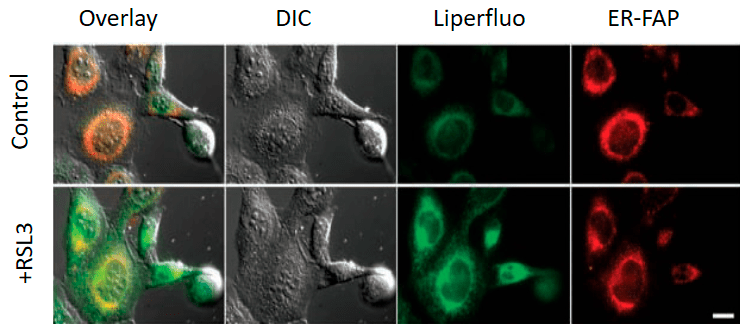
Конкретные механизмы редокс-модификации липидов, задействованные в выполнении программы ферроптоза, на сегодняшний день остаются тайной. Но, окрасив клетку различными флуоресцентными красителями, можно увидеть, насколько удивительные очертания они приобретают при ферроптозе (рис. 6) [11]!
Рисунок 6. Снимок конфокальной микроскопии эмбриональных фибробластов мыши, обработанных индуктором ферроптоза RSL3 (100 nM, 6h). Control — необработанные клетки. Liperfluo — флуоресцентный зонд, который после взаимодействия с гидроперекисями липидов способен флуоресцировать, если он встроен в плазматическую мембрану клеток. ER-FAP (ER-targeted fluorogen-activating protein) — флуоресцентный белок, чья флуоресценция активируется при связывании метки с эндоплазматическим ретикулумом.
В клетках организма существуют механизмы, препятствующие неконтролируемому перекисному окислению. Одним из ключевых ферментов здесь является глутатионпероксидаза 4 (GPX4), которая восстанавливает гидроперекиси липидов до спиртов за счет окисления глутатиона (GSH). Далее окисленная молекула глутатиона (GS-SG) восстанавливается с помощью фермента глутатион-редуктазы. В случае инактивации клеточного глутатиона и GSH-зависимой антиоксидантной защиты происходит накопление токсичных липидных АФК и запуск ферроптоза [12].
Две крайности одной и той же сущности. Как ферроптоз реализуется в целом организме и можно ли обернуть его в свою пользу?
Проведенные исследования показывают, что ферроптоз осуществляется во многих типах тканей человека. Так, при отравлении парацетамолом в организме накапливается N-ацетил-p-бензохинонимин, при этом наблюдается истощение глутатиона, в результате чего происходит массивная гибель клетки по механизму ферроптоза [13].
Имеющиеся данные указывают на то, что ферроптоз может выступать одним из ключевых механизмов развития некоторых нейродегенеративных заболеваний, а также является одной из возможных причин гибели клеток в условиях глутаматной эксайтотоксичности [14].
Ионы железа могут играть ключевую роль в гибели эпителиальных клеток почечных канальцев в условиях острой почечной недостаточности [13]. Данный механизм обусловлен нарушением гломерулярной фильтрации и накоплением ионов железа как внутриклеточно, так и в полости канальца, что приводит к реализации клеточной смерти.
Ферроптоз, как механизм регулируемой клеточной смерти, имеет и терапевтическую ценность. Существует ряд потенциальных молекул, ингибирующих Xc – — транспортную систему (эрастин, RSL3), которые, воздействуя на культуру опухолевых клеток, вызывают их гибель по механизму ферроптоза [12], [13]. Как доказать, что это происходит благодаря ферроптозу, а не случайному совпадению? При добавлении к клеткам веществ, связывающих железо, оно становится «неподвижным» и не может участвовать в химических процессах. В этом случае процессы ферроптоза значительно замедляются. Однако не все так просто и радужно! Эти молекулы не обладают высокой специфичностью, и при более высоких дозах клеточная гибель может происходить по механизму апоптоза!
Вывод
Благодаря редокс-липидомике стало известно, что кислородсодержащие липиды играют огромную роль в сохранении постоянства внутренней среды, запуская апоптоз, ферроптоз и контролируя воспаление. Однако стоит принять во внимание, что, несмотря на очевидное значение в регуляции множества биологических функций, содержание окисленных липидов в организме крайне мало (0,03–3,0 моль% от всего липидома организма) [4]. Кроме того, трудности анализа окисленных липидов заключаются в их химической нестабильности, термолабильности и неоднородности окисленных продуктов. Не зря их сравнивают с иголкой в стоге сена!