Известно что в растительных клетках присутствуют два вида хлорофилла хлорофилл
Тест по теме Фотосинтез
А) синтез глюкозы
Б) восстановление НАДФ +
В) фиксация углекислого газа
Г) фотолиз воды
Д) транспорт ионов водорода через мембрану
Е) синтез АТФ
1) световая
2) темновая
Верный ответ: 212111
Световая фаза фотосинтеза (1):
Под действием солнечного света в хлоропласте клетки происходит фотолиз воды (Г), и ионы водорода скапливаются у внутренней мембраны тилакоида. При достижении критической разницы зарядов между наружной и внутренней мембранами тилакоида часть протонов устремляется в строму хлоропласта (Д) через каналы АТФ-синтазы, образуя при этом АТФ (Е). Протоны, попав на поверхность мембраны тилакоидов, соединяются с электронами и образуют атомарный водород, который используется для восстановления молекулы-переносчика НАДФ (Б).
Темновая фаза фотосинтеза (2):
В ней происходит фиксация углекислого газа (В), что необходимо для синтеза глюкозы (А).
А) преобразование НАДФ*2H в НАДФ +
Б) восстановление рибозы
В) синтез молекул АТФ
Г) образование глюкозы
Д) фотолиз воды
Е) перемещение возбуждённых электронов
1) световая
2) темновая
Верный ответ: 221211
1) Для их разделения применяют метод хроматографии
2) Метод основывается на различной скорости движения смеси химических веществ через адсорбент в зависимости от их молекулярной массы
5443. Найдите три ошибки в приведённом тексте. Укажите номера предложений, в которых они сделаны, исправьте их.
(1)Солнечное излучение служит основным источником энергии для всех процессов, происходящих на Земле. (2)Жизнь на Земле возможна лишь потому, что длинноволновые лучи задерживаются озоновым экраном. (3)В небольших дозах инфракрасные лучи препятствуют возникновению рахита у человека, способствуют синтезу пигмента в клетках эпидермиса. (4)На долю видимых лучей приходится большая часть энергии солнечного излучения, достигающего земной поверхности. (5)Ультрафиолетовые лучи не воспринимаются глазом человека, но они являются важным источником внутренней энергии. (6)Солнечный свет проникает в глубину океана до 800 м. (7) На больших глубинах автотрофы используют другие источники энергии.
Ошибки допущены в предложениях 2, 3, 5:
2) Жизнь на Земле возможна лишь потому, что коротковолновые лучи задерживаются озоновым экраном (коротковолновые УФ-лучи губительны для живого, в отличие от длинноволновых)
3) В небольших дозах ультрафиолетовые лучи препятствуют возникновению рахита у человека, способствуют синтезу пигмента в клетках эпидермиса
5) Инфракрасные лучи не воспринимаются глазом человека, но они являются важным источником внутренней энергии
Известно что в растительных клетках присутствуют два вида хлорофилла хлорофилл
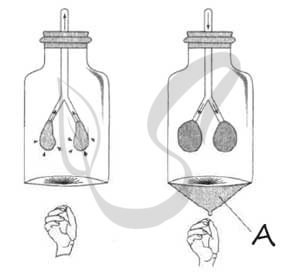
Известно, что концентрация солей в плазме крови соответствует концентрации 0,9% хлорида натрия в физиологическом растворе. В стеклянный стакан, заполненный раствором поваренной соли, поместили эритроциты. Сравните изображения нормального эритроцита в плазме (рис. А) и эритроцита в растворе (рис. Б). Объясните наблюдаемое явление. Определите концентрацию соли в стакане (0,9%, более 0,9%, менее 0,9%).
Известно, что в растительных клетках присутствуют два вида хлорофилла: хлорофилл a и хлорофилл b. Учёному, для изучения их структуры, необходимо разделить эти два пигмента. Какой метод он должен использовать для их разделения? На чём основан этот метод?
Анализа результатов нарушения сцепленного наследования генов позволяет определить последовательность расположения генов в хромосоме и составить генетические карты. Результаты многочисленных скрещиваний мух дрозофил показали, что частота нарушения сцепления между генами А и В составляет 5%, между генами А и С — 11%, между генами С и В — 6%. Перерисуйте предложенную схему фрагмента хромосомы на лист ответа, отметьте на ней взаимное расположение генов А, В, С и укажите расстояние между ними. Какая величина принята за единицу расстояния между генами?
1. эритроцит в растворе сморщился из-за потери воды;
2. вода по закону диффузии (осмоса) поступила из эритроцита в раствор;
3. концентрация раствора соли в стакане — более 0,9%.
Целесообразно применить метод хроматографии. Метод основан на разной скорости движения веществ смеси через адсорбент в зависимости от их молекулярной массы.
2) за единицу расстояния между генами принят 1% кроссинговера, эта величина названа морганидой.
Линия заданий 22, ЕГЭ по биологии
1) Плоды садовой земляники, которые созрели в солнечную погоду, гораздо слаще, чем плоды, созревшие в пасмурную погоду
2) В солнечную погоду активнее идет процесс фотосинтеза в клетках растений, за счет чего больше синтезируется углеводов, имеющих сладкий вкус
1) Дрожжи вызывают спиртовое брожение, вследствие чего образуется углекислый газ
2) При насыщении теста углекислым газом оно становится мягким и воздушным
1) В клетках плодов происходит дыхание
2) Кислород окисляет сахара до углекислого газа и воды; кислый вкус при этом остается, а сладкий исчезает (ну почему кислород такой жестокий? )))
1) Полость носа должна быть увлажненной, так как обонятельные клетки (рецепторы) раздражают только те вещества, которые растворились в слизи, покрывающей эпителий носовой полости
2) Избыточное, обильное выделение слизи затрудняет доступ химическим веществам к обонятельным рецепторам (например при насморке обонятельная функция носа страдает: снижается способность распознавать запахи)
1) Для их разделения применяют метод хроматографии
2) Метод основывается на различной скорости движения смеси химических веществ через адсорбент в зависимости от их молекулярной массы
1) Механизм вдоха и выдоха (механизм внешнего дыхания)
2) Внутри стеклянной прозрачной банки при опускании резиновой мембраны давление снижается и становится ниже атмосферного: вследствие разницы давлений объем мешков увеличивается
1) Сформировались речевые центры, которые обеспечили коммуникацию людей при трудовой деятельности
2) Получили дальнейшее развитие нервные центры, отвечающие за тонкую моторику пальцев рук
1) Биоценоз (природная экосистема), обладающий большим числом и разнообразием видов, заменяется на агроэкосистему с небольшим числом и малым разнообразием видов
2) В результате биоразнообразие на острове сократится, природная экосистема станет менее устойчивой
Задания части 2 ЕГЭ по теме «Биологические науки и их методы»
1. Какие методы биологии вы применяли на школьных практических работах по биологии?
Эмпирические (практические) методы: наблюдение, мониторинг, эксперимент. Теоретические методы: сравнение, абстрагирование, моделирование.
2. Назовите не менее пяти открытий, которые внесли существенный вклад в развитие биологии, и их авторов.
1) Гук открыл клетку на срезе пробки.
2) Дарвин заложил основы современной теории эволюции.
3) Линней основоположник классификации организмов (систематика).
4) Мендель основал генетику, первым установил законы наследования.
5) Павлов экспериментально изучал пищеварение и условные рефлексы.
6) Шлейден/Шванн создали клеточную теорию (цитология).
3. Почему современную биологию считают комплексной наукой?
Современная биология представляет собой систему наук, каждая из которых глубоко и детально исследует свой предмет (ботаника, зоология, анатомия, биохимия и т.п.). Знания, получаемые каждой из этих наук, объединяются, взаимно дополняются и проявляются в виде биологических законов и теорий, которые носят всеобщий характер.
4. Что такое метод исследования? Приведите примеры биологических методов исследования и ситуации, в которых они применяются.
Метод – это способ научного познания действительности. Примеры методов: наблюдение, центрифугирование, гибридологический. Например, центрифугирование применяется для того, чтобы получить фракции органоидов клетки. Гибридологический метод применяется для того, чтобы выяснить механизм наследования признаков.
5. Известно, что в растительных клетках присутствует два вида хлорофилла: хлорофилл a и хлорофилл b. Учёному для изучения их структуры необходимо разделить эти пигменты. Какой метод он должен использовать для их разделения? На чём основан этот метод?
1) метод хроматографии;
2) метод основан на разной скорости движения веществ смеси через адсорбент в зависимости от их способности связываться с его частицами
6. Рассмотрите таблицу «Методы биологических исследований» и заполните пустую ячейку, вписав соответствующий термин.
7. Рассмотрите таблицу «Биология как наука» и заполните пустую ячейку, вписав соответствующий термин.
О.В. Мосин
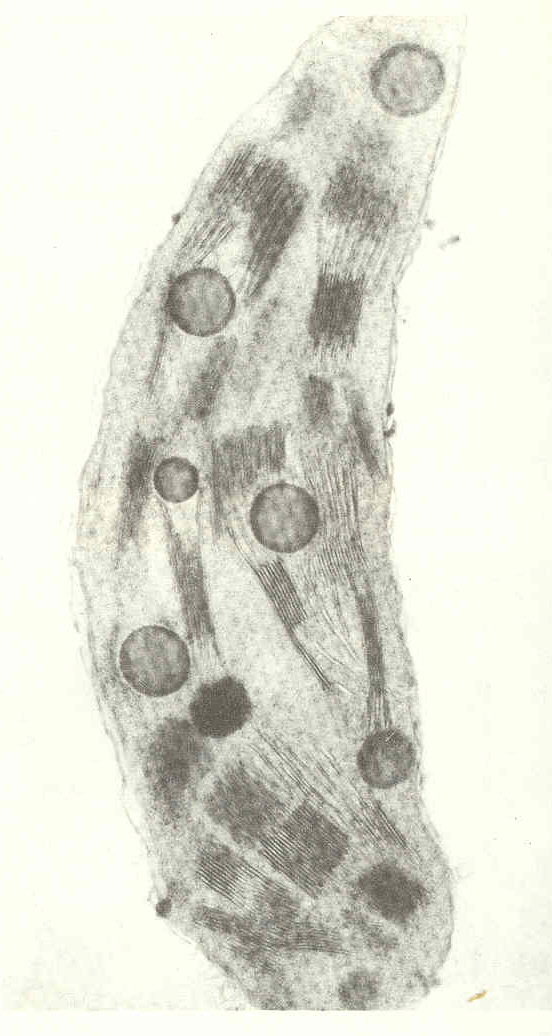
Ниже приведена микроструктура хлоропласта из листьев табака. Видно, что хлоропласт состоит из оболочки, заключающей в себе неоднородный по составу матрикс-строму со складчатыми образованиями-тилакоидами, в которых локализуются пигменты хлорофиллы и вспомогательные каротиноиды.
Клетки листьев растений могут содержать несколько сотен таких хлоропластов-элиптической формы-длиной около 3-10 мкм. При старении листьев и стеблей, созревании плодов хлоропласты вследствие разрушения хлорофилла утрачивают зелёную окраску, превращаясь в хромопласты.
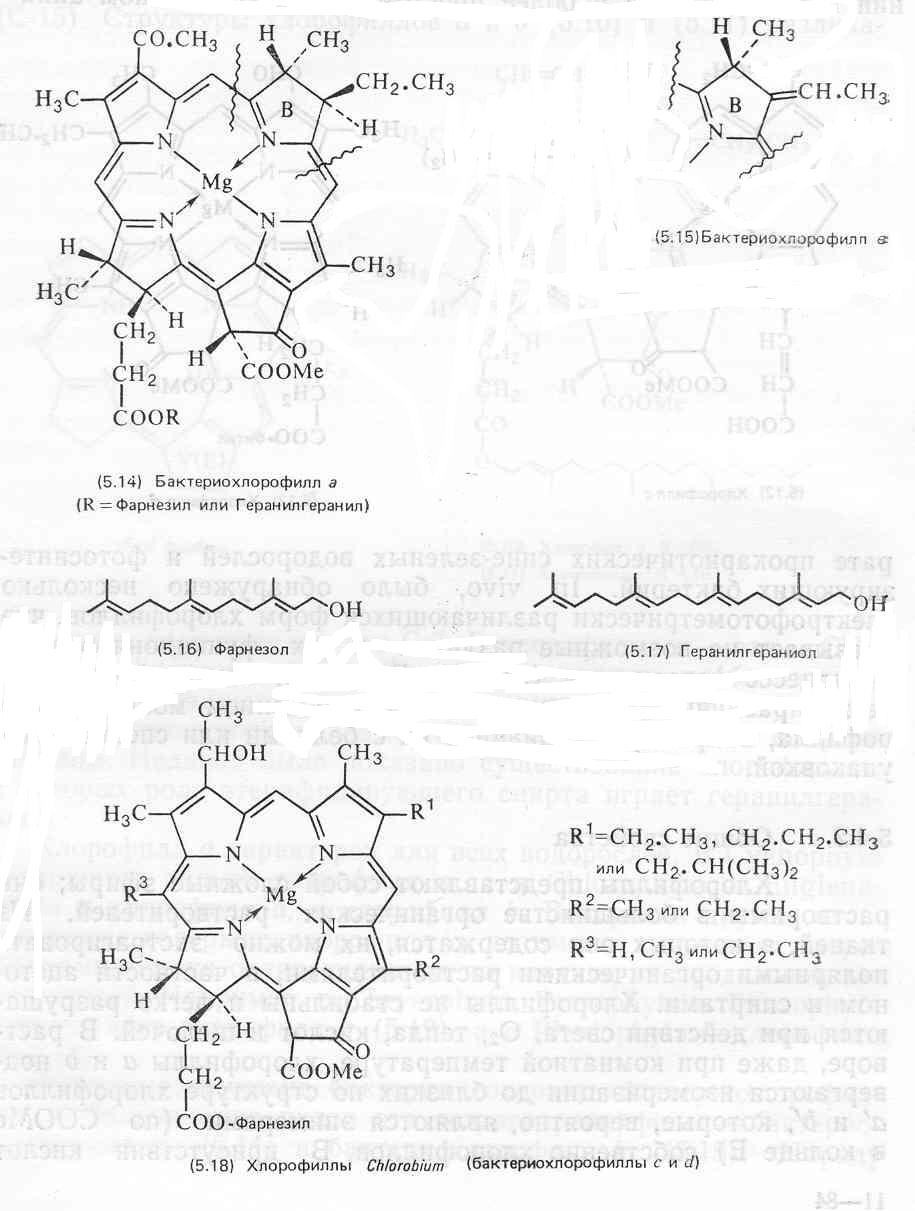
Серные бактерии Chlorobium содержат ряд хлоробиумхлорофиллов (бактериохлорофиллы с и d, которые являются дигидропорфинами (5.18).
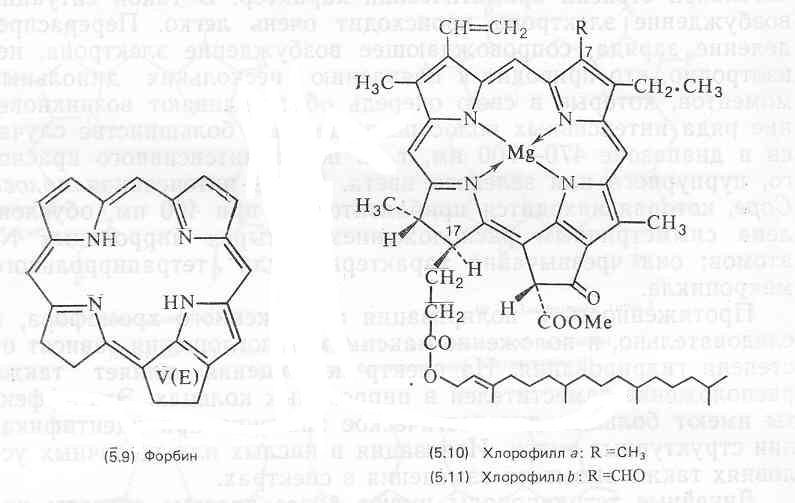
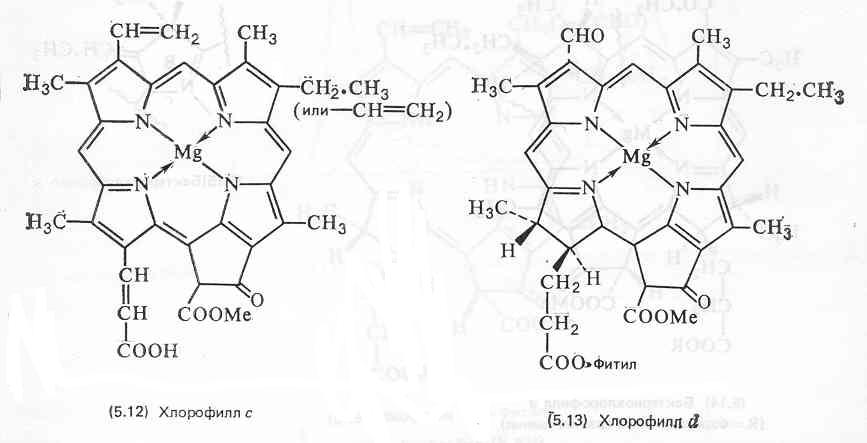
Хлорофиллы локализованы в хлоропластах высших растений и водорослей и в более простом фотосинтетическом аппарате прокариотических сине-зеленых водорослей и фотосинтезирующих бактерий. In vivo, было обнаружено несколько спектрофотометрически различающихся форм хлорофиллов, что указывает на возможные различия в их функционировании в процессе фотосинтеза. Вероятно, спектрофотометрические различия обусловлены микроокружением молекул хлорофилла, например ассоциацией их с белками или специальной упаковкой.
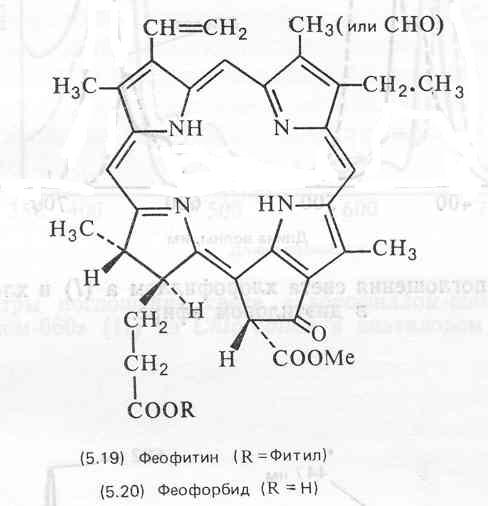
Хлорофиллы как все сложные эфиры растворимы в большинстве органических растворителей. Из тканей, в которых они содержатся, их можно экстрагировать полярными органическими растворителями, в частности ацетоном и спиртами. Хлорофиллы не стабильны и легко разрушаются при действии света, кислорода, тепла, кислот и щелочей. В растворе, даже при комнатной температуре, хлорофиллы а и Ь подвергаются изомеризации до близких по структуре хлорофиллов а’ и Ь’, которые, вероятно, являются эпимерами (по СООМе в кольце Е) собственно хлорофиллов. В присутствии кислот удаляется ион магния и в результате образуется феофитин (5.19). Это происходит настолько легко, что феофитин в довольно больших количествах обычно обнаруживается как артефакт на хроматограммах растительных экстрактов. Более жесткая обработка кислотой приводит к отщеплению этерифицирующего спирта (фитола и т. п.), в результате чего образуется водорастворимый феофорбид (5.20).
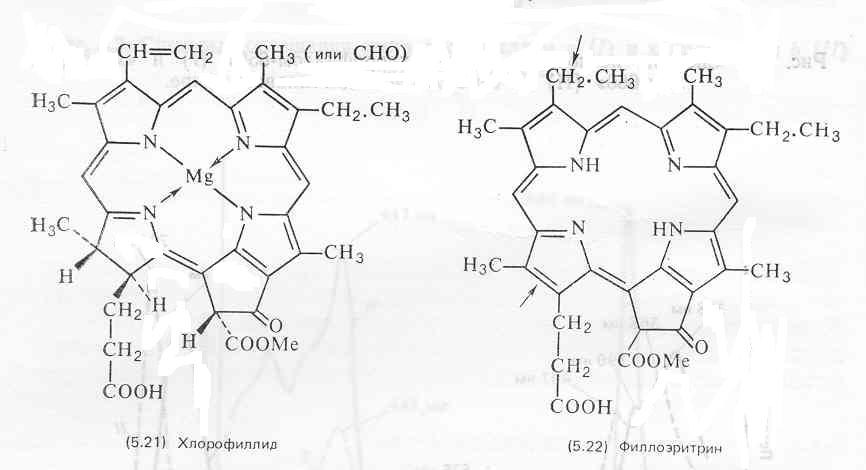
Феофорбиды и их метиловые эфиры, а также хлорофиллид (5.21) являются продуктами щелочного гидролиза хлорофиллов в отсутствие кислорода. Поэтому омыление служит полезным способом разрушения хлорофилла и применяется в целях облегчения работы с другими липидами растений. Водорастворимые продукты разрушения хлорофилла эффективно удаляются промыванием экстракта водой.
Некоторые из этих продуктов широко используются в исследованиях биосинтеза хлорофилла с применением радиоактивных ( 14С и 3Н) и стабильных (13С) изотопов. Продукты разрушения хлорофилла относительно стабильны, и работать с ними легко. Кроме того, их легко очистить и получить для них ЯМР-и другие спектры, которые значительно более просто интерпретировать, чем соответствующие спектры собственно хлорофиллов.
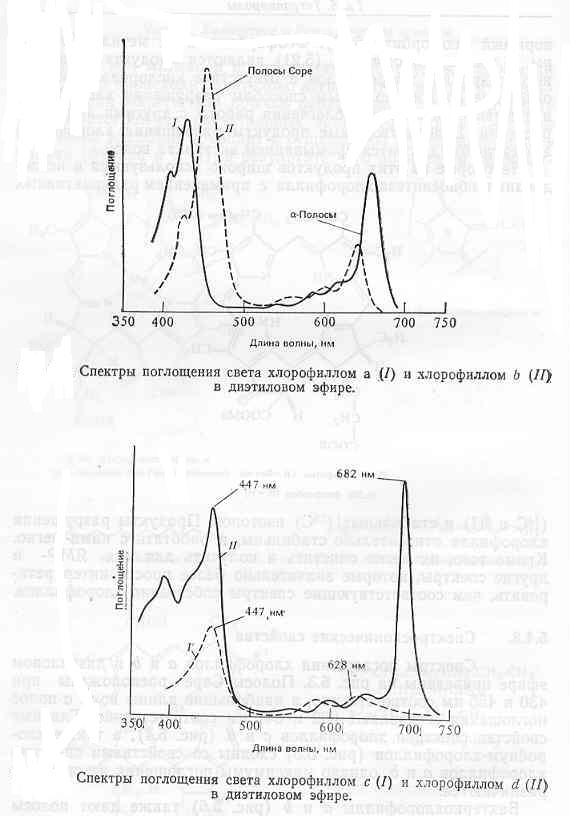
Спектры поглощения хлорофиллов а и б в диэтиловом эфире приведены на рисунке. Полосы поглощения расположены при 430 и 455 нм соответственно, а наибольшие длины волн а-полос поглощения составляют 662 и 641 нм соответственно. Главные свойства спектров хлорофиллов с и d, а также хлоробиум-хлорофиллов сходны со свойствами спектров хлорофиллов а и б, однако максимумы поглощения их спектров различаются.
Бактериохлорофиллы а и б (рис.) также дают полосы поглощения приблизительно при 400 нм (358 и 368 нм соответственно), однако характерная для них более сильная поляризация тетрагидропорфинового хромофора вызывает появление а-полос поглощения при значительно больших, чем у хлорофиллов, длинах волн (772 и 794 нм соответственно), находящихся в инфракрасной области спектра. Поэтому бактериохлорофиллы не имеют интенсивной окраски.
Свободного хлорофилла в животных тканях обычно нет; его можно обнаружить лишь в кишечнике травоядных. Некоторые виды животных, в частности водные беспозвоночные, содержат симбиотические одноклеточные водоросли. Интересным примером представляется одна из тропических асцидий, которая, как было обнаружено, содержит неизвестный ранее тип прокариотических зеленых водорослей Prochloron, в настоящее время рассматриваемый многими исследователями как «недостающее звено» в эволюционной цепи высших растений и их хлоропластов.
Другие животные способны сохранять и накапливать функционирующие хлоропласты из растительного материала, поступающего с пищей. Одним из примеров может служить кишечнодышащий моллюск Elysia viridis, который способен накапливать до 108 хлоропластов (в одном организме).
Источником этих хлоропластов является сифоновая водоросль Codium fragile, причем скорость фотосинтеза в хлоропластах, содержащихся в животном, сравнима со скоростью этого процесса в интактных водорослях. Очевидно, все такие животные должны содержать хлорофилл и поэтому окрашены обычно в зеленый цвет.
Продукты распада хлорофиллов, включая феофорбиды, хлорины и филлоэритрин (5.22), in vivo в растениях встречаются редко (хотя они и являются распространенными артефактами). В то же время ряд животных, в частности некоторые многощетинковые черви и эхиуриды, используют их в качестве пигментов наружных покровов. Эти соединения могут образовываться в животных из получаемого с пищей хлорофилла или поступать непосредственно с распадающимися растительными остатками, которыми питаются животные. У травоядных или всеядных, в том числе у человека, главным продуктом распада хлорофилла является филлоэритрин, который содержится в пищеварительном тракте и в желчи.
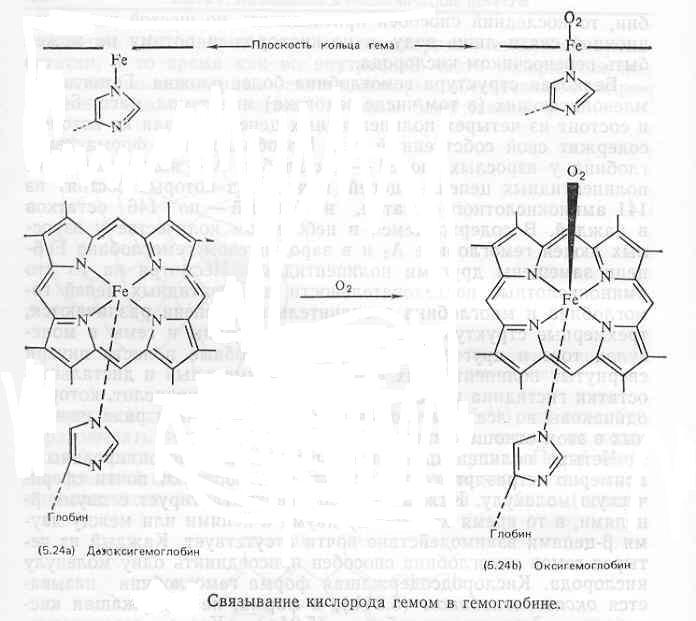
Способность обратимо образовывать комплексы с кислородом обусловливает жизненно важную роль гемоглобина как переносчика кислорода у животных. У млекопитающих гемоглобин содержится в красных кровяных клетках (эритроцитах) и отвечает за перенос кислорода из легких по артериям, артериолам и капиллярам в различные ткани тела. Он также помогает переносить двуокись углерода по обратному пути от тканей в легкие. Способность артериальной крови переносить кислород в присутствии гемоглобина в 70 раз выше, чем в его отсутствие. Сродство к кислороду у миоглобина значительно больше, чем у гемоглобина, поэтому миоглобин может принимать кислород от гемоглобина для использования или сохранения его в мышечных клетках.
Детали механизма связывания кислорода гемоглобином сложны, но хорошо изучены. Будучи чрезвычайно важным с физиологической точки зрения, этот процесс служит прекрасной иллюстрацией аллостерических взаимодействий и регуляции. Характерные особенности связывания кислорода гемоглобином могут быть суммированы следующим образом:
2. Сродство гемоглобина к кислороду зависит от величины рН и содержания СО2.
3. Органические фосфаты, особенно 2,3-дифосфоглицерат (ДФГ), также оказывают влияние на сродство гемоглобина к кислороду.
Аллостерические свойства гемоглобина обусловлены взаимодействием четырех субъединиц его молекулы. При связывании кислорода прежде всего происходит перемещение атома железа гема в плоскость гема оксигемоглобина, а проксимальный гистидин приближается к кольцу тема (рисунок). Такое перемещение вызывает последующие небольшие изменения третичной структуры субъединицы, в частности изменяется положение тирозино-вого остатка и смежной С-концевой аминокислоты. В результате исчезают некоторые взаимодействия между субъединицами; следовательно, четвертичная структура дестабилизируется. При этом изменяется конформация других субъединиц, что облегчает связывание ими кислорода. И наоборот, освобождение кислорода одним из гемов приводит к изменениям конформации и взаимодействий между субъединицами, что облегчает освобождение кислорода другими темами.
С понижением рН освобождение О2 гемоглобином облегчается. То же происходит при повышении концентрации СО2. Это чрезвычайно важно с физиологической точки зрения, так как в тканях с быстро протекающим обменом веществ, таких, как мышечная ткань, образуется много СО2 и кислот. Высокие уровни СО2 и Н+ стимулируют освобождение О2 из гемоглобина, и таким образом удовлетворяется потребность в большом количестве кислорода в метаболически активных тканях. После освобождения кислорода дезоксигемоглобин присоединяет Н+ и СО3. Для альвеолярных капилляров легких характерна более высокая концентрация кислорода, и там по мере связывания дезо-ксигемоглобином кислорода происходит освобождение Н+ и СО2.
Структурные превращения, которые претерпевает при этом молекула гемоглобина, были подробно изучены. При переходе от оксигемоглобина к дезоксигемоглобину в результате конформационных изменений карбоксилсодержащие аминокислотные остатки приближаются к некоторым гистидиновым остаткам и концевым NHs-группам. С изменением локального заряда микроокружения повышается величина рК кислого остатка и таким образом возрастает его сродство к Н+СОз также значительно легче связывается с дезоксигемоглобином, чем с ок-сигемоглобином. Она связывается с концевой NH2-группой каждой цепи с образованием карбаминопроизводных.
Сродство гемоглобина к окиси углерода гораздо больше, чем к кислороду; следовательно, СО может вытеснять кислород из оксигемоглобина. Образующийся при этом карбоксигемоглобин не способен служить переносчиком кислорода, и поэтому окись углерода является весьма эффективным ядом. Карбоксигемоглобин имеет вишневокрасную окраску, характерную для цвета лица людей, отравившихся окисью углерода, что позволяет легко диагностировать отравление. Функционирование гемоглобина могут серьезно нарушать различные лекарственные препараты. Известно, что продукты метаболизма ацетанилида, фенацетина и некоторых других лекарственных препаратов индуцируют окисление гемоглобина до Ре3+-формы (метгемоглобина), приводя к серьезному снижению кислород пер вносящей способности крови.
Так же как и у большинства других животных, у человека на разных стадиях развития организма имеются различные типы гемоглобина в крови. Гемоглобин плода и гемоглобин взрослого человека различаются по спектрам поглощения света и электрофоретическим свойствам. В крови зародыша на ранних стадиях его развития присутствует гемоглобин третьего типа. Зародышевый гемоглобин F обладает более высоким сродством к кислороду, чем гемоглобин А взрослых людей. Благодаря этому возможен оптимальный перенос кислорода от гемоглобина А матери к гемоглобину F плода. Более высокое сродство гемоглобина F к кислороду подтверждается также тем, что он связывает ДФГ менее прочно, чем гемоглобин А.
В настоящее время известно более 100 мутантных гемоглобинов. Некоторые из замен являются безвредными «поверхностными» заменами, тогда как другие, которые затрагивают кислородсвязывающие участки, третичную структуру или взаимодействия субъединиц в четвертичной структуре (что сказывается на аллостерических эффектах), могут очень сильно влиять на связывание кислорода.
Гемоглобин является пигментом крови практически у всех позвоночных, а также у многих беспозвоночных животных. Однако он не обнаружен у Porifera, Coelenterata, Rotifera, Sipuncula, Polyzoa, Brachiopoda, Onychophora, Tardigrada, Chaetognata и Protochordata и довольно редок у Arthropoda.
У позвоночных гемоглобин локализован в эритроцитах. У беспозвоночных он может содержаться в специальных частицах, но чаще присутствует в растворенном виде в крови или гемолимфе. Гемоглобин встречается почти во всех тканях тела.
Размеры гемоглобинового комплекса варьируют в очень широких пределах. Как уже упоминалось, гемоглобин млекопитающих имеет тетрамерную форму с мол. массой 64500. У других представителей животного царства были найдены его мономерные и димерные формы (с мол. массой 17000 и 34000 соответственно), в то время как у многих беспозвоночных сложные молекулы значительно крупнее и могут иметь мол. массу до 3 000 000.
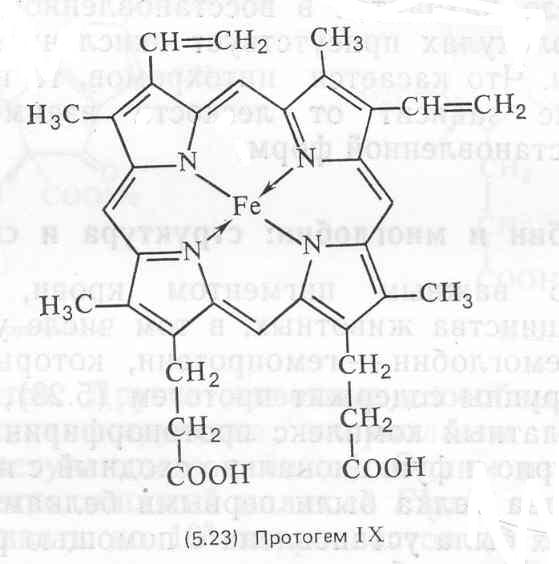
Состав и последовательность аминокислот в гемоглобинах различных видов животных сильно варьируют, что приводит к различиям в максимумах поглощения света, растворимости, изоэлектрической точке, сродстве к кислороду и устойчивости изолированных пигментов к кислотам, щелочам и нагреванию. Даже среди млекопитающих имеются значительные различия в стабильности и форме кристаллов выделенных гемоглобинов. Эти структурные различия ограничиваются белковой частью молекулы, тогда как все формы гемоглобинов содержат одну и ту же протогемовую простетическую группу.
Наряду с различиями в гемоглобине между семействами, родами, видами или даже подвидами могут также существовать различия в гемоглобине у какого-либо индивида в разные периоды жизни или даже в одно и то же время. Как упоминалось выше, человек имеет различные типы гемоглобина в крови в разные периоды жизни. Та же ситуация встречается и у других видов; например, гемоглобины цыпленка и курицы или головастика и лягушки различны, причем во всех случаях пигмент молодого организма имеет более высокое сродство к кислороду.
Гемоглобин эритроцитов в капиллярных кровеносных сосудах кожи придает розоватый оттенок коже людей «белой» расы. У большинства других позвоночных эта окраска скрыта волосами, перьями, чешуей или завуалирована другими кожными пигментами. Гемоглобином обусловлена розовая окраска языка, внутренней части ушей и кончика носа у многих млекопитающих. Некоторые специфические ткани или участки тела могут окрашиваться гемоглобином в красный цвет и играть при этом роль предупреждающих сигналов, или признаков определенного пола, например голая шея у некоторых грифов, бородка у индюка и других птиц, а также ягодицы у павиана. Среди беспозвоночных обусловленная гемоглобином окраска наблюдается у многих многощетинковых и однощетинковых кольчатых червей (например, у «мотыля»), а также при некоторых условиях у ветвистоусых и листоногих Crustaceae. Однако гемоглобин вносит свой вклад в окраску лишь небольшого числа животных, позвоночных и беспозвоночных.
Гемоцианин, гемоэритрин и гемованадин. Эти соединения служат пигментами крови или дыхательными пигментами у очень небольшого числа беспозвоночных. Они представляют собой металлопротеины и включены в этот раздел условно, так как, несмотря на названия, не являются ни производными гема, ни производными порфирина. Например, гемоцианины брюхоногих моллюсков, таких, как улитка Helix pomatia, представляют собой гигантские белки (мол. масса 9-106). Их функциональной единицей, которая связывает одну молекулу О2) служит пара атомов меди, окруженная компактно свернутым полипептидом с мол. массой 50000. От семи до девяти таких функциональных единиц составляют фрагмент с мол. массой 4-5-105, а молекула гемоцианина включает 20 таких фрагментов.
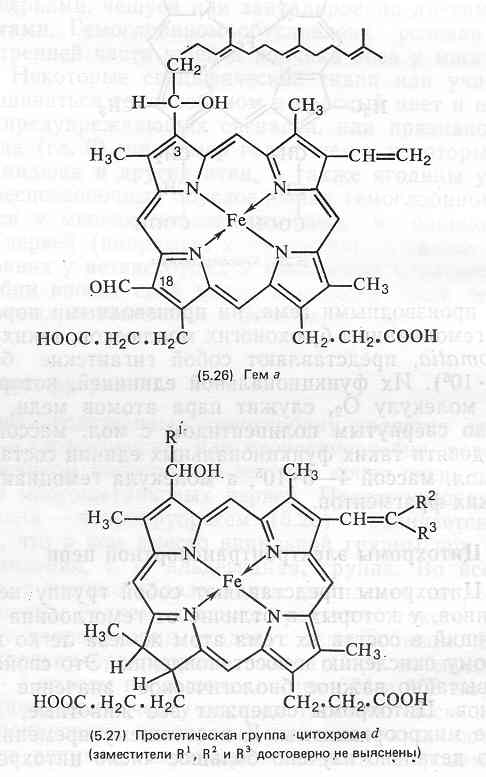
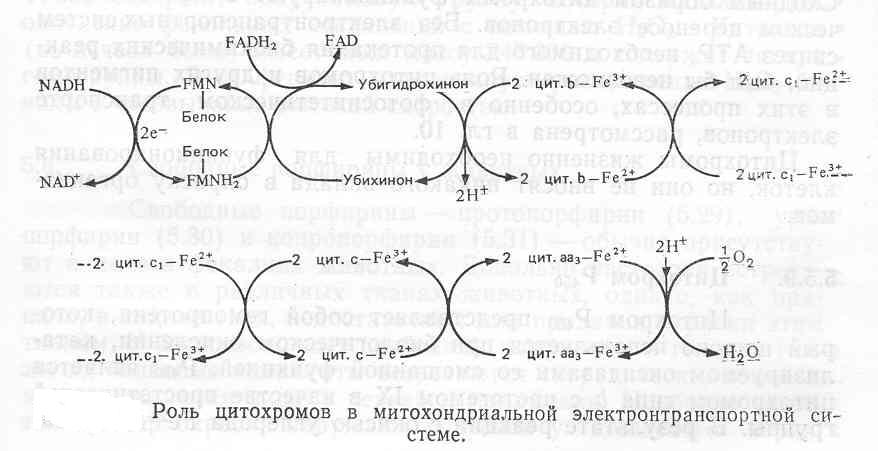
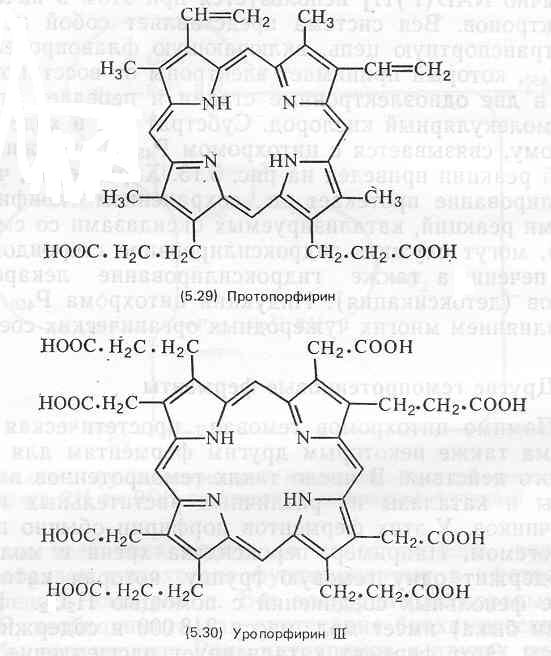
Простатическая группа цитохрома b представляет собой протогем (5.23), как и у гемоглобина. Гемогруппа цитохрома а, обозначаемая как гем а (5.26), отличается от протогема заменой метильнои группы при С-18 на СНО-группу и модификацией винильной группы при С-3 путем присоединения к ней С15-(фарнезил)изопреноидной цепи. Название цитохром d применяется к цитохромам с дигидропорфириновой (хлориновой)-простетической группой, содержащей железо (5.27); боковые цепи заместителей у этой простетической группы могут варьировать. Группа цитохрома с включает все цитохромы, у которых боковые цепи тема связаны с белком ковалентными тио-эфирными связями, например (5.28).
Индивидуальные цитохромы внутри этих групп обозначают нижними индексами, например цитохром b6, или в их название входит длина волны а-полосы в спектре поглощения, например цитохром б-550.
Количественный вклад цитохромов в суммарную концентрацию тетрапирролов у организмов, содержащих хлорофилл или гемоглобин, незначителен, однако они жизненно необходимы для функционирования этих организмов. В митохондриях эукариотических клеток они являются основой высокоорганизованной электронтранспортной цепи (рисунок), которая используется для аэробного окисления восстановленных коферментов (например, NADH), образующихся в ходе окислительного расщепления питательных веществ. С электронтранспортной цепью связан процесс окислительного фосфорилирования, в котором генерируется большая часть АТР клеток. В цепи участвуют несколько цитохромов, и гемовое железо каждого из них претерпевает окисление и восстановление по мере прохождения электрона по всей цепи вплоть до молекулярного кислорода. Сходным образом цитохромы функционируют в фотосинтетическом переносе электронов.
Цитохромы жизненно необходимы для функционирования клеток, но они не вносят никакого вклада в окраску организмов.
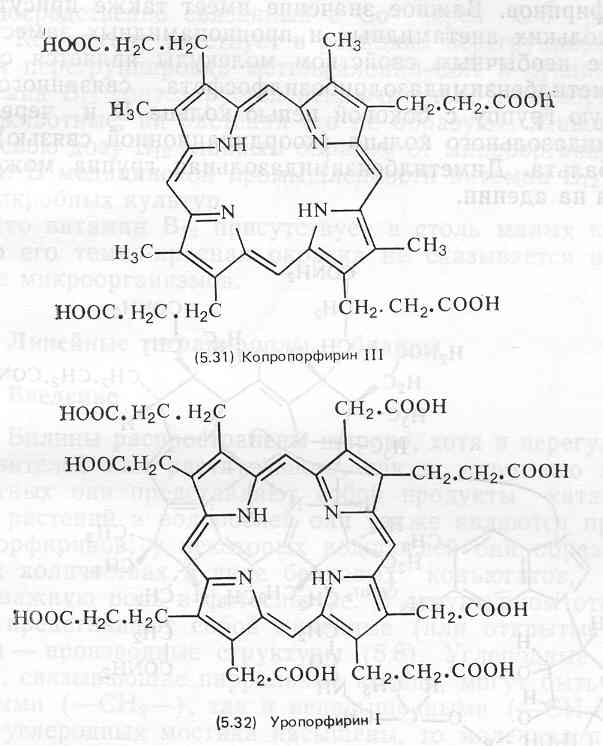
Довольно часто они встречаются также в различных тканях животных, однако, как правило, в количествах, недостаточных для придания окраски этим тканям. У беспозвоночных свободные порфирины и темы, а также их белковые конъюгаты встречаются спорадически, обычными они являются лишь у червей и моллюсков. Наиболее известен пример окраски наружных покровов у дождевого червя: пурпурно-багровый цвет переднедорзальной поверхности его тела обусловлен протопорфирином. Раковины некоторых моллюсков содержат очень большие количества уропорфирина, часто изомера уропорфирина I (5.32). Свободные порфирины чрезвычайно редко встречаются или вообще не обнаружены у простейших, кишечнополостных, членистоногих и протохордовых.
Подводя итог, следует отметить, однако, что в общем вклад свободных порфиринов в окраску животных невелик.
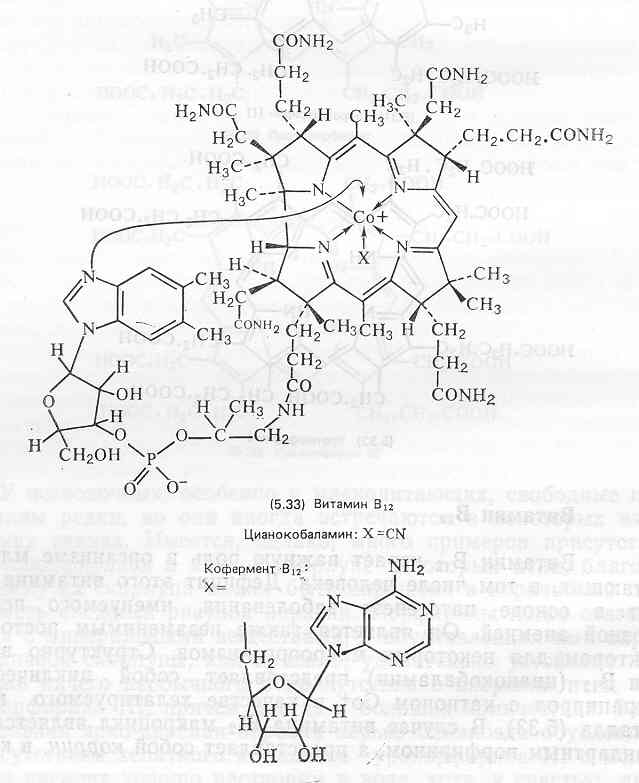
Витамин В12. Витамин B12 играет важную роль в организме млекопитающих, в том числе человека. Дефицит этого витамина лежит в основе патогенеза заболевания, именуемого пернициозной анемией. Он является также незаменимым ростовым фактором для некоторых микроорганизмов. Структурно витамин B12 (цианокобаламин) представляет собой циклический тетрапиррол с катионом Со+ в качестве хелатируемого иона металла (5.33). В случае витамина В12 макроцикл является не стандартным порфирином, а представляет собой коррин, в котором б-метиновый мостик (С-20) отсутствует, и в результате между кольцами А и D имеется непосредственная ковалентная связь. В то же время а- и (З-метиновые мостики (С-5, С-15) несут добавочные метильные группы и вся система целиком находится в гораздо более восстановленном состоянии, чем в случае порфиринов.
Важное значение имеет также присутствие в. ней нескольких ацетамидных и пропионамидных заместителей. Наиболее необычным свойством молекулы является содержание диметилбензимидазолрибозилфосфата, связанного через фосфатную группу с боковой цепью кольца D и через атом азота имидазольного кольца (координационной связью) с атомом кобальта. Диметилбензимидазольная группа может быть заменена на аденин.
Обычно витамин B12 выделяют из тканей в растворе, содержащем ионы CN
Витамин B12 синтезируется исключительно микроорганизмами: ни животные, ни растения его не образуют. Животные получают свою дозу B12 главным образом от микроорганизмов кишечника. В медицинской промышленности витамин B12 получают из микробных культур.
In vivo витамин В12 присутствует в столь малых количествах, что его темно-красная окраска не сказывается на внешнем виде микроорганизмов.
Bogorad L. (1976). Chlorophyll biosynthesis. In: Chemistry and biochemistry of plant pigments, 2nd edition, vol. 1, ed. T. W. Goodwin, p. 64, London, New York and San Francisco, Academic Press. Bouchier L A. D., Billing В. Н, (eds.) (1967). Bilirubin metabolism, Oxford.
Cooper D. Y., Rosenthal 0., Snyder R., Witmer C. (eds.) (1975). Cytochromes Р450 and b, New York, Plenum. dolphin D. (ed.) (1978). The porhyrins, vols. 1 and 2 (7 vols projected), New York, Academic Press.
Fox D. L. (1976). Animal biochromes and structural colours, 2nd edition, Berkeley, Los Angeles and London, University of California Press. Fox H. M., Vevers G. (1960). The nature of animal colours, London,
Sidgwick and Jackson. Goodwin T. W. (ed.) (1968). Porphyrins and related compounds, London and New York, Academic Press.
Hudson M. F., Smith K. M. (1975). Bile pigments, Chem. Soc. Revs., 4, 363. Jackson A, H. (1976). Structure, properties and distribution of chlorophylls. In: Chemistry and biochemistry of plant pigments, 2nd edition, vol. 1, ed. T. W. Goodwin, p. 1, London, New York and San Francisco, Academic Press.
The significance of zoochromes, Berlin, Heidelberg and
New York, Springer-Verlag. O’ Carra P., Oh Eocha C. (1976). Algal biliprotein and phycobilins. In: Chemistry and biochemistry of plant pigments, 2nd edition, vol. 1, ed. T. W. Goodwin, p. 328, London, New York and San Francisco, Academic Press. Perutz M. F. (1970).
Stereochemistry of cooperative effects of haemoglobin, Nature, 228, 726. .Riminglon C., Kennedy G. Y. (1962). Porphyrins. In: Comparative biochemistry, vol. 4, eds. M. Florktn and H. S. Mason, p. 557, New York and London, Academic Press. Rildiger W. (1980).
Plant biliproteins. In: Pigments in plants, 2nd edition, ed.
F.-C. Czygan, p. 314, Stuttgart and New York, Gustav Fischer. -Schneider H. (1980).
Chlorophyll biosynthesis. Enzymes and regulation of enzyme activities. In: Pigments in plants, 2nd edition, ed. F.-C. Czygan, p. 237,
Stuttgart and New York, Gustav Fischer. .Smith H., Kendrick R. E. (1976). The structure and properties of phytochrome. In: Chemistry and biochemistry of plant pigments, 2nd edition, vol. I, ed. T. W. Goodwin, p. 378, New York, London and San Francisco, Academic Press. .Smith K. M. (ed.) (1975). Porphyrins and metalloporphyrins, Amsterdam, Elsevier. Tschudy D. P., Schmid R. (1972).
The porphyrias. In: The metabolic basis of inherited diseases, 3rd edition, eds. J. B. Stanbury, J. B. Wyngaarden and D. S. Predrickson. p. 1087. New York, McGraw-Hill.
The chlorophylls. New York and London, Academic Press. With T. K. (1968). Bile pigments. (Trans. J. P. Kennedy), New York and London, Academic Press.