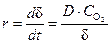какие кинетические законы роста пленок существуют
3.3.4. Законы роста оксидных пленок на металлах
В зависимости от ионной и диффузионной подвижности ионов металла и окислителя, фронт коррозии (условная линия химического взаимодействия), может находиться на внешней стороне пленки, внутри пленки или на границе раздела металл – пленка.
Процесс роста пористой
пленки не осложняется процессом подвода окислителя к поверхности металла, а контролируется скоростью химической реакции образования оксида. Скорость коррозии в этом случае выражается уравнением:
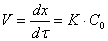
После разделения переменных:
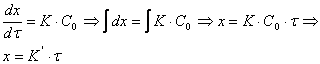
то есть рост пористой пленки, контролируемый скоростью химической реакции окисления металла, протекает во времени по линейному закону.
Линейный закон роста имеет место:
Сплошные пленки, затрудняют проникновение реагентов друг к другу и их рост сопровождается самоторможением процесса. Результирующая скорость этого сложного процесса определяется скоростью самой медленной стадии, то есть возможны различные варианты контроля течения процесса.
Первый вариант
Скорость коррозии контролируется стадией массопереноса (диффузионный контроль процесса). В этом случае:
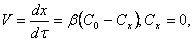
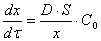
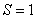
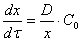
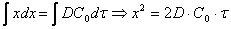
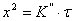
Следует особо подчеркнуть, что концентрация окислителя на границе раздела металл – оксидная пленка
(Сх) равна нулю, так как скорость химической реакции весьма велика.
Параболический закон роста реализуется, в частности, при окислении железа на воздухе при различных температурах.
Второй вариант.
В предыдущем случае 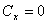
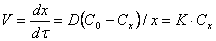
Решение (3.29) приводит к сложно-параболическому закону роста оксидной пленки:
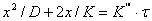
Рост оксидных пленок по сложно-параболическому закону выполняется:
Рост оксидных пленок при диффузионно-кинетическом контроле может быть выражен также степенным законом:
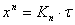
Третий вариант
Часто рост пленки протекает медленнее, чем это следует из параболического закона роста. Это наблюдается при возникновении оксидных пленок при низких температурах (на 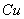
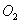
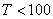
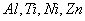
при 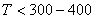
Затухание объясняется либо уплотнением пленок, либо появлением дефектов (пузырей, расслоений). В этих случаях рост пленки протекает в соответствии с логарифмическим законом роста:
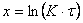
В заключение, можно отметить общую для большинства металлов тенденцию к снижению самоторможения процесса окисления во времени с ростом температуры: логарифмический закон Þ обратный логарифмический закон Þ степенной (n>2) закон Þ параболический закон Þ сложно-параболический закон Þ линейный закон.
Если металл образует с окислителем несколько устойчивых химических соединений, то образуются многослойные толстые пленки. При этом концентрация металла убывает от границы раздела фаз металл – пленка, а концентрация окислителя возрастает. Примером таких пленок могут быть пленки вида: Cu|Cu2O|CuO|O2; Fe|FeO|Fe3O4|Fe2O3|O2; Mn|MnO|Mn3O4|O2.
Рост слоев происходит вследствие диффузии ионов металла и окислителя; движущей силой является разность химических потенциалов крайних фаз указанных гальванических элементов. Наблюдаемые сложные зависимости скорости роста слоев таких пленок чаще всего объясняются соотношением коэффициентов роста отдельных слоев.
С ростом толщины пленки, возникающие внутренние напряжения могут приводить к образованию трещин и скалыванию пленок и окисление опять будет происходить с начальных стадий.
В ряде случаев обнаруживается двухслойность однофазной пленки (окалины). Приэтом металл в оксиде проявляет одну (низшую) валентность (NiO, Cu2O).
Окалина (пленка), которая представляет собой один и тот же оксид, состоит из двух слоев: внутреннего (пористого) и наружного (плотного, компактного).
Двухслойность объясняется одновременной встречной диффузией металла и окислителя. Наружный слой образуется за счет диффузии металла наружу, а внутренний − следствие диффузии окислителя внутрь.
Кинетика роста оксидных пленок
Кинетика газовой коррозии определяется главным образом свойствами оксидной пленки и температурой. Скорость газовой коррозии (r) обычно характеризуют зависимостью толщины оксидной пленки (d) от времени (t). Для газовой коррозии различают дифференциальную 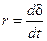
Газовая коррозия металла является гетерогенной химической реакцией: x Me (тв.) + y/2 O2 (газ) = MexOy (тв.), которая может протекать в кинетическом или диффузионном режимах. Соответственно законы изменения толщины пленки во времени для них будут различны.
Линейный закон роста пленки. При несплошной, пористой пленке оксида доступ молекул кислорода к поверхности металла свободен. Лимитирующей стадией коррозии является поверхностная химическая реакция, протекающая в условиях постоянства парциального давления кислорода и площади реакционной поверхности. В этом случае скорость коррозии определяется законом действующих масс:
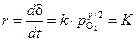
где k – константа скорости реакции; 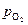
Постоянство скорости процесса газовой коррозии 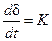
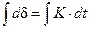
Такому закону подчиняется газовая коррозия щелочных и щелочноземельных металлов.
Рис. 9‑4 Основные законы изменения толщины оксидных пленок d(t) во времени (t)
Примечание. Аналогичная линейная зависимость увеличения глубины коррозии (h) от времени наблюдается и у металлов, имеющих летучие оксиды, которые легко переходят в газовую фазу. Например, коррозия вольфрама и молибдена при относительно высоких температурах.
Параболический закон роста пленки.При наличии сплошной оксидной пленки лимитирующей стадией коррозии является процесс диффузии реагирующих частиц. Скорость коррозии определяется законами диффузии:
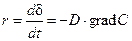
где D – коэффициент диффузии, 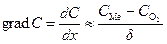
Поскольку самой медленной стадией коррозии является диффузия, то концентрация кислорода на внешней стороне оксидной пленки ( 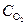
и, соответственно, 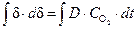
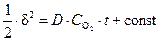
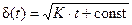
где K=2×D× 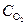
Параболический закон роста оксидной пленки наблюдается при окислении железа, меди, никеля и других металлов.
Для некоторых металлов (например, алюминий, хром) рост оксидной пленки происходит медленнее, чем это следует из диффузионного механизма. Это может быть объяснено протеканием при ее росте физико-химических процессов, замедляющих диффузию. В данном случае увеличение толщины оксидной пленки во времени можно описать логарифмическим законом:
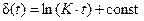
где K – постоянная величина (рис. 9.4).
Необходимо отметить, что кинетический закон роста оксидной пленки зависит от внешних условий (температура и состав среды) и для данного металла может меняться.
Примечание. Во всех законах роста const = d(t=0) – начальная толщина оксидной пленки.
Механизм высокотемпературной коррозии. Законы роста пленки
Наиболее изученным видом высокотемпературной коррозии является высокотемпературное окисление металлов кислородом. Поэтому основные кинетические закономерности высокотемпературных процессов будем рассматривать на примере этого вида коррозии. Основные положения теории высокотемпературной коррозии, которыми до сего дня пользуются коррозионисты, были разработаны Вагнером и Хауффе в 30-х годах XX столетия.
Для коррозиониста-практика особенно важно знать, как растет пленка продуктов коррозии во времени, т.е. уметь определить закон роста пленки. Анализ его, во-первых, позволяет оценить свойства пленки и, таким образом, прогнозировать опасность коррозионного поражения металлоконструкции в зависимость от периода ее эксплуатации. Во-вторых, с его помощью можно рассчитать необходимую «прибавку на коррозию» — величину, на которую следует увеличить толщину стенки металлоконструкции с целью обеспечения ее надежной работы в уставах развития коррозионного процесса.
Закон роста пленки определяется механизмом самого явления напыления. Считается, что первоначально происходит физическая адсорбция молекул кислорода поверхностью металла. Молекулярный кислород диссоциирует и образует вместе с атомами металла тончайший слой псевдоморфного оксида, который являются как бы кристаллографическим продолжением решетки самого металла. Скорость окисления металла на этой стадии определяется закономерностями, характерными для протекания гетерогенных химических реакций. В соответствии с законом действующих масс она пропорциональна парциальному давлению кислорода в системе:
где dm — масса металла, перешедшая в оксид. Она пропорциональна толщине образовавшегося слоя пленки у; dm = K*dy;
т — период роста пленки;
Kv — константа скорости реакции (4.1);
pO2 — парциальное давление кислорода в системе.
При постоянном парциальном давлении кислорода в системе скорость роста пленки будет равна некоторой постоянной величине K(K = K’Kv*pO2 mn/4):
где k — постоянная, в которую входят константа диффузии и направленной миграции частиц через пленку и парциальное давление кислорода в системе.
Проинтегрировав выражение (4.20), получим
Если в пленке по мере роста разрыхляется внешний слой, то n 2.
В ряде случаев сопротивление пленки может увеличиваться по мере ее роста. Так, иногда вследствие слияния вакансий в пленке могут образовываться полости. Перенос вещества в полостях отсутствует, поэтому сопротивление пленки по мере их появления растет и постепенно закон ее (пленки) роста может стать логарифмическим (кривая AD на рис. 4.2):
Он характерен для окисления цинка, алюминия и хрома.
Помимо этих основных законов роста пленки могут реализоваться и другие: обратный логарифмический
Характер зависимости может меняться во времени. Так, в самый начальный момент окисления при отсутствии на поверхности оксидной пленки для большинства металлов характерен линейный закон роста. По мере увеличения толщины пленки, когда она начинает ощутимо тормозить перенос частиц металла и окислителя друг к другу, закон ее роста может стать параболическим. Наконец, у таких металлов, как алюминий, хром и цинк, по мере роста пленки появляются дополнительные факторы торможения, и закон снова меняет свой характер — становится логарифмическим.
Как правило, тот или иной закон роста пленки характерен для металла в наиболее опасном с точки зрения коррозии температурном интервале. При другой температуре он может быть иным. Например, на железе в температурном интервале 500—1100°С пленка растет по параболическому закону, а при температуре до 400°С, когда высокотемпературное окисление железа кислородом не является опасным, — по логарифмическому.
На закон роста пленки существенное влияние оказывают внутренние напряжения, которые возникают в ней по мере формирования. Это связано с тем, что объем образующегося оксида как правило отличается от объема формирующего ее металла. Напряжения в пленке могут быть как растягивающими, так и сжимающими. Пиллинг и Бедвордс ввели параметр, который впоследствии стали называть их именами. Это соотношение молярных объемов образующегося оксида и формирующего его металла (VOx/VMe). Установлено, что если VOx/VMe 1, и образующаяся пленка недостаточно пластична, она легко разрушается вследствие реализации в ней внутренних напряжений.
В ряде случаев, когда окисление происходит очень быстро, закон роста пленки определить не удается. В этом случае говорят о катастрофическом окислении.
Рассмотренные закономерности высокотемпературного окисления металла свидетельствуют о том, что определяющим фактором его развития являются защитные свойства формирующейся на поверхности металла пленки продуктов коррозии.
При эксплуатации оборудования НПЗ и ГПЗ весьма существенно учитывать рассмотренные выше закономерности, поскольку они имеют место при окислении металла оборудования как кислородом, так и другими окислителями. Так, при наличии в топливе печей установок ванадия на поверхности труб печных змеевиков образуются легкоплавкие продукты коррозии, и защитные оксидные слои на поверхности металла практически отсутствуют. Реализуется линейная зависимость уменьшения толщины металлоконструкции от времени контакта со средой. Если рабочая среда аппарата содержит существенное количество нафтеновых кислот, продукты коррозии могут растворяться в углеводородной фазе, и поверхность металла оказывается незащищенной. Это вызывает существенное коррозионное поражение тарелок и элементов корпуса вакуумных колонн, и о росте пленки также не приходится говорить. Наконец, при наличии в среде сероводорода на высокотемпературном оборудовании возникают сульфидные пленки с VOx/VMe = 2,5-4,0, которые растрескиваются уже при толщине более 0,25 мм и плохо защищают металл от контакта с сероводородом, чем и объясняется высокая скорость ВТСК. Закон роста пленки близок к линейному.
ЗАКОНЫ РОСТА ОКСИДНЫХ ПЛЕНОК
В первом случае скорость реакции подчиняется уравнению Аррениуса:

Во втором случае зависимость скорости реакции от концентрации окислителя описывается более сложными уравнениями.
Рассмотрим законы роста оксидных пленок на металлах. Процесс образования оксидной пленки состоит из нескольких стадий:
1. Доставка окислителя к поверхности металла.
2. Адсорбция окислителя на поверхности металла и образование хемосорбированной пленки кислорода.
3. Превращение хемосорбированной пленки в состояние оксида металла. При этом образуется первичная тончайшая пленка оксида металла.
4. Доставка окислителя к внешней поверхности оксидной пленки.
5. Адсорбция окислителя на внешней поверхности оксида.
6. Ионизация окислителя.
7. Диффузия ионов металла в слой оксида.
8. Диффузии электронов в слой оксида.
9. Диффузия ионизированного окислителя в слое оксида.
10. Химическая реакция образования оксида металла из ионов металла и окислителя.
Кроме того, известны случаи, когда скорость реакции контролируется процессом переноса электронов через тонкую пленку оксида металла.
Если образующаяся оксидная пленка имеет большое количество пор, то она не препятствует доступу окислителя к поверхности металла. В этом случае самой медленной стадией является стадия химической реакции металла и окислителя, т.е. наблюдается кинетический контроль процесса роста оксидной пленки. В дифференциальной форме скорость образования пористой оксидной пленки описывается уравнением:

Для получения зависимости толщины оксидной пленки от времени и концентрации окислителя необходимо разделить переменные и взять определенный интеграл (считая, что в момент времени t = 0 толщина оксидной пленки равна нулю: h = 0). Полученное уравнение ( 
Линейный закон роста оксидных пленок наблюдается при окислении в кислороде лития, натрия, калия, кальция, магния (при 773 К), тантала и молибдена (при 973 К). Пористые пленки не обладают защитными свойствами.
Замедленные стадии диффузии наблюдаются, если образуется сплошная пленка оксида металла. Согласно Пиллингу, Бедворсу и Францевичу, сплошная пленка оксида металла, обладающая хорошими защитными свойствами, растет, если отношение молекулярного объема оксида к атомарному объему металла находится в пределах от 1 до 2,5.
При замедленной диффузии окислителя, когда ее скорость значительно меньше скорости химической реакции, концентрация окислителя на внутренней поверхности оксида металла равна нулю и скорость образования оксида может быть описана дифференциальным уравнением:

где 

Разделив переменные и взяв определенный интеграл (при t = 0, h = 0), получим выражение 
Такое же уравнение получается, если принять, что замедленной стадией является стадия 7 или одновременно стадии 7 и 9. В последнем случае рост оксида металла происходит внутри пленки оксида, причем граница роста непрерывно перемещается в соответствии с соотношением коэффициентов диффузии ионов металла и окислителя.
Процесс роста оксидных пленок по параболическому закону сопровождается значительным самоторможением реакции,
При отношении молекулярного объема оксида к атомарному объему металла, пошедшего на окисление, более чем 2,5 раза в слое оксида металла возникают большие внутренние механические напряжения, и защитные свойства оксидной пленки ухудшаются.
При соизмеримости скоростей стадий 7, 9 и 10 концентрация окислителя С на внутренней поверхности раздела металл-оксидная пленка не равна нулю. После установления стационарного режима окисления скорости стадий 7, 9 и 10 выравниваются:

Из этого уравнения алгебраическим путем можно найти значение концентрации окислителя на границе раздела металл-оксид металла:

Выражение для скорости роста оксидной пленки с учетом последнего уравнения примет вид:

Разделив переменные и взяв определенный интеграл (t = 0, h = 0), получим квадратное уравнение Эванса:

Закон роста оксидных пленок на металлах при кинетическом контроле процесса может быть представлен и степенным уравнением:
Показатель степени n при h может принимать значения от 1 до 2. Если n = 1, то наблюдается только кинетический контроль роста оксидной пленки. При n = 2 осуществляется диффузионный контроль роста оксидной пленки, а при 1 13 1415161718192021Следующая