какие клетки наиболее восприимчивы к вирусу sars cov 2 тест
Учёные рассказали, какие типы клеток наиболее уязвимы для коронавируса
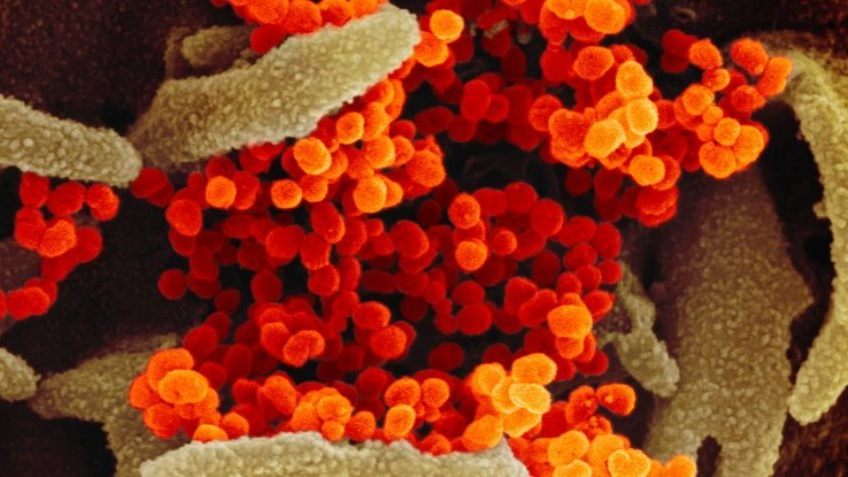
Как сообщает портал ScienceAlert, во время эпидемии атипичной пневмонии в начале 2000-х годов исследователи обнаружили, что ответственный за неё вирус SARS-CoV заражает клетки с помощью двух белков: рецептора ACE2, который помогает вирусу связываться с клеткой, и фермент TMPRSS2, который переносит инфекцию в клетки. Ранее учёные обнаружили, что новый коронавирус (SARS-CoV-2) использует для заражения клеток те же два белка. Это позволяет исследователям выявить наиболее восприимчивые для вируса типи клеток: дыхательные клетки и ткани кишечника, которые экспрессируют как ACE2, так и TMPRSS2.
В рамках масштабной работы исследователи изучили множество данных для секвенирования РНК, собрав информацию о тысячах различных типов клеток у людей, обезьян и мышей. Анализ показал, что очень небольшое количество дыхательных и кишечных клеток у людей имеют гены, которые экспрессируют ACE2 и TMPRSS2. Ими оказались клетки лёгких (альвеолоциты II типа), клетки эпителия кишечника (энтероциты), которые помогают организму усваивать питательные вещества, и бокаловидные клетки в носовом проходе, выделяющие слизь. По словам экспертов, знание типов клеток, которые наиболее восприимчивы к коронавирусу, может оказать большую помощь в разработке потенциальных противовирусных препаратов для борьбы с пандемией.
Ранее учёные выявили новые и более агрессивные штаммы коронавируса. Об этом читайте в материале канала «Наука».
На фото: вирус SARS—CoV-2 (оранжевый) появляется на поверхности клеток, выращенных в лаборатории (NIAID-RML).
Какие клетки наиболее восприимчивы к вирусу sars cov 2 тест
Своевременная и качественная диагностика – один из ключевых факторов в борьбе с COVID-19: диагностика необходима и для оценки общей эпидемиологической ситуации, и в случае принятия решения по каждому конкретному пациенту. По данным сайта стопкоронавирус.рф на 12.05.2020 г. проведено более более 5,8 миллионов тестов на наличие нового коронавируса. Цифра огромная. Однако, насколько достоверны результаты? Появляется все больше историй о типичной картине COVID-19 при отрицательных анализах. Почему так может происходить?
Сначала поговорим о ПЦР-тестах, которые специфически выявляют РНК вируса в пробах.
Взятие пробы для ПЦР
Показано, что для выявления нового коронавируса подходят смывы из носоглотки – из ротоглотки вероятность ложноотрицательного анализа немного выше [ 1 ]. Один из важнейших аспектов – время взятия материала. Проведенные исследования показывают, что при взятии материала у больного в первый день проявления симптомов COVID-19 положительный диагноз поставят с вероятностью 94 %, а вот к 10-му дню это будет всего лишь 67 %! [ 2 ].
Существует четкая закономерность: чем позже от возникновения симптомов взят материал, тем меньше шансов обнаружить в нем вирусную РНК.
Есть и хорошие новости: в течение первой недели от возникновения симптомов носоглоточные смывы имеют порядок от 100 000 до 1 000 000 копий вирусной РНК в 1 мл, что делает их легко обнаруживаемыми даже не самыми чувствительными системами. Исследования также показали, что вирусная нагрузка в верхних дыхательных путях может быть одинаковой у людей с проявленной симптоматикой и при бессимптомном течении болезни [ 3 ].
Транспортировка и хранение проб для ПЦР
Точность разных ПЦР-тест-систем
После попадания образцов в лабораторию правильность диагноза будет зависеть во многом от тест-системы, которую там используют. На сегодняшний день помимо двух тест-систем, разработанных еще в январе в ГНЦВБ «Вектор», зарегистрировано 8 ПЦР-тест систем [ 5 ]:
Из них системы «Вектора» и «Вектор-Беста» (последняя через сеть лабораторий «Инвитро» [ 6 ]) используются для исследования проб от государственных медицинских организаций. Здесь хочется отметить, что система «Вектора» не содержит в своем составе внутреннего контрольного образца, который должен добавляться во все пробы для контроля правильности выделения РНК и реакции обратной транскрипции [ 7 ]. Отсутствие такого контроля может также потенциально приводить к некоторому количеству ложноотрицательных результатов. Хорошая новость заключается в том, что остальные зарегистрированные тест-системы имеют в своем составе внутренний контроль, а также, по-видимому, обладают более высокой чувствительностью, т.е. дают меньше ложноотрицательных результатов.
Таким образом, в городах, где представлены сетевые лаборатории, есть возможность сдать анализ частным образом и надеяться на точность проведения процедуры. В первые дни появления симптоматики точность будет выше.
Экспресс-системы
Что касается экспресс-тест-систем, то есть опасения, что созданные в сжатые сроки «уникальные» тесты по своему качеству будут уступать системам, основанным на обычной ПЦР. Насколько надежны эти системы покажет время, однако уже сейчас количество ложноотрицательных результатов ПЦР в совокупности с длительностью ожидания результата привело к тому, что в клиниках страны диагноз стали ставить не на основе ПЦР-анализа, а на основе результатов компьютерной томографии (КТ).
КТ
Преимущество КТ-диагностики при наличии клинической картины – это скорость постановки диагноза и более высокая чувствительность по сравнению с реальностью ПЦР-диагностики: 97,2 % против 83,3 % согласно данным небольшого китайского исследования [ 12 ]. Начиная с 4-5 дня заболевания можно различить так называемый симптом «матового стекла», на стадии прогрессирования такие участки консолидируются, возникает симптом «булыжной мостовой», «обратного ореола», а в пиковая стадии – «белое легкое» [ 13 ]. Возникает закономерный вопрос: отличается ли картина пневмонии, вызванной именно новым коронавирусом, от заболеваний другой вирусной природы. Ответ – нет. Вирусные пневмонии, будь то аденовирус, грипп или другие респираторные вирусы, выглядят на КТ одинаково.
Однако в условиях пандемии, когда подавляющее большинство вирусных пневмоний имеют коронавирусную природу, использование КТ для диагностики становится более чем оправданным. В последней версии методических рекомендаций Минздрава по профилактике, диагностике и лечению COVID-19 указано, что «наличие клинических проявлений в сочетании с характерными изменениями в легких по данным КТ или обзорной рентгенографии органов грудной клетки вне зависимости от результатов однократного лабораторного исследования на наличие РНК SARS-CoV-2 и эпидемиологического анамнеза» является клинически подтвержденным случаем COVID-19 [ 14 ]. Отметим также, что объем поражения легких при РГ и КТ может не иметь прямой корреляции с клинической тяжестью заболевания.
ИФА (иммуноферментный анализ)
ПЦР-тест-системы, как и КТ-диагностика выявляет COVID-19 в острой фазе. Однако весьма актуальна и информация об уже переболевших, на основании которой можно судить об охвате населения заболеванием, а также о числе бессимптомных случаев. Ответы на эти, а также на многие другие вопросы, может дать тест-система на антитела. На сегодняшний день разработкой таких тест-систем помимо «Вектора» занимаются такие организации как «Вектор-Бест», «НПО «Диагностические системы», ФНКЦ ФХМ ФМБА России, «МБС-Технологии», а также «Генетико» и Институт молекулярной биологии РАН [5]. К сожалению, тест-системы на антитела требуют намного больших усилий и времени на разработку, чем ПЦР-системы, а их чувствительность и специфичность оставляет желать лучшего. Так, проведенное в США исследование доступных система на антитела показало, что лишь 3 из 14 систем дают надежные результаты (т.е. не более 1% ложноположительных результатов), но при этом их чувствительность не превышает 90% относительно положительных контрольных образцов [ 15 ]. Какова будет чувствительность и специфичность разрабатываемых российских систем – пока неизвестно.
Итак, самое разумное, что вы можете сказать клиентам:
Регистрируйся на нашем сайте и получай доступ ко в сем материалам о COVID-19 в специальном разделе.
Отвечаем на вопросы в прямых эфирах Вконтакте: https://vk.com/pharmznanie
Обсудить последние новости со всеми коллегами России вы можете в чатах:
Иммунный ответ на коронавирус SARS-CoV‑2 у больных COVID‑19
Академик Российской академии наук, д.м. н., президент
ФБГУ «НМИЦ ДГОИ им. Дмитрия Рогачева» Минздрава России
В статье представлен анализ результатов исследований иммунного ответа и памяти к SARS-CoV‑2, включая все ветви адаптивного иммунитета, иммуноглобулины, В-клетки памяти, CD8+- и CD4+-T-клетки у больных в динамике в течение 6–8 месяцев после начала заболевания.
Гуморальное звено
Факт первичного иммунного ответа слизистых на COVID‑19 необычен и требует объяснения. Обсуждаются две гипотезы.
Первая: вирусы контаминируют слизистые дыхательных путей и ЖКТ за 7–14 дней до появления системного ответа и клинических проявлений инфекции, поражая клетки микробиоты — используют их для репродукции вируса.
Вторая: кросс-реактивная продукция антител, предпосылкой которой являются Spike-реактивные CD4+-Т-клетки, обнаруженные у большинства пациентов с COVID‑19 и более чем у 34 % неинфицированных людей. Это подтверждает существование общих эпитопов эндемичных коронавирусов, вызывающих банальные ОРВИ и COVID‑19.
Важно, что изотипы иммуноглобулинов (либо IgG, либо IgA) конкурировали за нейтрализующую активность по отношению к SARS-CoV‑2 в зависимости от локализации. Сывороточные антитела IgG сильно коррелировали с величиной IgG-ответа и тяжестью заболевания. У пациентов, например, с IgA-назальным ответом определялась высокая активность нейтрализации вирусов. Инфекция у таких больных протекала бессимптомно.
Это, с одной стороны, предполагает возможность нейтрализации вируса с помощью IgA слизистых без системного ответа, что имеет отношение к исходам заболевания. А с другой стороны, из-за множества корреляций, наблюдаемых между типами антител и их активностью в разных анатомических участках, клиническая интерпретация гуморального ответа существенно затруднена.
Кроме того, эти данные имеют важное значение для нашего понимания защиты вакцинации, индуцирующей системный ответ на вакцинные гены или белки коронавируса по классическому пути и обеспечивающей иммунный ответ слизистых оболочек на 3–6‑й неделе после вакцинации. В идеале вакцина должна не только защитить реципиента от неизбежной болезни, но и предотвратить бессимптомное носительство, что закрыло бы проблему бессимптомных носителей в популяции.
Титры Spike IgА и RBD IgА сохранялись на стабильном уровне на протяжении всего периода наблюдения t1/2— 210 дней, но у отдельных пациентов уровень специфических IgА-антител достоверно снижался через 90 дней.
Нельзя дать однозначный ответ в отношении серонегативных случаев COVID‑19. По-видимому, кроме протективного эффекта иммунитета слизистых, ответ напрямую связан с уровнем вирусной нагрузки SARS-CoV‑2. С одной стороны, высокие вирусные нагрузки связаны с более ранним ответом антител, в то время как у пациентов с низкой вирусной нагрузкой не может быть сероконверсии. С другой стороны, кинетика иммунного ответа может быть показателем скорости элиминации вируса у больного.
Идентификация специфичных В-клеток памяти к Spike, RBD и NCP с использованием флюоресцентно окрашенных зондов на IgD– и (или) CD27+ c последующей дифференцировкой по изотипам поверхностных IgM, IgG или IgA показала следующее. Количество специфических В-клеток увеличивалось в течение 120 дней после начала заболевания с последующим выходом на плато, в то время как Spike-специфические В-клетки памяти у людей, не заболевших COVID‑19, практически не встречались. RBD-специфические В-клетки появлялись на 16‑й день, и их количество увеличивалось в течение последующих 4–5 месяцев. Интересно, что только 10–30 % Spike-специфических В-клеток памяти было специфично для домена RBD через 6 месяцев после выздоровления больных.
NCP-специфичные В-клетки памяти также стабильно увеличивались в те же сроки и определялись спустя 5–6 месяцев после заболевания. Представленность изотипов иммуноглобулинов Spike-специфических В-клеток имела следующую динамику. В ранней фазе (20–60 дней) после заболевания IgM+ и IgG+ на В-клетках были представлены одинаково. В период после 60 дней до 240‑х суток преобладали IgG+ Spike-специфические В-клетки. Частота IgА+ Spike-специфических клеток составляла примерно 5 %, и они равномерно распределялись в течение всего периода наблюдения в 8 месяцев. Корреляция между сывороточным IgA и IgA слизистых оболочек не проводилась.
Сходная картина динамики наблюдалась и в случае IgG+, IgM+ и IgА+ к эпитопам RBD и NCP коронавируса. В то же время долгосрочное присутствие циркулирующих В-клеток памяти, направленных как против основных SARS-CoV‑2‑нейтрализующих таргетов (Spike и RBD), так и против не нейтрализующего таргета (NCP), свидетельствует о клеточной памяти, сохраняющейся после естественного воздействия вируса. Это может быть использовано для планирования ревакцинации. Тот факт, что почти все RBD- специфические IgG+-В-клетки памяти экспрессировали CD27, свидетельствует о долгосрочной иммунной памяти.
Анализ полученных данных говорит о том, что снижение нейтрализующих и других антител к SARS-CoV‑2 после клинического выздоровления вовсе мунитета. Просто с развитием и сохра- нением памяти В-клеток, способных активизироваться при встрече с новыми штаммами коронавируса, уровень антител в сыворотке снижается, в то время как IgА-ответ слизистых сохраняется на постоянном уровне в течении всего периода наблюдения.
Клеточный ответ
Процент больных с обнаруживаемыми циркулирующими CD8+-Т-клетками памяти через месяц после возникновения симптомов составил 70 %. К 6–9 месяцам клетки обнаруживались у 50 % выздоровевших пациентов. Фенотипические маркеры показали, что большинство SARS-CoV‑2‑специфичных CD8+-Т-клеток представлены терминально дифференцированными клетками памяти.
Циркулирующие SARS-CoV‑2‑специфичные CD4+-Т-клетки памяти через месяц после начала заболевания обнаруживались у 93 % пациентов. Через 6–9 месяцев уровень этих клеток был стабильным, а сами они выявлялись у более чем у 90 % пациентов, перенесших COVID‑19. Причем это касалось как Spike-специфичных, так и мембраноспецифичных CD4+-Т-клеток памяти.
Интересно, что при сравнении параметров иммунного ответа у больных с тяжелым и легким течением инфекции гуморальные показатели были более высокими у тяжелых больных, в то время как CD8+-Т-клетки были стабильными, а CD4+ — более низкими в тяжелых случаях заболевания. Объяснений этому феномену нет, важно, что слабый ответ Т-клеток наблюдается в острой фазе заболевания. Кроме того, важна и методология исследования клеточного им-мунитета.
Нарушения клеточного ответа проиллюстрированы дефицитом интерферонов I и II типов у пациентов с тяжелыми и среднетяжелыми формами COVID‑19 по сравнению с легкими и бессимптомными случаями заболевания. Это может быть связано с подавлением воспаления интерлейкином‑12 (IL‑12) и развитием вторичного дефекта клеточного иммунитета.
Иммунное взаимодействие
Большой интерес представляет изучение взаимодействия гуморального и клеточного ответа на SARS-Cov‑2. В исследованиях RBD-IgG, Spike IgА, RBD-В-клеток памяти, CD8+- и CD4+-Т-клеток в динамике у одних и тех же пациентов установлено, что у большинства из них (64 %) положительные показатели отмечались через 1–2 месяц после начала заболевания. Через 5–8 месяцев число реконвалесцентов, позитивных на пять тестов, снизилось до 43 %. В то же время как минимум три из пяти тестов были положительными спустя 6–9 месяцев. Важно отметить, что IgG на Spike дает на порядок больше положительных ответов, чем на RBD-антиген. Попытки связать гуморально- клеточные взаимодействия не привели к успеху из-за неоднородности участников исследования и методик оценки иммунного ответа.
Неопределенный результат
В метаанализе 22 исследований (4969 пациентов) установлены неблагоприятные признаки тяжелых форм болезни и летальных исходов, такие как лимфопения и нейтрофилез. Поскольку CD4+-Т-клетки необходимы для сбалансированного и эффективного иммунного ответа, неудивительно, что низкий уровень лимфоцитов может отражать гипервоспалительные процессы и способствовать более тяжелому течению заболевания и повышенной смертности.
Нейтрофилы как неотъемлемая часть врожденной защиты контролируют баланс микробиоты и элиминацию продуктов клеточной деструкции за счет производства активных форм кислорода и высвобождения нейтрофильных внеклеточных ловушек в венозном кровотоке. Лимфопения (менее 500 клеток в 1 мкл) указывает на повышение риска тяжелой формы заболевания и смертельных исходов при COVID‑19 в 3 раза. Стойкий нейтрофилез со сдвигом влево свидетельствует об истощении костномозгового резерва, а при сдвиге вправо отражает нарушения выхода клеток в ткани. Этот легко контролируемый анализом крови параметр указывает на более чем семикратное увеличение для пациента риска заболеть тяжело и погибнуть от COVID‑19.
Попытки выявить закономерности иммунного ответа на SARS-CoV‑2 оказались пока безуспешными.
Во-первых, можно сделать вывод, что переболевшие коронавирусной инфекцией сохраняют иммунную память в последующие 6–9 месяцев. Дальнейшие динамические исследования покажут, в какие сроки наступает снижение иммунного ответа, требующее профилактической вакцинации и (или) ревакцинации.
Во-вторых, и это очень интересно, каждый изученный компонент иммунного ответа и иммунной памяти демонстрирует различную кинетику. Это связано с индивидуальным ответом на инфекцию, наличием преморбида и частого превращения моноинфекции в смешанные инфекции SARS-CoV‑2 с активизировавшейся микробиотой больного.
В-третьих, неоднородность ответа может быть центральным признаком, характеризующим иммунную память к SARSCoV‑2. Биологические специфические IgG имеют 21 день периода полураспада, уровень антител с течением времени отражает продукцию короткоживущих, а потом и долгоживущих плазматических клеток. С точки зрения исчезновения возбудителя в течение нескольких дней после появления клиники, процесс наработки антител должен быть снижен к 6 месяцам, но, если SARS-CoV‑2 Spike и RBD IgG сохраняются дольше 8 месяцев, это означает, что вирус персистирует в организме хозяина или его микробиоте. Нельзя исключать и связь с пролонгированным иммунным ответом естественной реиммунизации циркулирующими эпидемическими альфа-коронавирусами, поддерживающими иммунный ответ.
В-четвертых, выявление и анализ SARSCoV‑2‑специфических В-клеток памяти потенциально могут применяться в качестве маркера гуморального ответа при вакцинации. Сейчас исследования поствакцинального иммунного ответа проводятся с использованием иммунофлуоресцентного анализа с оценкой IgM- и IgG-антител в качестве маркеров эффективности вакцины (рис. 3). Методы ИФА-диагностики, к сожалению, не стандартизованы едиными белками S, RBD, NCP, качество которых зависит от очистки антигена. Поскольку количество В-клеток памяти стабильно с течением времени, они могут представлять собой более надежный маркер продолжительности гуморальных иммунных реакций, чем иммуноглобулины сыворотки крови.
Таким образом, из результатов исследований иммунного ответа у больных COVID‑19 невозможно сделать какие-либо выводы о защитном иммунитете при новой коронавирусной инфекции. Ведь изучение антител и клеток памяти при этом заболевании пока еще не завершено. А значит, обсуждаемые механизмы защитного иммунитета против SARS-CoV‑2 у людей окончательно не определены.
Источник: Газета «Педиатрия сегодня» №6, 2021
Нейтрализующие антитела к коронавирусу SARS‑CoV‑2, спайковый (S) белок, IgG, количественно ( Тест анти-RBD)
Доступен анализ на нейтрализующие антитела класса g после вакцинации или перенесенного COVID-19. ( Количественное определение антител класса IgG к RBD-домену спайкового (S) белка SARS-Co-V-2, пре- и поствакцинальные).
АКЦИЯ: все анализы со скидкой 25 %. (переходите по ссылке)
Что за тест анти-RBD и что он показывает?
В ответ на заражение организм начинает реагировать выработкой антител различных классов. Именно их обнаружение позволяет установить факт инфицирования даже у бессимптомных пациентов. IgG начинают выявляться в среднем на 3-й неделе заболевания, перемещаясь по сосудистому руслу пациентов длительно время. При лабораторном тестировании возможно определение IgG к различным белкам вируса. Наличие антител класса IgG к нуклеокапсидному белку является показателем перенесенной инфекции.
Выявление IgG к рецептору связывающего домена (RDB) – позволяет судить о наличии защитного иммунитета, который мог сформироваться после перенесенного заболевания, так и после вакцинации. Антитела к рецептору связывающего домена S белка обладают нейтрализующими свойствами и препятствуют связыванию вируса с клетками человека, тем самым обеспечивая важную роль в определении индивидуального протективного (защитного) иммунного ответа к SARS-CoV-2.
Кому показан и когда нужно сдавать тест на наличие антител к S-белку?
В первую очередь анализ на определение нейтрализующих антител класса g ( АНТИ RBD) показан лицам переболевшим новой коронавирусной инфекцией и лицам, после вакцинации препаратом «Спутник V» (Центр Гамалеи), а также другими вакцинами, разрешенными к применению на территории РФ. Рекомендуемый срок сдачи анализа на антитела после вакцины «Спутник V» 35-42 дня с момента постановки первого компонента. Для выявления антител после вакцины ЭпиваКкорона необходимы специальные тест системы «Вектор».
Чувствительность теста в диапазоне 80-99 %, специфичность 95-99%
Расшифровка результатов исследования
При каком уровне антител нужно прививаться от коронавируса?
Положительные антитела и опасность для окружающих
Антитела могут сохранятся и определятся в сыворотке в течении 5-7 месяцев после начала заболевания. Уровень антител зависит от нескольких факторов, перечисленных выше. (Вес, пол, влияние вредных факторов, степень тяжести перенесенного заболевания и тд.). Все чаще и чаще высказывается в научных кругах мнение, что в связи с появлением нового штамма «Дельта» ( Индийский штамм) необходим более высокий уровень антител, поэтому рекомендуем периодически сдавать анализ, с целью отслеживания динамики титров антител. В случае снижения титров до низких показателей, следует рассмотреть вопрос о ревакцинации.
По последним исследованиям, (статья опубликована 12.10.2021 ) проведенного в Швеции и Италии, показали, что у большинства переболевших COVID-19 в первые полгода количество антител снижалось постепенно, после чего показатель ( в течении 8-9 месяцев) до 15 месяцев был стабильным.
Авторы собрали 188 анализов крови у 136 пациентов, у которых заболевание сопровождалось характерными симптомами и протекало в различной форме, от легкой до тяжелой. В качестве контрольной выборки использовали плазму 108 человек с подтвержденным отрицательным ПЦР-тестом.
Ученые измеряли титры анти-S и анти-RBD антител в плазме. Первые специфически направлены на спайковый белок, или S-белок вируса целиком, а вторые — на рецептор-связывающий домен (RBD) S-белка, играющий ключевую роль в связывании вируса с клетками. Известно, что со временем в структуре S-белка и RBD-домена накапливаются мутации, которые снижают нейтрализующую способность антител. Задачей ученых было определить время, в течение которого антитела плазматических клеток сохраняют активность.
Результаты показали, что на пике иммунного ответа у выздоравливающих пациентов уровни анти-RBD иммуноглобулинов IgM и IgA были увеличены на 77 и 85 процентов соответственно, но затем в течение шести-пятнадцати месяцев упали до 4,5 и 11 процентов. Антитела IgM и IgA к S-белку показали значения чуть выше — соответственно 88 и 90 процентов в первые один-три месяца и вполовину меньше через 55-56 дней.
Титры специфических антител IgG к RBD и S-белку у 94 процентов пациентов достигли максимума через 15-28 дней после появления симптомов, потом, после прохождения пика ответа антител, они постепенно уменьшились примерно в четыре раза к концу шестого месяца, а затем оставались стабильными до 15 месяцев. Дольше сохранялся высокий уровень антител у тех, кто переболел COVID-19 в тяжелой форме.
Для сравнения ученые оценили уровень специфических IgG антител в плазме вакцинированных. Оказалось, что через 14-35 дней после введения первой дозы вакцины титры антител были аналогичны таковым у переболевших через шесть месяцев после заражения, а после второй соответствовали максимальному уровню естественного ответа у выздоравливающих пациентов.
Помимо основного штамма SARS-CoV-2, авторы проверили эффективность антител в отношении бета, гамма и дельта-вариантов (мутировавшие штаммы) в течение 15 месяцев после заражения и подтвердили, что нейтрализующая активность антител, хоть и в меньшей степени, сохраняется и для этих вариантов коронавируса.
Кроме того, ученые определяли уровень Т-клеточного ответа, пик которого был отмечен между третьим и шестым месяцами после заражения, за которым последовало значительное снижение через 12-15 месяцев. Однако интенсивность и продолжительность ответа при этом не зависели от тяжести заболевания.
Авторы исследования уточняют, что для оценки длительного иммунитета, сохраняющегося в В-клетках памяти, 15 месяцев, в течение которых проводили исследование, недостаточно, но очевидно, что у большинства перенесших COVID-19 пациентов циркулирующие В- и Т-клетки памяти и нейтрализующие антитела присутствуют в плазме крови до 15 месяцев после заражения.


