какие клетки нервной ткани обладают фагоцитозом
Какие клетки нервной ткани обладают фагоцитозом
Фагоциты выполняют не только защитные (поглощают и разрушают чужеродные агенты), но и дренажные функции (удаляют погибшие и деградировавшие структуры организма). Фагоциты представлены клетками миелопоэтического ряда (полиморфно-ядерные лейкоциты) и макрофагально-моноцитарной системы (моноциты, тканевые макрофаги). Основные свойства фагоцитирующих клеток представлены в табл. 10-5.
Полиморфно-ядерные лейкоциты имеют дольчатое ядро и множество мелких цитоплаз-матических гранул (поэтому их также называют гранулоциты). По окрашиванию гранул выделяют три типа клеток: нейтрофилы, эозинофилы и базофилы.
Нейтрофилы. Феномен краевого стояния. Нейтрофилия. Эозинофилия
Нейтрофилы — основные эффекторные клетки острого воспаления; у взрослых лиц они составляют самую многочисленную популяцию лейкоцитов. Основная часть нейтрофилов циркулирует в крови в течение 6-7 ч. Затем они скапливаются в капиллярах, где формируют краевой пул, прикрепляясь к эндотелию (по периметру кровотока); в таком состоянии нейтрофилы находятся в готовности немедленно покинуть кровеносное русло (феномен краевого стояния). Нейтрофилия (увеличение их количества в периферической крови) часто указывает на наличие воспалительной реакции.
Потенциал эозинофилов направлен не столько на фагоцитирование бактерий, сколько на нейтрализацию паразитов, особенно гельминтов (например, нематод). Поэтому, эозинофилия — признак, указывающий на возможную глистную инвазию. Кроме того, эозинофилы участвуют в разрушении гистамина, выделяя гистаминазу. Именно поэтому эозинофилию также наблюдают при аллергических заболеваниях. Определённая роль в подобной специализации эозинофилов принадлежит специфическим гранулам, содержащим пероксидазы и катионные белки (например, основный белок, катионные белки эозинофилов), активные именно в отношении паразитов. В активации эозинофилов важную роль играют IgE, образующиеся в ответ на сенсибилизацию организма аллергенами (в том числе микробными).
Иммунная система Часть 3 Иммунные клетки
Иммунная система Часть 3 Иммунные клетки
В костном мозге основные иммунные клетки рождаются из кроветворной стволовой клетки. Процесс называется гемопоэз – рождение клеток крови. Часть иммунных клеток известна всем как белые клетки крови – лейкоциты. Это большая группа клеток, разделяющаяся во время гемопоэза. Иммунные клетки врожденного иммунитета образовываются непосредственно в тканях и в костном мозге как из стволовых клеток, так и из клеток крови, других клеток кожи и слизистых оболочек.
Гранулоциты
Имеют такое название, поскольку содержат гранулы. Процесс выхода содержимого гранул называется дегрануляция. Вещества гранул обладают токсическим действием, являются регуляторами острого воспаления, приводя к развитию клинических симптомов (отек, зуд, спазм сосудов и т.п.). Составляют основу лейкоцитарной формулы крови.
Нейтрофилы
Эозинофилы
Базофилы
Лейкоцитарная формула (циркуляция в крови)
Во время острого воспалительного процесса нейтрофилы выходят в ткани. Их цель – фагоцитировать и разрушать антигены.
Атакуют крупные микроорганизмы, которые не могут быть поглощены. Источник регуляторов острого воспаления
Работают как тучные клетки тканей, обуславливая аллергическую воспалительную реакцию. Источник регуляторов острого воспаления
Повышаются в крови
При острых бактериальных и грибковых инфекциях; при системных воспалительных заболеваниях; при онкологии костного мозга
При аллергических заболеваниях; при паразитарных заболеваниях; при системных воспалительных заболеваниях.
При аллергических заболеваниях; при онкологических заболеваниях костного мозга
При тяжелой инфекции с развитием сепсиса; при многих вирусных инфекциях; при иммунодефиците и повреждении костного мозга.
При острых бактериальных инфекциях; при болезнях надпочечников.
При острых бактериальных инфекциях.
Тучные клетки
Ранее предполагалось, что образуются из базофилов крови, но выявлены их различия. Тучные клетки постоянно живут в тканях, как и базофилы играют ведущую роль в остром аллергическом воспалении.
Естественные клетки-киллеры
Моноциты крови как часть лейкоцитарной формулы (до 8%) коротко циркулируют в крови и в основном преобразуются в тканевые макрофаги (фагоцитирующие клетки), но от 5 до 15% моноцитов лейкоцитарной формулы на самом деле – естественные клетки-киллеры (ЕК-клетки). Они созревают в костном мозге и имеют колоссальное значение в уничтожении зараженных, отработанных и опухолевых клеток, умея распознавать их и участвуя в процессе апоптоза. Это важный компонент безопасной гибели клеток, ограничивающий выход ее содержимого. Также они являются источником некоторых молекулярных компонентов (ИФН-гамма, ИЛ-1, ФНО-альфа).
Антиген-презентирующие клетки
Не являются какой-то одной группой клеток. Скорее это способность многих клеток, обладающих фагоцитозом – процессом поглощения и переваривания антигенов. К ним относят тканевые макрофаги (образующиеся из моноцитов крови), клетки Лангерганса в коже, дендритные клетки, интердигитальные клетки, являющиеся клетками врожденного иммунитета. Для реализации приобретенного иммунитета требуется специальная обработка антигенов и представление их на поверхности клетки в связке с особыми рецепторами – презентация антигена.
Клетки, способные это делать, называют антиген-презентирующие. После поглощения антигена они устремляются в лимфатические узлы для встречи с Т-лимфоцитами. Именно для них нужна презентация антигена, чтобы информацию о нем передать В-лимфоцитам для синтеза антител. Кроме того, антиген-презентирующие клетки выделяют особые молекулы, необходимые для формирования популяций Т-лимфоцитов, определяющих направление иммунного ответа – клеточный или гуморальный.
Клетки осуществляющие фагоцитоз
Фагоцитоз – это явление захвата и переваривания чужеродных вредных частиц, попавших в организм, особыми клетками-защитниками. Притом к фагоцитозу способны не только «специально обученные» фагоциты, цель жизни которых заключается в защите здоровья человека, но и клетки, выполняющие в нашем теле совершенно иные задачи… Итак, какие же существуют клетки, способные к фагоцитозу?
Моноциты
Моноциты – одно их первых названий, которые всплывают 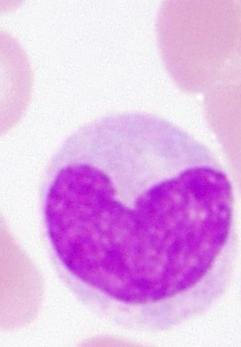
При фагоцитозе моноцит справляется с вредными объектами всего за 9 минут. Иногда он поглощает и расщепляет клетки и субстраты, превышающие его по размерам в несколько раз.
Нейтрофилы
Фагоцитоз нейтрофилов осуществляется похожим образом, с той лишь разницей, что они работают по принципу «Светя другим, сгораю сам». Это значит, что, захватив патоген и уничтожив его, нейтрофил погибает.
Макрофаги
Макрофаги – это осуществляющие фагоцитоз лейкоциты, образовавшиеся из моноцитов крови. Они располагаются в тканях: как непосредственно под кожей и слизистыми, так и в глубине органов. Существуют особые разновидности макрофагов, которые находятся в конкретных органах.
Например, в печени «живут» клетки Купфера, задача которых состоит в разрушении старых компонентов крови. В легких располагаются альвеолярные макрофаги. Эти клетки, способные к фагоцитозу, захватывают вредные частицы, проникшие в легкие с вдыхаемым воздухом, и переваривают их, разрушая своими ферментами: протеазами, лизоцимом, гидролазами, нуклеазами и т.д.
Обычные тканевые макрофаги обычно погибают после встречи с патогенами, то есть в этом случае происходит то же, что и при фагоцитозе нейтрофилов.
 Дендритные клетки
Дендритные клетки
Эти клетки – угловатые, ветвистые – совершенно не похожи на макрофаги. Тем не менее, они являются их родственниками, так как тоже образуются из моноцитов крови. К фагоцитозу способны только молодые дендритные клетки, остальные в основном «работают» с лимфоидной тканью, обучая лимфоциты правильно реагировать на некоторые антигены.
Тучные клетки
Помимо того, что тучные клетки запускают реакцию воспаления, эти лейкоциты способны к фагоцитозу. Особенность их работы состоит в том, что они уничтожают только грамотрицательные бактерии. Причины такой «разборчивости» не совсем понятны, видимо, у тучных клеток есть к этим бактериям особое сродство.
Они могут уничтожить сальмонеллу, кишечную палочку, спирохету, многих возбудителей ЗППП, но совершенно равнодушно воспримут возбудителя сибирской язвы, стрептококка и стафилококка. Борьбой с ними займутся другие лейкоциты.
Перечисленные выше клетки – это профессиональные фагоциты, об «опасных» свойствах которых известно всем. А теперь несколько слов о тех клетках, для которых фагоцитоз – не самая типичная функция.
Тромбоциты
Тромбоциты, или кровяные пластинки, занимаются главным образом тем, что отвечают за свертываемость крови, прекращают кровотечения, формируют тромбы. Но, помимо этого, у них обнаружены и фагоцитарные свойства. Тромбоциты могут образовывать ложноножки и уничтожать некоторые вредные компоненты, попавшие в организм.
Клетки эндотелия
Оказывается, клеточная выстилка сосудов тоже представляет 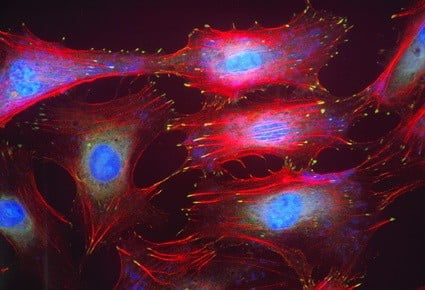
Гистиоциты
Под этим собирательным названием объединяют все клетки тканей: соединительной ткани, кожи, подкожной клетчатки, паренхимы органов и так далее. Раньше этого никто не мог предположить, но оказывается, при определенных условиях многие гистиоциты способны менять свои «жизненные приоритеты» и тоже приобретать способность к фагоцитозу! Повреждения, воспаление и другие патологические процессы пробуждают в них эту способность, которая в норме отсутствует.
Фагоцитоз и цитокины:
В процессе фагоцитоза клетки образуют цитокины. Это так называемые сигнальные молекулы, при помощи которых фагоциты передают информацию другим компонентам иммунной системы. Самыми важными из цитокинов являются трансфер факторы, или факторы передачи – белковые цепочки, которые можно назвать самым ценным источником иммунной информации в организме.
Чтобы фагоцитоз и другие процессы в иммунной системе проходили благополучно и полноценно, можно использовать препарат Трансфер Фактор, действующее вещество которого и представлено факторами передачи. С каждой таблеткой средства организм человека получает порцию бесценных сведений о правильной работе иммунитета, полученных и накопленных многими поколениями живых существ.
При приеме Трансфер Фактора нормализуются процессы фагоцитоза, ускоряется ответ иммунной системы на проникновение возбудителей, повышается активность клеток, защищающих нас от агрессоров. Кроме того, через нормализацию работы иммунитета улучшаются функции всех органов. Это позволяет повысить общий уровень здоровья и, если это необходимо, помочь организму в борьбе с практически любым заболеванием.
Научная электронная библиотека
Сологуб Т. В., Романцова М. Г., Кремень Н. В., Александрова Л. М., Аникина О. В., Суханов Д. С., Коваленко А. Л., Петров А. Ю., Ледванов М. Ю., Стукова Н. Ю., Чеснокова Н. П., Бизенкова М. Н., Понукалина Е. В., Невважай Т. А.,
3.5. Общая характеристика и механизмы развития сосудистых реакций в очаге острого воспаления
Как известно, острое воспаление характеризуется определенной последовательностью сосудистых изменений, проявляющихся развитием спазма сосудов, артериальной, венозной гиперемии и стаза.
Венозная гиперемия характеризуется дальнейшим расширением сосудов, снижением скорости кровотока, полнокровием ткани, феноменом краевого стояния лейкоцитов и их эмиграцией, нарушением реологических свойств крови, усилением процессов экссудации.
Факторы, влияющие на переход артериальной гиперемии в венозную, можно разделить на две группы: внутрисосудистые и внесосудистые [50].
К внутрисосудистым факторам, вызывающим развитие венозной гиперемии, относятся набухание эндотелиальных клеток, краевое стояние лейкоцитов, активация системы гемостаза, сладжирование эритроцитов, сгущение крови, повышение ее вязкости, образование микротромбов.
Из внесосудистых факторов наибольшее значение имеют отек ткани и сдавление венул, мелких вен, лимфатических сосудов экссудатом. Усиливают венозную гиперемию избыточное накопление в очаге воспаления медиаторов с сосудорасширяющим действием, ферментов лизосом и ионов водорода, а также нарушение околокапиллярного соединительнотканного скелета и десмосом в зоне первичной и вторичной альтерации.
Ограничение кровотока в участке венозной гиперемии и образование барьеров способствуют уменьшению резорбции из очага воспаления продуктов распада, токсических факторов, а также снижают риск распространения инфекционных агентов. Однако при развитии воспаления в паренхиматозных органах длительная венозная гиперемия может привести к снижению их специализированных функций и развитию склерозирования клеток [7, 8].
Механизмы эмиграции лейкоцитов. Роль лейкоцитов в очаге воспаления
Как уже было отмечено, важнейшим признаком венозной гиперемии является эмиграция лейкоцитов из сосудов в воспаленную ткань. Последовательность выхода лейкоцитов получила название закона Мечникова, согласно которому спустя несколько часов (1, 5-2 часа) с момента действия альтерирующего фактора интенсивно эмигрируют нейтрофилы и другие сегментоядерные лейкоциты, а затем моноциты и лимфоциты.
В настоящее время известно несколько классов молекул клеточной адгезии:
5. Хрящевые соединительные белки. Экспрессируются всеми видами лейкоцитов, распознают гиалуроновую кислоту, что обеспечивает перемещение лейкоцитов в основном веществе соединительной ткани [16, 18].
При недостаточном образовании селектинов и интегринов или выработке антител к мембранным рецепторам снижаются адгезивные свойства лейкоцитов, нарушается их способность к эмиграции, накоплению в очаге воспаления и фагоцитозу, что может способствовать частым гнойным инфекциям и развитию сепсиса.
После адгезии происходят перемещение лейкоцита по поверхности эндотелиоцита к межэндотелиальной щели, которая в очаге воспаления значительно расширена, а затем и образование ложноножки и передвижение лейкоцита через межэндотелиальную щель в подэндотелиальное пространство и базальную мембрану сосуда. Таким образом лейкоциты оказываются за пределами сосуда.
В большинстве случаев острого воспаления внутрисосудистые перемещения лейкоцитов и их эмиграция занимают несколько часов. Как правило, первыми в очаг воспаления выходят нейтрофилы, они обнаруживаются в воспаленной ткани уже через 6-24 часа. Несколько позднее эмигрируют моноциты и лимфоциты (24-48 часов). Такая асинхронность эмиграции клеток обусловлена неодновременным появлением молекул адгезии и хемотаксических факторов, специфичных для разных лейкоцитов.
Нужно отметить, что временные интервалы эмиграции лейкоцитов и последовательность их выхода весьма относительны и определяются типом сосуда, видом воспаления и стадией воспаления.
Направленное движение лейкоцитов обеспечивается хемоаттрактантами, концентрация которых по мере развития вторичной альтерации в очаге воспаления нарастает, а также наличием рецепторов к различным хемоаттрактантам на поверхности лейкоцитов.
При взаимодействии рецепторов и хемоаттрактантов возникает гиперполяризация мембраны лейкоцита, увеличивается ее проницаемость для ионов Са, инициируется синтез функционально активных фосфолипидов и циклических нуклеотидов, растет число внутриклеточных органелл, функционирование которых обеспечивает перемещение лейкоцита и секрецию содержимого гранул. Помимо ориентированного движения лейкоцитов, хемоаттрактанты индуцируют адгезию лейкоцитов к эндотелию, способствуют краевому стоянию лейкоцитов и их агрегации в просвете микрососудов. Хемотаксис опосредуется различными группами веществ:
1. Цитотаксигенами, которые, не являясь хемоаттрактантами, генерируют факторы хемотаксиса.
Хемоаттрактанты могут иметь эндогенное и экзогенное происхождение. Экзогенными хемоаттрактантами являются пептиды бактерий, особенно содержащие N-формиловые группы. Свойствами эндогенных хемоаттрактантов обладают компоненты комплемента, иммуноглобулины, иммунные комплексы, лимфокины и монокины, кинины, лейкотриен В4, продукты липоксигеназного пути превращения арахидоновой кислоты, фактор, активирующий тромбоциты, фактор Хагемана, лизосомальные ферменты и другие.
Роль лейкоцитов в очаге воспаления
Кроме вновь синтезирующихся факторов оксидантной системы, в гранулах нейтрофилов содержатся лизоцим, лактоферрин, катионные белки, щелочная и кислая фосфатазы, рибонуклеаза, дезоксирибонуклеаза, гиалуронидаза, b-глюкуронидаза, эластаза, коллагеназа, ФАТ, кинины, лейкоцитарный пироген, хемотаксические факторы.
Таким образом, накопление нейтрофилов в очаге воспаления и освобождение ими указанных биологически активных веществ вызывают гибель или ограничение жизнедеятельности микроорганизмов, разрушение и лизис омертвевших тканей, очищение зоны повреждения [57]. За счет нейтрофилов вокруг очага воспаления формируется нейтрофильный защитный барьер, который отграничивает зону повреждения (совместно с моноцитарным и фибробластическим) от здоровой ткани и препятствует распространению инфекции и токсических повреждающих факторов.
Высокоактивные медиаторы нейтрофилов участвуют в развитии вторичной альтерации, стимулируют выход биологически активных веществ из других клеток, способствуют расширению сосудов, увеличению их проницаемости, экссудации плазмы и эмиграции лейкоцитов. Поступая в системный кровоток, они вызывают проявление некоторых системных эффектов воспалительного процесса.
В очаге воспаления эозинофилы выполняют две основные функции: они становятся модуляторами реакций гиперчувствительности и главным механизмом защиты от личиночных стадий паразитарных инфекций.
Основными факторами, стимулирующими процесс дегрануляции эозинофилов, являются иммуноглобулины, иммунные комплексы, комплемент. Продукты секреции эозинофилов ингибируют выделение лаброцитами гистамина и участвуют в его инактивации за счет гистаминазы, эозинофильный катионный протеин связывает и нейтрализует гепарин, высокие концентрации арилсульфатазы инактивируют хемотаксические белки и медленно реагирующую субстанцию анафилаксии, фосфолипазы В и D инактивируют тромбоцитактивирующий фактор. Под влиянием эндотоксинов и в процессе фагоцитоза эозинофилы продуцируют и выделяют эндогенный пироген, обеспечивающий развитие лихорадочной реакции, сопровождающей воспалительный процесс.
Медиаторы эозинофилов, так же как и нейтрофилов, могут участвовать в реакциях повреждения ткани и распространении вторичной альтерации.
Вслед за гранулоцитами в очаге воспаления накапливаются мононуклеары. Моноциты, эмигрировавшие в ткани, превращаются в тканевые макрофаги. В зоне воспаления происходит накопление макрофагов за счет эмиграции моноцитов из кровеносного русла, а также за счет мобилизации тканевых макрофагов. Макрофаги обеспечивают фагоцитоз не только инфекционных возбудителей воспалительного процесса, но и клеточный детрит, тем самым очищая зону альтерации и подготавливая ее к последующей регенерации и репарации. Мононуклеарные фагоциты участвуют в обеспечении неспецифической защиты организма посредством фагоцитоза, секреции гуморальных факторов, таких как лизоцим, a-интерферон, ФНО, компоненты комплемента. В очаге воспаления макрофаги приобретают более выраженные антимикробные свойства благодаря фагоцитозу антимикробных компонентов, продуцируемых нейтрофилами (миелопероксидазы и катионных белков). Таким образом, макрофаги приобретают способность галоидировать белки. Микробицидная функция макрофагов реализуется через продукты «респираторного взрыва», секреции монокинов, лизосомальных ферментов. Окислительные реакции сопровождаются накоплением в очаге воспаления высокотоксичных продуктов ПОЛ, вызывающим дальнейшую деструкцию клеток, сосудов и элементов соединительной ткани.
Под действием пусковых медиаторов макрофагов в очаге воспаления происходит активация различных типов лейкоцитов, клеток соединительной ткани, эндотелия сосудов, паренхиматозных клеток, что приводит к синтезу и секреции биологически активных соединений, оказывающих повреждающие, защитные и системные эффекты.
Все лейкоциты в зоне воспаления довольно быстро подвергаются жировой дегенерации, превращаются в гнойные тельца и удаляются вместе с гноем. В очаге воспаления возможны два пути гибели лейкоцитов.
Молекулярная патология крови
| Сайт: | Образовательный портал МБФ (ВолгГМУ) |
| Курс: | Молекулярные механизмы болезней и молекулярно-биологические исследования |
| Книга: | Молекулярная патология крови |
Оглавление
1. Лейкоциты
Лейкоци́ты (от др.-греч. λευκός — белый и κύτος — вместилище, тело) — белые кровяные клетки; неоднородная группа различных по внешнему виду и функциям клеток крови человека или животных, выделенная по признакам наличия ядра и отсутствия самостоятельной окраски.
Главная сфера действия лейкоцитов — защита. Они играют главную роль в специфической и неспецифической защите организма от внешних и внутренних патогенных агентов, а также в реализации типичных патологических процессов.
Все виды лейкоцитов способны к активному движению и могут переходить через стенку капилляров и проникать в межклеточное пространство, где они поглощают и переваривают чужеродные частицы. Этот процесс называется фагоцитоз, а клетки, его осуществляющие, — фагоциты.
Если чужеродных тел проникло в организм очень много, то фагоциты, поглощая их, сильно увеличиваются в размерах и в конце концов разрушаются. При этом освобождаются вещества, вызывающие местную воспалительную реакцию, которая сопровождается отеком, повышением температуры и покраснением пораженного участка.
Вещества, вызывающие реакцию воспаления, привлекают новые лейкоциты к месту внедрения чужеродных тел. Уничтожая чужеродные тела и поврежденные клетки, лейкоциты гибнут в больших количествах. Гной, который образуется в тканях при воспалении, — это скопление погибших лейкоцитов.
Клеточные элементы крови (изображение получено с помощью сканирующего электронного микроскопа). Видны двояковогнутые эритроциты и сферические лейкоциты с шероховатой поверхностью.
2. Количество лейкоцитов
В крови взрослого человека лейкоцитов содержится в 1000 раз меньше, чем эритроцитов, и в среднем их количество составляет 4—9·10 9 /л. У новорождённых детей, особенно в первые дни жизни, количество лейкоцитов может сильно варьировать от 9 до 30·10 9 /л. У детей в возрасте 1—3 года количество лейкоцитов в крови колеблется в пределах 6,0—17,0·10 9 /л, а в 6—10 лет в пределах 6,0-11,0·10 9 /л.
Содержание лейкоцитов в крови не является постоянным, а динамически изменяется в зависимости от времени суток и функционального состояния организма. Так, количество лейкоцитов обычно несколько повышается к вечеру, после приёма пищи, а также после физического и эмоционального напряжения.
Увеличение общего абсолютного количества лейкоцитов в единице объёма выше верхней границы нормы называется абсолютным лейкоцитозом, а уменьшение её ниже нижней границы — абсолютная лейкопения
2.1. Лейкоцитоз
Истинный лейкоцитоз возникает при усилении образования лейкоцитов и выхода их из костного мозга. Если же увеличение содержания лейкоцитов в крови связано с поступлением в циркуляцию тех клеток, которые в обычных условиях прикреплены к внутренней поверхности сосудов, такой лейкоцитоз называют перераспределительным.
Именно перераспределением лейкоцитов объясняются колебания в течение дня. Так, количество лейкоцитов обычно несколько повышается к вечеру, а также после еды.
Физиологический лейкоцитоз наблюдается в предменструальный период, во второй половине беременности, через 1—2 недели после родоразрешения.
Физиологический перераспределительный лейкоцитоз может наблюдаться после приёма пищи, после физического или эмоционального напряжения, воздействия холода или тепла.
Лейкоцитоз как патологическая реакция чаще всего свидетельствует об инфекционном или асептическом воспалительном процессе в организме. Кроме того, лейкоцитоз часто выявляется при отравлениях нитробензолом, анилином, в начальную фазу лучевой болезни, как побочный эффект некоторых медикаментов, а также при злокачественных новообразованиях, острой кровопотере и многих других патологических процессах. В наиболее тяжёлой форме лейкоцитоз проявляется при лейкозах.
2.2. Лейкопения
Лейкопения — снижение количества лейкоцитов в единице объёма крови.
Нейтропения является подтипом лейкопении и связана с уменьшением количества циркулирующих нейтрофильных гранулоцитов, наиболее многочисленных белых кровяных телец.
Фебрильная нейтропения определяется как внезапное (в течение нескольких часов, а иногда даже нескольких десятков минут) повышение температуры больного выше 38 °C, на фоне снижения абсолютного числа циркулирующих нейтрофилов ниже 500 на кубический миллиметр или абсолютного числа циркулирующих гранулоцитов ниже 1000 на кубический миллиметр. При этом характерна резчайшая общая слабость, озноб, тяжёлое общее состояние. Возможен проливной пот, тремор (как следствие озноба), тахикардия, гипотензия вплоть до признаков сердечно-сосудистого коллапса или шока.
При этом, поскольку при таком критическом снижении числа нейтрофилов воспалительная реакция организма на инфекцию резко угнетена, быстро обнаружить очаг инфекции, причину повышения температуры, не представляется возможным. Лёгкие больного «чистые» (хрипы отсутствуют), нет симптомов и со стороны глотки, носовых ходов, мочеиспускательного тракта или ЖКТ, не обнаруживаются абсцессы мягких тканей или гнойничковые поражения кожи. Эти поражения могут проявиться значительно позже, иногда незадолго до смерти больного, когда интенсивность инфекции станет настолько велика, что даже в ситуации глубокого угнетения иммунитета проявится воспалительная реакция.
Таким образом, диагноз «фебрильная нейтропения» является «диагнозом исключения», диагнозом, который ставится при невозможности быстро установить причину повышения температуры у больного с нейтропенией, найти очаг воспаления. В случае обнаружения конкретной причины повышения температуры диагноз изменяется на более точный (например, может идти речь о пневмонии или бактериальном сепсисе на фоне нейтропении).
3. Виды лейкоцитов
Лейкоциты — собирательное понятие, введённое в XIX веке и сохраняемое для простоты противопоставления «белая кровь—красная кровь». По современным данным лейкоциты различаются по происхождению, функциям и внешнему виду. Часть лейкоцитов способны захватывать и переваривать чужеродные микроорганизмы (фагоцитоз), а другие могут вырабатывать антитела. Вследствие этого существует несколько видов деления лейкоцитов, простейший из которых основан на наличии/отсутствии специфических гранул в их цитоплазме.
По морфологическим признакам лейкоциты, окрашенные по Романовскому—Гимзе, со времён Эрлиха традиционно делят на две группы:
Соотношение разных видов белых клеток, выраженное в процентах, называется лейкоцитарной формулой или лейкограммой.
Лейкограмма — процентное соотношение различных видов лейкоцитов, определяемое при подсчёте их в окрашенном мазке крови под микроскопом.
Существует такое понятие, как сдвиг лейкограммы влево и вправо.
Сдвиг лейкограммы влево — увеличение количества незрелых (палочкоядерных) нейтрофилов в периферической крови, появление метамиелоцитов (юных), миелоцитов;
Сдвиг лейкограммы вправо — уменьшение нормального количества палочкоядерных нейтрофилов и увеличение числа сегментоядерных нейтрофилов с гиперсегментированными ядрами (мегалобластная анемия, болезни почек и печени, состояние после переливания крови).
Модификация: Gartner L.P, Hiatt J.M. Color Textbook of Histology, 3th ed., The McGraw-Hill Companies, 2006, 592 p
Количество / мм 3
Доля общего количества лейкоцитов, %
Диаметр в мазке, мкм
Две дольки (в форме сосиски)
0,1 мкм, светлорозовые (окраска по Романовскому или по её модификации)
1 ÷ 1,5 мкм, тёмнорозовые (окраска по Романовскому или по её модификации)
0,5 мкм, синие/чёрные (окраска по Романовскому или по её модификации)
Коллагеназа тип-IV, фосфолипаза-A2, лактоферрин, лизозим, фагоцитин, Щёлочная фосфатаза, белок, связывающий витамин B12
Арил-сульфатаза, гистаминаза, бета-глукуронидаза, кислая фосфатаза, фосфолипаза, главный осно́вный белок, эозинофильный катионный белок, нейротоксин, рибонуклеаза, катепсин, пероксидаза
Гистамин, гепарин, эозинофильный хемотаксический фактор, нейтрофильный хемотаксический фактор, пероксидаза, нейтральные протеазы, хондроитин сульфат
Fc-рецепторы, рецепторы для активатора кровяных пластинок, рецепторы для лейкотриена B4, молекула-1 для склеивания лейкоцитов
Рецепторы-IgE для иммуноглобулинов, рецепторы для хемотаксического фактора эозинофилов
Рецепторы-IgE для иммуноглобулинов
T-лимфоциты: рецепторы T-лимфоцитов, CD-молекулы, IL-рецепторы.
B-лимфоциты: поверхностные иммуноглобулины
Класс-II HLA, Fc-рецепторы
Меньше одной недели
Меньше двух недель
От нескольких месяцев до нескольких лет
Несколько дней в крови, несколько месяцев в соединительной ткани
Фагоцитоз и разрушение бактерий
Фагоцитоз комплексов антиген-антитело, разрушение паразитов
Подобно тучным клеткам опосредуют процесс воспаления
T-лимфоциты опосредуют иммунный ответ,
B-лимфоциты гуморально опосредуют иммунный ответ
Дифференцируются в макрофаги: фагоцитоз и предоставление антигенов
3.1. Нейтрофильные гранулоциты
Нейтрофильные гранулоциты или нейтрофилы, сегментоядерные нейтрофилы, нейтрофильные лейкоциты — подвид гранулоцитарных лейкоцитов.Названы нейтрофилами за то, что при окраске по Романовскому они интенсивно окрашиваются как кислым красителем эозином, так и основными красителями, в отличие от эозинофилов, окрашиваемых только эозином, и от базофилов, окрашиваемых только основными красителями.
Зрелые нейтрофилы имеют сегментированное ядро, то есть относятся к полиморфноядерным лейкоцитам, или полиморфонуклеарам. Они являются классическими фагоцитами: имеют адгезивность, подвижность, способность к хемотаксису, а также способность захватывать частицы (например, бактерии).
Зрелые сегментоядерные нейтрофилы в норме являются основным видом лейкоцитов, циркулирующих в крови человека, составляя от 47 % до 72 % общего количества лейкоцитов крови. Ещё 1—5 % в норме составляют юные, функционально незрелые нейтрофилы, имеющие палочкообразное сплошное ядро и не имеющие характерной для зрелых нейтрофилов сегментации ядра — так называемые палочкоядерные нейтрофилы.
Нейтрофилы способны к активному амёбоидному движению, к экстравазации (эмиграции за пределы кровеносных сосудов), и к хемотаксису (преимущественному движению в направлении мест воспаления или повреждения тканей).
Нейтрофилы способны к фагоцитозу, причём являются микрофагами, то есть способны поглощать лишь относительно небольшие чужеродные частицы или клетки.
Нейтрофилы содержат большое количество миелопероксидазы, фермента, который способен окислять анион хлора до гипохлорита — сильного антибактериального агента. Миелопероксидаза как гем-содержащий белок имеет зеленоватый цвет, что определяет зеленоватый оттенок самих нейтрофилов, цвет гноя и некоторых других выделений, богатых нейтрофилами.
Погибшие нейтрофилы вместе с клеточным детритом из разрушенных воспалением тканей и гноеродными микроорганизмами, послужившими причиной воспаления, формируют массу, известную как гной.
Повышение доли нейтрофилов в крови называется относительным нейтрофилёзом, или относительным нейтрофильным лейкоцитозом.
Повышение абсолютного числа нейтрофилов в крови называется абсолютным нейтрофилёзом. Снижение доли нейтрофилов в крови называется относительной нейтропенией.
Снижение абсолютного числа нейтрофилов в крови обозначается как абсолютная нейтропения.
Нейтрофилы играют очень важную роль в защите организма от бактериальных и грибковых инфекций, и сравнительно меньшую — в защите от вирусных инфекций. В противоопухолевой или антигельминтной защите нейтрофилы практически не играют роли.
В 2004 г. был открыт важный механизм, посредством которого нейтрофилы осуществляют защитные функции, названный нетозом (от англ. NETosis (от NET — Neutrophil Extracellular Trap))[1].
Нетоз является третьим основным типом клеточной смерти нейтрофилов наравне с апоптозом и некрозом.
При нетозе нейтрофил проходит стадии деконденсации хроматина, наработки реактивных форм кислорода (ROS — Reactive Oxigen Species), дегрануляции; затем следует выброс ДНК-сети, связанной с ROS, гистонами, миелопероксидазой и другими молекулами, повреждающими патоген.
Нейтрофильные ДНК-ловушки связаны с патогенезом различных заболеваний, таких как сепсис, ревматоидный артрит, тромбоз, волчанка и другие аутоиммунные заболевания[3].
Также показано, что другие клетки крови, такие как моноциты, эозинофилы, базофилы также имеют подобный механизм, называемый этозом (от англ. ETosis (от ET — Extracellular Trap))[4].
Нейтрофильный ответ (инфильтрация очага воспаления нейтрофилами, повышение числа нейтрофилов в крови, сдвиг лейкоцитарной формулы влево с увеличением доли «юных» форм, указывающий на усиление продукции нейтрофилов костным мозгом) — самый первый ответ на бактериальные и многие другие инфекции.
Нейтрофильный ответ при острых воспалениях и инфекциях всегда предшествует более специфическому лимфоцитарному. При хронических воспалениях и инфекциях роль нейтрофилов незначительна и преобладает лимфоцитарный ответ (инфильтрация очага воспаления лимфоцитами, абсолютный или относительный лимфоцитоз в крови).
↑ Brinkmann V., Reichard U., Goosmann C., Fauler B., Uhlemann Y., Weiss D. S., Weinrauch Y., Zychlinsky A. Neutrophil extracellular traps kill bacteria. (англ.) // Science (New York, N.Y.). — 2004. — Vol. 303, no. 5663. — P. 1532–1535. — DOI:10.1126/science.1092385. — PMID 15001782. исправить
↑ Jenne C. N., Wong C. H., Zemp F. J., McDonald B., Rahman M. M., Forsyth P. A., McFadden G., Kubes P. Neutrophils recruited to sites of infection protect from virus challenge by releasing neutrophil extracellular traps. (англ.) // Cell host & microbe. — 2013. — Vol. 13, no. 2. — P. 169–180. — DOI:10.1016/j.chom.2013.01.005. — PMID 23414757. исправить
↑ Xu J., Zhang X., Pelayo R., Monestier M., Ammollo C. T., Semeraro F., Taylor F. B., Esmon N. L., Lupu F., Esmon C. T. Extracellular histones are major mediators of death in sepsis. (англ.) // Nature medicine. — 2009. — Vol. 15, no. 11. — P. 1318–1321. — DOI:10.1038/nm.2053. — PMID 19855397. исправить
↑ Wartha F., Henriques-Normark B. ETosis: a novel cell death pathway. (англ.) // Science signaling. — 2008. — Vol. 1, no. 21. — P. 25. — DOI:10.1126/stke.121pe25. — PMID 18506034. исправить
3.2. Эозинофильные гранулоциты
Эозинофильные гранулоциты или эозинофилы, сегментоядерные эозинофилы, эозинофильные лейкоциты — подвид гранулоцитарных лейкоцитов крови.
Эозинофилы названы так потому, что при окраске по Романовскому интенсивно окрашиваются кислым красителем эозином и не окрашиваются основными красителями, в отличие от базофилов (окрашиваются только основными красителями) и от нейтрофилов (поглощают оба типа красителей). Также отличительным признаком эозинофила является двудольчатое ядро (у нейтрофила оно имеет 4-5 долей, а у базофила не сегментировано).
Эозинофилы способны к активному амебоидному движению, к экстравазации (проникновению за пределы стенок кровеносных сосудов) и к хемотаксису (преимущественному движению в направлении очага воспаления или повреждения ткани).
Эозинофилы, как и нейтрофилы, способны к фагоцитозу, причём являются микрофагами, то есть способны, в отличие от макрофагов, поглощать лишь относительно мелкие чужеродные частицы или клетки. Однако, эозинофил не является «классическим» фагоцитом, его главная роль не в фагоцитозе. Главнейшее их свойство — экспрессия Fc-рецепторов, специфичных для Ig E. Физиологически это проявляется в мощных цитотоксических, а не фагоцитарных, свойствах эозинофилов, и их активном участии в противопаразитарном иммунитете. Однако, повышенная продукция антител класса E может привести к аллергической реакции немедленного типа (анафилактический шок), что является главным механизмом всех аллергий такого типа.
Эозинофилы способны поглощать и связывать гистамин и ряд других медиаторов аллергии и воспаления. Обладают способностью при необходимости высвобождать эти вещества, подобно базофилам. То есть эозинофилы способны играть как проаллергическую, так и защитную антиаллергическую роль. Процентное содержание эозинофилов в крови увеличивается при аллергических состояниях.
Эозинофилы менее многочисленны, чем нейтрофилы. Большая часть эозинофилов недолго остаётся в крови и, попадая в ткани, длительное время находится там.
Количество эозинофилов в крови составляет
0,02 ÷ 0,3 · 109 / л, или 0,5 ÷ 5,0 % количества всех лейкоцитов крови. Диаметр нейтрофилов в мазке крови составляет
12 ÷ 14 мкм, а в капле свежей крови
9 ÷ 10 мкм. Ядра нейтрофилов, как правило, сегментированы на 2 дольки, соединённые тонкой перемычкой.
В центральных областях цитоплазмы эозинофилов могут находиться все виды органелл: эндоплазматическая сеть, рибосомы, аппарат Гольджи, митохондрии, актиновые нити и др. В периферических слоях цитоплазмы расположены гранулы. Среди гранул различают азурофильные и эозинофильные. Азурофильные гранулы более крупные (
0,4 мкм). Они окрашиваются в фиолетово-красный цвет. Они являются первичными лизосомами и содержат ряд гидролитических ферментов. Азурофильные гранулы в процессе дифференцировки эозинофилов в костном мозге появляются раньше, поэтому называются первичными в отличие от вторичных специфических, эозинофильных гранул.
Более многочисленные вторичные специфические эозинофильные гранулы светлее и мельче азурофильных. Они заполняют почти всю цитоплазму. Их доля составляет
80 ÷ 90% всех гранул. Их наибольший размер
0,6 ÷ 1,0 мкм. В центре гранул расположен кристаллоид. Он содержит несколько белков, лизосомные ферменты. Вещества кристаллоида обладают бактериостатическими и бактерицидными свойствами.
Плазмалемма эозинофилов имеет белки-рецепторы: Fc-рецептор для иммуноглобулинов Е, G, M (IgE, IgG, IgM), а также С3-рецепторы и С4-рецепторы, обеспечивающие участие эозинофилов в организации воспаления и аллергических и анафилактических реакций.
Эозинофилы являются подвижными клетками и способны к фагоцитозу. Их фагоцитарная активность ниже, чем у нейтрофилов. Эозинофилы обладают положительным хемотаксисом к ряду веществ, в частности, к гистамину (выделяется тучными клетками при воспалении и аллергических реакциях), к лимфокинам (выделяются T-лимфоцитами), и к иммунным комплексам (антиген-антитело).
Характерной особенностью эозинофилов является их защитная антипаразитарная функция. При гельминтозах, шистосомозе и других паразитарных заболеваниях наблюдается резкое увеличение (до
90%) доли эозинофилов в общем количестве лейкоцитов. Эозинофилы убивают личинки паразитов, проникших в кровь или в ткани органов (например, в слизистую оболочку кишки). Хемотаксическими факторами паразитов эозинофилы привлекаются в очаги воспаления. Вследствие наличия на паразитах обволакивающих их комплементов, эозинофилы прилипают к паразитам. Вслед за этим происходит дегрануляция эозинофилов и выделение их основного белка, оказывающего антипаразитарное действие.
Эозинофилы находятся в периферической крови менее
12 ч, после чего мигрируют в ткани. Их главными органами-мишенями являются: кожа, лёгкие и желудочно-кишечный тракт.
Нормальным уровнем для человека считается 120—350 эозинофилов на микролитр. Повышение уровня эозинофилов в крови называют Эозинофилией, снижение уровня Эозинопенией.
Заболевания и состояния, сопровождающиеся эозинофилией [ править | править вики-текст ]
Причины эозинопении [ править | править вики-текст ]
В большинстве случаев эозинопения обусловлена повышением адренокортикоидной активности, которая приводит к задержке эозинофилов в костном мозге. Эозинопения особенно характерна для начальной фазы инфекционно-токсического процесса. Уменьшение числа эозинофилов в постоперационном периоде говорит о тяжелом состоянии больного
3.3. Базофильные гранулоциты
Базофильные гранулоциты, или базофилы, сегментоядерные базофилы, базофильные лейкоциты — подвид гранулоцитарных лейкоцитов. Содержат базофильное S-образное ядро, зачастую не видимое из-за перекрытия цитоплазмы гранулами гистамина и прочих аллергомедиаторов. Базофилы названы так за то, что при окраске по Романовскому интенсивно поглощают основной краситель и не окрашиваются кислым эозином, в отличие и от эозинофилов, окрашиваемых только эозином, и от нейтрофилов, поглощающих оба красителя.
Базофилы — очень крупные гранулоциты: они крупнее и нейтрофилов, и эозинофилов. Гранулы базофилов содержат большое количество гистамина, серотонина, лейкотриенов, простагландинов и других медиаторов аллергии и воспаления.
Базофилы принимают активное участие в развитии аллергических реакций немедленного типа (реакции анафилактического шока). Существует заблуждение, что базофилы являются предшественниками лаброцитов. Тучные клетки очень похожи на базофилов. Обе клетки имеют грануляцию, содержат гистамин и гепарин. Обе клетки также выделяют гистамин при связывании с иммуноглобулином Е. Это сходство заставило многих предположить, что тучные клетки и есть базофилы в тканях. Кроме того, они имеют общего предшественника в костном мозге. Тем не менее базофилы покидают костный мозг уже зрелым, в то время как тучные клетки циркулируют в незрелом виде, только со временем попадают в ткани.[1] Благодаря базофилам яды блокируются в тканях и не распространяются по всему телу. Также базофилы регулируют свертываемость крови при помощи гепарина. Однако исходное утверждение всё же частично верно: базофилы являются прямыми родственниками и аналогами тканевых лаброцитов, или тучных клеток. Подобно тканевым лаброцитам, базофилы несут на поверхности иммуноглобулин E и способны к дегрануляции (высвобождению содержимого гранул во внешнюю среду) или аутолизу (растворению, лизису клетки) при контакте с антигеном-аллергеном. При дегрануляции или лизисе базофила высвобождается большое количество гистамина, серотонина, лейкотриенов, простагландинов и других биологически активных веществ. Это и обусловливает наблюдаемые проявления аллергии и воспаления при воздействии аллергенов.
Базофилы способны к экстравазации (эмиграции за пределы кровеносных сосудов), причём могут жить вне кровеносного русла, становясь резидентными тканевыми лаброцитами (тучными клетками).
Базофилы обладают способностью к хемотаксису и фагоцитозу. Кроме того, по всей видимости, фагоцитоз не является для базофилов ни основной, ни естественной (осуществляемой в естественных физиологических условиях) активностью. Единственная их функция — мгновенная дегрануляция, ведущая к усилению кровотока, увеличению проницаемости сосудов. росту притока жидкости и прочих гранулоцитов. Другими словами, главная функция базофилов заключается в мобилизации остальных гранулоцитов в очаг воспаления.
3.4. Лимфоциты
Лимфоциты (от лимфа и греч. κύτος — «вместилище», здесь — «клетка») — клетки иммунной системы, представляющие собой разновидность лейкоцитов группы агранулоцитов. Лимфоциты — главные клетки иммунной системы, обеспечивают гуморальный иммунитет (выработка антител), клеточный иммунитет (контактное взаимодействие с клетками-жертвами), а также регулируют деятельность клеток других типов. В организме взрослого человека 25-40% всех лейкоцитов крови составляют лимфоциты (500-1500 клеток в 1 мкл), у детей доля этих клеток равна 50%.
По морфологическим признакам выделяют два типа лимфоцитов: большие гранулярные лимфоциты (чаще всего ими являются NK-клетки или, значительно реже, это активно делящиеся клетки лимфоидного ряда — лимфобласты и иммунобласты) и малые лимфоциты (T и B клетки).
По функциональным признакам различают три типа лимфоцитов: B-клетки, T-клетки, NK-клетки.
B-клетки распознают чужеродные структуры (антигены), вырабатывая при этом специфические антитела (белковые молекулы, направленные против конкретных чужеродных структур).
T-киллеры выполняют функцию регуляции иммунитета. Т-хелперы стимулируют выработку антител, а Т-супрессоры тормозят её.
NK-лимфоциты осуществляют контроль над качеством клеток организма. При этом NK-лимфоциты способны разрушать клетки, которые по своим свойствам отличаются от нормальных клеток, например, раковые клетки.
Содержание Т-лимфоцитов в крови составляет 65—80 % от общего количества лимфоцитов, В-лимфоцитов — 8—20 %, NK-лимфоцитов — 5—20 %
3.5. Моноциты
Локализация в организме
Содержание моноцитов в крови
В норме моноциты составляют от 3% до 11% общего количества лейкоцитов крови. Абсолютное их содержание составляет приблизительно 450 клеток в 1 мкл. Относительное увеличение доли моноцитов в лейкоцитарной формуле называется относительным моноцитозом. Абсолютное увеличение числа моноцитов называется абсолютным моноцитозом. Относительное уменьшение доли моноцитов называется относительной монопенией, а абсолютное уменьшение их числа — абсолютной монопенией.
Другие ткани
Помимо крови, эти клетки всегда присутствуют в количествах в лимфатических узлах, стенках альвеол и синусах печени, селезенки и костного мозга.
Миграция из крови в ткани
Моноциты находятся в крови 2-3 дня, после чего большинство из них либо гибнет через апоптоз, либо становится макрофагами (например, в кишечнике).Моноциты крови являются предшественниками резидентных тканевых макрофагов, и теперь мы знаем, что это так (см. макрофаги).
Образование моноцитов
Моноциты образуются в костном мозге, а не в ретикуло-эндотелиальной системе, как считалось ранее. В кровь выходят не окончательно созревшие клетки, которые обладают самой высокой способностью к фагоцитозу.
Рост и созревание моноцитарно-макрофагального ростка костного мозга усиливается ГМ-КСФ и М-КСФ, тормозится глюкокортикоидами. При стрессе, шоке, терапии экзогенными глюкокортикоидами отмечается абсолютная или относительная монопения.
Свойства моноцитов
Фагоцитоз
Моноциты обладают выраженной фагоцитарной функцией. Это самые крупные клетки периферической крови, они являются макрофагами, то есть могут поглощать относительно крупные частицы и клетки или большое количество мелких частиц и как правило не погибают после фагоцитирования (возможна гибель моноцитов при наличии у фагоцитированного материала каких-либо цитотоксических для моноцита свойств). Этим они отличаются от микрофагов — нейтрофилов и эозинофилов, способных поглощать лишь относительно небольшие частицы и как правило погибающих после фагоцитирования.
Моноциты способны фагоцитировать микроб в кислой среде, когда нейтрофилы неактивны. Фагоцитируя микробов, погибших лейкоцитов, поврежденные клетки тканей, моноциты очищают место воспаления и подготавливают его для регенерации. Эти клетки образуют отграничивающий вал вокруг неразрушаемых инородных тел.
Функции
Активированные моноциты и тканевые макрофаги
Преобразование в тканевые макрофаги
Моноциты, выходя из кровяного русла, становятся макрофагами, которые наряду с нейтрофилами являются главными «профессиональными фагоцитами». Макрофаги, однако, значительно больше по размерам и дольше живут, чем нейтрофилы. Клетки-предшественницы макрофагов — моноциты, выйдя из костного мозга, в течение нескольких суток циркулируют в крови, а затем мигрируют в ткани и растут там. В это время в них увеличивается содержание лизосом и митохондрий. Вблизи воспалительного очага они могут размножаться делением.
Моноциты способны, эмигрировав в ткани, превращаться в резидентные тканевые макрофаги. Моноциты также способны, подобно другим макрофагам, выполнять процессинг антигенов и представлять антигены T-лимфоцитам для распознавания и обучения, то есть являются антигенпрезентирующими клетками иммунной системы.
Макрофаги — это большие клетки, активно разрушающие бактерии. Макрофаги в больших количествах накапливаются в очагах воспаления. По сравнению с нейтрофилами моноциты более активны в отношении вирусов, чем бактерий, и не разрушаются во время реакции с чужеродным антигеном, поэтому в очагах воспаления, вызванного вирусами, гной не формируется. Также моноциты накапливаются в очагах хронического воспаления.
Синтез биологически активных факторов
Моноциты секретируют растворимые цитокины, оказывающие воздействие на функционирование других звеньев иммунной системы. Цитокины, секретируемые моноцитами, называют монокинами.
Моноциты синтезируют отдельные компоненты системы комплемента. Они распознают антиген и переводят его в иммуногенную форму (презентация антигена).
Моноциты продуцируют как факторы, усиливающие свертывание крови (тромбоксаны, тромбопластины), так и факторы, стимулирующие фибринолиз (активаторыплазминогена). В отличие от В- и T-лимфоцитов, макрофаги и моноциты не способны к специфическому распознаванию антигена.
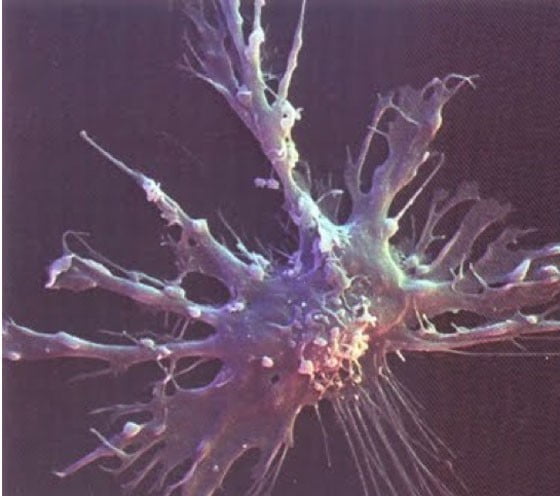 Дендритные клетки
Дендритные клетки









