какие клинические признаки учитывают при подсчете индекса wells
Тест с ответами по теме «Современное представление о патогенезе, основных принципах профилактики и лечения венозных тромбоэмболических осложнений в травматологии и ортопедии»
Сосудисто-тромбоцитарное звено гемостаза активизируется за счет выброса в кровоток тромбопластических факторов из тромбоцитов.
1. В каком случае доза дабигатрана этексилата для профилактики тромбоэмболических осложнений снижается с 220 мг до 150 мг однократно в сутки?
1) у пациентов в возрасте старше 65 лет;
2) у пациентов в возрасте старше 75 лет;+
3) у пациентов с клиренсом креатинина в интервале от 30 до 50 мл/мин;+
4) у пациентов с клиренсом креатинина ниже 30 мл/мин;
5) у пациентов, принимающих амиодарон, верапамил, хинидин.+
2. В патогенезе развития тромбоэмболических осложнений после эндопротезирования крупных суставов, пусковыми механизмами являются
1) массивная травма тканей;+
2) обнажение сосудистого коллагена;+
3) повреждение кровеносных сосудов;+
4) снижение эластичности сосудистой стенки;
5) формирование «белого» тромба.
3. В течение какого времени, происходит образование первичного сгустка при массивном повреждении тканей?
1) 10 секунд;
2) 15 секунд;+
3) 20 секунд;
4) 25 секунд.
4. В течение какого времени, с момента появления симптомов венозной тромбоэмболии, рекомендуется проведение ультразвукового ангиосканирования вен нижних конечностей и таза?
1) 12 часов;
2) 24 часа;
3) 4 часа;+
4) 8 часов.
5. В условиях, когда дальнейшая лечебная тактика ведения больного с тромбоэмболическими венозными осложнениями не определена, целесообразно использовать
1) внутривенную инфузию нефракционированного гепарина;+
2) внутримышечное введение нефракционированного гепарина;
3) пероральный прием варфарина;
4) пероральный прием новых оральных антикоагулянтов;
5) подкожное введение нефракционированного гепарина;
6) подкожное введение низкомолекулярного гепарина.
6. В этиопатогенезе венозных тромбоэмболических осложнений принято выделять два основных звена
1) гиперкоагуляция и эндотелиальная дисфункция;
2) хирургическая травма и длительная иммобилизация;
3) хирургическая травма и эндотелиальная дисфункция;+
4) хирургический стресс и гиперкоагуляция.
7. Венозные тромбозы можно классифицировать по
1) времени с момента операции;
2) локализации;+
3) наличию осложнений;+
4) направлению тромботического процесса;+
5) степени гемодинамических расстройств;+
6) степени фиксации тромба.+
8. Венозные тромбоэмболические осложнения (ВТЭО) — собирательное понятие, объединяющее
1) легочную тромбоэмболию;+
2) тромбоз глубоких вен нижних конечностей;+
3) тромбоз поверхностных вен нижних конечностей;+
4) тромбоз почечных вен;
5) тромбоз яремной вены.
9. Венозные тромбоэмболические осложнения представляют собой сложное (многофакторное) заболевание, которое включает взаимодействие между
1) воздействием окружающей среды;+
2) наследственной предрасположенностью к тромбозу;+
3) обменом веществ;
4) образом жизни;
5) приобретенной предрасположенностью к тромбозу.+
10. Все диагностические исследования при подозрении на венозные тромбоэмболические осложнения необходимо провести в течение
1) 12 часов;
2) 24 часов;+
3) 48 часов;
4) 6 часов.
11. Выберите единственное верное высказывание
1) всем пациентам без клинических признаков, позволяющих предположить тромбоз глубоких вен и/или тромбоэмболию легочной артерии, рекомендуется проводить определение уровня D-димера в плазме с целью скрининга;
2) всем пациентам старше 70 лет без клинических признаков, позволяющих предположить тромбоз глубоких вен и/или тромбоэмболию легочной артерии, рекомендуется проводить определение уровня D-димера в плазме с целью скрининга;
3) пациентам без клинических признаков, позволяющих предположить тромбоз глубоких вен и/или тромбоэмболию легочной артерии, проводить определение уровня D-димера в плазме, с целью скрининга, не рекомендуется.+
12. Выберите единственное верное высказывание
1) повышение уровня D-димера в плазме у пациентов после травм или ортопедических операций не является достоверным признаком венозного тромбоза;+
2) повышение уровня D-димера в плазме у пациентов после травм или ортопедических операций является достоверным признаком венозного тромбоза;
3) повышение уровня D-димера в плазме у пациентов старше 65 лет после травм или ортопедических операций является достоверным признаком венозного тромбоза.
13. Выберите единственное верное высказывание
1) пациентам с клинической симптоматикой и анамнезом, не оставляющими сомнений в наличии тромбоза глубоких вен и/или тромбоэмболии легочной артерии, проводить определение уровня D-димера не рекомендуется;+
2) пациентам с клинической симптоматикой и анамнезом, не оставляющими сомнений в наличии тромбоза глубоких вен и/или тромбоэмболии легочной артерии, рекомендуется проводить определение уровня D-димера;
3) пациентам с клинической симптоматикой и анамнезом, не оставляющими сомнений в наличии тромбоза глубоких вен и/или тромбоэмболии легочной артерии, рекомендуется проводить определение уровня D-димера как минимум дважды в динамике.
14. Выберите правильное определение кроссэктомии
1) кроссэктомия — это высокая приустьевая перевязка большой подкожной вены;+
2) кроссэктомия — это операция по удалению большой подкожной вены;
3) кроссэктомия — это операция по удалению тромботических масс из пораженных тромбоэмболическим процессом сосудов.
15. Выброс катехоламинов в ответ на хирургическую агрессию увеличивает агрегационные свойства
1) макрофагов;
2) нейтрофилов;
3) тромбоцитов;+
4) эритроцитов.
16. Для оценки вероятности тромбоза глубоких вен нижних конечностей по клиническим данным применяют
1) индекс PESI;
2) индекс Wells;+
3) шкалу Ватерлоу;
4) шкалу Сильвермана.
17. Доза апиксабана в первые 7 суток после развития тромбоза глубоких вен составляет
1) 10 мг дважды в сутки;+
2) 2,5 мг дважды в сутки;
3) 20 мг дважды в сутки;
4) 5 мг дважды в сутки.
18. Доза дабигатрана этексилата при лечении тромбоэмболических осложнений составляет
1) 110 мг дважды в сутки;
2) 110 мг однократно в сутки;
3) 150 мг дважды в сутки;+
4) 150 мг однократно в сутки;
5) 220 мг дважды в сутки;
6) 220 мг однократно в сутки.
19. Доза ривароксабана в первые 3 недели после развития тромбоза глубоких вен составляет
1) 10 мг дважды в сутки;
2) 10 мг однократно в сутки;
3) 15 мг дважды в сутки;+
4) 15 мг однократно в сутки;
5) 20 мг дважды в сутки.
20. Дозировка далтепарина натрия при развитии тромбоэмболических венозных осложнений составляет
1) 100 МЕ/кг двукратно в сутки;+
2) 100 МЕ/кг однократно в сутки;
3) 200 МЕ/кг двукратно в сутки;
4) 200 МЕ/кг однократно в сутки;+
5) 400 МЕ/кг однократно в сутки.
21. Дозировка надропарина кальция при развитии тромбоэмболических венозных осложнений составляет
1) 171 МЕ/кг двукратно в сутки;
2) 171 МЕ/кг однократно в сутки;+
3) 258 МЕ/кг однократно в сутки;
4) 86 МЕ/кг двукратно в сутки;+
5) 86 МЕ/кг однократно в сутки.
22. Дозировка эноксапарина натрия при развитии тромбоэмболических венозных осложнений для однократного введения составляет
1) 100 МЕ/кг;
2) 150 МЕ/кг;+
3) 200 МЕ/кг;
4) 250 МЕ/кг;
5) 500 МЕ/кг.
23. К немедикаментозным средствам профилактики венозных тромбоэмболических осложнений относят
1) венозную помпу для стопы;+
2) иммобилизацию поврежденной конечности;
3) миостимуляцию мышц голени;+
4) последовательную перемежающуюся пневматическую компрессию;+
5) статическую эластическую компрессию нижних конечностей.+
24. К причинам повышенного риска тромбообразования относятся
1) вынужденное положение конечности;+
2) избыточная масса тела и ожирение;
3) манипуляции на костномозговом канале;+
4) применение костного цемента;+
5) применение турникета.+
25. Как часто после первичного эндопротезирования диагностируют наиболее тяжелое тромбоэмболическое осложнение — тромбоэмболию легочной артерии?
26. Какие клинические признаки учитывают при подсчете индекса Wells?
1) активное злокачественное новообразование (в настоящее время или предшествующие 6 месяцев);+
2) болезненность при пальпации по ходу глубоких вен;+
3) документированный тромбоз глубоких вен в анамнезе;+
4) распространенный отек нижней конечности;+
5) трофические нарушения кожи нижней конечности;
6) хирургическое вмешательство на сосудах нижних конечностях в предшествующие 6 месяцев.
27. Каким пациентам с клиническими признаками, позволяющими заподозрить тромбоз глубоких вен и/или тромбоэмболию легочной артерии, обязательно показано определение уровня D-димера?
1) всем пациентам;
2) пациентам старше 60 лет, которым нельзя эмпирически назначить антикоагулянты;
3) пациентам, которым невозможно выполнить в ближайшие часы компрессионное ультразвуковое ангиосканирование.+
28. Каков характер боли, возникающей при тромбозе глубоких вен конечности?
1) колющая, жгущая боль;
2) приступообразная боль;
3) пульсирующая боль;
4) распирающая боль;+
5) тянущая боль.
1) высокая;
2) низкая;
3) средняя.+
30. Какой параметр коагулограммы необходимо контролировать для индивидуального подбора дозы варфарина?
1) АЧТВ;
2) МНО;+
3) протромбиновый индекс;
4) тромбиновое время.
31. Какой параметр коагулограммы необходимо контролировать для индивидуального подбора дозы нефракционированного гепарина?
1) АЧТВ;+
2) МНО;
3) протромбиновый индекс;
4) тромбиновое время.
32. Какой период времени оптимален для удаления съемных моделей кава-фильтров, после устранения опасности ТЭЛА?
33. Какой препарат из группы антиагрегантов показал схожую с антикоагулянтами эффективность в профилактике венозных тромбоэмболических осложнений после эндопротезирования коленного и тазобедренного сустава, у пациентов без дополнительных факторов риска развития ВТЭО?
1) ацетилсалициловая кислота;+
2) клопидогрел;
3) тикагрелор;
4) тиклопидин.
34. Какой фактор запускает свертывание крови по внутреннему пути?
1) активация системы комплемента;
2) активация сосудисто-тромбоцитарного звена гемостаза;
3) образование большого количества фибрина;
4) повреждение эндотелия сосудов.+
35. Клиническими признаками тромбоза поверхностных вен являются
1) боль по ходу сосудисто-нервного пучка;
2) гиперестезия кожных покровов;+
3) местное повышение температуры;+
4) отек всей конечности или голени;
5) распирающая боль в конечности;
6) шнуровидный, плотный, резко болезненный тяж при пальпации.+
36. Коагуляционное звено гемостаза активизируется за счет высвобождения тромбопластических веществ из
1) костного мозга;
2) стенки сосудов;+
3) травмированных тканей;
4) тромбоцитов.
37. Наиболее эмболоопасным видом тромбов является
1) окклюзионный;
2) пристеночный неокклюзионный;
3) флоттирующий неокклюзионный.+
38. Наличие полосы гиперемии в проекции вены является характерным клиническим признаком тромбоза
1) глубоких вен;
2) поверхностных вен;+
3) поверхностных и глубоких вен.
39. Нефракционированный гепарин в виде непрерывной инфузии вводят со скоростью
1) 1000 – 2000 ЕД в час;+
2) 2000 – 2500 ЕД в час;
3) 2500 – 3000 ЕД в час;
4) 2500 – 5000 ЕД в час.
40. Основными лекарственными средствами для лечения больных с тромбоэмболическими венозными осложнениями (в том числе бессимптомными) принято считать
1) антиагреганты;
2) антикоагулянты;+
3) гемостатики;
4) свежезамороженную плазму.
41. От чего зависят клинические проявления тромбоза?
1) от вида оперативного вмешательства;
2) от возраста пациента;
3) от длительности заболевания;+
4) от локализации тромбоза;+
5) от распространенности и характера поражения венозного русла.+
42. По наличию осложнений выделяют следующие виды венозных тромбоэмболий
1) восходящий поверхностный тромбофлебит;+
2) неосложненные;+
3) осложненные;+
4) потенциально осложненные.
43. По направлению распространения тромботического поражения выделяют следующие виды венозных тромбоэмболических осложнений
1) восходящий;+
2) нисходящий;+
3) поперечный;
4) продольный.
44. По распространенности тромботического поражения выделяют следующие виды венозных тромбоэмболических осложнений
1) двустороннее;+
2) локальное;
3) мультифокальное;+
4) одностороннее;
5) сегментарное или распространенное.+
45. Режим введения далтепарина натрия у больных с высокой степенью риска венозных тромбоэмболических осложнений при проведении ортопедических операций
1) подкожно 2500 МЕ вечером накануне операции, затем 2500 МЕ каждый вечер;
2) подкожно 2500 МЕ вечером накануне операции, затем 5000 МЕ каждый вечер;
3) подкожно 5000 МЕ вечером накануне операции, затем 2500 МЕ каждый вечер;
4) подкожно 5000 МЕ вечером накануне операции, затем 5000 МЕ каждый вечер.+
46. Рекомендуемая доза и режим дозирования ривароксабана для профилактики тромбоэмболических осложнений
1) 10 мг дважды в сутки;
2) 10 мг однократно в сутки;+
3) 15 мг дважды в сутки;
4) 15 мг однократно в сутки.
47. Совокупность нарушений регуляции в системе гемостаза, приводящих к повышению свертывающей способности, замедлению кровотока в конечности и повреждению сосудистой стенки, составляют триаду
1) Бека;
2) Вирхова;+
3) Селье;
4) Ясперса.
48. Сосудисто-тромбоцитарное звено гемостаза активизируется за счет выброса в кровоток тромбопластических факторов из
1) лейкоцитов;
2) сосудистой стенки;
3) тромбоцитов;+
4) эритроцитов.
49. Типичный спектр симптоматики тромбоза глубоких вен конечности включает следующие признаки
1) боль по ходу сосудисто-нервного пучка;+
2) онемение конечности;
3) отек всей конечности или ее части;+
4) ощущение «ползания мушек»;
5) распирающая боль в конечности;+
6) усиление рисунка подкожных вен;+
7) цианоз кожных покровов.+
50. Тромбоз поверхностных вен в клинической практике традиционно обозначают термином
1) варикозная болезнь;
2) посттромботическая болезнь;
3) тромбофлебит;+
4) флеботромбоз.
51. У больных с сопутствующей почечной недостаточностью с клиренсом креатинина 25 мл/мин для профилактики тромбоэмболических осложнений целесообразно применять следующий препарат из группы новых оральных антикоагулянтов
1) апиксабан;+
2) дабигатрана этексилат;
3) ривароксабан.
52. Целевой уровень МНО во время приема варфарина при лечении тромбоэмболических осложнений составляет
53. Частота бессимптомных тромбозов глубоких вен (диагностируемых только при скрининговом ультразвуковом исследовании сосудов) после первичного эндопротезирования составляет
54. Частота клинически значимых тромбозов глубоких вен после первичного эндопротезирования составляет
55. Что входит в стандартный объем ультразвукового сканирования у больных с подозрением на развитие венозного тромбоэмболического осложнения?
1) исследование вен сосудов головного мозга;
2) исследование вен таза;+
3) исследование вен шеи;
4) исследование поверхностных и глубоких вен контралатеральной конечности;+
5) исследование поверхностных и глубоких вен пораженной конечности.+
Если хотите поблагодарить автора за его огромный труд, полученные знания и уникальный ресурс, то можете отправить ДОНАТ (от скромной до щедрой суммы).
Шкала оценки клинической вероятности ТЭЛА (критерии Уэллса)
Шкалы для оценки клинической вероятности ТЭЛА используются у стабильных пациентов (без шока, гипотензии) с подозрением на ТЭЛА. Они позволяют определить очередность диагностических процедур для подтверждения или исключения диагноза тромбоэмболии легочной артерии. Шкала стратификации вероятности ТЭЛА Уэллса (Wells’ критерии) помогает определить вероятность развития у пациента ТЭЛА. После оценки по шкале врач может выбрать, какие дальнейшие исследования необходимы для диагностики тромбоэмболии легочной артерии (например, D-димер или КТ-ангиография).
| Вероятность ТЭЛА | Баллы | Клинический совет |
|---|---|---|
| 0 | 0 | 0 |
| Вероятность ТЭЛА | Баллы | Клинический совет |
|---|---|---|
| 0 | 0 | 0 |
| Баллы | ||
| Клинические признаки ТГВ | Да | 3 |
| Нет | 0 | |
| Альтернативный диагноз менее вероятен чем ТЭЛА | Да | 3 |
| Нет | 0 | |
| Частота сердечных сокращений ≥ 100 уд/мин | Да | 1.5 |
| Нет | 0 | |
| Хирургическое вмешательство или иммобилизация в течение последних 4 недель | Да | 1.5 |
| Нет | 0 | |
| Предыдущие случаи ТЭЛА или ТГВ | Да | 1.5 |
| Нет | 0 | |
| Кровохарканье | Да | 1 |
| Нет | 0 | |
| Активно развивающаяся или пролеченная в последние 6 месяцев злокачественная опухоль или паллиативное ведение | Да | 1 |
| Нет | 0 |
Трехуровневая шкала
Двухуровневая шкала
Зарегистрируйтесь на нашем сайте прямо сейчас, чтобы иметь доступ к большему количеству обучающих материалов!
5.4. Диагностика тромбоэмболии легочных артерий
Наиболее часто наблюдаются следующие симптомы и признаки:
боль в грудной клетке по типу плеврита — 52%
боль за грудиной — 12%
тахипноэ l20 в минуту — 70%
тахикардия l100 в минуту — 26%
признаки тромбоза глубоких вен — 15%
лихорадка l38,5°C — 7%
При оценке клинической вероятности ТЭЛА следует учитывать не только состояние пациента, но и наличие факторов, предрасполагающих к развитию венозных тромбоэмболических осложнений:
Факторы, имеющие высокое прогностическое значение (ОР > 10):
перелом бедра или голени;
протезирование бедренного или коленного сустава;
большая хирургическая операция;
повреждение спинного мозга.
Факторы, имеющие умеренное прогностическое значение (ОР 2—9):
артроскопическая операция на коленном суставе;
катетеризация центральной вены;
хроническая сердечная или дыхательная недостаточность;
заместительная гормональная терапия;
прием оральных контрацептивов;
беременность и ранний (до 6 недель) послеродовый период;
венозные тромбоэмболические осложнения в анамнезе;
Факторы, имеющие низкое прогностическое значение (ОР 3 суток;
длительное сидячее положение (например, авиаперелет);
Согласно нашим собственным наблюдениям, средний возраст пациентов с прижизненно диагностированной ТЭЛА составлял 57 ± 16 лет; в подавляющем большинстве случаев (94%) больные имели тот или иной фактор риска или их сочетание. Наиболее часто выявлялись хроническая сердечная недостаточность (36%), тромбоз глубоких вен и/или венозные тромбоэмболические осложнения в анамнезе (26%), ожирение (25%), онкологические заболевания (22%), варикозное расширение вен (21%), постельный режим (17%). Доля травм, оперативных вмешательств и неврологических заболеваний в спектре причин ТЭЛА оказалась существенно ниже — в частности, большая травма была ответственна за 7%, большая хирургическая операция — за 6%, а парез или плегия — за 9% тромбоэмболических осложнений, однако лишь при условии адекватной профилактики тромбообразования.
У больных с подозрением на ТЭЛА ее клиническую вероятность можно оценить с помощью шкал риска (табл. 5.2 и 5.3).
Несмотря на то, что этот метод признан «золотым стандартом» в диагностике ТЭЛА, риск, связанный с процедурой, и трудность интерпретации результатов правой вентрикулографии привели к постепенному вытеснению ангиопульмонографии другими методами — мультидетекторной КТ, эхокардиографией и лабораторному определению маркеров тромбообразования.
В подавляющем большинстве случаев для установления диагноза достаточно неинвазивного обследования.
Для аккуратной стратификации риска и выбора тактики ведения у пациентов с доказанной ТЭЛА следует оценить функцию правого желудочка и степень повреждения миокарда, в связи с чем алгоритм обследования должен включать эхокардиографию и определение уровня сердечных тропонинов.
При наличии тромбоэмболических осложнений в отсутствие факторов риска желательно дообследование на предмет заболеваний, характеризующихся патологией свертывания крови — в первую очередь, тромбофилий и злокачественных новообразований.
Какие шкалы должен использовать кардиолог у пациентов с фибрилляцией предсердий? Что нового?
Частота фибрилляции предсердий (ФП) у взрослых людей в популяции составляет 2-4% [1]. Она увеличивается с возрастом, в том числе под действием различных сопутствующих заболеваний и факторов риска, таких как артериальная гипертония, сахарный диабет, коронарная болезнь сердца, хроническая болезнь почек, ожирение, употребление алкоголя, курение и т.д. В ближайшие годы можно ожидать дальнейшего роста распространенности ФП не только за счет увеличения продолжительности жизни и постарения населения, но и внедрения новых систем скрининга нарушений ритма с помощью мобильных технологий (смартфонов), позволяющих зарегистрировать малосимптомные или бессимптомные нарушения ритма [2]. Например, в исследовании REHEARSE-AF регистрация ЭКГ в одном отведении с помощью смартфона/ планшета два раза в неделю в течение 12 мес у пациентов в возрасте ≥65 лет привела к увеличению частоты диагностики ФП в 3,9 раза по сравнению с обычной тактикой ведения [3]. Использование подобных устройств для скрининга ФП наиболее обосновано у людей пожилого и старческого возраста, а также пациентов с высоким риском инсульта [4].
ФП ассоциируется более чем с 3-кратным увеличением риска смерти [5] и является одной из основных причин инсульта (20-30% и 10% случаев ишемического и криптогенного инсульта, соответственно), который характеризуется тяжелым и рецидивирующим течением и часто приводит к смерти или инвалидизации [1]. ФП сопровождается нарушением функции сердца и развитием сердечной недостаточности, как со сниженной, так и сохраненной фракцией выброса левого желудочка, которая наблюдается у 20-30% таких больных и вызывает дополнительное ухудшение прогноза для жизни [6]. Неблагоприятные последствия ФП включают в себя также снижение качества жизни, особенно у женщин [7], когнитивные расстройства вплоть до деменции [8] и частые госпитализации, ассоциирующиеся с увеличением затрат для системы здравоохранения [9]. По данным мета-анализа 35 исследований в целом более чем у 300000 больных с ФП частота госпитализаций составила в среднем 43,7 на 100 пациентов в год, а одним из основных факторов, ассоциировавшихся с увеличением вероятности поступления в стационар, был пожилой возраст [10].
Ведение больных с ФП
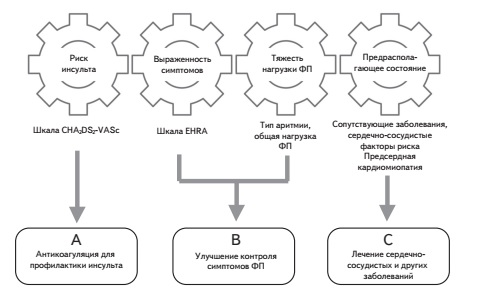
Антикоагулянтная терапия
Для оценки риска инсульта у больных с ФП и, соответственно, необходимости в применении антикоагулянтов используют шкалу CHA2DS2-VASc (табл. 1), которая включает в себя хроническую сердечную недостаточность (ХСН), артериальную гипертонию, возраст ≥75 лет, сахарный диабет, инсульт/транзиторную ишемическую атаку (ТИА)/системную эмболию в анамнезе, сердечно-сосудистое заболевание, в том числе стенозирующий коронарный атеросклероз, подтвержденный при ангиографии, перенесенный инфаркт миокарда, атеросклероз периферических артерий или бляшку в аорте, возраст 65-74 года и женский пол [18]. Необ ходимо отметить, что женский пол скорее модифицирует общий риск развития инсульта, чем является фактором риска сам по себе [19], так как при отсутствии дополнительных факторов риска у женщин вероятность развития инсульта такая же низкая как у мужчин с индексом по шкале CHA2DS2-VASc, равным 0. В то же время при наличии по крайней мере одного дополнительного фактора риска у женщин вероятность инсульта увеличивается в большей степени, чем у мужчин [20].
Склонность к падениям сама по себе не является независимым фактором риска кровотечения на фоне антикоагулянтной терапии, однако травма при падении у пожилого пациента, принимающего пероральные антикоагулянты, может привести к более тяжелому кровотечению, например, внутричерепному. Любопытные данные были получены в одном исследовании, в котором моделировались эффекты падений у пациентов, получающих пероральные антикоагулянты. Авторы показали, что пациенты, принимающие варфарин, должны падать примерно 295 раз в год, чтобы угроза серьезного кровотечений перевесила пользу снижения риска ишемического инсульта [26]. Тем не менее, приведенные данные не отменяют необходимость профилактики падений с помощью простых мер, таких как использование вспомогательных устройств при ходьбе, ношение соответствующей обуви, устранение препятствий для пожилого человека в квартире (ковры, лишняя мебель) и т.д.
Показания к назначению пероральных антикоагулянтов в новых рекомендациях Европейского общества кардиологов не изменились. Их применение необходимо, если значение индекса по шкале CHA2DS2-VASc составляет по крайней мере 2 у мужчин и 3 у женщин. Это означает, что пероральные антикоагулянты следует назначать всем больным с ФП (независимо от пола), достигшим возраста 75 лет, и пациентам в возрасте 6574 года при наличии по крайней мере одного дополнительного фактора риска инсульта, например, артериальной гипертонии или сахарного диабета, в то время как в более молодом возрасте основанием для антикоагуляции служит наличие по крайней мере двух факторов риска как у мужчин, так и у женщин (рис. 2). Если индекс по шкале CHA2DS2-VASc составляет 1 у мужчин или 2 у женщин, то антикоагулянтную терапию считают возможной, хотя четкие показания к ее назначению в таких случаях в рекомендациях не приводятся. ФП обычно развивается у людей пожилого и старческого возраста, страдающих различными заболеваниями, поэтому индекс по шкале CHA2DS2-VASc у большинства больных с этой аритмией превышает указанные значения, обосновывая применение антикоагулянтов. Кроме того, индекс CHA2DS2-VASc имеет тенденцию к увеличению как за счет возраста, так и присоединения новых заболеваний, повышающих риск инсульта. Необходимо еще раз подчеркнуть, что тип ФП (пароксизмальная/персистирующая или постоянная) не имеет значения для решения вопроса об антикоагулянтной терапии и не учитывается при расчете индекса по шкале CHA2DS2-VASc.
Для профилактики инсульта у пациентов с неклапанной ФП применяют антагонисты витамина К, прежде всего варфарин, или прямые оральные антикоагулянты (ПОАК), в том числе ривароксабан, апиксабан, дабигатрин и эдоксабан (последний не зарегистрирован в Российской Федерации). Комбинированная терапия ацетилсалициловой кислотой и клопидогрелом у таких пациентов по эффективности уступала варфарину и сопровождалась сопоставимым риском кровотечений [27], а монотерапия ацетилсалициловой кислотой оказалась неэффективной и ассоциировалась с более высоким риском ишемического инсульта у пожилых людей с ФП [28]. Таким образом, антитромбоцитарные препараты не следует рассматривать как более безопасную альтернативу пероральным антикоагулянтам у пациентов с ФП, нуждающихся в эффективной профилактике инсульта.
В настоящее время ПОАК считают препаратами первой линии в профилактике инсульта у пациентов с неклапанной ФП [11]. В регистрационных клинических исследованиях все препараты этой группы по эффективности по крайне мере не уступали варфарину. Однако при мета-анализе клинических исследований у больных, получавших ПОАК, было выявлено снижение риска инсульта и системных эмболий на 19% по сравнению с таковым при лечении варфарином, снижение риска геморрагического инсульта на 51% и риска смерти от любых причин на 10%. Кроме того, при применении ПОАК было отмечено недостоверное снижение риска больших кровотечений на 14% и статистически значимое снижение риска внутричерепного кровотечения на 52%, в то время как частота желудочно-кишечных кровотечений увеличилась на 25% [29]. Эти данные позволяют рассматривать ПОАК в целом как более эффективную и безопасную альтернативу непрямым антикоагулянтам.
В отличие от ПОАК, варфарин может взаимодействовать с различными лекарственными препаратами, которые могут усилить или, наоборот, ослабить его антикоагулянтное действие. При лечении непрямыми антикоагулянтами необходимо регулярно контролировать международное нормализованное отношение (МНО) и при необходимости корректировать их дозы. В целом антагонисты витамина К считают эффективными и относительно безопасными препаратами, если МНО удается поддерживать в терапевтическом диапазоне более 70% времени, хотя добиться этого удается не всегда. Предложена шкала SAMe-TT2R2 (женский пол, возраст менее 60 лет, наличие по крайней мере двух сопутствующих заболеваний, таких как артериальная гипертония, сахарный диабет, ИБС, атеросклероз периферических артерий, сердечная недостаточность, инсульт в анамнезе, заболевание легких и поражение печени или почек, лечение некоторыми препаратами, курение, неевропеоидная раса), которая позволяет выделить пациентов с ФП, у которых труднее обеспечить адекватный антикоагулянтный эффект варфарина [30]. Величина индекса по этой шкале >2 служит дополнительным доводом в пользу выбора ПОАК. Если больному все же приходится назначить варфарин или другой антагонист витамина К (обычно по экономическим причинам), то необходимо принимать дополнительные меры, чтобы повысить эффективность и безопасность терапии, например, более частое мониторирование МНО, повторные консультации и т.п.
Профиль эффективности ПОАК в профилактике инсульта у пациентов с неклапанной ФП подтвержден также в пострегистрационных исследованиях, результаты которых соответствовали таковым рандомизированных контролируемых исследований 31. P. Kirchhof и соавт. обобщили результаты применения ривароксабана у 11121 пациента с неклапанной ФП (средний возраст 70,5±10,5 лет; 42,9% женщин), включенных в исследования, которые проводились в обычной клинической практике в 47 странах в рамках программы XANTUS (Xarelto for Prevention of Stroke in Patients With Atrial Fibrillation) [34]. Проспективный дизайн исследований повышает клиническую ценность полученных данных. Пациентов с ФП, начавших прием ривароксабана, наблюдали в течение 1 года. Частота больших кровотечений составила в среднем 1,7 на 100-пациентолет, смерти от любых причин – 1,9 на 100 пациентолет, инсульта и системных эмболий – 1,0 на 100 пациенто-лет. Для сравнения, частота первичной конечной точки, включавшей в себя инсульт и системные эмболии, в рандомизированном исследовании ROCKET AF, подтвердившем эффективность ривароксабана в профилактике инсульта у пациентов с неклапанной ФП, составила 1,7 на 100 пациенто-лет [35]. Частота как кровотечений, так и инсульта была низкой во всех странах, принимавших участие в программе XANTUS, а доля пациентов, продолжавших прием ривароксабана в течение года, равнялась 77,4% (от 66,4% в странах Восточной Азии до 84,4% в Западной Европе). Высокая приверженность к приему антикоагулянтной терапии отражает удобство применения ривароксабана, в том числе отсутствие необходимости в титровании дозы и регулярном мониторировании МНО, низкий риск взаимодействия с другими лекарственными средствами, стабильность антикоагулянтного эффекта и возможность назначения один раз в день [36].
Все ПОАК частично выводятся почками – в большей степени дабигатран и в меньшей степени ривароксабан и апиксабан, поэтому при выборе препарата и его дозы следует учитывать функцию почек. Например, дозу ривароксабана у пациентов с клиренсом креатинина 1549 мл/мин следует снизить с 20 до 15 мг один раз в день. Чтобы обеспечить безопасность антикоагулянтной терапии у больных с ФП, необходимо регулярно контролировать функцию почек с помощью клиренса креатитина, рассчитанного по формуле Кокрофта-Гоулта, так как именно этот показатель использовался в регистрационных клинических исследованиях. Оценивать функцию почек следует по крайней мере один раз в год или чаще у пациентов, относящихся к группе риска, например, при наличии исходного снижения функции почек. У пациентов с нарушенной и/или ухудшающейся функцией почек целесообразно рассмотреть применение ПОАК, которые в меньшей степени выводятся почками (ривароксабан или апиксабан). В практическом руководстве Европейской ассоциации аритмологов клиренс креатинина рекомендовано измерять каждые 6 мес у больных в возрасте ≥75 лет (особенно при лечении дабигатраном) и «хрупких» пациентов [37]. Чтобы оценить минимальный интервал определения клиренса креатинина у пациентов с исходно сниженной функцией почек клиренс креатинина следует разделить на 10. Например, у пациентов с его значением 40 мл/мин, клиренс креатинина следует измерять по крайней мере каждые 4 мес. Необходимо учитывать, что функция почек может быстро ухудшиться под влиянием различных интеркуррентных заболеваний, например, инфекций или острой сердечной недостаточности. Соответственно, в таких случаях необходимо также измерить клиренс креатинина.
ФП примерно в трети случаев сочетается с хронической болезнью почек (ХБП) III-V стадии, т.е. снижением расчетной скорости клубочковой фильтрации (СКФ)
Улучшение контроля симптомов
Для оценки симптомов (сердцебиение, одышка, утомляемость, дискомфорт в груди и др.) ФП используют шкалу, предложенную Европейской ассоциацией аритмологов (EHRA) и отражающую влияние проявлений аритмии на обычную повседневную активность пациентов (табл. 3) [46,47]. Необходимо учитывать, что все указанные симптомы неспецифичны и могут быть следствием сопутствующих заболеваний, а подтвердить их связь с ФП иногда удается только ретроспективно. В рекомендациях Европейского общества кардиологов предлагается также оценивать тяжесть нагрузки ФП, которая отражает ее тип, общую длительность сохранения нарушения ритма при мониторировании ЭКГ, например, в течение 24 ч, число эпизодов аритмии, их максимальную длительность и т.п. [11]. Следует отметить, что в рекомендациях отсутствуют четкие критерии интепретации полученных данных. В некоторых исследованиях была выявлена ассоциация между параметрами нагрузки ФП и неблагоприятными клиническими исходами. A. Ganesan и соавт. при мета-анализе 12 исследований примерно у 100000 больных с непароксизмальной неклапанной ФП выявили увеличение риска тромбоэмболий и смерти (относительный риск 1,384; p ТАБЛИЦА 3. Шкала оценки выраженности симптомов ФП (EHRA)
Амиодарон остается самым эффективным антиаритмическим препаратом у больных с ФП, в том числе с сердечной недостаточностью и низкой фракцией выброса левого желудочка. В рекомендациях указано, что с учетом экстракардиальной токсичности амиодарона для длительного контроля синусового ритма у пациентов с ФП желательно по возможности применять другие антиаритмические препараты [11]. Тем не менее, как и в предыдущих версиях рекомендаций, другие антиаритмические средства, такие как пропафенон и соталол, рекомендовано использовать только при отсутствии признаков значительного структурного поражения сердца. Соталол может применяться у пациентов с ишемической болезнью сердца под тщательным контролем интервала QT, сывороточных уровней калия, клиренса креатинина и других факторов риска аритмогенного действия. К последним относят пожилой возраст, женский пол, нарушение функции почек и/или печени, коронарную болезнь сердца, гипокалиемию, случаи внезапной смерти у родственников. Анти арит мическую терапию не следует назначать пациентам с постоянной формой ФП, которые получают урежающие ритм препараты, а также больным с выраженными нарушениями проводимости, если им не установлен водитель ритма.
Лечение сердечно-сосудистых и других сопутствующих заболеваний
Сердечно-сосудистые заболевания и факторы риска, с одной стороны, способствуют развитию и рецидированию ФП, а, с другой стороны, сами могут быть причиной неблагоприятных исходов, в том числе инсульта, инфаркта и смерти. A. Gómez-Outes и соавт. провели мета-анализ 4 клинических исследований, в которых ПОАК сравнивали с варфарином в целом у 71683 больных с неклапанной ФП [55]. Во время периода наблюдения умерли 9% из них, а скорректированная смертность составила 4,72% в год. Доля сердечных причин в структуре общей смертности составила 46%. Основными факторами риска смерти от любых причин были сердечная недостаточность, постоянная/персистирующая ФП, сахарный диабет, мужской пол, пожилой возраст и сниженный клиренс креатинина. Сходные данные были получены в одном из исследований, включенных в мета-анализ, – ROCKET AF, в котором изучался ривароксабан [56]. Приведенные данные указывают на важность модификации сердечнососудистых факторов риска для улучшения прогноза у больных с неклапанной ФП.
Предложены шкалы, позволяющие стратифицировать больных с неклапанной ФП по риску основных сердечно-сосудистых событий, в том числе смертель ного и несмертельного инфаркта миокарда, реваску ляризации коронарных артерий и смерти от сердечно-сосудистых причин. Например, на основании проспективного когортного исследования у 1019 пациентов с ФП разработан индекс 2MACE, который рассчитывается с учетом возраста и наличия метаболического синдрома, застойной сердечной недоста точности и инфаркта миокарда/реваскуляризации коронарных артерий и тромбоэмболий в анамнезе (табл. 4) [57]. Величина индекса 2MACE варьируется от 0 до 7, а его значение ≥3 позволяло с высокой чувствительностью и специфичностью предсказать развитие неблагоприятных исходов у пациентов с неклапанной ФП (отношение рисков 3,92, 95% ДИ 2,41-6,40, p ТАБЛИЦА 4. Шкала 2MACE, предназначенная для оценки риска сердечно-сосудистых событий у пациентов с неклапанной ФП
Заключение
Современная стратегия лечения больных с неклапанной ФП, которая подробно рассматривается в рекомендациях Европейского общества кардиологов 2020 г., предполагает антикоагуляцию с целью профилактики инсульта и системных эмболий, улучшение контроля симптомов ФП путем урежения ЧСС или восстановления и удержания синусового ритма и оптимальное лечение сердечно-сосудистых и других сопутствующих заболеваний, которые в структуре смертности паци ентов с ФП занимают даже более важное место, чем ишемический инсульт. Накапливаются данные, демонстрирующие дополнительные преимущества ПОАК перед непрямыми антикоагулянтами. Например, в мета-анализах рандомизированных клинических исследованиях показано снижение риска развития инфаркта миокарда/ОКС при лечении ривароксабаном по срав нению с контролем. В ретроспективных исследованиях лечение ривароксабаном улучшало почечные исходы у пациентов с неклапанной ФП. Пациентам с ФП следует проводить структурированное обследование, включающее в себя оценку риска инсульта, выраженности симптомов, тяжести нагрузки ФП (тип аритмии, число и длительность эпизодов и т.п.) и предрасполагающего состояния. Важное значение имеет использование различных шкал, в том числе CHA2DS2-VASc (риск инсульта), HAS-BLED (риск кровотечения), EHRA (выраженность симптомов ФП) и 2MACE (риск сердечно-сосудистых исходов), которые помогают выбрать оптимальное лечение. Для более точной оценки риска инсульта и кровотечений у пациентов с ФП предложены новые шкалы на основе не только клинических показателей, но и лабораторных маркеров, однако их потенциальные преимущества перед существующими общепринятыми индексами нуждаются в подтверждении.
- какие клинические признаки могут быть использованы для диагностики свинцовой колики тест
- какие клинические ситуации могут привести к тромбоэмболии церебральных артерий