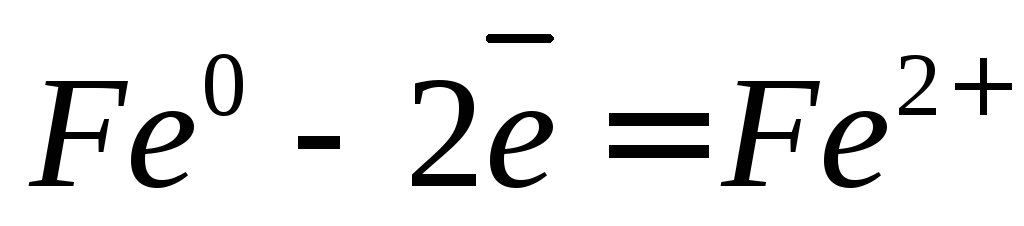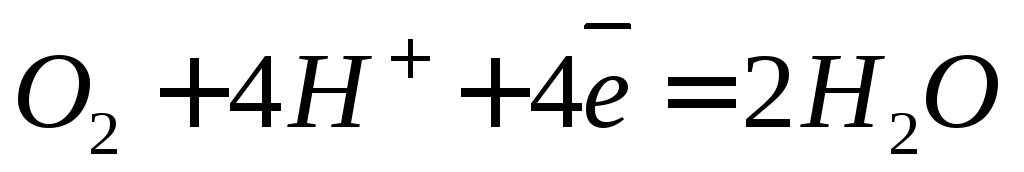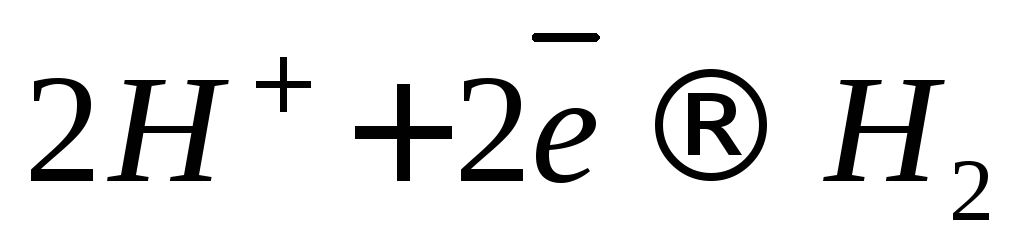какие компоненты являются деполяризаторами в процессе электрохимической коррозии
Электрохимическая коррозия
К электрохимической коррозии относятся такие виды местных разрушений, как питтинги, межкристаллитная коррозия, щелевая. Кроме того процессы электрохимической коррозии происходят в грунте, атмосфере, море.
Механизм электрохимической коррозии может протекать по двум вариантам:
1) Гомогенный механизм электрохимической коррозии:
— поверхностный слой мет. рассматривается как гомогенный и однородный;
— причиной растворения металла является термодинамическая возможность протекания катодного или же анодного актов;
— К и А участки мигрируют по поверхности во времени;
— скорость протекания электрохимической коррозии зависит от кинетического фактора (времени);
— однородную поверхность можно рассматривать как предельный случай, который может быть реализован и в жидких металлах.
2) Гетерогенный механизм электрохимической коррозии:
— у твердых металлов поверхность негомогенная, т.к. разные атомы занимают в сплаве различные положения в кристаллической решетке;
— гетерогенность наблюдается при наличии в сплаве инородных включений.
Электрохимическая коррозия имеет некоторые особенности: делится на два одновременно протекающих процесса (катодный и анодный), которые кинетически зависимы друг от друга; на некоторых участках поверхности электрохимическая коррозия может принять локальный характер; растворение основного мет. происходит именно на анодах.
Поверхность любого металла состоит из множества короткозамкнутых через сам металл микроэлектродов. Контактируя с коррозионной средой образующиеся гальванические элементы способствуют электрохимическому его разрушению.
Причины возникновения местных гальванических элементов могут быть самые разные:
1) неоднородность сплава
— неоднородность мет. фазы, обусловленная неоднородностью сплава и наличием микро- и макровключений;
— неравномерность окисных пленок на поверхности за счет наличия макро- и микропор, а также неравномерного образования вторичных продуктов коррозии;
— наличие на поверхности границ зерен кристаллов, выхода дислокации на поверхность, анизотропность кристаллов.
2) неоднородность среды
— область с ограниченным доступом окислителя будет анодом по отношению к области со свободным доступом, что ускоряет электрохимическую коррозию.
3) неоднородность физических условий
— температура (по отношению к холодным участкам, нагретые являются анодами) и т. д.
При работе гальванического элемента одновременно протекает два электродных процесса:
Происходит реакция окисления.
O2 + 4H + + 4e → 2H2O (кислородная деполяризация в кислых средах)
2 H + + 2e → H2 (при водородной деполяризации).
Торможение анодного процесса приводит к торможению и катодного.
Скачек потенциалов в процессе электрохимической коррозии может происходить из-за двух причин:
При достаточно большой энергии гидратации ионы металла могут отрываться и переходить в раствор, оставляя на поверхности эквивалентное число электронов, которые определяют ее отрицательный заряд. Отрицательно заряженная поверхность притягивает к себе катионы мет. из раствора. Так на границе раздела фаз возникает двойной электрический слой.
На поверхности металла разряжаются катионы электролита. Это приводит к тому, что поверхность мет. приобретает положительный заряд, который с анионами раствора образует двойной электрический слой.
Иногда возникает ситуация, когда поверхность не заряжена и, соответственно, отсутствует ДЭС. Потенциал, при котором это явление наблюдается называется потенциалом нулевого заряда (φN). У каждого металла потенциал нулевого заряда свой.
Величина электродных потенциалов оказывает очень большое влияние на характер коррозионного процесса.
Скачок потенциала между двух фаз не может быть измерен, но при помощи компенсационного метода можно измерить электродвижущую силу элемента (ЭДС), который состоит из электрода сравнения (его потенциал условно принят за ноль) и исследуемого электрода. В качестве электрода сравнения берется стандартный водородный электрод. ЭДС гальванического элемента (стандартный водородный электрод и исследуемый элемент) называют электродным потенциалом. Электродами сравнения могут также выступать хлорсеребряный, каломельный, насыщенный медно-сульфатный.
Международной конвенцией в Стокгольме 1953г. решено при записях электрод сравнения всегда ставить слева. При этом ЭДС рассчитывать, как разность потенциалов правого и левого электродов.
При коррозии в электролитах самыми распространенными и значимыми являются адсорбционные (адсорбция катионов или анионов на границе раздела фаз) и электродные потенциалы (переход катионов из металла в электролит или наоборот).
Электродный потенциал, при котором металл находится в состоянии равновесия с собственными ионами называется равновесный (обратимый). Он зависит от природы металлической фазы, растворителя, температуры электролита, активности ионов мет.
Равновесный потенциал подчиняется уравнению Нернста:
При установленном равновесном потенциале электрохимическая коррозия не наблюдается.
Скорость электрохимической коррозии тем меньше, чем больше поляризация. Поляризация характеризуется величиной перенапряжения.
Поляризация бывает трех типов:
— электрохимическая (при замедлении анодного или катодного процессов);
— концентрационная (наблюдается, когда скорость подхода деполяризатора к поверхности и отвода продуктов коррозии мала);
— фазовая (связана с образованием на поверхности новой фазы).
Электрохимическая коррозия наблюдается также при контакте двух разнородных металлов. В электролите они образуют гальванопару. Более электроотрицательный из них будет анодом. Анод в процессе будет постепенно растворяться. При этом идет замедление или даже полное прекращение электрохимической коррозии на катоде (более электроположительном). Например, при контакте в морской воде дюралюминия с никелем интенсивно растворятся будет именно дюралюминий.
Электрохимическая коррозия металлов. Виды электрохимической коррозии. Электрохимическая коррозия с кислородной и водородной деполяризацией
Электрохимическая коррозия сопровождается возникновением электрического тока и протекает в средах с хорошей ионной проводимостью. К электрохимической коррозии относится коррозия в водных растворах. Электрохимической коррозии подвергаются подводные части судов, паровые котлы, проложенные в земле трубопроводы. К электрохимической коррозии относится: коррозия в электролитах, атмосферная коррозия, электрокоррозия, коррозия под напряжением.
В результате электрохимической коррозии окисление металлов может приводить как к образованию нерастворимых продуктов (ржавчины), так и к переходу металла в раствор в виде ионов.
Растворенный кислород, ионы водорода, молекулы воды – это важнейшие окислители, вызывающие электрохимическую коррозию металлов.
Все металлы делят на пять групп по степени термодинамической устойчивости. Такое деление соответствует их положению в ряду напряжений.
К группе повышенной термодинамической нестабильности относятся металлы, имеющие значение стандартного электродного потенциала меньше, чем потенциал водородного электрода при рН = 7 (-0,413 В), а именно Li, Rb, Cs, Ba, Sr, Ca, Na, Mg, Al, Ti, Zr, Mn, Cr, Zn, Fe. Данные металлы могут коррозировать даже в нейтральных средах, то есть могут окисляться водой. Естественно эти металлы коррозируют и в кислых средах. Металлы могут окисляться кислотой, кислородом, а также под действием других окислителей, при этом протекает процесс, описываемый уравнением
Процесс электрохимической коррозии – это совокупность двух процессов, одновременно протекающих на поверхности металла:
-анодного, сопровождающегося окислением атомов металла, протекающего по уравнению (10);
— катодного, сопровождающегося восстановлением окислителя коррозионной среды, протекающего по уравнению
Окислители электрохимической коррозии называют деполяризаторами. Приведем возможные процессы восстановления окислителей:
Коррозию, сопровождающуюся восстановлением (ионизацией) молекул кислорода (14), (15), называют коррозией с поглощением кислорода или коррозией с кислородной деполяризацией. С кислородной деполяризацией протекают следующие виды электрохимической коррозии: атмосферная, подземная, в пресной и морской воде, в растворах солей, в аэрированных растворах органических кислот.
Коррозию, сопровождающуюся восстановлением молекул воды и ионов водорода (12), (13), называют коррозией с выделением водорода или коррозией с водородной деполяризацией.
Металлы термодинамически нестабильные имеют значения стандартных электродных потенциалов больше, чем металлы группы повышенной термодинамической нестабильности, но не выше нуля. К этой группе относятся металлы: Cd, In, Tl, Co, Ni, Mo, Pb, W. Эти металлы не окисляются водой при рН = 7, но окисляются в кислых средах и в любых средах в присутствии кислорода.
Группа металлов промежуточной термодинамической стабильности: Bi, Sb, Re, Tc, Cu, Ag, Rh. Данные металлы имеют положительные значения стандартных электродных потенциалов, но не превышающие значения электродного потенциала, связанного с окисляющим действием кислорода в нейтральной среде (14). Эти металлы будут устойчивы в любых кислых и нейтральных средах в отсутствие кислорода.
Металлы высокой стабильности устойчивы во влажной атмосфере, то есть в присутствии кислорода в нейтральной среде. К данным металлам относятся Hg, Pd, Ir, Pt. Стандартные электродные потенциалы этих металлов находятся в интервале между значениями двух электродных потенциалов, характеризующих окисляющее действие кислорода в нейтральной и кислой средах, то есть от 0,816 В до 1,229 В.
Металлом полной стабильности является золото. Оно не может окисляться рассмотренными выше окислителями и у него максимальный электродный потенциал.
Чтобы получить уравнения реакций, лежащих в основе электрохимической коррозии металлов в различных средах, которые называются коррозионные токообразующие реакции, суммируют (10) поочередно с (12) – (15). Если уравнять число отданных и принятых электронов, то получим следующие уравнения
4M + nO2 + 4nH + → 4M n+ + 2nH2O (17)
2M + 2 nH + → 2M n + + nH2↑ (19).
Причинами возникновения электрохимической коррозии служат различные виды неоднородностей как самой поверхности металла или сплава, так и коррозионной среды. В результате вся поверхность, соприкасающаяся с токопроводящей коррозионной средой, разделяется на катодные и анодные участки, которые имеют очень маленькие размеры и чередуются друг с другом. В такой среде они представляют собой совокупность огромного числа короткозамкнутых коррозионных гальванических микроэлементов. Коррозия осуществляется в результате протекания анодного процесса или коррозионного окисления металла и катодного процесса или восстановления окислителя, находящегося во влажной среде.
Рассмотрим различные случаи возникновения коррозионных гальванических пар.
1. Контакт с электролитом двух разных металлов в случае сочетания в одном узле или детали металлов различной активности в данной среде, или в случае применения сплава эвтектического типа из двух металлов разной активности,
2. Контакт металла и его соединения, обладающего металлообразными или полупроводниковыми свойствами. В любом случае свободный металл имеет отрицательный электрический заряд, а соединение — положительный заряд, так как в нем часть электронов проводимости связана. Этотакже справедливо и для интерметаллидов.
3. Различные концентрации электролитов или воздуха, растворенного в жидком электролите.
4. Различный уровень механических напряжений в одной и той же детали.
Механизм электрохимической коррозии, определяемый разностью потенциалов пассивных (катодных) и активных (анодных) участков, сводится к работе гальванического элемента, однако результат коррозионных разрушений может быть различен.
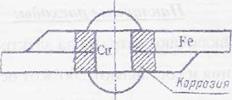
На механизм низкотемпературной коррозии влияет много различных причин: переменная температура и влажность воздуха, переменный состав газовой и электролитной среды и даже бактериальная флора, например при почвенной коррозии, так как некоторые виды бактерий способствуют окислению железа. Развитие коррозии в результате контакта разных металлов можно иллюстрировать схемой, представленной на рис. 1. Наибольшее коррозионное разрушение наблюдается рядом с контактом, так как здесь сопротивление наименьшее и, следовательно, наибольшая плотность тока.
Рис. 1. Разрушение в месте контакта разных металлов
Если возникновение разности потенциалов вызвано применением эвтектических сплавов, состоящих из металлов различной активности, то не всегда можно руководствоваться данными по стандартным потенциалам растворения, так как активность изменяется в зависимости от состава электролита и рН среды.
Так, например, стандартный потенциал алюминия меньше стандартного потенциала цинка, а в растворе поваренной соли получается наоборот — εА1 > εZn и в данной паре цинк будет анодом. При контакте эвтектического сплава с электролитом может быть два случая:
1) коррозия сведется к вытравливанию из поверхностного слоя одного из компонентов (селективная коррозия);
Тщательное соблюдение требований к электрической изоляции (битум, полиэтилен) закладных изделий и правильной эксплуатации электрических сетей может исключить электрокоррозию.
Дата добавления: 2015-08-08 ; просмотров: 3513 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Роль поляризации и деполяризации при коррозии металлов
Поляризация вызывается отставанием электродных процессов от процесса передвижения электронов в металле от анода к катоду. Если анодный процесс перехода ионов металла в раствор отстает от перетока электронов от анода к катоду, то это приводит к уменьшению отрицательного заряда на поверхности металла (анодная поляризация). Анодная поляризация при коррозии металла может быть вызвана:
Пассивность в определенных условиях наблюдается у титана, алюминия, хрома, молибдена, магния, никеля, кобальта, железа и некоторых других металлов. Пассивность металлов зависит как от внутренних факторов (состав, структура, состояние поверхности), так и от внешних факторов (состав и концентрация электролита, температура, движение раствора, наложение внешнего тока и т.д.).
Ввещества, способствующие переходу металла в пассивное состояние, называются пассиваторами. К пассиваторам относятся такие окислители, как HNO3, NaNO2, K2CrO7, O2 и др.
Пассивное состояние может сохраняться и после изменения внешних условий, вызвавших пассивацию.
Катодная поляризация при коррозии металлов может быть вызвана:
Поляризация тормозит коррозионные процессы, и если бы этот процесс не имел бы места в реальных условиях, многие металлы потеряли бы свое техническое значение.
Любые процессы, уменьшающие явление поляризации, называются процессами деполяризации, а вещества ее вызывающие-деполяризаторами. Деполяризация ускоряет коррозионные процессы.
В зависимости от среды различают процессы коррозии, протекающие:
Наиболее распространена коррозия с кислородной деполяризацией, которая имеет место в нейтральных, щелочных и слабокислых средах. Примером коррозии с кислородной деполяризацией может служить коррозия углеродистой стали в атмосферных условиях. В этом случае на поверхности металла находится пленка влаги, образованная за счет атмосферных осадков или конденсации паров из воздуха. Установлено, что для протекания коррозии по электрохимическому механизму достаточно слоя электролита толщиной всего 40-50 молекул. В воде растворяются O2, CO2, SO2, соли и др., что повышает электропроводность электролита. Сталь содержит в своем составе зерна карбида железа (Fe3C), выполняющие функцию микрокатодов (рис.22).
На анодных участках (железо) происходит процесс окисления, при этом железо переходит в виде ионов в раствор:
Так протекает реакция ионизации кислорода в нейтральных или щелочных средах. В кислых средах кислородная деполяризация протекает по уравнению:
При коррозии имеют место вторичные процессы, при которых ионы железа с ионами гидроксила образуют гидроксид железа (П), который далее окисляется кислородом до гидроксида железа (III):
Частично теряя воду, этот гидроксид образует ржавчину переменного состава:
Катодный процесс коррозии с кислородной деполяризацией состоит из нескольких стадий:
Обычно наиболее замедленной стадией является диффузия кислорода к поверхности металла, поэтому аэрация сильно сказывается на скорости коррозии. Однако, при больших скоростях подвода кислорода к корродирующей поверхности наиболее медленной стадией становится ионизация кислорода и в этом случае большое значение имеет перенапряжение ионизации кислорода.
Скорость коррозионного процесса определяется скоростью наиболее заторможенной стадии, поэтому эта стадия называется лимитирующей стадией или контролирующим фактором.
Таким образом, перенапряжение выделения водорода является фактором, тормозящим разрушение металла.
Какие компоненты являются деполяризаторами в процессе электрохимической коррозии
8.2 ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ
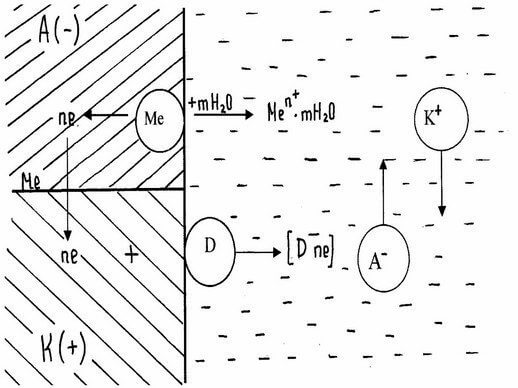
Причиной электрохимической коррозии * является возникновение на поверхности металла короткозамкнутых гальванических элементов *.
В тонком слое влаги, обычно покрывающем металл, растворяются кислород, углекислый, сернистый и другие газы, присутствующие в атмосферном воздухе. Это создает условия соприкосновения металла с электролитом *. Различные участки поверхности любого металла обладают разными потенциалами. Причинами этого могут быть наличие примесей в металле, различная обработка отдельных его участков, неодинаковые условия (окружающая среда), в которых находятся различные участки поверхности металла. При этом участки поверхности металла с более электроотрицательным потенциалом становятся анодами и растворяются.
Представим схематично работу короткозамкнутого гальванического элемента, возникающего на поверхности металла, подверженного коррозии в электролите * (рисунок 8.1). Анодный участок имеет более электроотрицательный потенциал, поэтому на нем идет процесс окисления металла. Образовавшиеся в процессе окислен ия ио ны переходят в электролит, а часть освободившихся при этом электронов может перемещаться к катодному участку (на рисунке 8.1 показано стрелками). Процесс коррозии будет продолжаться в том случае, если электроны, перешедшие на катодный участок, будут с него удаляться. Иначе произойдет поляризация электродов *, и работа коррозионного гальванического элемента прекратится.
Рисунок 8.1 – Схема электрохимической коррозии. Д – деполяризатор
Процесс отвода электронов с катодных участков называется деполяризацией. Вещества, при участии которых осуществляется деполяризация, называются деполяризаторами. На практике чаще всего приходится встречаться с двумя типами деполяризации: водородной и кислородной. Тип деполяризации (катодный процесс) зависит от реакции среды раствора электролита.
А: Fe – 2e → Fe 2+ – окисление
К: 2 H + + 2e → H2 ↑ – восстановление
Схема возникающего короткозамкнутого гальванического элемента выглядит следующим образом:
В нейтральной среде коррозия протекает с кислородной деполяризацией, т.е. роль деполяризатора выполняет кислород, растворенный в воде. Этот вид коррозии наиболее широко распространен в природе: он наблюдается при коррозии металлов в воде, почве и в незагрязненной промышленными газами атмосфере. Если коррозии во влажном воздухе подвергается железо с примесями меди, то электродные процессы можно записать в виде:
(А) Fe – 2e → Fe 2+ – окисление
(К) 2 H2O + O2 + 4e → 4 OH – – восстановление
У поверхности металла в электролите протекают следующие реакции:
Fe 2+ + 2 OH – → Fe( OH)2
Основная масса черных металлов разрушается вследствие процесса ржавления, в основе которого лежат вышеуказанные реакции.
Рисунок 8.2 – Коррозия в результате неравномерного доступа кислорода. Б – техническое сооружение; А – анодный участок; К – катодный участок.
Часть конструкции, находящаяся в воде, омывается растворенным в ней кислородом и, в случае возникновения условий для электрохимической коррозии, будет выполнять роль катода. Другая же часть конструкции, находящаяся в почве, будет анодом и подвергнется разрушению.
11.2.5. Роль поляризации и деполяризации при коррозии металлов.
Поляризация вызывается отставанием электродных процессов от процесса передвижения электронов в металле от анода к катоду. Если анодный процесс перехода ионов металла в раствор отстает от перетока электронов от анода к катоду, то это приводит к уменьшению отрицательного заряда на поверхности металла (анодная поляризация). Анодная поляризация при коррозии металла может быть вызвана:
перенапряжением ионизации металла,
замедлением диффузии ионов металла от электрода в толщу раствора (концентрационная поляризация),
пассивностью анода, т.е. особым состоянием металла, имеющим место при достижении определенного значения потенциала, называемого потенциалом пассивации, и связанного с образованием на поверхности анода защитных пленок.
Пассивность в определенных условиях наблюдается у титана, алюминия, хрома, молибдена, магния, никеля, кобальта, железа и некоторых других металлов. Пассивность металлов зависит как от внутренних факторов (состав, структура, состояние поверхности), так и от внешних факторов (состав и концентрация электролита, температура, движение раствора, наложение внешнего тока и т.д.).
Ввещества, способствующие переходу металла в пассивное состояние, называются пассиваторами.К пассиваторам относятся такие окислители, какHNO3, NaNO3, NaNO2, K2CrO7, O2и др.
Пассивное состояние может сохраняться и после изменения внешних условий, вызвавших пассивацию.
Депассивирующими факторами при коррозии металлов, нарушающими пассивное состояние металла, являются: действие некоторых восстановителей, например H2, Na2SO3и др. некоторых ионов, например,CI — , Br — , I — , 
Катодная поляризация при коррозии металлов может быть вызвана:
перенапряжением катодной реакции (присоединение электронов окислителем на катод происходит медленнее, чем образование электронов на аноде; электроны накапливаются у катода, сдвигая его потенциал в отрицательную сторону),
замедленностью диффузии окислителя из объема электролита к катоду.
Поляризация тормозит коррозионные процессы, и если бы этот процесс не имел бы места в реальных условиях, многие металлы потеряли бы свое техническое значение.
Любые процессы, уменьшающие явление поляризации, называются процессами деполяризации, а вещества ее вызывающие-деполяризаторами.Деполяризация ускоряет коррозионные процессы.
В зависимости от среды различают процессы коррозии, протекающие:
а) с водородной деполяризацией,
б) с кислородной деполяризацией.
Наиболее распространена коррозия с кислородной деполяризацией, которая имеет место в нейтральных, щелочных и слабокислых средах. Примером коррозии с кислородной деполяризацией может служить коррозия углеродистой стали в атмосферных условиях. В этом случае на поверхности металла находится пленка влаги, образованная за счет атмосферных осадков или конденсации паров из воздуха. Установлено, что для протекания коррозии по электрохимическому механизму достаточно слоя электролита толщиной всего 40-50 молекул. В воде растворяются O2, CO2, SO2, соли и др., что повышает электропроводность электролита. Сталь содержит в своем составе зерна карбида железа (Fe3C), выполняющие функцию микрокатодов (рис.22).
На анодных участках (железо) происходит процесс окисления, при этом железо переходит в виде ионов в раствор:
Так протекает реакция ионизации кислорода в нейтральных или щелочных средах. В кислых средах кислородная деполяризация протекает по уравнению:
При коррозии имеют место вторичные процессы, при которых ионы железа с ионами гидроксила образуют гидроксид железа (П), который далее окисляется кислородом до гидроксида железа (III):
Частично теряя воду, этот гидроксид образует ржавчину переменного состава:
Рис. 3. Схема коррозии стали с кислородной деполяризацией в нейтральной среде.
Катодный процесс коррозии с кислородной деполяризацией состоит из нескольких стадий:
растворение кислорода воздуха в электролите,
диффузия кислорода к катодным участкам коррелирующей поверхности,
Обычно наиболее замедленной стадией является диффузия кислорода к поверхности металла, поэтому аэрация сильно сказывается на скорости коррозии. Однако, при больших скоростях подвода кислорода к корродирующей поверхности наиболее медленной стадией становится ионизация кислорода и в этом случае большое значение имеет перенапряжение ионизации кислорода.
Скорость коррозионного процесса определяется скоростью наиболее заторможенной стадии, поэтому эта стадия называется лимитирующей стадиейиликонтролирующим фактором.
Таким образом, перенапряжение выделения водорода является фактором, тормозящим разрушение металла.