какие кости образуют латеральную стенку глазницы
Анатомия: Полость носа (cavum nasi). Стенки полости носа, носовые ходы и их сообщения
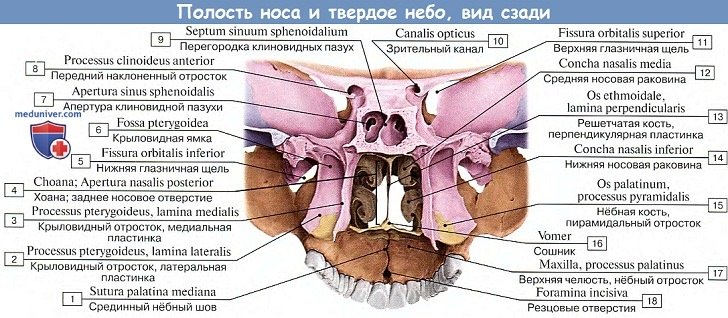
Полость носа (cavum nasi), занимающая центральное положение в лицевом черепа, спереди открывается грушевидной апертурой (apertura piriformis), ограниченной носовыми вырезками (правой и левой) верхних челюстей и нижним краем носовых костей. В нижней части грушевидной апертуры выступает вперед передняя носовая ость (spina nasalis anterior), продолжающаяся кзади в костную перегородку носа.
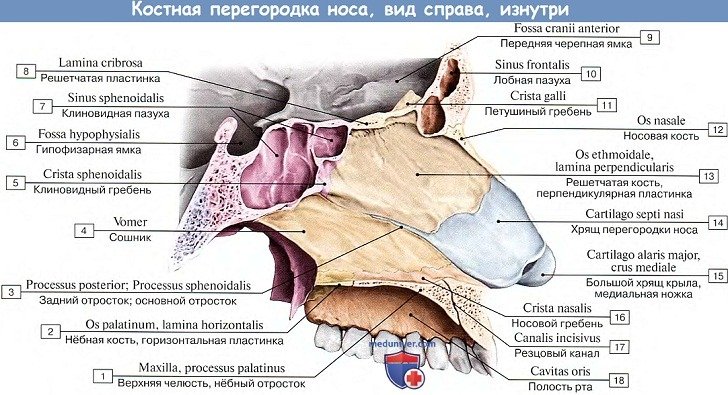
Костная перегородка носа (septum nasi osseum), образованная перпендикулярной пластинкой решетчатой кости (lamina perpendicularis ossis ethmoidalis) и сошником (vomer), расположенным внизу на носовом гребне, делит полость носа на две половины (рис. 70). Задние отверстия полости носа, или хоаны (choanae), сообщают полость носа с полостью глотки. Каждая хоана ограничена с латеральной стороны медиальной пластинкой крыловидного отростка (lamina medialis processus pterygoidei), с медиальной — сошником, сверху — телом клиновидной кости (corpus ossis sphenoidalis), снизу — горизонтальной пластинкой нёбной кости (lamina horizontalis ossis palatini).
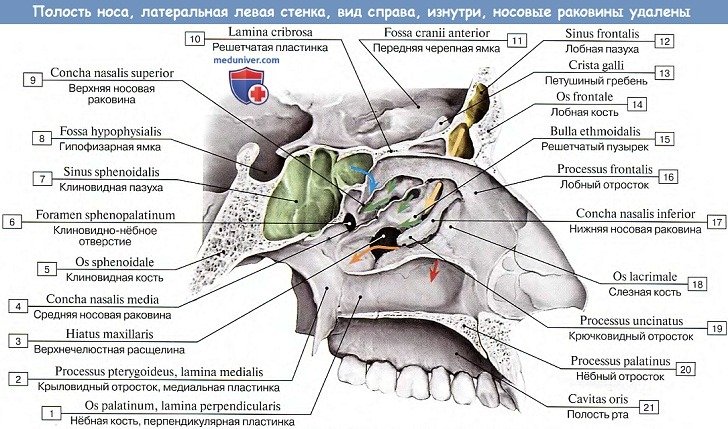
Полость носа имеет три стенки: верхнюю, нижнюю и латеральную.
Верхняя стенка полости носа (paries superior) спереди образована носовыми костями, носовой частью лобной кости, сзади — решетчатой пластинкой решетчатой кости и нижней поверхностью тела клиновидной кости. Сверху в носовую полость свисают ячейки решетчатой кости.
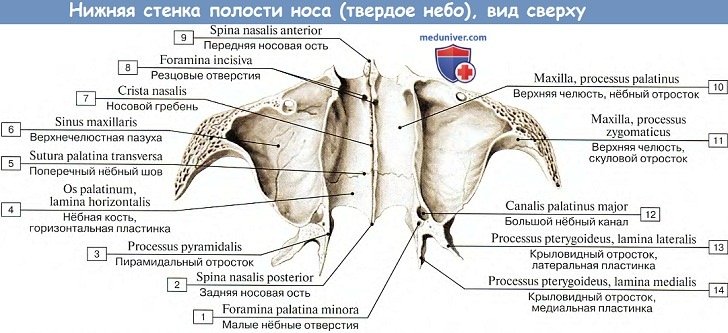
Нижняя стенка полости носа (paries inferior) сформирована нёбными отростками верхних челюстей и горизонтальными пластинками нёбных костей. По срединной линии эти кости образуют носовой гребень (crista nasalis), к которому присоединяется костная перегородка носа, являющаяся медиальной стенкой для правой и левой половин полости носа.
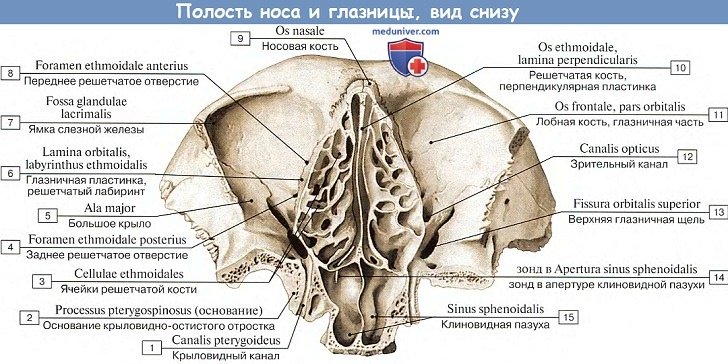
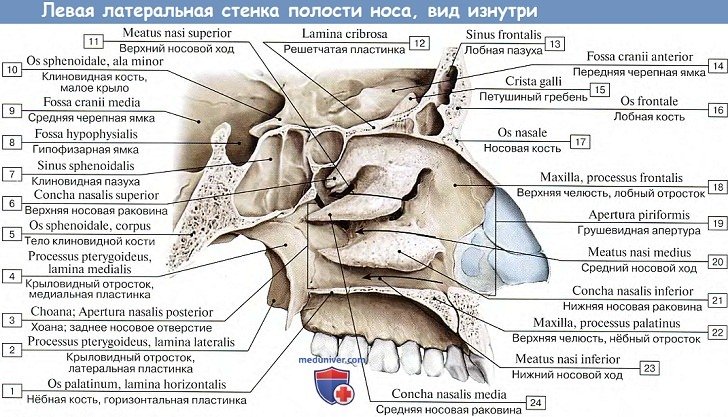
Латеральную стенку полости носа (paries lateralis) образуют носовая поверхность тела и лобный отросток верхней челюсти, носовая кость, слезная кость, решетчатый лабиринт решетчатой кости, перпендикулярная пластинка нёбной кости, медиальная пластинка крыловидного отростка клиновидной кости.
На латеральной стенке полости носа выступают три изогнутые костные пластинки — носовые раковины, расположенные одна над другой.
Верхняя и средняя носовые раковины принадлежат решетчатому лабиринту, а нижняя носовая раковина (concha nasalis inferior) — самостоятельная кость.
Над верхней носовой раковиной может располагаться самая верхняя носовая раковина (concha nasalis supreme) — Санториниева раковина — непостоянная тонкая костная пластинка, расположенная на медиальной стенке лабиринта решетчатой кости (Санторини Джованни, (Santorini Giovanni Domenico, 1681—1737) — итальянский анатом).
Носовые раковины разделяют боковой отдел полости носа на три узкие продольные щели — носовые ходы: верхний, средний и нижний. Эти структуры имеют важное клиническое значение, так как в них часто развиваются воспалительные процессы (синуситы, этмоидиты). Верхний носовой ход (meatus nasi superior) находится между верхней носовой раковиной (concha nasalis superior) — Морганиевой раковиной — сверху и средней носовой раковиной (concha nasalis media) снизу (Морганьи Джованни (Morgagni Giovanni Battista, 1682—1771) — итальянский анатом и врач). В этот короткий носовой ход, расположенный в задней части полости носа, открываются задненижние и передние ячейки решетчатой кости. Пазухи воздухоносных костей открываются в носовую полость.
Средний носовой ход (meatus nasi medius) располагается между средней и нижней носовыми раковинами. Он значительно длиннее и шире верхнего носового хода. В средний носовой ход открываются передние и средние ячейки решетчатой кости, апертура лобной пазухи посредством решетчатой воронки и полулунная расщелина (hiatus semilunaris), ведущая в верхнечелюстную пазуху (sinus maxillaris) — Гайморову пазуху (Гаймор Натаниэль (Highmore Nathaniel, 1613—1685) — английский врач и анатом).
Через находящееся позади средней носовой раковины клиновидно-нёбное отверстие (foramen sphenopalatinum) средний носовой ход сообщается с крыловидно-нёбной ямкой, из которой в носовую полость проникает клиновидно-нёбная артерия и нервы (носовые ветви крылонёбного узла).
Нижний носовой ход (meatus nasi inferior) — самый длинный и самый широкий, ограничен сверху нижней носовой раковиной, а снизу — твердым нёбом (носовой поверхностью нёбного отростка верхней челюсти и горизонтальной пластинки нёбной кости). Латеральную стенку нижнего носового хода образует нижняя часть стенки верхнечелюстной (гайморовой) пазухи. В передний отдел нижнего носового хода открывается носослезный канал, начинающийся в глазнице (ямке слезного мешка) и содержащий носослезный проток.
Узкая сагиттально расположенная щель, ограниченная перегородкой полости носа с медиальной стороны и носовыми раковинами, составляет общий носовой ход (meatus nasi communis).
В области ниши круглого окна барабанной полости среднего уха имеется щель Гиртля (Йозеф Гиртль (Hyrtl Joseph, 1811—1894) — австрийский анатом), располагающаяся параллельно канальцу улитки, которая может оставаться открытой в первые месяцы жизни ребенка, а в случае возникновения гнойного отита через нее возможен затек гноя в область латерального треугольника шеи с образованием абсцесса.
Важным топографическим ориентиром является линия Гиртля (син.: лицевая линия, linea facialis), направленная вертикально, соединяющая надглазничное, подглазничное и подбородочное отверстия, которые являются местами выхода ветвей тройничного нерва в передней области лица.
Зачаток лобной пазухи появляется на первом году жизни, на третьем году жизни начинает формироваться клиновидная пазуха. Верхнечелюстная пазуха начинает формироваться на пятом-шестом месяце внутриутробной жизни (у новорожденного имеется только эта пазуха размером с горошину) — в таблице ниже.
Какие кости образуют латеральную стенку глазницы
ВЧП — верхнечелюстная пазуха
ВСТ — волокнистая соединительная ткань
РФКТ — ретикулофиброзная костная ткань
ПКТ — пластинчатая костная ткань
МСКТ — мультиспиральная компьютерная томография
Перелом стенки глазницы — распространенная патология, частота которой составляет от 18 до 80% среди всех черепно-мозговых травм [1, 2]. Перелом нижней стенки глазницы (типа blow-out) встречается в 15—20% всех орбитальных переломов [3, 4]. Восстановление нижней стенки глазницы является сложной и актуальной клинической проблемой, находящейся на стыке нескольких специальностей: оториноларингологии, офтальмохирургии и челюстно-лицевой хирургии. Выбор тактики ведения больных с указанной патологией определяется многими факторами: размерами дефекта, наличием пролапса содержимого орбиты в верхнечелюстную пазуху (ВЧП) или защемления глазодвигательных мышц (нарушения со стороны органа зрения, длительность периода, прошедшего с момента травмы), наличием энофтальма (нарушения подвижности глазного яблока) и др. [5, 6]. Повреждение нижней стенки глазницы обычно подтверждается компьютерной томографией, которая дает возможность оценить состояние костных структур орбиты, размер и местоположение дефекта, а также позволяет измерить любое смещение костных стенок и мягких тканей глазницы для выбора оптимального способа хирургического лечения [3, 7—9].
Известно, что раннее выполнение оперативного вмешательства улучшает прогноз для больного. Несмотря на то, что хирургическую реконструкцию дефекта нижней стенки орбиты можно отложить, при повреждении типа blow-out существует риск защемления мышц, при котором необходимо выполнить экстренное оперативное вмешательство [5, 6]. Для восстановления нижней стенки глазницы применяются различные материалы, в том числе титановые конструкции и разные варианты костных трансплантатов, однако экспериментальное обоснование по их применению отсутствует [2, 10—13].
Цель исследования — представить экспериментальное и клиническое обоснование применения нетканной титановой конструкции и аллогенного деминерализованного костного трансплантата для восполнения дефекта нижней стенки глазницы.
Материал и методы
На базе отдела морфологии ФГБУ «Всероссийский центр глазной и пластической хирургии» Минздрава России (Уфа) были выполнены экспериментальные исследования на 24 полуторагодовалых кроликах породы шиншилла обоего пола. У лабораторных животных стоматологическим бором моделировали дефект стенки ВЧП диаметром 4 мм. Ранее экспериментальным путем было установлено, что данный размер дефекта не замещается костной тканью самопроизвольно. Затем производили закрытие костного дефекта с помощью конструкции на основе пористого титана (n=12), аллогенного деминерализованного костного трансплантата (n=12) по технике press-fit («заглушка»), после чего выполняли послойное ушивание мягких тканей над областью пластики.
Разработанные технологии закрытия дефектов нижней стенки глазницы применяли в соответствии с регистрационным удостоверением №ФСР 2011/12012 от 30.09.11. С использованием данных технологий нами были прооперированы 15 пациентов с дефектами нижней стенки глазницы.
В тканевом банке ФГБУ «Всероссийский центр глазной и пластической хирургии» Минздрава России (Уфа) производятся аллогенные трансплантаты костного происхождения «Аллоплант» (ТУ 9398−001−04537642−2011), адаптируемые под размер дефекта нижней стенки глазницы. При обширных (более 3 см) дефектах верхней стенки ВЧП (n=7, или 47%) использовали нетканую титановую конструкцию производства ООО «Прототип» (Самара; ТУ 9437−002−01963143−2010).
Результаты
Применение нетканной титановой конструкции. Через 2 мес после имплантации титановой конструкции на гистологических препаратах выявлялся регенерат, представленный комплексом костных тканей, замещающих дефект.
Перифокальная зона, непосредственно прилежащая к титановой конструкции, была образована из незрелой грубоволокнистой костной ткани, состоящей из крупнопетлистых тонких трабекул. В межтрабекулярных пространствах выявлялась рыхлая волокнистая соединительная ткань (ВСТ), инфильтрированная фибробластами. В ней были обнаружены развитая сеть кровеносных сосудов, жировая ткань и клетки костного мозга. В полостях центральной зоны регенерата наблюдались мелкоячеистые (наноструктурированные) полые структуры, которые состояли из множества округлых ячеек, сгруппированных между собой в кластеры. Гематоксилином и эозином прокрашивались в розовый цвет только стенки ячеек, просветы были свободные. Данные образования не вызывали выраженной воспалительной реакции, однако в костных полостях они покрывались тонкой соединительнотканной капсулой.
В дальнейшем объем коллагеновых волокон увеличивался, петли титана обрастали рыхлой соединительной тканью с небольшим количеством фибробластов, макрофагов и полностью погружались в волокнистый матрикс. Рыхлая ВСТ постепенно трансформировалась в плотную неоформленную соединительную ткань с толстыми пучками коллагеновых волокон, редуцированными кровеносными сосудами. Происходила остеоинтеграция: миграция остеогенных клеток со стороны материнской кости и минерализация коллагеновых волокон, образовавшихся вокруг петель титана (рис. 1). 
При этом петли титана оказывались в толще костного матрикса. Вокруг кластеров титана в кости определялись зоны активного аппозиционного костеобразования. Каналы выстилали активные остеобласты II типа, расположенные плотно друг к другу в один ряд и синтезирующие остеоид и костный матрикс. Сами ячейки титана приобретали более плотную структуру, между ними определялась ВСТ с утолщенными коллагеновыми пучками. При окраске гематоксилином и эозином просветы ячеек окрашивались ацидофильно в розовый цвет и базофильно — в голубой. Некоторые ячейки теряли свою первоначальную структуру и были деформированы. Их стенки лизировались, гомогенизировались и представляли собой плотную бесформенную массу (рис. 2). 
В глубокой зоне костного регенерата, непосредственно прилегающей к материнской кости, выявлялись признаки последовательной трансформации грубоволокнистой незрелой кости в зрелую пластинчатую кость. По всей окружности дефекта определялась тонкая неравномерная полоса зрелой губчатой костной ткани с многочисленными костными лакунами, заполненными остеоцитами. Утолщенные костные трабекулы постепенно созревали в пластинчатую кость с характерной структурой. В костном матриксе пластинчатой кости обнаруживалась развитая сеть гаверсовых каналов, заполненных рыхлой соединительной тканью с кровеносными сосудами.
Таким образом, репаративное костеобразоование происходило центростремительно — от периферии к центру (аппозиционный остеопоэз). Причем скорость процессов остеогенеза и биодеградации титана была различной — темп деструкции имплантата оказался ниже. Механизм остеогенеза представлен интрамембранозным окостенением, т. е. костеобразование происходило через стадию формирования ВСТ с постепенной трансформацией в грубоволокнистую костную ткань и дальнейшим преобразованием в пластинчатую кость. Титановая конструкция не вызывает бурной воспалительной реакции и не обладает иммуногенной активностью, но окружающие ткани реагируют на имплантат как на инородное тело — происходит его инкапсулирование и развитие фиброза.
Применение деминерализованного костного трансплантата. Несколько иные механизмы заместительной регенерации были обнаружены в области имплантации деминерализованного костного трансплантата в трепанационный дефект переднелатеральной стенки ВЧП. В ранние сроки (на 14-е сутки) в области трансплантации определяется полиморфноклеточная инфильтрация. При этом в инфильтрате верифицируются клетки фибробластического, остеобластического и макрофагального дифферонов. Важно подчеркнуть отсутствие в составе клеточного инфильтрата представителей лимфоцитарного дифферона и сегментоядерных лейкоцитов, что свидетельствует об отсутствии гнойной инфекции в зоне подсадки аллогенного трансплантата.
На 45-е сутки деминерализованный костный трансплантат подвергается интенсивной деградации и лизису, о чем свидетельствует изменение его тинкториальных свойств. Однако на данном сроке деминерализованный костный трансплантат все же сохраняет значительную часть объема (рис. 3). 
Процессы резорбции превалировали над синтетической активностью фибробластов и остеобластов, поэтому на 45-е сутки формирующийся регенерат имел незначительные включения костной ткани и на 36,48±4,81% был представлен рыхлой ВСТ.
Далее (90-е сутки) происходит дальнейшая деградация аллогенного костного трансплантата. Большая часть костного биоматериала замещена новообразованной ретикулофиброзной костной тканью (РФКТ). Выраженной инфильтрации макрофагами в области подсадки трансплантата не наблюдается. Скорость резорбции костного трансплантата преобладала над скоростью заместительного остеогенеза. Сам трансплантат частично сохранил структурную организацию пластинчатой костной ткани (ПКТ). Формирующийся регенерат представляет собой плотную оформленную ВСТ с относительно бόльшим, чем в окружающих тканях, количеством клеточных элементов и сосудов. При этом в регенерате менее выражены извилистость коллагеновых волокон и плотность их упаковки. В составе регенерата определялись включения РФКТ. Как показывает морфометрический анализ, костная ткань при этом составляет значительный объем от общей площади исследуемой области.
В результате слияния двух встречных фронтов замещения аллогенного биоматериала на 180-е сутки формируется непрерывный массив РФКТ с включениями ПКТ (см. таблицу). 
Приводим описание клинических наблюдений пластики нижней стенки глазницы деминерализованным костным трансплантатом и нетканной титановой конструкцией.
Клинический пример 1
Пациент С., 17 лет, обратился в нейрохирургическое отделение стационара медико-санитарной части «Нефтяник» с жалобами на диплопию, сохраняющуюся в течение 1 мес после тупой травмы глазницы справа. На мультиспиральной компьютерной томографии (МСКТ) околоносовых пазух и орбиты определяется дефект верхней стенки правой ВЧП с пролабированием параорбитальной жировой клетчатки в пазуху (рис. 4). 
Под общим обезболиванием совместно с нейрохирургом выполнена нижняя орбитотомия. Область дефекта верхней стенки ВЧП освобождена от рубцов, параорбитальная клетчатка смещена кверху. Проведена ревизия ВЧП через верхнюю стенку с использованием эндоскопа «Элмед» 70° диаметром 4 мм. В область дефекта установлен предварительно смоделированный фрагмент деминерализованного костного аллогенного трансплантата (рис. 5). 
На 7-е сутки была выполнена контрольная МСКТ, которая подтвердила стабильное положение аллогенного трансплантата, при этом наблюдался незначительный реактивный отек слизистой оболочки ВЧП со стороны вмешательства (рис. 6). 
Клинический пример 2
Пациент Ш., 18 лет, обратился в нейрохирургическое отделение стационара медико-санитарной части «Нефтяник» с жалобами на диплопию, сохраняющуюся в течение 2 нед после тупой травмы глазницы справа. На МСКТ околоносовых пазух и орбиты справа определяется дефект верхней стенки ВЧП с пролабированием параорбитальной жировой клетчатки в пазуху (рис. 7). 
Под общим обезболиванием совместно с нейрохирургом выполнена нижняя орбитотомия. Область дефекта верхней стенки ВЧП освобождена от рубцов, параорбитальная клетчатка смещена кверху. Проведена ревизия ВЧП через верхнюю стенку с использованием эндоскопа Элмед 70° диаметром 4 мм. В область дефекта установлена предварительно смоделированная нетканная титановая конструкция (рис. 8). 
Мягкие ткани ушиты послойно, на кожу нижнего века наложен косметический шов. В полость носа на 10 мин были введены марлевые турунды, пропитанные 0,1% раствором оксиметазолина. Затем под контролем торцевого жесткого эндоскопа Элмед диаметром 4 мм инфильтрировали слизистую оболочку полости носа (перед крючковидным отростком, у основания и передний конец средней носовой раковины) 1% раствором лидокаина с адреналином 1:100 000. Распатором провели щадящую медиализацию средней носовой раковины, с помощью разработанного инструмента для мобилизации крючковидного отростка выполнили расширение полулунной щели за счет медиального смещения крючковидного отростка.
На 2-е сутки была выполнена контрольная МСКТ, которая подтвердила стабильное положение нетканной титановой конструкции и отсутствие реактивных изменений слизистой оболочки ВЧП. Произведено снятие косметического шва на нижнем веке, зрачки на одном уровне. Пациент отмечает отсутствие диплопии.
Заключение
Целью лечения орбитального перелома помимо освобождения заключенных мягких тканей является восстановление анатомии глазницы и предотвращение серьезных риногенных внутриглазничных осложнений. Клиническая оценка в сочетании с соответствующим рентгенологическим исследованием прооперированных пациентов подтверждает эффективность и безопасность использования нетканной титановой конструкции и аллогенного деминерализованного костного трансплантата при реконструкции нижней стенки орбиты. На основании экспериментального исследования сделан вывод о том, что использование пористого титана предпочтительнее при больших дефектах нижней стенки орбиты. Это связано с более низким темпом деструкции имплантата по сравнению с костным трансплантатом. В целом же выбор способа реконструкции дефекта нижней стенки орбиты типа blow-out должен осуществляться с учетом опыта хирурга и наличия соответствующего материала.
Авторы заявляют об отсутствии конфликта интересов.
Концепция и дизайн исследования: Д.Щ., А.И.К., В.К.
Сбор и обработка материала: Д.Щ., А.Щ., А.С.К.