какие манипуляции возможны при стенозе фатерова сосочка
Какие манипуляции возможны при стенозе фатерова сосочка
Будзинский С. А., к. м. н.,
старший научный сотрудник научно-исследовательской лаборатории хирургической гастроэнтерологии и эндоскопии кафедры госпитальной хирургии № 2 лечебного факультета РНИМУ им. Н. И. Пирогова, старший ординатор отделения эндоскопии № 1 ГКБ № 31
Орлов С. Ю., к. м. н.,
заведующий отделением эндоскопии ГКБ № 4
Федоров Е. Д., д. м. н.,
профессор, главный научный сотрудник научно-исследовательской лаборатории хирургической гастроэнтерологии и эндоскопии РНИМУ им. Н. И. Пирогова
Бахтиозина Д. В.,
интерн кафедры госпитальной хирургии № 2 лечебного факультета РНИМУ им. Н. И. Пирогова
Шаповальянц С. Г., д. м. н.,
профессор, зав. кафедры госпитальной хирургии № 2 лечебного факультета РНИМУ им. Н. И. Пирогова
г. Москва
Аденомы большого дуоденального сосочка (БДС) составляют 1 % всех новообразований желудочно-кишечного тракта и являются потенциально злокачественными, в 15–30 % приводящими к развитию рака БДС [1].
В последние два десятилетия появился ряд работ, демонстрирующих высокую эффективность эндоскопических операций при аденомах БДС. Методики лечения в основном, представлены различными вариантами эндоскопической папиллэктомии [2].
В настоящее время эндоскопическая папиллэктомия в первую очередь показана пациентам с аденомами БДС низкой и высокой степенями дисплазии, а также раком in situ [3]. Это связано с небольшой частотой осложнений и летальности по сравнению с традиционными хирургическими методами лечения, а также экономической выгодой. В то же время при подобном подходе к лечению образований БДС существует целый ряд трудностей и ограничений. В первую очередь таковыми являются возможность нерадикального удаления аденомы БДС с риском ее рецидива [4]. Технически выполнение подобного вмешательства возможно в 98 % случаев, при этом единым блоком образование удалимо в 88,8 % наблюдений. [5]. Однако, даже после успешного эндоскопического удаления опухоли в 7,4 % — 14 % случаев при наличии опухолевых клеток в краях резекции требуется повторная полостная операция [6].
Наиболее частыми осложнениями эндоскопической папилэктомии, встречающимися в 4–29 % случаев, являются кровотечение из области операции, перфорация стенки даенадцатиперстной кишки (ДПК), острый холангит, острый постманипуляционный панкреатит (ОПМП) и формирование стриктуры терминального отдела главного панкреатического протока (ГПП) с развитием клинической картины хронического панкреатита (ХП) в отдаленные сроки [6,7].
В клинике госпитальной хирургии № 2 РНИМУ им. Н. И. Пирогова на базе 31 ГКБ с 01.2008 по 01.2015 выполнено 3107 оперативных ретроградных вмешательств на БДС. Эндоскопическое удаление образований БДС методом папиллэктомии было произведено в 16 случаях (0,5 %). При этом послеоперационное осложнение в виде кровотечения из области операции возникло в 1 случае (6,3 %). Еще в 1 наблюдении имело место развитие ХП на фоне стриктуры терминального отдела ГПП в отдаленные сроки.
Мы хотим представить одно из успешных клинических наблюдений радикального эндоскопического удаления аденомы БДС с высокой степенью дисплазии, а также интраоперационной коррекции возникших при данной операции осложнений.
У больного А., 66 лет при амбулаторном обследовании по данным УЗИ была выявлена дилатация общего желчного протока до 10 мм и панкреатического протока до 4 мм. При ЭГДС визуализировано полиповидное образование БДС, выполнена биопсия. При гистологическом исследовании полученный материал представлен тубулярной аденомой с дисплазией 1–2 степени. Неделю спустя пациент отметил пожелтение кожных покровов и был госпитализирован в ГКБ № 31 г. Москвы.
По результатам предоперационной диагностики в биохимическом анализе крови уровень общего билирубина составил 59 мкмоль/л, АЛТ — 92 е/л, АСТ — 101 е/л, щелочная фосфатаза — 285 е/л. При традиционном ультразвуковом исследовании выявлены признаки билиарной и панкреатической гипертензии (ширина общего желчного протока — 11 мм, ГПП — 4 мм) при отсутствии патологии со стороны желчного пузыря.
При эндоскопической ультрасонографии были подтверждены билиарная и панкреатическая гипертензия, а также выявлено образование БДС в виде гипоэхогенной структуры в области Фатерова сосочка, диаметром 18 мм, без распространения на терминальные отделы желчного и панкреатического протоков.
Таким образом, клинический диагноз был сформулирован следующим образом: тубулярная аденома БДС с билиарной и панкреатической гипертензией без распространения на терминальные отделы холедоха и ГПП, осложненная механической желтухой.
Учитывая предоперационные находки, больному было решено выполнить эндоскопическую папиллэктомию.
Целями эндоскопической процедуры были декомпрессия общего желчного и главного панкреатического протоков, лечение желтухи и собственно удаление аденомы.
Операция производилась под внутривенной седацией в условиях рентгенопрерационной. Первоначально была выполнена хромоскопия с использованием индиго-кармина для четкого определения границ образования и зоны резекции (Рис. 1)
Затем при помощи игольчатого папиллотома KD‑17Q‑1 (Olympus, Japan) произведена разметка краев резекции и выполнен циркулярный разрез. При этом отмечено возникновение струйного кровотечения из области разреза, которое с техническими трудностями было остановлено комбинированным способом путем инъекции р‑ра адреналина и точечной моноактивной коагуляцией сосуда (Рис. 2).
После этого по завершении циркулярного разреза, на аденому была наложена полипэктомическая петля и в смешанном режиме коагуляции и резания образование было удалено. Выполнена дополнительная канюляционная папиллосфинктеротомия. Кровотечения не было, однако, при ревизии области вмешательства в нижнем ее краю был обнаружен дефект стенки ДПК диаметром 2–3 мм. С целью закрытия перфорации было выполнено клипирование дефекта посредством наложения 2 клипс HX‑610–135 (Olympus, Japan) с достижением полной герметизации области перфорации (Рис. 3).
Затем с целью профилактики ОПМП и формирования стриктуры терминального отдела ГПП была произведена установка пластикового панкреатического стента диаметром 5 Фр типа PBD‑230–0704 (Olympus, Japan).
Послеоперационный период протекал гладко, панкреатический стент был удален на 4‑е сутки. Пациент был выписана из стационара на 5‑е сутки после операции.
По данным гистологического исследования операционного материала была выявлена тубулярно-ворсинчатая аденома высокой (2–3) степени дисплазии.
При контрольной дуоденоскопии и биопсии через 1 год данных за рецидив аденомы выявлено не было.
Таким образом, эндоскопическая папиллэктомия, являющаяся методом выбора в лечении доброкачественных новообразований БДС, обладает рядом серьезных, а иногда и фатальных осложнений. В то же время при их интраоперационном выявлении или развитии в раннем послеоперационном периоде, технически возможна и показана их эндоскопическая коррекция. При этом основными способами лечения при возникновении кровотечения являются инфильтрационный и коагуляционный методы, при перфорации — клипирование, а при развитии ОПМП — стентирование ГПП.
Список литературы:
1. Beger H. G., Staib L., Schoenberg M. H. Ampullectomy for adenoma of the papilla and ampulla of Vater// Langenbeck’s‑Arch Surg. 1998 Apr, 383 (2): 190–3,
2. Hirooka Y., Iton A., Goto H. EUS/IDUS And Endoscopic Papillectomy//Digestive Endoscopy 2004, 16 (Suppl.), S176‑S177
3. Attaallah, W. et al. Endoscopic snare excision of adenoma of the papilla of Vater without prophylactic pancreatic-duct stent. JOP. 2014 Nov 28;15 (6):587–90. doi: 10.6092/1590–8577/2639.
4. Moon J. H., Choi H. J., Lee Y. N. Current status of endoscopic papillectomy for ampullary tumors.. Gut Liver. 2014 Nov;8 (6):598–604. doi: 10.5009/gnl14099. Epub 2014 Nov 15.
5. De Palma G. D., et al. Endoscopic snare papillectomy: A single institutional experience of a standardized technique. A retrospective cohort study. Int J Surg. 2014 Dec 10;13C:180–183. doi: 10.1016/j. ijsu.2014.11.045.
6. Hauke S. Heinzow, Philipp Lenz et al. Feasibility of Snare Papillectomy in Ampulla of Vater Tumors: Meta-Analysis and Study Results from a Tertiary Referral Center. Hepato-Gastroenterology 2012; 59:332–335 doi 10.5754/ hge11414
7. Ismail, S. Marianne, U. et al. Endoscopic papillectomy, single-centre experience. Surg Endosc. 2014 Nov;28 (11):3234–9. doi: 10.1007/s00464–014–3596–5. Epub 2014 Jun 14.
Какие манипуляции возможны при стенозе фатерова сосочка
Известно, что изменения структуры БДС могут видоизменяться с учетом возрастных особенностей. По данным Пушкарского В.В. (2004) при желчнокаменной болезни в пожилом и старческом возрастах преобладают атрофическо-склеротическая форма хронического папиллита (до 54 % случаев), в возрасте до 60 лет преобладают гиперпластические (аденоматозные, аденомиоматозные) изменения БДС.
Повышенное внимание к острым и хроническим воспалительным изменениям БДС не случайно. По мнению Едемского А.И. (2002) острый и хронический папиллит наблюдается у 100% больных, страдающих желчнокаменной болезнью и у 89,6 % пациентов с рецидивирующим панкреатитом. Хронические воспалительные изменения сосочка подразделяют на три формы: аденоматозный хронический папиллит, аденомиоматозный и атрофическо-склеротическая форма хронического папиллита.
Анализ эндоскопического биопсийного и операционного материала поступившего в патологоанатомическое отделение ГКБ № 31 за период с 2002 по 2004 гг. показал, что морфологический спектр патологических изменений БДС чрезвычайно широкий. В случаях патологии желчевыводящих путей и поджелудочной железы, а также в пожилом и старческом возрастах в БДС наблюдаются выраженные как гиперпластические и метапластические, так и атрофические изменения желез сосочка вследствии воспалительных процессов: на ранних этапах возникает отек, острая воспалительная инфильтрация, в дальнейшем развивается гипертрофия, а затем деформация и атрофия клапанов. Значительную часть (379 наблюдений 87%) занимают воспалительные процессы, преимущественно хронического течения. Часто хронические папиллиты сопровождаются гиперпластическими изменениями различных структур элементов слизистой оболочки: клапанов, переходной складки, папиллярных желез. Большая доля представлена гиперпластическими полипами устья и интраампулярной части БДС (174 наблюдения 46%). Железисто-кистозная гиперплазия встретилась в меньшем количестве наблюдений (23 случая 6%). Среди хронических папиллитов наиболее часто встречающаяся форма атрофическо-склеротическая, за данный период времени она встретилась в 67 наблюдениях (40%). Аденомиоз относится к группе гетеротопических процессов и считают, что он развивается вследствие пермещения гиперплазированных желез в мышечный слой сосочка. В зависимости от особенностей строения различают три, последовательно развивающиеся гистологические формы: узловатая, являющаяся ранней фазой развития, узловато-диффузная и далее диффузная фрорма аденомиоза. По нашим данным аденомиоз встретился за истекший период всего в 11 наблюдениях (2%).
Ряд аспектов, касающихся морфологических особенностей БДС в полной мере не разработан. К их числу относится гистогенетическая и цитологическая квалификация его эпителиальных структур. Вопрос о дуоденальной или протоковой природе эпителия сосочка остается дискуссионным (Медведева М.С., Саввина Т.В. 1993г). Между тем, гистогенетическая принадлежность эпителия определяет биологические
свойства опухолей и опухолеподобных изменений, ранние стадии которых могут симулировать дисфункции БДС. Источником злокачественного роста могут быть слизистая оболочка дистального отдела холедоха, конечных отделов панкреатического протока, двенадцатиперстной кишки, эпителий самого БДС (Блохин Н.Н. с соавт., 1981, Шалимов С.А., 1985г). Первые две формы большинство морфологов относят к протоковому или панкреатобилиарному типу рака фатерова соска, остальные же к кишечному (Howe J.R. 1998, Ficher H.P., et al., 2003). На долю последних приходится 53-63% всех ампулярных неоплазм, протоковые же составляют 20-27% (Howe J.R., et al.,1998). Доминирующим гистологическим типом злокачественной опухоли БДС является простая аденокарцинома различной степени дифференцировки, на долю которой приходится до 70% всех случаев, причем в большинстве случаев карцинома БДС является высокоили умеренно дифференцированной.
По нашим данным эпителиальные новообразования БДС представлены папиллярными аденомами (21 наблюдение) из них 8 случаев (38%) с малигнизацией по типу аденокарциномы, преимущественно умеренной степени дифференцировки, а также аденокарциномами различной степени дифференцировки (26 наблюдений, из них умереннодифференцированные21 случай). Кроме того, в одном случае была диагностирована зернистоклеточная опухоль БДС.
Таким образом, патология БДС как воспалительного, так и опухолевого генеза приводит часто к тяжелым осложнениям, требующим нередко экстренного оперативного лечения. Одновременно крайне важна квалифицированная морфологическая диагностика патологического процесса данного анатомического образования играющего в последующем ведущую роль в выборе тактики и обьема хирургического вмешательства.
Какие манипуляции возможны при стенозе фатерова сосочка
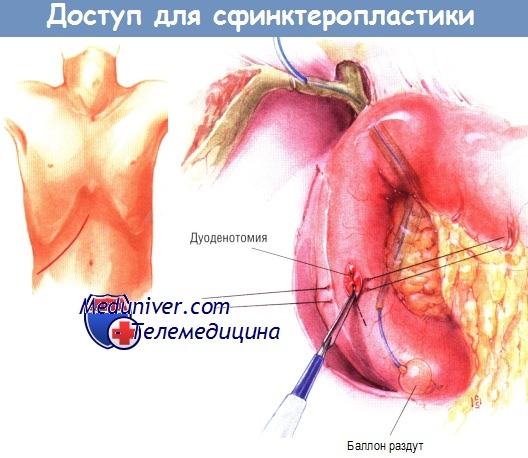
Обычно используют правосторонний подрёберный доступ. Если у больного сохранён желчный пузырь, выполняют холецистэктомию. После мобилизации желчного пузыря часто проводят холангиографию. Если принято решение сделать сфинктеропластику, на пузырном протоке создают небольшое отверстие, через которое в общий желчный проток вводят баллонный катетер, продвигаемый дистально через ампулу сосочка в двенадцатиперстную кишку.
Двенадцатиперстную кишку мобилизуют по Кохеру и после раздувания баллона пальпаторно идентифицируют большой дуоденальный сосочек. Над тем местом, где ощущается баллон, выполняют продольную дуоденотомию. Если желчный пузырь был удалён при предыдущей операции, хирург, выбирая место для дуоденотомии, старается нащупать ампулу через стенку двенадцатиперстной кишки. Если пропальпировать ампулу не удаётся, можно выполнить небольшую холедохотомию, через которую в дистальный отдел желчного дерева вводят дилататор Бейкса, продвигаемый через ампулу в двенадцатиперстную кишку.
На стенку кишки над ампулой накладывают швы-держалки шёлком № 3/0. После этого баллонный катетер втягивают выше ампулы, чтобы не прорезать его при дуоденотомии. Сам разрез на двенадцатиперстной кишке делают диатермокоагулятором. По завершении дуоденотомии ампулу можно легко найти, ориентируясь на баллонный катетер, выступающий из желчного дерева.
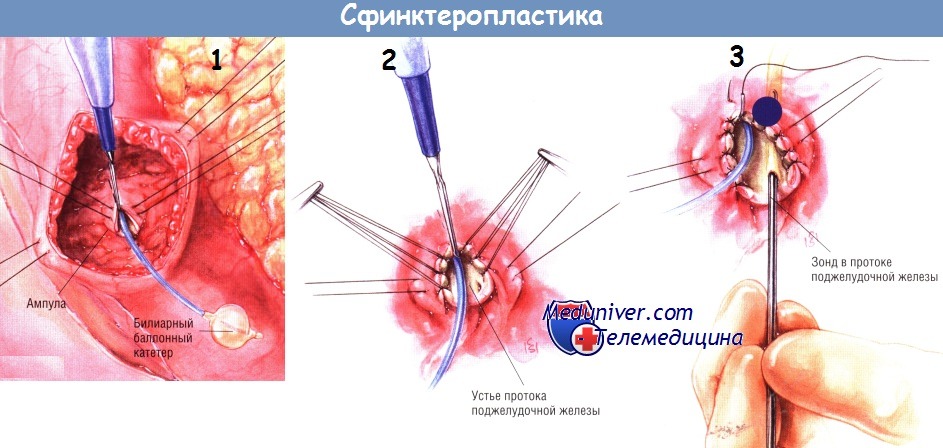
После того, как хирург чётко увидит ампулу, он для лучшей экспозиции может расширить разрез на стенке кишки в обоих направлениях. Фиброзно-мышечный слой ампулы фиксируют швами-держалками из синтетического рассасывающегося материала № 5/0, размещёнными на 3 и 9 ч условного циферблата.
Используя баллонный катетер как ориентир, диатермокоагулятором производят сфинктеротомию на 11 или 12 ч условного циферблата. За один приём отверстие соска расширяют на 3-4 мм. После того, как ампула будет раскрыта полностью, слизистые оболочки протока и двенадцатиперстной кишки соединяют серией одиночных швов из синтетического рассасывающегося материала № 5/0. Концы этих швов собирают в один пучок и захватывают в гемостатический зажим.
Их натягивание обеспечивает дальнейшую экспозицию зоны. Когда будет сделан первичный разрез на сфинктере, станет возможным найти устье панкреатического протока серебряным зондом. Сфинктеротомию, как правило, расширяют на длину 1-2 см с последующим наложением синтетических рассасывающихся швов № 5/0, сближающих слизистые оболочки протока и двенадцатиперстной кишки. Когда длина сфинктеротомии станет достаточной, накладывают последний шов на вершину разреза. Нет особых причин делать сфинктеротомию длиной больше диаметра общего желчного протока.
Длина разреза при сфинктеропластике варьирует в зависимости от причины, по которой делают операцию. Если хирург предпринял сфинктеропластику только для извлечения вколоченного желчного камня общего желчного протока, длина разреза должна быть такой, чтобы обеспечить «рождение» камня, но не больше. С другой стороны, если сфинктеропластику выполняют при значительном расширении общего желчного протока и есть опасность оставления «забытых» камней, либо если хирург делает операцию в связи с рецидивом холедохолитиаза, он может сделать разрез при сфинктеропластике длиной от 2 до 3 см.
Следует быть осторожным, чтобы не разрезать сфинктер выше той точки, где кончается общая стенка желчного протока и двенадцатиперстной кишки. Тем не менее при тщательном сопоставлении слизистых оболочек кишки и протока риск просачивания содержимого в забрюшинное пространство или в брюшную полость фактически исключён.
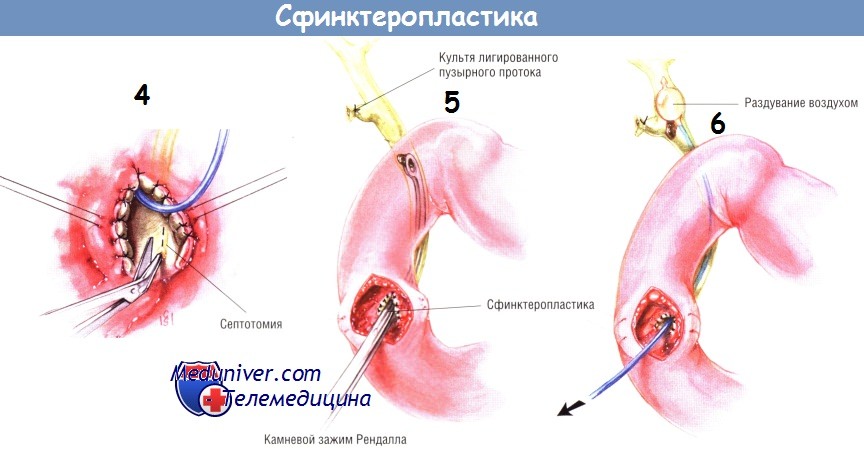
Если сфинктеропластику выполняют в связи с симптомами, свидетельствующими о поражении поджелудочной железы (стеноз устья протока поджелудочной железы), можно выполнить септотомию ножницами Потта. Разрез обычно можно продлить на 4-5 мм — до места утолщения септы, где расходятся в разные стороны панкреатический и желчный протоки. Некоторые хирурги также считают, что слизистые оболочки панкреатического и желчного протоков нужно сшивать рассасывающимися синтетическими нитями № 5/0 или 6/0.
По завершении сфинктеропластики баллонный катетер удаляют, выше и ниже отверстия на пузырный проток накладывают два зажима и пересекают его между ними. Извлекают желчный пузырь. Культю пузырного протока перевязывают шёлком № 2/0. Если потребовалась холедохотомия для введения расширителя Бейкса, следует установить Т-образный дренаж в общий желчный проток.
Когда на холангиограмме видны тени конкрементов в нормальном или узком протоке, мы выполняем сфинктеропластику для трансампулярной эксплорации общего желчного протока, чтобы избежать проблем, связанных с исследованием узкого протока через холедохотомический разрез. Проток можно исследовать теми же инструментами, что и при традиционной ревизии через холедохотомическое отверстие. Применяют камневые ложки, камневые щипцы Рендалла, промывание протока через эластический и баллонный катетер.
В конце процедуры не возникает проблем, связанных с установкой малого Т-образного дренажа в узкий проток. Кроме того, поскольку была сделана сфинктеропластика, не страшно, если какой-либо камень остался в желчном дереве, поскольку он сможет свободно выйти в кишечник.
Со стенки двенадцатиперстной кишки снимают латеральные швы-держалки, после чего другие фиксирующие швы (шёлк № 3/0) накладывают на углы разреза двенадцатиперстной кишки. Разрез можно закрыть как в продольном, так и в поперечном направлении. Обычно мы накладываем швы продольно. Швы — двухрядные, причём внутренний ряд — непрерывный, по методике Conn, синтетической рассасывающейся нитью № 3/0. Швы начинают с каждого угла и завязывают посредине. Наружный слой — ряд отдельных швов Ламбера шёлком № 3/0.
К области дуоденотомии можно подвести закрытый аспирационный дренаж из силиконизированного пластика. Он нужен в основном не из-за опасений несостоятельности швов на кишке, а для профилактики перитонита, если разрез при сфинктеропластике был продлён выше точки, где обосабливаются стенки желчных путей и двенадцатиперстной кишки.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Стенозирующий дуоденальный папиллит: этиология, диагностика, лечение.
Развитие стенозирующего дуоденального папиллита чаще всего связано с желчнокаменной болезнью, в первую очередь с холедохолитиазом. Ранение сосочка при прохождении камня, активный инфекционный процесс в складках и клапанном аппарате ампулы вызывают в дальнейшем развитие фиброзной ткани и стенозирование,с последующим нарушением оттока желчи.
Стеноз БДС представляет собой доброкачественное заболевание, обусловленное воспалительными изменениями и рубцовыми сужениями папиллы, которые вызывают непроходимость желчного и панкреатического протоков и связанные с этим патологические процессы в желчных путях и поджелудочной железе. В клинической практике под термином «стенозирующий дуоденальный папиллит» подразумевают: стеноз фатерова соска, стеноз дуоденального сосочка, стеноз терминального отдела общего желчного протока, стенозирующий оддит, фиброз сфинктера Одди, стеноз печеночно-панкреатической ампулы, то есть сужение ампулы БДС или сфинктера печеночно-панкреатической ампулы, а также прилегающего отдела общего желчного протока. БДС нередко называют пространством (зоной) Одди. Сужение пространства Одди возникает преимущественно за счет воспалительно-фиброзирующих процессов. Известно, что структура БДС может видоизменяться с учетом возрастных особенностей. По данным В. В. Пушкарского (2004), при желчнокаменной болезни в пожилом и старческом возрасте преобладает атрофическо-склеротическая форма хронического папиллита (до 54 % случаев), в возрасте до 60 лет — гиперпластические (аденоматозные, аденомиоматозные) изменения БДС.
Повышенное внимание к острым и хроническим воспалительным изменениям БДС не случайно. По мнению А. И. Едемского (2002), острый и хронический папиллит наблюдается у 100 % больных, страдающих желчнокаменной болезнью, и у 89, 6 % пациентов с рецидивирующим панкреатитом. Выделяют 3 формы хронических патологических изменений сосочка: аденоматозный хронический, аденомиоматозный и атрофическо-склеротический хронический папиллит.
БДС расположен на границе двух (общий желчный проток и двенадцатиперстная кишка), а иногда и трех (при впадении большого панкреатического протока в ампулу сосочка) полых систем. Патогенная микрофлора, колебания давления и рН, застой в этих двух или трех полостях способствуют развитию патологических изменений БДС. Несомненно, травмирует его также прохождение плотных структур, в первую очередь миграция камней по общему желчному протоку. Длина БДС обычно не превышает 5–10 мм. Внутри сосочка примерно в 85 % случаев располагается расширение общего желчного протока, которое обозначается как ампула сосочка. Примыкающая к сосочку терминальная часть общего желчного протока длиной в среднем около 1 см (0, 6–3 см) расположена внутри стенки двенадцатиперстной кишки и называется интрамуральным сегментом протока. Этот сегмент в физиологическом плане составляет единое целое с БДС. Полость БДС вместе с терминальной частью общего желчного протока обозначают как пространство Одди.
Запирающий аппарат БДС — сфинктер Одди — состоит: 1) из сфинктера собственно дуоденального сосочка, так называемого сфинктера Вестфаля, который представляет собой группу кольцевидных и продольных волокон, достигающих верхушки дуоденального сосочка; при сокращении сфинктер Вестфаля отграничивает полость сосочка от полости двенадцатиперстной кишки; 2) сфинктера общего желчного протока — по-видимому, наиболее мощного из этой группы сфинктеров — сфинктера Одди, достигающего в ширину 8–12 мм; проксимальная часть его нередко выходит за пределы стенки двенадцатиперстной кишки; при своем сокращении он отграничивает полость общего желчного протока (а иногда и панкреатического протока) от полости БДС; 3) сфинктера большого панкреатического протока, обычно развитого слабо, а иногда и полностью отсутствующего. Стенозирующий дуоденальный папиллит захватывает не только зону сфинктера Вестфаля и ампулу сосочка, но и нередко зону сфинктера общего желчного протока, т. е. всю зону Одди. Таким образом, стенозирующий дуоденальный папиллит представляет собой в какой-то мере собирательное понятие, которое охватывает по крайней мере два патологических процесса: 1) стеноз протока в зоне ампулы БДС; 2) стеноз терминальной (в основном интрамуральной) части собственно общего желчного протока.
Значительная часть длительно существующих дискинезий сфинктера Одди по существу представляет собой начальную стадию стенозирующего дуоденального папиллита. При прямой трансдуоденальной эндоскопии тонкими (диаметром 2, 0–2, 1 мм) зондами у многих подобных больных определяются рубцовые изменения в зоне пространства Одди. Тесные анатомо-топографические взаимоотношения БДС с желчевыводящей системой и поджелудочной железой, а также зависимость функции БДС от состояния органов билиопанкреатодуоденальной зоны и патологических процессов, развивающихся в них, в значительной степени влияют на состояние БДС. Это приводит к тому, что специфические симптомы, характерные для заболевания самого БДС, выявить достаточно трудно. По этой причине патология БДС часто не диагностируется. Тем не менее главным симптомом, при котором врач должен думать о возможном патологическом процессе в БДС, является билиарная или панкреатическая гипертензия (возникновение желтухи или характерного для панкреатита болевого синдрома).
Заболевания БДС можно разделить на первичные и вторичные. К первичным заболеваниям относятся патологические процессы, локализующиеся в самом БДС: воспалительные заболевания (папиллит), доброкачественные и злокачественные опухоли. К вторичным заболеваниям БДС можно отнести камни ампулы БДС, стенозы БДС (как следствие желчнокаменной болезни), а также сдавление БДС вследствие патологического процесса, локализующегося в головке поджелудочной железы при панкреатите или опухоли. К вторичным заболеваниям БДС следует отнести нарушения функции сфинктерного аппарата БДС, возникающие на фоне язвенной болезни двенадцатиперстной кишки и дуоденостаза. Если патологический процесс в БДС развивается на фоне заболеваний органов желчевыводящей системы, клиническая картина проявляется симптомами, характерными для желчнокаменной болезни. В случаях когда патологический процесс в БДС является причиной развития воспаления поджелудочной железы, это сопровождается клиническими признаками панкреатита. В пользу того, что патологический процесс локализуется в БДС, может говорить появление желтухи. При этом отмечаются изменения окраски кала (серый, обесцвеченный) и мочи (моча цвета пива). Нарушение оттока желчи в двенадцатиперстную кишку может сопровождаться повышением температуры тела больного, что связано с развитием острого холангита. Стенозирующий дуоденальный папиллит — заболевание, нередко протекающее малосимптомно, а иногда и бессимптомно. Очень часто симптомы сужения БДС и терминального отдела общего желчного протока ошибочно связывают с другими патологическими процессами, в первую очередь с проявлениями собственно желчнокаменной болезни (камень общего желчного протока и др. ). Возможно, вследствие этих обстоятельств и трудностей в распознавании подчас достаточно грозное заболевание длительно не привлекало к себе заслуженного внимания. Стенозирующий дуоденальный папиллит был описан лишь в конце XIX в. как рубцовый стеноз сосочка, вызванный вклинившимся камнем. В 1926 году D. Dell Vail и R. Donovan сообщили о стенозирующем папиллите, не связанном с желчнокаменной болезнью, назвав его склероретрактильным оддитом. Как и во времена Лангебуха, стенозирующий дуоденальный папиллит продолжал рассматриваться как редкое казуистическое заболевание. Лишь в 1950–60-х годах положение изменилось. Использование внутривенной и операционной холангиографии, манометрии и радиометрических исследований позволило P. Mallet-Guy, J. Caroli, N. Hess и другим исследователям выявить широкое распространение этого заболевания, особенно при желчнокаменной болезни. Так, W. Hess из 1220 случаев заболеваний желчного пузыря и желчных путей отметил стеноз БДС в 29 %. При бескаменном холецистите стенозирующий дуоденальный папиллит наблюдался у 13 %, при холецистолитиазе — у 20 %, при холедохолитиазе — у 50 % больных. В последние два десятилетия с момента широкого распространения эндоскопических исследований, и в частности эндоскопической папиллосфинктеротомии, частота и клиническое значение этого заболевания стали совершенно очевидными. Появилась необходимость четко разделить стенозирующий и нестенозирующий (катаральный) дуоденальный папиллит.
Развитие стенозирующего дуоденального папиллита чаще всего связано с желчнокаменной болезнью, в первую очередь с холедохолитиазом. Ранение сосочка при прохождении камня, активный инфекционный процесс в складках и клапанном аппарате ампулы вызывают в дальнейшем развитие фиброзной ткани и стенозирование различных частей ампулы БДС или непосредственно прилегающей к ней части общего желчного протока, т. е. зоны Одди.
При калькулезном холецистите и особенно бескаменном холецистите развитие этого заболевания связано с хронической инфекцией, которая распространяется по лимфатическим путям. P. Mallet-Guy предположил, что в патогенезе папиллита важная роль принадлежит следующим механизмам: гипертонии сфинктера Одди, задержке эвакуации желчи в двенадцатиперстную кишку, активизации инфекционного процесса в области БДС, развитию воспалительного фиброза. Воспалительно-фиброзирующие процессы в БДС нередко возникают у больных с парафатеральным дивертикулом, некоторыми формами дуоденита, язвой двенадцатиперстной кишки. При язвенной болезни с локализацией язвы в двенадцатиперстной кишке и отчасти при дуодените в развитии стенозирующего дуоденального папиллита определенную роль играет пептический фактор. При нарушении процессов ощелачивания в вертикальной части двенадцатиперстной кишки, что подтверждается методом многоканальной рН-метрии, выявлялась травматизация БДС хлористоводородной кислотой. Именно пептический компонент во многих случаях является причиной болей у лиц, страдающих стенозирующим дуоденальным папиллитом, что и объясняет обезболивающий эффект антацидов и Н2-блокаторов. Травмированная слизистая оболочка БДС, включая ампулу, в последующем легко подвергается бактериальной инвазии, и развивается инфекционно-воспалительный процесс.
Как указывалось, стенозирующий дуоденальный папиллит во многих случаях является вторичным процессом, при котором в качестве первопричины заболевания рассматривается желчнокаменная болезнь. Первичный стенозирующий папиллит, при котором отсутствуют традиционные причины (желчнокаменная болезнь, парафатеральные дивертикулы и др. ), встречается, по-видимому, реже. По данным J. Caroli, такое развитие болезни наблюдается у 2–8 % больных. В последние годы частота первичных форм стенозирующего дуоденального папиллита увеличилась до 12–20 %. Гистологическая картина первичных форм заболевания идентична вторичным. Этиология первичных стенозов остается неясной. По морфологическим признакам можно выделить три основные формы стеноза БДС:
— воспалительно-склеротическая, отличающаяся разной степенью выраженности фиброза; на ранних стадиях — гипертрофия и дегенеративные изменения мышечных волокон клапанного аппарата БДС с наличием круглоклеточных инфильтратов, а также фиброзной ткани; в далеко зашедших случаях практически исключительно определяется фиброзная ткань;
— фиброкистозная форма, при которой наряду с явлениями фиброза определяется большое количество мельчайших кист, нередко представляющих собой резко расширенные периканаликулярные железки, сдавленные гипертрофированными мышечными волокнами;
— аденомиоматозная форма, характеризующаяся аденоматозной гиперплазией периканаликулярных желез, гипертрофией волокон гладкой мускулатуры, разрастанием фиброзных волокон (фиброаденомиоматоз), часто наблюдается у пожилых людей.
Клиническая картина болезни обусловлена степенью сужения желчевыводящих и панкреатических протоков, желчной и панкреатической гипертензией, присоединением инфекции, вторичным повреждением печени и поджелудочной железы. До сих пор неясно, почему у больных с почти одинаковыми анатомическими изменениями БДС и терминального отдела общего желчного протока в одних случаях постоянные мучительные боли наблюдаются ежедневно, в других — только при погрешностях в диете, а в третьих — отмечаются лишь незначительные эпизодические боли и изжога.
Наиболее частым симптомом стенозирующего дуоденального папиллита является боль. Обычно боль локализуется правее и выше пупка, иногда в эпигастральной области, особенно в правой ее половине. У небольшой части больных она мигрирует между правым подреберьем и эпигастральной областью. Можно выделить несколько видов боли: 1) дуоденального типа, когда больного беспокоит «голодная» или поздняя боль, нередко довольно длительная и монотонная; 2) сфинктерная — кратковременная схваткообразная, подчас возникающая с первыми глотками пищи, особенно при употреблении холодных шипучих напитков и крепленых вин; 3) собственно холедохеальная в виде сильной монотонной боли, появляющейся через 30–45 мин после еды, особенно обильной или богатой жиром. В тяжелых случаях боль отличается упорством, длительностью, часто сопровождается тошнотой и рвотой. Наиболее выраженный болевой синдром чаще наблюдается у больных со сравнительно незначительным расширением общего желчного протока до 10–11 мм. В редких случаях резкого расширения желчного протока (до 20 мм и более) болевой синдром выражен существенно слабее. Уже указывалось, что боли возникают и усиливаются после обильной, жирной пищи. Опасны в этом отношении тугоплавкие жиры (свиное, баранье, говяжье сало, жир осетровых пород рыб). Особенно опасно сочетание жира и теста — расстегаи, пироги с гусятиной, блины со сметаной; именно они нередко провоцируют резкое обострение болезни. Непереносимы для большинства больных холодные шипучие напитки. У части больных усиление болей вызывает теплый хлеб.
Более чем у половины больных наблюдаются различные проявления диспептического синдрома: тошнота, рвота, неприятный запах изо рта и изжога. У некоторых больных частые рвоты являются наиболее тягостным проявлением заболевания. После проведения эндоскопической папиллосфинктеротомии наблюдавшаяся ранее рвота, как правило, прекращается, тогда как боли в верхней половине живота лишь уменьшаются. Рвоту относят к характерным признакам стенозирующего дуоденального папиллита. В противоположность последнему, рвота очень редко наблюдается при неосложненных формах рака БДС. С нередким сопутствующим заболеванием — холангитом — связаны такие жалобы, как познабливание, недомогание, субфебрилитет. Потрясающие ознобы с приступообразным подъемом температуры встречаются реже, чем у лиц с камнем общего желчного протока. Легкую кратковременную желтуху наблюдают у трети больных. Яркая длительная желтуха в случае отсутствия сочетанных заболеваний (камень общего желчного протока, парафатеральный дивертикул и др. ) встречается нечасто. Также редко наблюдается прогрессирующее снижение массы тела. Нередко констатируется небольшое похудание на 2–3 кг. Пальпация эпигастральной области у большинства больных дает неопределенный результат. Лишь у 40–45 % больных удается выявить участок локальной (чаще малоинтенсивной) болезненности на 4–6 см выше пупка и на 2–5 см правее средней линии, примерно соответствующий зоне Шоффара. Периферическая кровь у большинства больных не изменена, лишь у 20–30 % при обострении болезни отмечается небольшой лейкоцитоз и еще реже — умеренное увеличение скорости оседания эритроцитов (СОЭ).
Присоединение холангита, особенно гнойного, влечет за собой появление лейкоцитоза с палочкоядерным сдвигом и значительным увеличением СОЭ. Аналогичные изменения отмечаются при развитии у больных стенозирующим дуоденальным папиллитом острого панкреатита. Задержка продвижения желчи по общему желчному протоку и большому дуоденальному сосочку относится к важным диагностическим признакам заболевания. В этом отношении помогают два метода. При кратковременных (0, 5–3 сут. ) нарушениях оттока желчи, наступающих вслед за употреблением значительных доз алкоголя или погрешностей в диете и, вероятно, связанных с усилением отека в зоне ампулы сосочка, наблюдается кратковременное, но значительное (в 5–20 раз) повышение активности глутаматдегидрогеназы, аминотрансфераз и амилазы сыворотки крови. Особенно отчетливо эти изменения регистрируются в первые 4–8 ч усиления болей. Подобные обострения болезни чаще возникают во второй половине дня или ночью. Одновременное умеренное повышение содержания билирубина сыворотки крови при таких кратковременных нарушениях оттока желчи наблюдается нечасто. При однократном экстренном заборе крови, произведенном в первые часы резкого усиления болей в животе, повышение активности ферментов выявляется у 50–60 % обследованных. При двукратном подобном исследовании выраженная гиперферментемия выявляется у 70–75 % обследованных.
При длительных стабильных нарушениях оттока желчи достаточно результативными являются радионуклидные методы. При проведении изотопной гепатографии у 50–60 % больных выявляется замедление поступления радионуклида в двенадцатиперстную кишку. При проведении холесцинтиграфии с использованием производных уксусной кислоты (препараты ХИДА, ИДА и др. ) умеренное замедление поступления радионуклида в двенадцатиперстную кишку отмечается у 65–70 % обследованных; у 7–10 % выявляется парадоксальное явление — ускоренное поступление небольших порций препарата в кишку, связанное, по-видимому, со слабостью системы сфинктеров БДС. В целом повторное экстренное исследование активности ферментов в начале резкого усиления болей и плановая холесцинтиграфия позволяют выявить у 80–90 % больных стенозирующим дуоденальным папиллитом симптомы задержки поступления желчи в двенадцатиперстную кишку (в сущности, симптомы острой и хронической желчной гипертензии).
Важное место в диагностике болезни занимают эндоскопический метод и сочетанные эндоскопически-радиологические (рентгенологические) методы исследования. При катаральном и стенозирующем папиллите сосочек нередко увеличен, достигая 1, 5 см. Слизистая оболочка гиперемирована, отечна. На вершине сосочка довольно часто виден воспалительный белесоватый налет. Характерным признаком стенозирующего папиллита считается уплощение сосочка. Уплощенный, сморщенный сосочек характерен для длительно текущего процесса.
Большую роль в разграничении катарального и стенозирующего папиллита нередко играют данные внутривенной холеграфии. При стенозирующем процессе у 50–60 % больных определяется, как правило, умеренное (10–12 мм) расширение общего желчного протока. Контрастное вещество задерживается в общем желчном протоке. У части больных удается выявить также воронкообразное сужение терминального отдела общего желчного протока. Иногда это сужение выглядит своеобразно — в виде писчего пера, перевернутого мениска и др. Изредка обнаруживается расширение ампулы БДС. Важные результаты обследования могут быть получены во время лапаротомии. Операционная холангиография, чаще выполняемая через культю пузырного протока, приносит результаты, близкие к данным эндоскопической ретроградной панкреатохолангиографии (ЭРПХГ). Нередко она выполняется в два приема. Сначала вводится 1/3 объема контраста и производится снимок. На нем обычно достаточно хорошо видны камни общего желчного протока. Затем вводится вторая, бульшая порция контраста. На снимке достигается тугое заполнение общего желчного протока, видны его сужение, задержка опорожнения. Мелкие камни в протоке при тугом заполнении часто невидимы. Манометрическое исследование общего желчного протока в основном производится во время операции, хотя в последние годы изготовлены специальные, приспособленные для манометрии зонды, которые вводятся трансдуоденально.
Бужирование БДС с диагностическими целями во время операции находит некоторое применение. В норме через зону Одди в двенадцатиперстную кишку относительно свободно проходит зонд диаметром 3 мм. Возможность введения зонда меньшего диаметра (2 мм или только 1 мм) свидетельствует о стенозирующем дуоденальном папиллите. Сама процедура бужирования достаточно травматична. Иногда она наносит тяжелую травму области дуоденального сосочка. Далеко не все хирурги охотно идут на это исследование.
ЭРПХГ играет важную роль в распознавании стенозирующего дуоденального папиллита. При выполнении катетеризации БДС нередко возникают затруднения. Часть из них при введении катетера в общий желчный проток может свидетельствовать о стенозирующем дуоденальном папиллите. Более того, при проведении катетера эндоскопист иногда довольно точно определяет длину участка сужения. Различная степень сужения пространства Одди наблюдается у 70–90 % больных. Определенную диагностическую роль играет задержка опорожнения контраста. При задержке более 45 мин можно говорить о стенозе или затяжном спазме зоны Одди. Дифференциальная диагностика. В первую очередь следует решить вопрос о возможном наличии камней в общем желчном протоке. Результаты УЗИ и внутривенной холеграфии при выявлении камней в крупных желчных протоках часто оказываются недостаточно надежными, поэтому в подобной ситуации необходимо проведение ЭРПХГ. Изредка, в случаях стойкой желтухи, приходится прибегать к чрескожной холангиографии. Среди других заболеваний общего желчного протока и прилегающих к нему органов с относительно сходной симптоматикой следует иметь в виду: 1) парафатеральный дивертикул; 2) индуративный панкреатит; 3) проксимально расположенные сужения общего желчного протока, в первую очередь в зоне впадения пузырного протока; 4) рак головки поджелудочной железы; 5) рак общего желчного протока; 6) первичный склерозирующий холангит.
Как первичный, так и вторичный склерозирующий холангит характерен обычно тем, что поражены внепеченочные и меньше — внутрипеченочные протоки, что регистрируется при ЭРПХГ в виде чередований сужений и расширений холедоха. В сомнительных случаях (а это бывает не так редко) ЭРПХГ приходится повторять, и второе прицельное исследование, как правило, дает определенный, почти однозначный результат. Как видно, в дифференциальной диагностике главную роль играет ЭРПХГ в сочетании с УЗИ и КТ.
Клиническое значение стенозирующего дуоденального папиллита. В большинстве случаев это заболевание находится как бы в тени другой патологии, которая рассматривается как основная. В первую очередь таким основным заболеванием является холедохолитиаз, несколько реже — холецистолитиаз. Не так редко стенозирующий дуоденальный папиллит оказывается в тени хронического бескаменного холецистита и парафатерального дивертикула. До известной степени эти четыре различных заболевания объединяет малая эффективность лечения при наличии у больных и папиллита. Удаление камней из желчного пузыря и общего желчного протока, санация бескаменного холецистита и парафатерального дивертикула часто оказываются малоэффективными, т. е. не уменьшают проявлений клинической симптоматики при терапевтическом игнорировании папиллита. Более чем у половины больных с постхолецистэктомическим синдромом симптоматика в основном или в значительной степени связана со стенозирующим дуоденальным папиллитом, который либо не был распознан, либо не был ликвидирован в период проведения холецистэктомии. Из двух болезней, которыми страдал больной, холецистэктомия решила вопрос лишь с одной из них. Неудивительно, что после холецистэктомии нередко папиллит протекает тяжелее, чем до операции. Перед плановой холецистэктомией опасность просмотра папиллита и холедохолитиаза делает необходимым выполнение дуоденоскопии и внутривенной холеграфии.
Лечение. Больные с наиболее тяжелыми формами стенозирующего дуоденального папиллита, протекающими с упорной болью, рвотой, повторной желтухой, похуданием, подлежат эндоскопическому или оперативному лечению. Как правило, им выполняется эндоскопическая папиллосфинктеротомия. Только в тех случаях, когда стеноз выходит за рамки пространства Одди, выполняется трансдуоденальная папиллосфинктеротомия с пластикой.
При более легких формах назначают консервативную терапию, которая включает диету № 5, антацидную терапию, при особенно упорных болях используют Н2-блокаторы; холинолитическую терапию — атропин, платифиллин, метацин, аэрон, гастроцепин; антибактериальную терапию.
Эндоскопическая папиллосфинктеротомия особенно показана при расширении общего желчного протока. Эффективность ее различна. Чаще болевой синдром уменьшается. Рвота, как правило, прекращается. Желтуха не рецидивирует. У больных с сохраненным желчным пузырем сразу же после вмешательства и в течение первого месяца сравнительно часто (до 10 %) развивается острый холецистит. Эта закономерность как бы подчеркивает связь патологических процессов в области БДС и желчного пузыря.
В период ремиссии больным папиллитом рекомендуется особый режим питания, который можно расценивать как поддерживающую терапию. Больным рекомендуются также ежедневная ходьба не менее 5–6 км, утренняя гимнастика без прыжков и упражнений для брюшного пресса. Желательно плавание. Питание не должно быть избыточным, следует следить за стабильностью массы тела. Питание должно быть частым: не менее 4 раз в сутки. Рацион желательно обогащать овощами и растительным маслом. Запрещаются тугоплавкие жиры, холодные шипучие напитки, острые приправы, жареные блюда. Особенно нежелательна обильная еда на ночь. При небольшом усилении тупых болей в правом подреберье, тошноты, изжоги рекомендуется курс лечения желчегонными средствами.
Таким образом, патология БДС часто приводит к тяжелым осложнениям, нередко требующим экстренного оперативного лечения. Одновременно крайне важна квалифицированная морфологическая диагностика патологического процесса данного анатомического образования, играющая в последующем ведущую роль в выборе тактики лечения и объема хирургического вмешательства.