какие металлы могут быть использованы в качестве анодного покрытия на стальном изделии
По механизму защиты различают анодные и катодные металлические покрытия. Металл анодных покрытий имеет электродный потенциал более отрицательный, чем потенциал защищаемого металла. В случае применения анодных покрытий не обязательно, чтобы оно было сплошным. При действии растворов электролитов в возникающим коррозионном элементе основной металл–покрытие основной металл является катодом и поэтому при достаточно большой площади покрытия не разрушается, а защищается электрохимически за счёт растворения металла покрытия. Примерами анодных покрытий являются покрытия железа цинком и кадмием. Анодные покрытия на железе, как правило, обладают сравнительно низкой стойкостью.
Катодные металлические покрытия, электродный потенциал которых более электроположителен, чем потенциал основного металла, могут служить надёжной защитой от коррозии только при условии отсутствия в них сквозных пор, трещин и других дефектов, так как они механически препятствуют проникновению агрессивной среды к основному металлу. Примерами катодных защитных покрытий являются покрытия железа медью, никелем, хромом и т. п.
Металл анодных покрытий имеет электродный потенциал более отрицательный (менее положительный), чем потенциал защищаемого металла.
Металл катодных покрытий имеет электродный потенциал менее отрицательный (более положительный), чем потенциал защищаемого металла.
В качестве анодного покрытия для железа могут выступать: цинк, магний, алюминий.
В качестве катодного покрытия для железа могут выступать: свинец, медь, золото.
Пример 3. Приведите пример анодной и катодной защиты железа от коррозии (метод металлических покрытий)



Для защиты металлов от коррозии применяют различные виды покрытий, в том числе и металлические. Металлические покрытия могут быть анодными и катодными, в зависимости от того, анодом или катодом будет покрытие металла в микрогальванической паре.
Анодным покрытием на железе будет металл, стоящий в ряду напряжений левее, т. е. с меньшим значением электродного потенциала, например, марганец (E 0 Mn = – 1,05 В, E 0 Fe = – 0,44 В).
В технике в качестве анодного покрытия на железе используется цинк (оцинкованное железо). Составим схему коррозии оцинкованного железа в кислой среде:
катод (Fe) – 2H + + 2 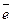
Чтобы покрытие было катодным, железо нужно покрыть металлом с большим значением электродного потенциала, например, оловом (железо луженое). Олово в паре с железом играет роль катода. Напишем схему коррозии луженого железа в кислой среде:
катод (Sn) – 2H + + 2 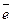
Как видно из приведенных примеров, если нарушается целостность покрытия анодного типа (оцинкованное железо), корродирует металл покрытия, а основной металл не разрушается. Если же нарушается целостность покрытия катодного типа, корродирует основной металл. Следовательно, анодное покрытие более надежно, чем катодное.
Катодное и анодное покрытия металлов как способ защиты их от коррозии
Решение задач по химии на защиту металлов от коррозии
При покрытии железа медью возникает коррозионная пара, в которой медь является катодом, а железо – анодом, так как железо имеет более отрицательный стандартный электродный потенциал (-0,44 В), чем медь (0,34 В). При этом будут протекать следующие электрохимические процессы:
а) Во влажном воздухе:
Так как ионы Fe 2+ с гидроксильной группой образуют нерастворимый гидроксид, то продуктом атмосферной коррозии железа будет Fe(OH)2. При контакте с кислородом воздуха Fe(OH)2 быстро окисляется до метагидроксида железа FeO(OH), приобретая характерный для него бурый цвет:
б) В хлороводородной (соляной) кислоте:
Таким образом, при покрытии железа медью при повреждении или при образовании пор разрушается основной металл – железо. Это пример катодного покрытия металла.
а) Во влажном воздухе:
Так как ионы Fe 2+ с гидроксильной группой образуют нерастворимый гидроксид, то продуктом атмосферной коррозии железа будет Fe(OH)2. При контакте с кислородом воздуха Fe(OH)2 быстро окисляется до метагидроксида железа FeO(OH), приобретая характерный для него бурый цвет:
б) В хлороводородной (соляной) кислоте:
а) Во влажном воздухе:
Так как ионы Pb 2+ с гидроксильной группой образуют нерастворимый гидроксид, то продуктом атмосферной коррозии свинца будет Pb(OH)2.
б) В хлороводородной (соляной) кислоте:
Таким образом, свинец является анодом в гальванической паре Fe — Pb, значит, это анодное покрытие. При анодном покрытии во время коррозии разрушается само покрытие, а основная конструкция не разрушается.
Коррозия (175)
1. Какие металлы могут быть использованы в качестве катодного покрытия на стальном изделии 1) Ag 2) Ni
2. Медное изделие, паянное серебром, эксплуатируется в растворе соляной кислоты. Является ли коррозионный процесс в этом случае термодинамически возможным? 2) нет
4. Какие металлы могут быть использованы в качестве протектора на стальном изделии.
1) магний 2) алюминий 3) медь 4) олово
5. Гальванопара образуется на поверхности оцинкованного железа в результате повреждения покрытия во влажной атмосфере воздуха. Указать продукты коррозии
6. Коррозионная гальванопара возникает при нарушении сплошности покрытия на никелированном стальном изделии во влажной атмосфере воздуха. Указать продукт коррозии. 1) Ni(OH)2 2) Fe(OH)2
7. Какие металлы могут быть использованы в качестве анодного покрытия на стальном изделии 1) Zn 2) Cr
3) Ni 4) Ag 5) Mn
8. В кислой среде или во влажной атмосфере воздуха более устойчив сплав цинка с медью 1) во влажной атмосфере воздуха 2) в кислой среде
9. С какой деполяризацией идет процесс коррозии сплава алюминия со ртутью в нейтральной водной среде 1) с водородной деполяризацией 2) с кислородной деполяризацией
10. С какой деполяризацией идет процесс коррозии чугуна во влажной атмосфере воздуха 1) с кислородной деполяризацией 2) с водородной деполяризацией
11. С какой деполяризацией идет процесс коррозии сплава меди с цинком в кислой среде 1) с водородной деполяризацией 2) с кислородной деполяризацией
12. Какие частицы являются деполяризаторами в процессе коррозии чугуна в кислой среде 1) H + 2) H2O 3) O2
13. Какие частицы являются деполяризаторами в процессе коррозии чугуна во влажной атмосфере воздуха 1) O2 2) H2O 3) H +
14. Какие частицы являются деполяризаторами в процессе коррозии сплава алюминия с ртутью в нейтральной водной среде без растворенного кислорода. 1) H2O 2) H + 3) O2
15. Указать продукты коррозии оцинкованного железа в соляной кислоте 1) ZnCl2 2) FeCl2 3) Zn(OH)2
16. Указать продукты коррозии луженого железа (контакт железа с оловом) в соляной кислоте 1) FeCl2 2) H2 3) Cl2 4) SnCl2 5) Fe2O3*xH2
17. Сплав меди со ртутью находится в кислой среде. Возможен ли при этом процесс коррозии. Указать знак изменения свободной энергии Гиббса 1) >0
18. Указать продукты химической коррозии алюминия 1) Al2O3 2) Al(OH)3 3) H2 4) H2O
26. Коррозионная гальванопара возникает на поверхности луженого железа (Sn-Fe) при нарушении сплошности покрытия в кислой среде. Указать продукты коррозии 1) FeCl2 2) H2 3) SnCl2 4) Sn(OH)2 5) Fe(OH)2 6) Fe2O3*xH2O
27. Коррозионная гальванопара возникает на поверхности магниево-алюминиевого сплава во влажной атмосфере воздуха в приморском районе ( учтите возможность попадания хлорид-ионов на поверхность металла). Указать продукты коррозии.
28. Какие металлы можно использовать в качестве катодного покрытия на стальном изделии. 1) Pb 2) Sr 3) Mn 4) Ag
29. Какие металлы можно использовать в качестве анодного покрытия на стальном изделии 1) Au 2) Al
3) Co 4) Ti
30. Расположить гальванопары в порядке увеличения разности потенциалов катодного и анодного процессов, протекающих в кислой среде 1) Cu-Fe 2) Cu-Cr 3) Cu-Al 4) Cu-Mg
31. В какой среде устойчивы легированные стали 2) во влажной атмосфере воздуха
32. Какая защита наиболее эффективна для защиты от коррозии морских судов
Дата добавления: 2015-04-20 ; просмотров: 38 | Нарушение авторских прав
Металлические защитные покрытия (анодные, катодные).



Неметаллические защитные покрытия. Электрохимические методы защиты от коррозии.
Методы защиты от коррозии можно объединить в следующие группы:
1) нанесение защитных покрытий и пленок;
2) изменение электрохимического потенциала защищаемого материала по отношению к среде на границе фаз;
3) модификация коррозионной среды.
Борьба с коррозией с применением защитных покрытий является наиболее распространенным способом. В качестве защитных применяют металлические и неметаллические покрытия.
Металлические покрытия могут быть выполнены из металла более или менее благородного, чем подложка. В связи с этим они делятся на две группы: катодные и анодные покрытия.
К катодным покрытиям относятся те покрытия, электрохимический потенциал которых в данных условиях больший, чем у защищаемого металла. На алюминий почти всегда наносят катодные покрытия. Покрытия из благородных металлов на стали имеют такой же характер. Катодные покрытия защищают металл только благодаря его изоляции от атакующей среды. Поэтому свою роль они выполняют только при наличии полной сплошности. Если в катодном покрытии образуется щель, то в условиях коррозии она становится катодом, а открытая часть защищаемого металла – анодным элементом. Анодная поверхность при этом значительно меньше, чем катодная. Электрохимическое разрушение металла концентрируется на небольшой поверхности. Учитывая опасности, кроющиеся в возможных несплошностях катодных покрытий, их делают сравнительно большой толщины.
Анодные покрытия – это покрытия, выполненные из металла, у которого электродный потенциал меньше, чем у защищаемого металла. Для железа, работающего в малокислых или нейтральных растворах, анодными покрытиями являются цинк, алюминий. Защитные свойства анодных покрытий состоят не только в механической изоляции металла от коррозионной среды. Они заключаются еще и в электрохимическом воздействии. В случае нарушения покрытия и образования коррозионного элемента, защищаемый металл, являющийся катодом, не разрушается. Небольшие несплошности в анодных покрытиях не опасны.
Металлические покрытия наносят электроосаждением, погружением в расплавленные металлы, металлизацией напылением, химическим осаждением солей, диффузией и т. д. В последнее время все большее распространение получает нанесение покрытий в вакууме.
Неметаллические покрытия применяются в случае возникновения химической реакции металла в соответствующих средах. К ним, в частности, относят оксидные алюминиевые покрытия, полученные в ходе специального электролитического процесса. Фосфатные покрытия применяются в большинстве случаев с дополнительными защитными средами, как, например, краски, лаки и т. п. Фосфатирование стали состоит в погружении изделия в разбавленный раствор фосфорной кислоты и кислых фосфатов цинка или магния. В результате реакции образуется нерастворимый фосфат железа, который в ходе процесса плотно покрывает поверхность металла. К этой же группе относят керамические покрытия и стекловидные эмали. Эти покрытия достаточно стойки к воздействию минеральных и органических кислот. Их недостатком является повышенная хрупкость и низкая стойкость в условиях резких перепадов температуры.
Одним из самых популярных способов защиты металла от коррозии является нанесение неметаллических составов. Это может быть пластик, керамика, каучук, битум, полиуретан, лакокрасочные составы и многое другое. Причем последние представляют собой наиболее широкий ассортимент и могут применяться в зависимости от условий среды, в которых будет использоваться изделие. Так выделяют лакокрасочные покрытия, устойчивые к действиям воды, атмосферы, химическим растворам и т. д.
К органическим покрытиям относятся разнообразные лакокрасочные материалы.
Знание механизма коррозии позволило создать методы коррозионной защиты путем наложения на металл такого потенциала, при котором он становится термодинамически устойчивым. К таким методам относятся катодная защита и уменьшение агрессивности среды, окружающей металлоконструкцию.
Катодная защита состоит в присоединении к защищаемой конструкции анода-протектора с более отрицательным электрохимическим потенциалом. Протектор (лат. protector – покровитель, защитник) и служит таким анодом, препятствующим разрушению защищаемого сплава; сам протектор при коррозии постепенно разрушается.
Протектором может являться любой металл, имеющий по отношению к данному сплаву более отрицательный потенциал. Однако разница в потенциалах не должна быть слишком большой, чтобы при электрохимическом процессе не происходило быстрого разрушения протектора.
Протекторы представляют собой обычно небольшие пластинки, присоединяемые к защищаемой детали заклепками или болтами. Катодную или протекторную защиту широко применяют при защите от морской и подземной коррозии металлоконструкций, коммуникаций, трубопроводов, сосудов и т. д. В качестве анодов-протекторов для защиты стальных изделий обычно применяют сплавы магния или цинка. Защита может также осуществляться присоединением защищаемого металла к отрицательному полюсу постоянного тока.
Для уменьшения агрессивности окружающей среды в нее вводят добавки, называемые ингибиторами коррозии, которые или способствуют пассивации металла, или значительно снижают скорость его коррозии. Условием использования ингибиторов является эксплуатация изделия в замкнутой среде постоянного состава.
Различают анодные и катодные ингибиторы. В качестве анодных ингибиторов коррозии используют различные вещества, образующие нерастворимые соединения на анодных участках. Одним из таких пассиваторов является хромпик К2Сr207, вводимый в количестве 2 – 3 г/л в раствор охлаждающей жидкости.
Катодные ингибиторы тормозят катодный процесс. К их числу относятся различные травильные присадки, добавляемые в количестве 1 – 2 % в кислоты для снятия окалины без разрушения основного металла.
Летучие ингибиторы, такие как нитрат натрия NaNO2, применяют для пропитки бумаги, в которую заворачивают детали, подлежащие хранению или транспортировке. Испаряясь, они насыщают окружающее детали пространство, создавая защитную газовую среду. Летучие ингибиторы отличаются высокой эффективностью. Стальные изделия, завернутые в бумагу, обработанную NaNO2, в условиях относительной влажности 85 % не ржавеют в течение 5 лет. Преимуществом летучих ингибиторов является отказ от применения защитных покрытий, удобство расконсервации и постоянная готовность деталей к немедленному использованию без дополнительной обработки.
Суть электрохимической защиты
К готовому металлическому изделию извне подключается постоянный ток (источник постоянного тока или протектор). Электрический ток на поверхности защищаемого изделия создает катодную поляризацию электродов микрогальванических пар. Результатом этого является то, что анодные участки на поверхности металла стают катодными. А вследствии воздействия коррозионной среды идет разрушение не металла конструкции, а анода.



