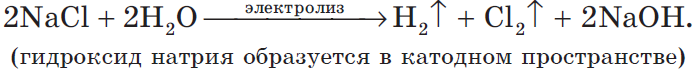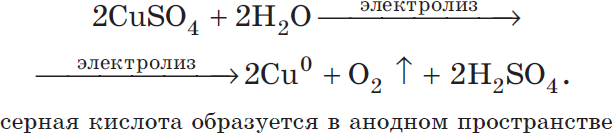какие металлы получают электролизом расплавов солей
Электролиз
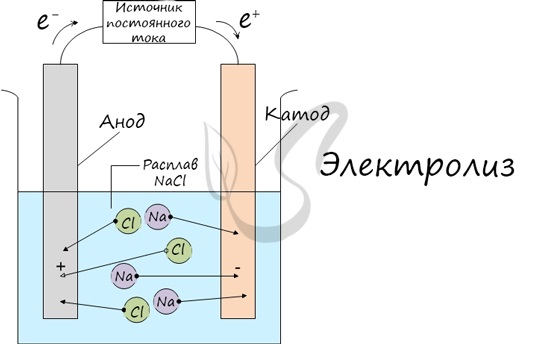
Процесс электролиза заключается в перемещении катионов (положительно заряженных ионов) к катоду (заряжен отрицательно), и отрицательно заряженных ионов (анионов) к аноду (заряжен положительно).
Итак, анионы и катионы устремляются соответственно к аноду и катоду. Здесь и происходит химическая реакция. Чтобы успешно решать задания по этой теме и писать реакции, необходимо разделять процессы на катоде и аноде. Именно так и будет построена эта статья.
Катод
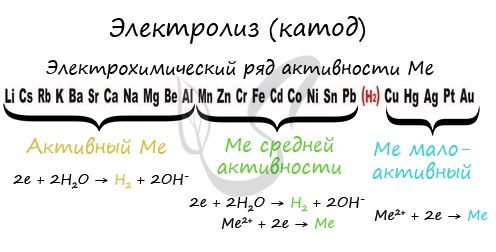
Чтобы установить, какая реакция идет на катоде, прежде всего, нужно определиться с активностью металла: его положением в электрохимическом ряду напряжений металлов.
Примеры решения
В процессе тренировки вам могут попадаться металлы, которые пропущены в ряду активности. На этапе обучения вы можете пользоваться расширенным рядом активности металлов.
Теперь вы точно будете знать, что выделяется на катоде 😉
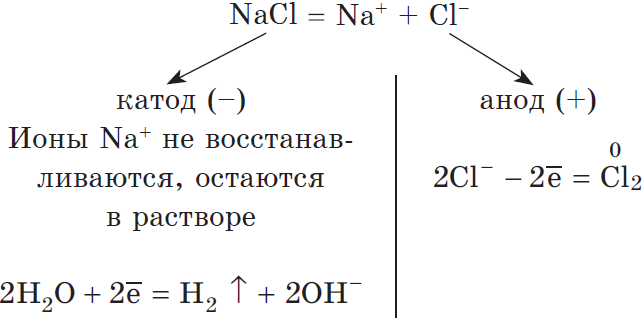
Итак, потренируемся. Выясним, что образуется на катоде и аноде при электролизе растворов AgCl, Cu(NO3)2, AlBr3, NaF, FeI2, CH3COOLi.
Иногда в заданиях требуется записать реакцию электролиза. Сообщаю: если вы понимаете, что образуется на катоде, а что на аноде, то написать реакцию не составляет никакого труда. Возьмем, например, электролиз NaCl и запишем реакцию:
NaCl + H2O → H2 + Cl2 + NaOH (обычно в продуктах оставляют именно запись «NaOH», не подвергая его дальнейшему электролизу)
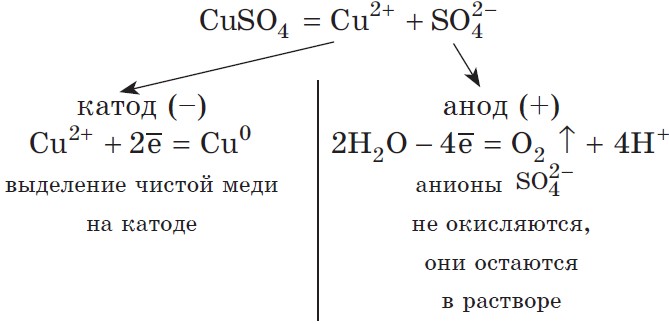
Запишем реакцию электролиза для CuSO4:
Медь относится к малоактивным металлам, поэтому сама в чистом виде выделяется на катоде. Анион кислородсодержащий, поэтому в реакции выделяется кислород. Сульфат-ион никуда не исчезает, он соединяется с водородом воды и превращается в серую кислоту.
Электролиз расплавов
Все, что мы обсуждали до этого момента, касалось электролиза растворов, где растворителем является вода.
Но как быть с активными металлами: Na, K, Li? Ведь при электролизе их растворов они не выделяются на катоде в чистом виде, вместо них восстанавливаются молекулы воды и выделяется водород. Тут нам как раз пригодятся расплавы, которые не содержат воды.
В безводных расплавах реакции записываются еще проще: вещества распадаются на составные части:
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Электролиз расплавов и растворов
Теория к заданию 22 из ЕГЭ по химии
Электролиз расплавов и растворов (солей, щелочей)
Если в раствор или расплав электролита опустить электроды и пропустить постоянный электрический ток, то ионы будут двигаться направленно: катионы к катоду (отрицательно заряженному электроду), анионы к аноду (положительно заряженному электроду).
На катоде катионы принимают электроны и восстанавливаются, на аноде анионы отдают электроны и окисляются. Этот процесс называют электролизом.
Электролиз — это окислительно-восстановительный процесс, протекающий на электродах при прохождении электрического тока через расплав или раствор электролита.
Электролиз расплавленных солей
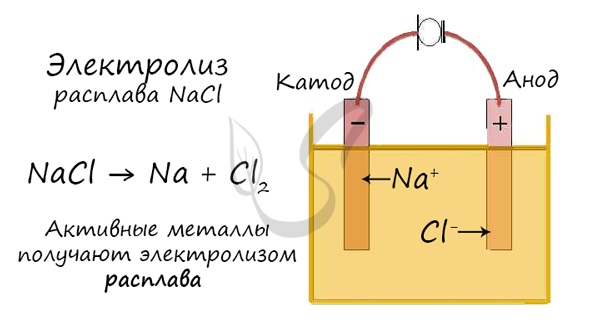
Рассмотрим процесс электролиза расплава хлорида натрия. В расплаве идет процесс термической диссоциации:
Суммарное уравнение процессов:
На катоде образуется металлический натрий, на аноде — газообразный хлор.
Главное, что вы должны помнить: в процессе электролиза за счет электрической энергии осуществляется химическая реакция, которая самопроизвольно идти не может.
Электролиз водных растворов электролитов
Более сложный случай — электролиз растворов электролитов.
В растворе соли, кроме ионов металла и кислотного остатка, присутствуют молекулы воды. Поэтому при рассмотрении процессов на электродах необходимо учитывать их участие в электролизе.
Для определения продуктов электролиза водных растворов электролитов существуют следующие правила:
1. Процесс на катоде зависит не от материала, из которого сделан катод, а от положения металла (катиона электролита) в электрохимическом ряду напряжений, при этом если:
1.2. Катион электролита находится в ряду напряжений между алюминием и водородом, то на катоде восстанавливаются одновременно и ионы металла, и молекулы воды.
1.3. Катион электролита находится в ряду напряжений после водорода, то на катоде восстанавливаются катионы металла.
1.4. В растворе содержатся катионы разных металлов, то сначала восстанавливается катион металла, стоящий в ряду напряжений правее.
2. Процесс на аноде зависит от материала анода и от природы аниона.
2.1. Если анод растворяется (железо, цинк, медь, серебро и все металлы, которые окисляются в процессе электролиза), то окисляется металл анода, несмотря на природу аниона.
2.2. Если анод не растворяется (его называют инертным — графит, золото, платина), то:
а) при электролизе растворов солей бескислородных кислот (кроме фторидов) на аноде идет процесс окисления аниона;
в) анионы по их способности окисляться располагаются в следующем порядке:
Попробуем применить эти правила в конкретных ситуациях.
Рассмотрим электролиз раствора хлорида натрия в случае, если анод нерастворимый и если анод растворимый.
1) Анод нерастворимый (например, графитовый).
В растворе идет процесс электролитической диссоциации:
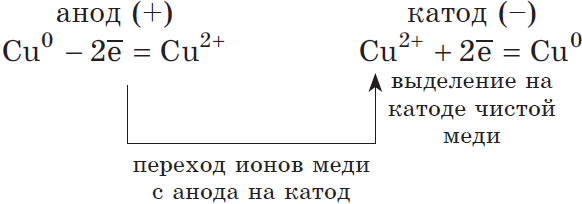
2) Анод растворимый (например, медный):
Если анод растворимый, то металл анода будет окисляться:
Рассмотрим электролиз раствора сульфата меди (II) на нерастворимом аноде:
Суммарное ионное уравнение:
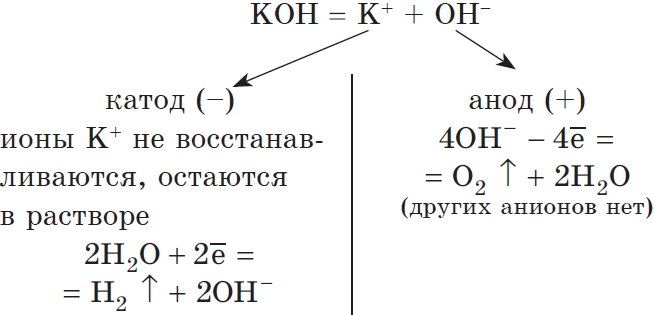
Рассмотрим электролиз раствора гидроксида калия на нерастворимом аноде:
Суммарное ионное уравнение:
Суммарное молекулярное уравнение:
Электролиз расплавов и растворов веществ широко используется в промышленности:
Какие металлы получают электролизом расплавов солей
Долговечность и устойчивость строения зависит от качества и прочности фундамента. Специальные блоки нередко используют для того, чтобы создать надежное основание. Со.
Натяжной потолок — отличное решение для современного интерьера, имеющее целый ряд преимуществ.
В сохранности стремятся сохранить свое имущество все люди. Только злые собаки и надежные замки раньше были в распоряжении владельцев частных домов. Дополнительную охрану.
В современных интерьерах все чаще можно увидеть стеклянные элементы. Это козырьки, душевые кабины, перегородки, двери и другие конструкции.
Когда дело касается покупок и необходимо срочно что то приобрести, возникают две проблемы: первая, это нехватка денежных средств, ведь деньги как вода, сегодня они есть.
Постоянный стресс сегодня один частых факторов современного ритма нашей жизни. Везде кругом суета, все нужно делать быстро чтобы успеть и не опоздать, ведь промедление.
Вам требуется трубошпунт.
Ученые подсчитали, что человек в среднем за свою жизнь проводит 16 лет в постели. Поэтому к выбору матраса надо подойти со всей ответственностью.
Какие металлы получают электролизом расплавов солей
Все щелочные металлы встречаются в природе исключительно в виде соединений, являются сильными восстановителями, и их получение требует высоких энергетических затрат.
Литий получают электролизом расплава хлорида лития, который образуется при переработке сподумена. Переработка сподумена – процесс довольно сложный, включает стадии получения алюмината лития, гидроксида лития и хлорида лития:
2LiCl 
Известен также способ получения лития из его оксида в вакууме при 300°С:
Натрий получают электролизом расплава хлорида натрия с добавками хлорида кальция:
2NaCl 
Натрий можно получить, прокаливая соду с углем в закрытых тиглях, пары металла конденсируются на крышке тигля, выход реакции невысокий:
Калий, рубидий и цезий можно получить электролизом расплава их солей, однако на практике таким способом их не получают из-за их высокой химической активности.
Калий получают, пропуская пары натрия через расплав хлорида калия при 800°С, выделяющие пары калия конденсируют:
или при взаимодействии между расплавленным гидроксидом калия и жидким натрием при 440°С:
Рубидий и цезий получают восстановлением их хлоридов кальцием при 700–800 °С:
2RbCl + Ca = 2Rb + CaCl2,
в качестве восстановителя также используют цирконий, реакция протекает при 650 °С:
§ 45.1. Получение металлов электролизом водных растворов солей
| Сайт: | Профильное обучение |
| Курс: | Химия. 11 класс |
| Книга: | § 45.1. Получение металлов электролизом водных растворов солей |
| Напечатано:: | Гость |
| Дата: | Среда, 17 Ноябрь 2021, 22:14 |
Оглавление
В § 45 вы познакомились с электрохимическим методом промышленного получения металлов, который основан на электролизе, — электрометаллургией.
У этого метода есть две разновидности. Первая — это проведение электролиза расплава соединений металлов. Особенности этого способа вы рассмотрели на примере электролиза расплава хлорида магния.
Вторая разновидность электрохимического метода, называемая гидроэлектрометаллургией, основана на электролизе водных растворов солей металлов. Преимущество этого метода, по сравнению с электролизом расплавов, заключается в том, что он не требует энергетических затрат на расплавление вещества. Ограничение электролитического метода извлечения металлов из водных растворов состоит в том, что он пригоден лишь для металлов, стоящих в ряду активности металлов правее алюминия.
Особенность проведения электролиза водных растворов солей заключается в том, что наряду с процессами восстановления ионов металла на катоде и окисления анионов соли на аноде протекает конкурирующий процесс электролиза молекул воды. В результате на катоде может выделяться водород, а на аноде — кислород.
Процессы на катоде:
2Н + + 2е – = Н2↑ при рН – = Н2↑ + 2ОН – ≥ 7.
2Н2О – 4е – = О2↑ + 4Н + при рН ≤ 7;
4ОН – – 4е – = О2↑ + 2Н2О при рН > 7.
Способность металлов восстанавливаться на катоде при электролизе водного раствора солей определяется положением металла в ряду активности.
Этот процесс доминирует, но если электролит имеет сильно кислую среду, то одновременно с ионами металла могут восстанавливаться ионы водорода:
При электролизе водных растворов солей металлов следует учитывать возможность протекания процессов гидролиза, который ускоряется в результате образования гидроксид-ионов в электролите вблизи катода. В результате на поверхности катода могут образовываться нерастворимые основные соли и основания:
Электропроводность электрода уменьшается, и процесс электролиза замедляется или прекращается. Один из способов борьбы с таким явлением — подкисление электролитов.
На аноде протекают процессы окисления компонентов электролита. В процессе окисления может участвовать и материал самого анода. Различают процессы электролиза в растворах с активным и инертным анодами.
Инертные аноды не окисляются под действием электрического тока и не реагируют с веществами раствора. При электролизе они служат лишь передатчиками электронов. Инертными являются электроды из графита, платины, платинированного титана.
К активным относятся аноды, изготовленные из Сu, Ag, Fe, Ni, Sn, Zn. Металл активных анодов в процессе электролиза разрушается и переходит в раствор в виде ионов. Активные аноды обычно применяют в промышленности при получении покрытий путём электрохимического восстановления металлов из растворов, поскольку растворение металлического анода в процессе электролиза восполняет убыль ионов восстанавливаемого металла из электролита. При этом они обеспечивают постоянство состава раствора, скорости процесса электролиза, состава и свойств получаемых металлических покрытий.
Рассмотрим подробнее процессы, протекающие при электролизе растворов на инертных анодах. Можно выделить следующие закономерности (табл. 31.1):
• в растворах бескислородных кислот и их солей (кроме HF и фторидов) на аноде окисляются анионы, например:
Таблица 31.1. Способность к окислению на аноде анионов при электролизе водных растворов солей
В водном растворе не окисляются; окислению подвергаются молекулы воды с выделением кислорода:
В водном растворе легко окисляются, например:
В специально созданных условиях в водных растворах может идти процесс окисления и кислородсодержащих анионов с максимальной степенью окисления неметалла. Например, электролизом концентрированного раствора гидросульфата калия получают сильный окислитель — пероксодисульфат калия:
Примеры использования электролиза водных растворов солей металлов в промышленности и в лаборатории
При разработке условий электролиза следует учитывать, что продукты электролиза могут вступать в химические реакции с электродами и водными растворами или между собой.
Промышленный электролиз водного раствора NaCl. Процесс используют для получения водорода, хлора и каустической соды (NaOH). При этом на катоде выделяется водород:
а в растворе накапливается каустическая сода:
Если не разделить продукты электролиза, то между образовавшимися газами произойдёт химическая реакция.
В растворе также возможно взаимодействие хлора со щёлочью:
Cl2 + 2NaOH = NaClO + NaCl + H2O.
Для того чтобы между продуктами электролиза не происходило взаимодействие, катодное и анодное пространство разделяют мембраной (рис. 108.2).
С 2015 года в ОАО «Беларуськалий» функционирует цех мембранного электролиза. Продукцией цеха являются: водный раствор гидроксида калия (с массовой долей KOH 46−54 % ); твёрдый гидроксид калия (с массовой долей KOH 9 0−95 % ); соляная кислота (с массовой долей HCl 28−35 % ); гипохлорит натрия NaClO.
Электролиз растворов солей в лаборатории.
Для наглядности при рассмотрении особенностей электролиза водных растворов солей обратимся к химическому эксперименту.
Опыт 1. Проведём электролиз водного раствора CuSO4. Для этого соберём прибор по схеме, представленной на рис. 108.3. В U-образную трубку нальём раствор сульфата меди(II) и опустим два графитовых стержня, закреплённых в резиновых пробках. Стержни с помощью проводов присоединим к источнику тока, на котором поддерживается напряжение постоянного тока до 12 В.
При пропускании электрического тока через раствор CuSO4 на стержне, присоединённом к положительному полюсу источника тока (анод), можно наблюдать выделение пузырьков газа (это кислород), а на стержне, присоединённом к отрицательному полюсу (катод), — появление красного налёта (это восстановленная медь) (рис. 108.4).
Объяснить наблюдаемое явление можно следующими процессами.
В растворе сульфата меди происходит диссоциация:
При подключении электродов к источнику тока в растворе электролита происходит направленное движение ионов к электродам, имеющим противоположные заряды.
На катоде происходит восстановление меди, которая образует красный налёт на электроде:
На аноде (положительно заряженном электроде) происходит окисление молекул воды с выделением кислорода:
Суммарное уравнение процессов на электродах в молекулярной форме:
Опыт 2. Проведите электролиз водного раствора йодида калия.
Для проведения электролиза раствора KI воспользуемся установкой из примера 1 (рис. 108.3).
В U-образную трубку нальём раствор KI и пропустим через него электрический ток. Через 3–5 минут, отключив ток и достав электроды, в катодное пространство добавим 2−3 капли фенолфталеина, а в анодное пространство прильём крахмальный клейстер.
Раствор в катодном пространстве окрашивается в малиновый цвет, что свидетельствует о щелочной среде. В анодном пространстве наблюдается выделение жёлто-бурого вещества, при добавлении к которому 2–3 капель крахмального клейстера происходит посинение раствора, что указывает на присутствие в растворе йода (рис. 108.5).
Таким образом, продуктами электролиза водного раствора йодида калия являются I2 и щёлочь.
Наблюдаемые явления свидетельствуют о протекании на электродах следующих реакций:
2Н2О + 2e – = Н2↑ + 2ОН – на катоде;
2I – – 2e – = I2 на аноде.
Суммарное уравнение процесса электролиза в молекулярной форме:
Электролиз с активными анодами в промышленности. Помимо электрохимического осаждения металлических покрытий и получения порошков металлов, этот метод применяют для извлечения металлов из растворов, а также для очистки (рафинирования) металлов от содержащихся в них примесей. Так получают чистое золото, медь и многие другие металлы.
Например, при очистке (рафинировании) меди исходный металл, содержащий нежелательные примеси, служит анодом. Анод погружают в раствор сульфата меди(II). При пропускании тока медь на аноде окисляется, её ионы переходят в раствор, перемещаются к катоду и на нём восстанавливаются. Примеси в этом процессе не участвуют из-за их малой концентрации, и поэтому на катоде образуется слой чистой меди.
Процессы электролиза с активными анодами используют для получения покрытий из оксидов металлов. Так, при проведении электролиза с анодом из алюминия его поверхность окисляется, покрываясь слоем оксида. Такой процесс специального наращивания оксида на поверхности металла называют электрохимическим оксидированием (или анодированием). Анодирование применяют для защиты металла от коррозии, придания его поверхности декоративного внешнего вида, повышенной твёрдости.
Методом электролиза растворов солей на поверхность различных изделий наносят покрытия из металлов и их сплавов, композитов с неметаллами, что придаёт изделиям нужные свойства (повышенная коррозионная стойкость, декоративная отделка, электропроводность и др.). К распространённым промышленным процессам относятся цинкование, никелирование, меднение, хромирование, оловянирование, золочение и серебрение.
Электролиз водных растворов используется также в синтезе различных неорганических веществ, в обработке поверхностей металлов (азотирование, борирование, электрополировка, очистка), в очистке сточных вод (процессы электрокоагуляции, электроэкстракции, электрофлотации). Электролизом получают кислород и водород.
При электролизе водных растворов солей на катоде восстанавливаются катионы металлов, расположенных в ряду активности после водорода.
На катоде одновременно с водородом из воды восстанавливаются катионы металлов, расположенных в ряду активности между алюминием и водородом.
На аноде в растворах солей бескислородных кислот окисляются анионы (кроме фторид-ионов).
Вопросы, задания, задачи
1. Какие из веществ — каменная соль, сахар, медный купорос, глицерин, серная кислота — могут подвергнуться электролизу в водном растворе?
2. Объясните, почему алюминий нельзя получить электролизом водного раствора его хлорида.
3. Приведите уравнения реакций на электродах при электролизе водного раствора сульфата никеля(II).
4. Сравните продукты электролиза расплава и водного раствора хлоридов натрия, никеля(II) и меди(II). Приведите соответствующие уравнения химических реакций.
5. При электролизе водного раствора хлорида натрия без разделения электродных пространств можно получить гипохлорит натрия. Приведите возможные уравнения электродных процессов и химических реакций в растворе.
6. Продукцией цеха мембранного электролиза ОАО «Беларуськалий» являются водный раствор гидроксида калия и соляная кислота. Приведите уравнения реакций, которые лежат в основе получения этих веществ.
7. Как изменится концентрация катионов и анионов в водных растворах CuCl2, Na2SO4, KI, NaOH, HCl при электролизе? Приведите соответствующие уравнения реакций.
8. В качестве лабораторного способа дезинфекции воды используется электролиз водного раствора хлорида натрия в портативных электролизёрах. Объясните процессы, на которых основан этот способ дезинфекции воды.
10. Оксид марганца(IV) получают электролизом раствора сульфата марганца(II) в присутствии серной кислоты. Предположите, какие процессы протекают на электродах и приведите уравнения соответствующих реакций.
Самоконтроль
1. При электролизе водных растворов солей восстанавливаются ионы:
2. При электролизе водных растворов солей не восстанавливаются ионы:
3. Продуктами электролиза водного раствора калийной соли являются:
4. На катоде могут протекать процессы:
5. При электролизе водного раствора хлорида натрия выделился водород объёмом 2,24 дм 3 (н. у.). Число электронов, отданных при этом ионами хлора, равно: