какие металлы реагируют с аммиаком
Аммиак: получение и свойства
Аммиак
Строение молекулы и физические свойства
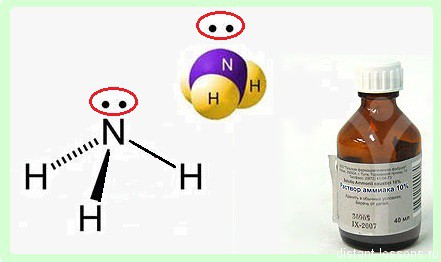
В молекуле аммиака NH3 атом азота соединен тремя одинарными ковалентными полярными связями с атомами водорода:
Геометрическая форма молекулы аммиака — правильная треугольная пирамида. Валентный угол H-N-H составляет 107,3 о :
Аммиак – бесцветный газ с резким характерным запахом. Ядовит. Весит меньше воздуха. Связь N-H — сильно полярная, поэтому между молекулами аммиака в жидкой фазе возникают водородные связи. При этом аммиак очень хорошо растворим в воде, т.к. молекулы аммиака образуют водородные связи с молекулами воды.
Способы получения аммиака
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поск ольку аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Видеоопыт получения аммиака из хлорида аммония и гидроксида кальция можно посмотреть здесь.
Еще один лабораторный способ получения аммиака – гидролиз нитридов.
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
Процесс проводят при температуре 500-550 о С и в присутствии катализатора. Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непровзаимодействовавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Более подробно про технологию производства аммиака можно прочитать здесь.
Химические свойства аммиака
1. В водном растворе аммиак проявляет основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H + ), он превращается в ион аммония. Реакция может протекать и в водном растворе, и в газовой фазе:
Видеоопыт растворения аммиака в воде можно посмотреть здесь.
2. Как основание, аммиак взаимодействует с кислотами в растворе и в газовой фазе с образованием солей аммония.
Еще один пример : аммиак взаимодействует с водным раствором углекислого газа с образованием карбонатов или гидрокарбонатов аммония:
Видеоопыт взаимодействия аммиака с концентрированными кислотами – азотной, серной и и соляной можно посмотреть здесь.
В газовой фазе аммиак реагирует с летучим хлороводородом. При этом образуется густой белый дым – это выделяется хлорид аммония.
NH3 + HCl → NH4Cl
Видеоопыт взаимодействия аммиака с хлороводородом в газовой фазе (дым без огня) можно посмотреть здесь.
4. Соли и гидроксиды меди, никеля, серебра растворяются в избытке аммиака, образуя комплексные соединения – аминокомплексы.
Гидроксид меди (II) растворяется в избытке аммиака:
Если реакцию проводить в присутствии катализатора (Pt), то азот окисляется до NO:
Также возможно образование Na2NH, Na3N.
При взаимодействии аммиака с алюминием образуется нитрид алюминия:
2NH3 + 2Al → 2AlN + 3H2
Пероксид водорода также окисляет аммиак до азота:
2NH3 + 3CuO → 3Cu + N2 + 3H2O
Аммиак. Отгаданные загадки
Химические свойства аммиака
1. Реакции с металлами.
Будет ли аммиак реагировать с металлами? У атома азота в этом соединении формально восемь внешних электронов (пять своих и три оттянуты от атомов водорода), а металлы стремятся свои валентные электроны отдать. С одной стороны, атому азота уже некуда их принять. С другой – в аммиаке есть атомы водорода, частично обедненные электронами, т. е. имеющие возможность принять их.
Известно, что активные металлы вытесняют водород из воды, а чем аммиак хуже? Ну только разве тем, что аммиак газообразен при температурах выше его точки кипения, равной –33,4 °С. Соответственно газ NH3 рассредоточен в пространстве, и требуется дополнительный подогрев, чтобы реакция пошла. Именно накаливанием металлов в атмосфере аммиака чаще всего и получают нитриды. (Нитриды – это соединения, состоящие из двух элементов, один из которых азот, причем атомы азота имеют в этом соединении отрицательный заряд.) Например:
2. Реакции с неметаллами.
Формальная степень окисления азота в аммиаке –3. Следовательно, аммиак может реагировать с кислородом (и другими окислителями!), увеличивая при этом степень окисления азота, т. е. отдавая электроны. Однако на пути к положительным степеням окисления находится нулевая – простое вещество азот, как мы уже выяснили, необычайно устойчиво.
Можно предположить, что при реакции аммиака с кислородом будут образовываться азот и вода. Именно так и происходит в действительности. Следует добавить, что аммиак горит только в чистом кислороде, а не на воздухе:
Как быть, если надо получить из аммиака оксиды азота? Вспомним о катализаторах – веществах, которые ускоряют реакцию или меняют ее направление. Катализаторы используют и при получении оксидов азота из аммиака и кислорода. Реакцию каталитического окисления проводят на металлической платине:
Интересна реакция аммиака с другим простым веществом – озоном, более агрессивным окислителем, чем кислород. Озон переводит азот из степени окисления –3 в степень окисления +5. Но не весь! В результате получается нитрат аммония:
3. Реакция с водой.
Мы уже говорили о хорошей растворимости аммиака в воде. Но почему фенолфталеин становится в таком растворе малиновым? Загадка?
Попробуем разобраться, откуда появилась в растворе щелочная среда. Для начала вспомним теорию электролитической диссоциации. В водных растворах все ионы и молекулы гидратированы – окружены «шубой» из молекул воды, сориентированных соответствующим образом: к атомам водорода потянулись «кислородные половинки», а к атому азота – «водородная половинка» (рис. 5).

Рис. 5. Аммиак в воде:
атом азота – черный шар; атомы кислорода – большие белые шары; атомы водорода – малые белые шары
В какой-то момент образовалась конструкция Н3N•••НОН. Далее, известно, что вода слабо, но диссоциирует по реакции:
Поскольку электроотрицательность кислорода больше, чем азота, связь кислорода с водородом полярнее, чем связь азота с водородом. Можно предположить, что равновесие в реакции диссоциации гидратированной молекулы аммиака будет больше смещено в сторону образования ионов (по сравнению с водой):
4. Реакции с кислотами.
Как слабое, но все же основание, водный раствор аммиака реагирует с кислотами с образованием соли и воды:
Соли аммония, подобно солям натрия и калия, хорошо растворяются в воде, но при этом частично гидролизуются:
С кислотами реагирует и газообразный аммиак, причем не только с растворами, но и с газообразными кислотами. В лабораториях, в которых работают с растворами соляной кислоты и аммиака, постоянно появляется белый налет на окружающих предметах. Даже небольших количеств аммиака и хлороводорода в воздухе достаточно для протекания реакции:
5. Реакции со щелочами.
Газообразный аммиак со щелочами не реагирует. А вот водный раствор аммиака «откликается» на добавление щелочи. Поскольку при растворении аммиака в воде протекает обратимая реакция образования иона аммония и гидроксид-иона, то добавление последнего в раствор смещает равновесие, растворимость аммиака уменьшается (а интенсивность запаха соответственно увеличивается):
NН4OH + NaOH = NH3 + H2O + NaOH.
Физические свойства аммиака в цифрах
Молярная масса M(NH3) = 17 г/моль. Температура плавления равна –78 °C, температура кипения –33 °С. Плотность газообразного аммиака при нормальных условиях (0 °С, 1 атм) 0,771 г/л (аммиак легче воздуха почти в два раза). Растворимость при атмосферном давлении и 0 °С около 90 л (!) газа в 100 г воды, при 20 °С – 65 л в 100 г воды.
При сравнении физических свойств аммиака и азота в первую очередь обращает на себя внимание температура кипения. Почему у аммиака она настолько выше? У азота – почти –200 °С, а у аммиака – только –33 °С. Загадка? Попробуем отгадать.
Для начала сопоставим температуры кипения соединений с водородом элементов V, VI и VII групп главных подгрупп периодической системы (рис. 6).

Рис. 6. Графики зависимости температур кипения
водородных соединений элементов V( · ), VI( C )и VII( Д ) групп
главных подгрупп от номера периода (массы атома)
Если экстраполировать графики такой зависимости, можно оценить, какими должны бы быть эти температуры, исходя из общей закономерности. Из графика видно, что аммиак, вода и фтороводород имеют аномально высокие температуры кипения: аммиак – примерно на 50 °С выше «теоретической», фтороводород – на 100 °С, а вода – на 160 °С. Во-первых, видно, что аммиак не одинок, а во-вторых, вспоминается, что у азота, кислорода и фтора самая высокая электроотрицательность. Значит, и связи этих элементов с водородом самые полярные. Водород в таких соединениях почти без электрона и поэтому сильно притягивается к неподеленным парам электронов, которые есть и у азота, и у кислорода, и у фтора. Образуются водородные связи. Они, конечно, слабее обычных ковалентных связей, но их много. И это «много» многое значит.
Водородные связи играют в природе огромную роль. Например, спираль из двух молекул ДНК образуется только за счет водородных связей. Такие связи сравнительно легко разрываются, когда происходит считывание информации с определенного участка ДНК. Когда водородных связей много, получается крепкое связывание в целом.
В заключение стоит сказать, что связь водорода с фтором полярнее, чем связь азота с водородом, и соответственно притяжение сильнее, а температура кипения HF выше, чем NH3. У воды же самая высокая температура кипения из этой троицы, потому что молекулы воды образуют водородные связи сразу «двумя руками» – две неподеленные пары электронов и два атома водорода в каждой молекуле! Аммиак и фтороводород по своему строению «однорукие».
Химические свойства аммиака (дополнение)
Аммиак сам по себе устойчив и разлагается только при очень высоких температурах. Но если проводить нагревание в присутствии обыкновенного железа, он разлагается на азот и водород при значительно более низких температурах. Интересно, что при каталитическом разложении небольшая часть аммиака всегда остается в смеси газов, независимо от времени и температуры проведения реакции. Именно этот факт подсказал ученым мысль о возможности связывания атмосферного азота через аммиак. Действительно, логично предположить, что разложение аммиака – процесс обратимый, тогда изменением условий и подбором катализатора можно сместить процесс в сторону образования аммиака до такой степени, что это станет выгодно для его промышленного получения.
Еще немного о реакциях аммиака с простыми веществами. Интересны реакции аммиака с галогенами. Йод не может изменить степень окисления азота! Он просто сам диспропорционирует:
Нитрид йода (по названию понятно, что у йода в этом соединении степень окисления положительная), или иначе йодистый азот, в сухом виде разлагается со взрывом даже от простого сотрясения.
Бром и хлор могут отнять у азота только по три электрона, переведя в простое вещество. И только фтору под силу перевалить через эту сверхустойчивую нулевую степень окисления азота. Получается трифторид. И это максимально возможный, просто потому, что у атомов второго периода нет «запасных» орбиталей. Не бывает поэтому и пятивалентного азота!
Жидкий аммиак – хороший растворитель. Реакции в жидком аммиаке идут по тем же законам, что и в воде, а вот растворимость в воде и в жидком аммиаке у соединений различная. Например, реакция
в воде идет в сторону образования нерастворимого бромида серебра, а в жидком аммиаке – в сторону образования нерастворимого бромида бария.
Из жидкого аммиака, как и из воды, активные металлы вытесняют водород. Например, реакция с цезием протекает за несколько минут:
А вот аналогичная реакция с натрием протекает значительно дольше. При этом образуется сольватированный электрон! (Сольватация – процесс, аналогичный гидратации, только в других растворителях.)
Экологические свойства аммиака
Аммиак – активное и «едкое» соединение (едкость кислот и щелочей проявляется в том, что большие количества ионов Н + или ОН – разъедают живую ткань растений, животных и, естественно, человека; впрочем, неживую «ткань» они тоже разъедают). Однако если заменить в аммиаке один, два или все три атома водорода на органические радикалы, то «едкость» существенно снижается, а основные свойства остаются. Такие соединения выполняют в живой природе функции оснований.
Однако, как и многие другие яды, в малых дозах аммиак оказывает положительное влияние на организм: 10%-й раствор аммиака в воде используют в медицине для стимуляции дыхания (его не пьют, конечно, а просто дают понюхать), центральной нервной системы и т. п.
В больших количествах аммиак вреден и для растений. Но в небольших количествах он им необходим. Ведь без азота, и в частности без аммиака, не построить те органические соединения, которые потом превращаются в растительные белки, а в дальнейшем – в белки животных. Большим количествам газообразного аммиака растения противостоят по-разному. Некоторые стараются прекратить ему доступ внутрь (например, закрывают устьица на листьях). Другие растения перерабатывают аммиак с помощью соответствующих ферментов в нитрат-ионы, которые для растений не ядовиты, тем самым запасая ценный для своего развития элемент.
Химия, Биология, подготовка к ГИА и ЕГЭ
Резкий запах аммиака известен человеку с доисторических времен, так как этот газ образуется в значительных количествах при гниении, разложении и сухой перегонке содержащих азот органических соединений, например мочевины или белков.
Аммиак — NH3, нитрид водорода, при нормальных условиях — бесцветный газ с резким характерным запахом (запах нашатырного спирта).
Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы. Это человек и воспринимает как резкий запах. Пары аммиака вызывают обильное слезотечение, боль в глазах, химический ожог конъюнктивы и роговицы, потерю зрения, приступы кашля, покраснение и зуд кожи
В больших количествах токсичен для человека.
Химические свойства аммиака
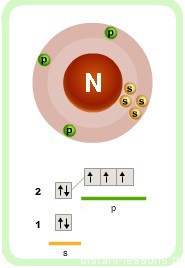
Интересными химическими свойствами молекула аммиака обязана атому азота — p-элемент элемент 2-го периода V группы периодической системы имеет на внешнем энергетическом уровне 5 электронов.
На 3 ковалентных связи с водородом расходуются 3 электрона. 2 остаются. Эти 2 неспаренных электрона образуют неподеленную электронную пару.
Именно эта свободная неподеленная пара электронов определяет многие химические свойства аммиака.
— у аммиака есть неподеленная электронная пара, а у иона водорода есть абсолютно свободная орбиталь;
Формулу такого раствора часто записывают вот в таком виде:
NH4OH — гидроксид аммония. Т.к. азот притягивает к себе водород из воды, то по химическим свойствам аммиак — слабое основание, т.е. очень слабо диссоциирует на NH4 + (ион аммония) и OH — — гидроксид-ион.
NH3 + HСl → NH4Cl — хлорид аммония
(аммиак окисляется до азота)
В чистом кислороде он сгорает бледно-желтым пламенем:
Качественные реакции на аммиак:
лакмус — становится синим,
фенолфталеин — малиновым,
метиловый-оранжевый — желтым;
Свойства солей аммония:
гидролиз по катиону и аниону:
Последняя реакция — разложение бихромата аммония часто используется в заданиях С3 ЕГЭ по химии (химический эксперимент), так что стоит ее выучить.
Химические свойства аммиака обусловлены строением молекулы, т.е. электронной конфигурацией атома азота. Т.к. в заданиях ГИА и ЕГЭ уделяется много внимания как самому аммиаку, так и его соединениям, то эту тему надо знать хорошо.
Cвойства аммиака
Аммиак, формула, газ, характеристики:
Аммиак – химическое соединение азота и водорода, состоящее из одного атома азота и трех атомов водорода, нитрид водорода.
Аммиак (NH3) – наиболее простое и устойчивое соединение азота с водородом.
Химическая формула аммиака NH3. Изомеров не имеет.
Строение молекулы аммиака:
Форма молекулы аммиака напоминает тригональную пирамиду, в вершине которой расположен атом азота. Три неспаренных p-электрона атома азота участвуют в образовании полярных ковалентных связей с 1s-электронами трёх атомов водорода (связи N−H), четвёртая пара внешних электронов является неподелённой, она может образовать ковалентную связь по донорно-акцепторному механизму с ионом водорода, образуя ион аммония NH4+. Несвязывающее двухэлектронное облако строго ориентировано в пространстве, поэтому молекула аммиака обладает высокой полярностью, что приводит к его хорошей растворимости в воде.
Аммиак – при нормальных условиях бесцветный газ, с резким характерным запахом (запах «нашатырного спирта»).
Аммиак – токсичное горючее газообразное вещество, обладающее свойством образовывать при контакте с воздухом взрывоопасную смесь.
Легче воздуха. Плотность по сравнению с плотностью воздуха 0,59. Таким образом, аммиак практически вдвое (в 1,7 раза) легче воздуха. Его можно собирать в перевернутые вверх дном сосуды.
Аммиак – это горючий газ. Пожаро- и взрывоопасен. В чистом кислороде аммиак сгорает бледно-желтым пламенем, превращаясь, в основном, в азот и воду. Аммиак горит при наличии постоянного источника огня. Наличие масел и другого горючего увеличивает пожаровзрывоопасность этого вещества.
Аммиак образует с воздухом взрывоопасную смесь. Концентрационные пределы распространения пламени – 15,0-33,6 объемные доли, %; либо 107-240 г/м3. Наиболее легковоспламеняемая концентрация 24,5% (180 г/м3).
Хорошо растворим в воде как в газообразном, та и в жидком состоянии. Растворимость NH3 в воде чрезвычайно велика – около 1200 объёмов (при 0 °C) или 700 объёмов (при 20 °C) в объёме воды. При растворении аммиака в воде выделяется значительное количество тепла.
Водный раствор аммиака имеет сильную щелочную реакцию вследствие образования гидроокиси аммония NH4OH.
Аммиак относится к токсичным веществам, к IV классу опасности (малоопасные вещества) по ГОСТ 12.1.007. ПДК аммиака в атмосферном воздухе населенных мест по ГОСТ 6221-90 составляет: максимально разовая – 0,2 мг/м3; среднесуточная – 0,04 мг/м3. Предельно допустимая концентрация в воздухе рабочей зоны производственного помещения (ПДКр.з.) по ГОСТ 12.1.005-88 составляет 20 мг/м³. Ощущение запаха аммиака свидетельствует о превышении допустимых норм, т.к. запах аммиака ощущается при концентрации 37 мг/м³.
Аммиак по физиологическому действию на организм относится к группе веществ удушающего и нейротропного действия, способных при ингаляционном поражении вызвать токсический отёк лёгких и тяжёлое поражение нервной системы. Аммиак обладает как местным, так и резорбтивным действием. Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы. Жидкий аммиак или струя газа, попадая на кожу человека, вызывает сильные ожоги.
Аммиак в следовых количествах содержится в природе и планетах Солнечной системы. Почки человека выделяют аммиак для нейтрализации избыточной кислоты.
Ежегодное мировое промышленное производство аммиака составляет более 180 млн тонн. Он относится к числу важнейших продуктов химической промышленности. Аммиак выпускается в жидком виде или в виде водного раствора – аммиачной воды, которая обычно содержит 25% NH3.
[править] Химические свойства
Электронная и структурная формулы аммиака
Молекулы аммиака образуются с помощью ковалентных связей. Однако связи N — Н в молекуле аммиака полярные, так как электронная пара смещена к атому азота. Поэтому атом азота имеет отрицательный заряд, а атом водорода — положительный. В химическом отношении аммиак является восстановителем, а сам обычно окисляется до свободного азота. Так, в атмосфере кислорода аммиак горит:
Аммиак также легко восстанавливает монооксид меди до металлической меди при высокой температуре:
Аммиак, жидкость, твердое тело, характеристики:
Жидкий аммиак – бесцветная жидкость, сильно преломляющая свет.
Аммиак как жидкость является хорошим растворителем для очень большого числа органических, а также для многих неорганических соединений. В жидком аммиаке хорошо растворяются щелочные, щелочноземельные металлы, а также другие простые вещества, как, например, фосфор, йод, сера. Слабо растворяются в жидком аммиаке азотнокислые, хлористые и бромистые соли, а соли серной, угольной, уксусной и фосфорной кислот, как правило, нерастворимы.
Чистый жидкий аммиак является диэлектриком, поэтому способен к образованию на стенках сосудов статического электричества.
Сжиженный безводный аммиак относится к трудногорючим веществам.
Жидкий аммиак или струя газа, попадая на кожу человека, вызывает сильные ожоги.
Твёрдый аммиак внешне представляет собой снегообразную массу из кубических кристаллов правильной формы.
Физические свойства аммиака:
| Наименование параметра: | Значение: |
| Цвет | без цвета |
| Запах | с резким характерным запахом (запах «нашатырного спирта») |
| Вкус | едкий |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | газ |
| Плотность жидкости (при температуре кипения и атмосферном давлении 1 атм.), кг/м3 | 682,8 |
| Плотность газа (при температуре кипения и атмосферном давлении 1 атм.), кг/м3 | 0,8886 |
| Плотность (при 15 °C и атмосферном давлении 1 атм.), кг/м3 | 0,73 |
| Плотность (при 25 °C и атмосферном давлении 100 кПа ≈ 1 атм.), кг/м3 | 0,7723 |
| Температура плавления, °C | -77,73 |
| Температура кипения, °C | -33,34 |
| Критическая температура*, °C | 132,4 |
| Критическое давление, МПа | 11,32 |
| Критический удельный объем, м3/кг | 0,00426 |
| Коэффициент теплопроводности газа (при 0 °C и атмосферном давлении 1 атм.), Вт/(м·К) | 0,026 |
| Температура самовоспламенения, °C | 651 ± 1 |
| Взрывоопасные концентрации смеси газа с воздухом, % объёмных | от 14,5 (15,0) до 33,6 |
| Взрывоопасные концентрации смеси газа с кислородом, % объёмных | от 13,5 до 82 |
| Удельная теплота сгорания, МДж/кг | 20,5 |
| Температура пламени, °C | 700 |
| Константа диссоциации кислоты | 9,21 ± 0,01 |
| Молярная масса, г/моль | 17,0304 |
* при температуре выше критической температуры газ невозможно сконденсировать ни при каком давлении.
[править] Физические свойства
Аммиак — бесцветный газ с характерным резким запахом и едким вкусом. Он почти в два раза легче воздуха. При −33,35 °С и обычном давлении аммиак сжижается в бесцветную жидкость, а при −77,75 °C замерзает, превращаясь в бесцветную кристаллическую массу. Его хранят и транспортируют в жидком состоянии в стальных баллонах под давлением 6-7 атм.
В воде аммиак растворяется очень хорошо: при 0 °С и обычном давлении в 1 объеме воды растворяется около 1200 объемов NH3, а при 20 °С — 700 объемов. Концентрированный раствор содержит 25 % NH3 и имеет плотность 0,91 г/см3. Раствор аммиака в воде называют аммиачной водой или нашатырным спиртом. Обычный медицинский нашатырный спирт содержит до 10 % NH3, аммиачная вода — от 10 % и более. При нагревании раствора аммиак легко испаряется.
Химические свойства аммиака:
Основные свойства аммиака обусловлены наличием неподеленной пары электронов у атома азота. Степень окисления азота в аммиаке «-3» – минимальная. Поэтому в химическом отношении аммиак довольно активен: он вступает в реакции взаимодействия со многими веществами и проявляет только восстановительные свойства.
Для аммиака характерны следующие химические реакции:
1. реакция взаимодействия аммиака и воды:
В результате реакции образуется гидрат аммония (NH3•H2O или NH4OН). Раствор аммиака в воде имеет щелочную среду.
NH3•H2O → NH3 + H2O (to).
При кипении гидрат аммиака разлагается с образованием аммиака и воды.
2. реакция взаимодействия аммиака и ортофосфорной кислоты:
NH3 + H3PO4 → NH4H2PO4.
В результате реакции образуется дигидрофосфат аммония.
Аналогичным образом протекают реакции аммиака с другими кислотами – с образованием солей аммония.
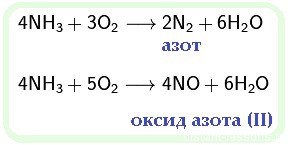
3. реакция взаимодействия аммиака и кислорода – горения аммиака:
4NH3 + 3O2 → 2N2 + 6H20.
В результате реакции образуется азот и вода. Реакция носит необратимый характер.
4. реакция каталитического окисления аммиака:
4NH3 + 5O2 → 4NO + 6H2O (kat = Pt и пр., t = 800 оС);
NH3 + 2O2 → HNO3 + H2O (kat = Pt, Rh, t = 850 оС, p = 5 атм.).
В результате первой реакции образуются оксид азота (II) и вода. В качества катализатора используются платина и ее сплавы с металлами-платиноидами, оксиды железа, марганца, кобальта, хрома и др.
В результате второй реакции образуются азотная кислота и вода. Это промышленный способ получения азотной кислоты. При этом смесь воздуха с 10% (по объему) аммиака пропускается над рядами металлических сеток (платина с 5-15% родия) при температуре около 850 оС и давлении 5 атм; время контактирования с катализатором ограничено до ≤ 1 мс чтобы минимизировать нежелательные побочные реакции. Степень превращения составляет около 96% (одна из наиболее эффективных из известных промышленных каталитических реакций); выходящие газы пропускают через абсорбционную колонну и получают 60%-й водный раствор азотной кислоты при 40°C. Реакция протекает в три стадии.
5. реакция взаимодействия аммиака и оксида меди:
2NH3 + 3CuO → N2 + 3Cu + 3H2O (t = 500-550 оС).
В результате реакции образуются азот, медь и вода. В ходе реакции аммиак пропускается через нагретый оксид меди.
6. реакция термического разложения аммиака:
2NH3 ⇄ N2 + 3H2 (t = 1200-1300 оС).
В результате реакции образуются азот и водород.
7. реакция взаимодействия аммиака и фтора:
2NH3 + 3F2 → 6HF + N2 (tо).
В результате реакции образуются фтороводород и азот. Реакция происходит при высоких температурах.
Аналогичным образом протекают реакции аммиака с другими галогенами.
8. реакция взаимодействия оксида калия и аммиака:
В результате реакции образуются амид калия и гидроксид калия. Реакция медленно протекает в жидком аммиаке.
Аммиак. Опасен при вдыхании и незаменим в промышленности
При отравлении аммиаком необходимо принять следующие меры:
Первая медицинская помощь: промыть глаза и лицо водой, надеть противогаз или ватно-марлевую повязку, смоченную 5% раствором лимонной кислоты, открытые участки кожи обильно промыть водой, немедленно покинуть очаг заражения.
Индивидуальная защита: изолирующий и фильтрующие противогазы марок М, КД, респиратор РПГ-67КД, при их отсутствии — ватно-марлевая повязка, смоченная 5% раствором лимонной кислоты, защитный костюм, резиновые сапоги, перчатки.
Действия общего характера: удалить посторонних. Держаться с наветренной стороны.
Изолировать опасную зону и не допускать посторонних. В зону аварии входить только в полной защитной одежде. Соблюдать меры пожарной безопасности, не курить.
При утечке и разливе: устранить источники открытого огня. Устранить течь. Для осаждения газов использовать распыленную воду. Оповестить об опасности отравления местные органы власти. Эвакуировать людей из зоны, подвергшейся опасности заражения ядовитым газом. Не допускать попадания вещества в водоемы, тоннели, подвалы, канализацию. В случае загрязнения воды сообщить СЭС.
При пожаре: убрать из зоны пожара, если это не представляет опасности, и дать возможность догореть. Не приближаться к горящим емкостям. Охлаждать емкости водой с максимального расстояния. Тушить распыленной водой, воздушно-механической пеной с максимального расстояния.
Случаи утечки аммиака
В декабре 1999 года в Калининградской области в приграничном с Литвой городе Советске на целлюлозно-бумажном комбинате произошла авария, в результате которой из резервуаров на почву вытекло более 100 тонн аммиачной воды.
В мае 2000 года в Черкасской области Украины в результате железнодорожной аварии из двух вагонов-цистерн вылилось около 100 тонн аммиачной воды.
В сентябре 2005 года произошел аварийный выброс аммиака на Калининградском мясокомбинате.
В июле 2006 аварийный выброс аммиака произошел в г. Корсакове Сахалинской области. На территории предприятия «Корсаковский рыбоконсервный завод» при замене сальника на вентиле трубопровода, соединяющего емкость для хранения аммиака с компрессором, произошел выброс аммиака в объеме до 70 кг. В результате выброса пострадало 3 человека.
В январе 2007 года на северо-востоке Москвы три человека пострадали в результате утечки аммиака. На территории завода железобетонных конструкций были обнаружены 20 баллонов с аммиаком. Из баллона, в котором еще находился аммиак, произошла утечка, и образовалось небольшое аммиачное облако.
В феврале 2007 года в Дзержинске Нижегородской области произошел выброс аммиака из теплообменника в цехе этанол-амина ООО «Синтез-Ока». Утечка произошла в результате разгерметизации фланцевого соединения аппарата Т-12, предназначенного для испарения аммиака.
Области применения аммиака
Аммиак — один из самых важных продуктов химической промышленности.
Большая часть получаемого в промышленности аммиака идёт на приготовление азотной кислоты, азотных удобрений, красителей. Применяется аммиак и для получения взрывчатых веществ. Широко используются водные растворы аммиака. Как слабое летучее основание, он применяются в химических лабораториях и производствах. С помощью аммиака получают пищевую соду.
В медицине 10% водный раствор аммиака известен как нашатырный спирт. Резкий запах аммиака раздражает специфические рецепторы слизистой оболочки носа и способствует возбуждению дыхательного и сосудодвигательного центров, поэтому при обморочных состояниях или алкогольном отравлении пострадавшему дают вдыхать пары нашатырного спирта.
При пайке металлов используют хлорид аммония — нашатырь — NH4Сl. При высокой температуре нашатырь разлагается с образованием аммиака, который очищает поверхности паяльника и спаиваемого изделия от оксидов металлов.
При испарении жидкого аммиака поглощается большое количество теплоты, поэтому его используют в холодильных установках.
Все справки>>
Получение аммиака в промышленности и лаборатории. Химические реакции – уравнения получения аммиака:
Аммиак в лабораторных условиях получается в результате следующих химических реакций:
NH4Cl + NaOH → NH3 + NaCl + H2O.
В результате реакции образуются газообразный аммиак, хлорид натрия и вода.
(NH4)2SO4 + Ca(OH)2 → 2NH3 + CaSO4 + 2H2O.
В результате реакции образуются газообразный аммиак, сульфат кальция и вода.
NH4Cl + Ca(OH)2→ 2NH3 + CaCl2 + 2H2O.
В результате реакции образуются газообразный аммиак, хлорид кальция и вода.
Таким образом, для получения аммиака в лаборатории используют действие сильных щелочей на соли аммония.
Аммиак в промышленности получают путем прямого взаимодействия водорода и азота:
N2 + 3H2 ↔ 2NH3 (kat = пористое железо с примесями Al2O3 и K2O, t = 500 оС, p = 350 атм.).
За счет высокого давления равновесие в указанной реакции смещается в сторону аммиака. Это так называемый процесс Габера. Немецкий физик Фриц Габер разработал физико-химические основы метода.
Химические
Основные химические свойства описаны в таблице.