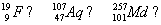какие модели атомных ядер вы знаете
Какие модели атомных ядер вы знаете
Модели строения атома
Первые модели строения атома появились в самом начале XX века. Жан Перрен в 1901 г. высказал предположение о ядерно-планетарном устройстве атома.
Подобную же модель предложил в 1904 г. японский физик Хантаро Нагаока. В модели Нагаоки атом уподоблялся планете Сатурн; роль планеты выполнял положительно заряженный шар, представляющий собой основную часть объёма атома, а электроны располагались подобно спутникам Сатурна, образующим его кольца. Однако более широкое распространение получила т.н. кексовая модель атома: в 1902 г.
Уильям Томсон (лорд Кельвин) высказал предположение о том, что атом представляет собой сгусток положительно заряженной материи, внутри которого равномерно распределены электроны. Простейший атом – атом водорода – представлял собой, по мнению У. Томсона, положительно заряженный шар, в центре которого находится электрон. Детально данную модель разработал Дж. Дж. Томсон, считавший, что электроны внутри положительно заряженного шара расположены в одной плоскости и образуют концентрические кольца.
Дж. Дж. Томсон предложил способ определения числа электронов в атоме, основанный на рассеивании рентгеновских лучей в предположении, что именно электроны должны являться центрами рассеивания. Проведённые эксперименты показали, что количество электронов в атомах элементов равно приблизительно половине величины атомной массы. Дж. Дж. Томсон, предположив, что число электронов в атоме непрерывно возрастает при переходе от элемента к элементу, впервые попытался связать строение атомов с периодичностью свойств элементов.
Немецкий физик Филипп фон Ленард попытался создать модель, не предполагающую раздельного существования в атоме противоположных зарядов. Атом, согласно модели Ленарда, состоит из нейтральных частиц (т.н. динамид), каждая из которых является электрическим дуплетом. Выполненные Ленардом расчёты показали, что эти частицы должны иметь крайне малые размеры, и, следовательно, большая часть объёма атома представляет собой пустоту. Сосредоточение массы атома в небольшой части его объёма отчасти подтверждалось и проведёнными Ленардом в 1903 г. опытами, в которых пучок быстрых электронов легко проходил через тонкую металлическую фольгу.
Все упомянутые модели являлись сугубо гипотетическими и исключительно качественными.
Так как атом в целом нейтрален, это означает, что электронная оболочка содержит Z электронов.
Загрузите модуль Состав атомных ядер (протоны, нейтроны). Вам предлагается просмотреть и прослушать материал о строении атома, объясняется методика определения числа элементарных частиц в атоме и закрепляется материал при помощи заполнения таблицы перетаскиванием автоматически появляющихся значений в соответствующие ячейки таблицы.
Общее число протонов и нейтронов в ядре выражается массовым числом
Рассмотрим пример. Каков состав атома и его ядра
Модель атома Резерфорда при несомненных достоинствах содержала важное противоречие: в соответствии с законами классической электродинамики вращающийся вокруг ядра электрон должен был непрерывно испускать электромагнитное излучение, теряя энергию. Вследствие этого радиус орбиты электрона должен был быстро уменьшаться, и рассчитанное из этих представлений время жизни атома оказывалось ничтожно малым. Тем не менее, модель Резерфорда послужила основой для создания принципиально новой теории, которую разработал в 1913 г. датский физик Нильс Хенрик Давид Бор.
Осталось неясным, где расположены электроны в атоме?
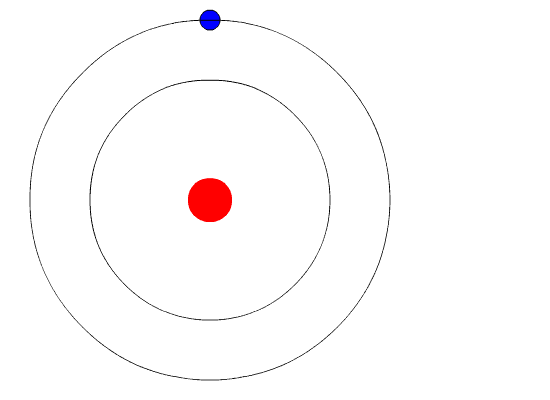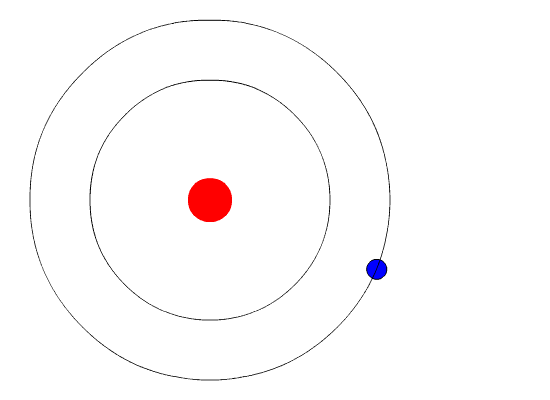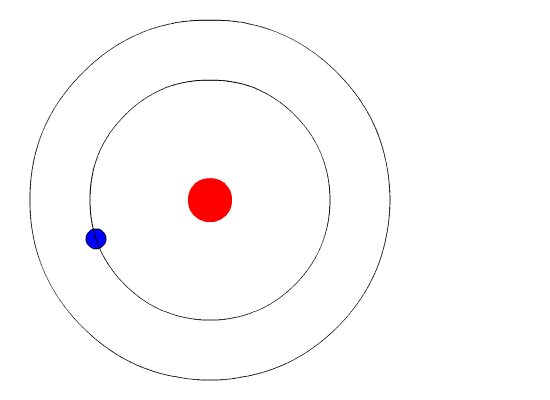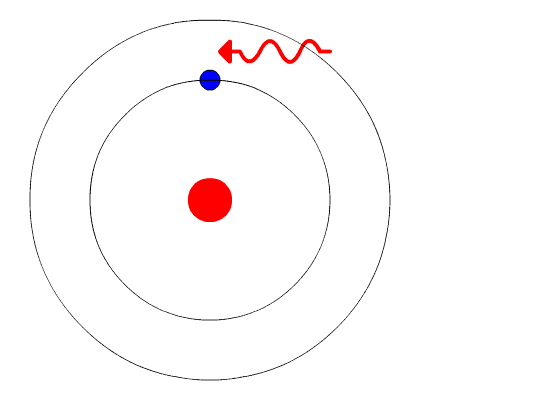
Расположение и количество электронов на оболочках можно изобразить на рисунке:

Определите строение атома какого химического элемента изображено на рисунке?
Отгадайте, о какой элементарной частице идет речь?
Какие модели атомных ядер вы знаете
Модели строения ядра.
Как пpедставить ядpо? Это непpостой вопpос, и было пpедложено несколько моделей ядpа. Наиболее популяpными и используемыми к настоящему вpемени являются две модели: капельная и оболочечная.
В оболочечной модели ядpо сpавнивается с атомом, котоpый имеет оболочечную стpуктуpу: центp атома, в котоpом сосpедоточено ядpо, окpужен слоями электpонной оболочки. На пеpвый взгляд кажется, что ядpо ничего общего не должно иметь с атомом, так как в ядpе нет никакого физически выделенного центpа, вокpуг котоpого могли бы pасполагаться слои из нуклонов. Однако нужно учесть квантовую стpуктуpу и ядpа, и атома. Ведь слои электpонной оболочки атома создаются благодаpя тому, что дискpетный энеpгетический спектp атомов таков: его энеpгетические уpовни pаспадаются на pяд сpавнительно близко лежащих гpупп, заполнение уpовней котоpых и составляет слои оболочек из электpонов. Оказалось, что спектpы энеpгии ядеp в этом отношении напоминают спектpы атомов: они также составляют гpуппы близко pасположенных уpовней. Потому постепенное заполнение нуклонами этих гpупп уpовней напоминает электpонные слои атомов. Так стpоится оболочечная модель ядеp.
Для того, чтобы атомные ядра были устойчивыми, протоны и нейтроны должны удерживаться внутри ядер огромными силами, во много раз превосходящими силы кулоновского отталкивания протонов.
Ядерные силы – силы, действующие между ядерными частицами – нуклонами.
Свойства ядерных сил:
1. Это короткодействующие силы, действуют на расстояниях между нуклонами, порядка 10 −15 м, и резко убывают при увеличении расстояния; при расстояниях 1,4 ∙ 10 −15 м они уже практически равны 0.
2. Это самые мощные силы из всех, которыми располагает природа, поэтому взаимодействие частиц в ядре часто называют сильными взаимодействиями.
3. Ядерным силам свойственно насыщение, т.е. нуклон взаимодействует не со всеми остальными нуклонами, а лишь с некоторыми ближайшими соседями.
4. Ядерным силам свойственна зарядовая независимость. Это значит, что с одинаковой по модулю силой притягиваются друг к другу и заряженные, и незаряженные частицы, т.е. сила притяжения Fрр между двумя протонами равна силе притяжения Fпп между двумя нейтронами и равна силе притяжения Fрп между протоном и нейтроном.
5. Ядерные силы не являются центральными, т.е. они не направлены вдоль прямой, соединяющей центры этих зарядов.
6. Ядерные силы являются так называемыми обменными силами.
Напоминаю, что различают четыре вида фундаментальных взаимодействий в природе: сильное, электромагнитное, слабое и гравитационное.
Все четыре взаимодействия необходимы и достаточны для построения разнообразного мира.
Без сильных взаимодействий не существовали бы атомные ядра, а звезды и Солнце не могли бы генерировать за счет ядерной энергии теплоту и свет.
Без электромагнитных взаимодействий не было бы ни атомов, ни молекул, ни макроскопических объектов, а также тепла и света.
Без слабых взаимодействий не были бы возможны ядерные реакции в недрах Солнца и звезд, не происходили бы вспышки сверхновых звезд и необходимые для жизни тяжелые элементы не могли бы распространиться во Вселенной. Без гравитационного взаимодействия не только не было бы галактик, звезд, планет, но и вся Вселенная не могла бы эволюционировать, поскольку гравитация является объединяющим фактором, обеспечивающим единство Вселенной как целого и ее эволюцию.
Это предположение носит чисто теоретический характер, поскольку экспериментальным путем его проверить невозможно. Косвенно эти идеи подтверждаются астрофизическими данными, которые можно рассматривать как экспериментальный материал, накопленный Вселенной.
Открытие нейтрона и протона.
К 20-м годам XX века физики уже не сомневались в том, что атомные ядра, открытые Э. Резерфордом в 1911 г., также как и сами атомы, имеют сложную структуру. В этом их убеждали многочисленные экспериментальные факты, накопленные к этому времени: открытие радиоактивности, экспериментальное доказательство ядерной модели ядра, измерение отношения e / m для электрона, α-частицы и для так называемой H-частицы – ядра атома водорода, открытие искусственной радиоактивности и ядерных реакций, измерение зарядов атомных ядер и т. д. В настоящее время твердо установлено, что атомные ядра различных элементов состоят из двух частиц – протонов и нейтронов.
Первая из этих частиц представляет собой атом водорода, из которого удален единственный электрон. Эта частица наблюдалась уже в опытах Дж. Томсона (1907 г.), которому удалось измерить у нее отношение e / m. В 1919 году Э. Резерфорд обнаружил ядра атома водорода в продуктах расщепления ядер атомов многих элементов. Резерфорд назвал эту частицу протоном. Он высказал предположение, что протоны входят в состав всех атомных ядер.
Схема опытов Резерфорда по обнаружению протонов в продуктах расщепления ядер. К – свинцовый контейнер с радиоактивным источником α-частиц, Ф – металлическая фольга, Э – экран, покрытый сульфидом цинка, М – микроскоп.
Прибор Резерфорда состоял из вакуумированной камеры, в которой был расположен контейнер К с источником α-частиц. Окно камеры было закрыто металлической фольгой Ф, толщина которой была подобрана так, чтобы α-частицы не могли через нее проникнуть. За окном располагался экран Э, покрытый сернистым цинком. С помощью микроскопа М можно было наблюдать сцинтилляции в точках попадания на экран тяжелых заряженных частиц. При заполнении камеры азотом при низком давлении на экране возникали световые вспышки, указывающие на появление потока каких-то частиц, способных проникать через фольгу Ф, практически полностью задерживающую поток α-частиц.
Отодвигая экран Э от окна камеры, Резерфорд измерил среднюю длину свободного пробега наблюдаемых частиц в воздухе. Она оказалась приблизительно равной 28 см, что совпадало с оценкой длины пробега H-частиц, наблюдавшихся ранее Дж. Томсоном. Исследования действия на частицы, выбиваемые из ядер азота, электрических и магнитных полей показали, что эти частицы обладают положительным элементарным зарядом и их масса равна массе ядра атома водорода. Впоследствии опыт был выполнен с целым рядом других газообразных веществ. Во всех случаях было обнаружено, что из ядер этих веществ α-частицы выбивают H-частицы или протоны. По современным измерениям, положительный заряд протона в точности равен элементарному заряду e = 1,60217733·10–19 Кл, то есть равен по модулю отрицательному заряду электрона. В настоящее время равенство зарядов протона и электрона проверено с точностью 10–22. Такое совпадение зарядов двух непохожих друг на друга частиц вызывает удивление и остается одной из фундаментальных загадок современной физики.
Масса протона, по современным измерениям, равна mp = 1,67262·10–27 кг. В ядерной физике массу частицы часто выражают в атомных единицах массы (а. е. м.), равной 1/12 массы атома углерода с массовым числом 12:
1 а. е. м. = 1,66057·10 –27 кг.
Это была очень красивая, но, как выяснилось впоследствии, ошибочная идея. Электрон не может входить в состав ядра. Квантово-механический расчет на основании соотношения неопределенностей показывает, что электрон, локализованный в ядре, то есть области размером R ≈ 10 –13 см, должен обладать колоссальной кинетической энергией, на много порядков превосходящей энергию связи ядер в расчете на одну частицу.
Идея о существовании тяжелой нейтральной частицы казалась Резерфорду настолько привлекательной, что он незамедлительно предложил группе своих учеников во главе с Дж. Чедвиком заняться поиском такой частицы. Через 12 лет в 1932 г. Чедвик экспериментально исследовал излучение, возникающее при облучении бериллия α-частицами, и обнаружил, что это излучение представляет собой поток нейтральных частиц с массой, примерно равной массе протона. Так был открыт нейтрон.
При бомбардировке бериллия α-частицами, испускаемыми радиоактивным полонием, возникает сильное проникающее излучение, способное преодолеть такую преграду, как слой свинца толщиной в 10 –20 см. Это излучение почти одновременно с Чедвиком наблюдали супруги Жолио-Кюри Ирен и Фредерик (Ирен – дочь Марии и Пьера Кюри), но они предположили, что это γ-лучи большой энергии. Они обнаружили, что если на пути излучения бериллия поставить парафиновую пластину, то ионизирующая способность этого излучения резко возрастает. Они доказали, что излучение бериллия выбивает из парафина протоны, которые в большом количестве имеются в этом водородосодержащем веществе. По длине свободного пробега протонов в воздухе они оценили энергию γ-квантов, способных при столкновении сообщить протонам необходимую скорость.
Она оказалась огромной – порядка 50 МэВ. Дж. Чедвик в 1932 г. выполнил серию экспериментов по всестороннему изучению свойств излучения, возникающего при облучении бериллия α-частицами. В своих опытах Чедвик использовал различные методы исследования ионизирующих излучений. На рис. 2 изображен счетчик Гейгера, предназначенный для регистрации заряженных частиц. Он состоит из стеклянной трубки, покрытой изнутри металлическим слоем (катод), и тонкой нити, идущей вдоль оси трубки (анод). Трубка заполняется инертным газом (обычно аргоном) при низком давлении. Заряженная частица, пролетая в газе, вызывает ионизацию молекул. Появившиеся в результате ионизации свободные электроны ускоряются электрическим полем между анодом и катодом до энергий, при которых начинается ударная ионизация. Возникает лавина ионов, и через счетчик проходит короткий разрядный импульс тока. Другим важнейшим прибором для исследования частиц является так называемая камера Вильсона, в которой быстрая заряженная частица оставляет след (трек). Траекторию частицы можно наблюдать непосредственно или фотографировать.
Действие камеры Вильсона, созданной в 1912 г., основано на конденсации перенасыщенного пара на ионах, образующихся в рабочем объеме камеры вдоль траектории заряженной частицы. С помощью камеры Вильсона можно наблюдать искривление траектории заряженной частицы в электрическом и магнитном полях. Дж. Чедвик в своих опытах наблюдал в камере Вильсона треки ядер азота, испытавших столкновение с бериллиевым излучением. На основании этих опытов он сделал оценку энергии γ-кванта, способного сообщить ядрам азота наблюдаемую в эксперименте скорость. Она оказалась равной 100–150 МэВ. Такой огромной энергией не могли обладать γ-кванты, испущенные бериллием. На этом основании Чедвик заключил, что из бериллия под действием α-частиц вылетают не безмассовые γ-кванты, а достаточно тяжелые частицы.
Поскольку эти частицы обладали большой проникающей способностью и непосредственно не ионизировали газ в счетчике Гейгера, следовательно, они были электронейтральны. Так было доказано существование нейтрона – частицы, предсказанной Резерфордом более чем за 10 лет до опытов Чедвика. Нейтрон – это элементарная частица. Ее не следует представлять в виде компактной протон-электронной пары, как первоначально предполагал Резерфорд. По современным измерениям, масса нейтрона mn = 1,67493·10–27 кг = 1,008665 а. е. м. В энергетических единицах масса нейтрона равна 939,56563 МэВ. Масса нейтрона приблизительно на две электронные массы превосходит массу протона. Сразу же после открытия нейтрона российский ученый Д. Д. Иваненко и немецкий физик В. Гейзенберг выдвинули гипотезу о протонно-нейтронном строении атомных ядер, которая полностью подтвердилась последующими исследованиями.
Ядро состоит из нуклонов: протонов и нейтронов.
Г. Мозли (Англия) установил, что положительный заряд ядра атома (в условных единицах) равен порядковому номеру элемента в периодической системе Менделеева. Каждый протон имеет заряд +1, поэтому заряд ядра равен числу протонов.
Масса протона, как и масса нейтрона, приблизительно в 1840 раз больше массы электрона. Протоны и нейтроны находятся в ядре, поэтому масса атома почти равна массе ядра. Масса ядра, как и масса атома, определяется суммой числа протонов и числа нейтронов. Эта сумма называется массовым числом атома. Массовое число атома (A) = Число протонов (Z) + Число нейтронов (N) A=Z+N
Протоны и нейтроны, входящие в состав любого ядра, не являются неделимыми элементарными частицами, а состоят из кварков.
Энергия связи нуклонов в ядре, дефект массы.
Устойчивость атомного ядра характеризуется энергией связи (Есв.).
Точнейшие измерения показывают, что масса покоя ядра М всегда меньше суммы масс покоя составляющих ее протонов и нейтронов: Мя
Энергия связи – минимальная энергия, которую необходимо затратить для полного расщепления ядра на отдельные нуклоны или энергия, выделяющаяся при слиянии свободных нуклонов в ядро. Расчетная формула энергии связи:
Если в результате реакции Е=∆Мc 2 > 0, то энергия выделяется, если Е=∆М c 2
Для характеристики прочности ядра используется величина, которая называется удельной энергией связи εсв.
Удельная энергия связи — энергия связи, приходящаяся на один нуклон ядра, равна отношению энергии связи Есв к массовому числу ядра атома А: εсв=Есв/А, Удельная энергия связи определяется экспериментально.
Ядерные реакции — процессы, происходящие при столкновении ядер или элементарных частиц с другими ядрами, в результате которых изменяются квантовое состояние и нуклонный состав исходного ядра, а также появляются новые частицы среди продуктов реакции.
При этом возможны реакции деления, когда ядро одного атома в результате бомбардировки делится на два ядра разных атомов. При реакциях синтеза происходит превращение легких ядер в более тяжелые.
ВНИМАНИЕ: Разница между химическими и ядерными реакциями состоит в том, что в химических реакциях общее число атомов каждого определенного элемента, а также атомы, составляющие определенные вещества, остаются неизменными. В ядерных реакциях изменяются и атомы, и элементы.
Изотопы — это разновидности атомов одного и того же химического элемента, атомные ядра которых имеют одинаковое число протонов Z и различное число нейтронов n. Изотопы занимают одно и то же место в периодической системе элементов, откуда и произошло их название. По своим ядерным свойствам изотопы, как правило, существенно отличаются. Химические (и почти в той же мере физические) свойства изотопов одинаковы. Это объясняется тем, что химические свойства элемента определяются зарядом ядра, поскольку именно он влияет на структуру электронной оболочки атома.
У всех химических элементов имеются изотопы. У некоторых элементов имеются только нестабильные (радиоактивные) изотопы. Для всех элементов искусственно получены радиоактивные изотопы. В атомной индустрии все возрастающую ценность для человечества представляют радиоактивные изотопы.
Как менялась атомная модель на протяжении многих лет?
От эпохи древнегреческой философии до современной квантовой механики атомная теория получала множество обновлений, и каждое из них было весьма революционным для своего времени.
Наше понимание природы окружающих нас вещей продолжает меняться с течением времени. То, что кажется нам очевидным сейчас, могло бы не существовать столетие назад или устареть в ближайшие десятилетия. Прекрасным примером того, как наука совершенствуется с течением времени, является эволюция атомной теории.
Давайте начнем со старых добрых времен, когда наука была не доказательной базой, а философией, и люди верили, что все состоит только из четырех элементов. Представьте себе, насколько простой была бы химия в те времена.
Демокрит
Но эта теория была в значительной степени дискредитирована Аристотелем, который считал, что все на нашей планете состоит из четырех элементов: земли, огня, воды и воздуха.
Джон Дальтон
Следующая остановка в атомной теории произошла спустя почти 2000 лет, от британского химика и любителя метеорологии Джона Дальтона. Он проводил эксперименты, в которых смешивал два газа и наблюдал за их поведением. Большинство газов, которые он тестировал, существовали независимо, не беспокоясь о присутствии другого. Но он обнаружил нечто иное, когда оксиду азота позволили взаимодействовать с атмосферным кислородом. 36 мер чистого азотистого газа прореагировали со 100 мерами воздуха и дали 80 мер нового газа, который не был ни азотистым, ни кислородным.
Это вызвало у него любопытство, поэтому он провел один и тот же эксперимент с разными объемами газа. Он заметил, что газы реагируют друг с другом только в фиксированном соотношении. Это породило закон кратных отношений и теорию атомизма.
Джозеф Джон Томсон
Джозеф Джон Томсон
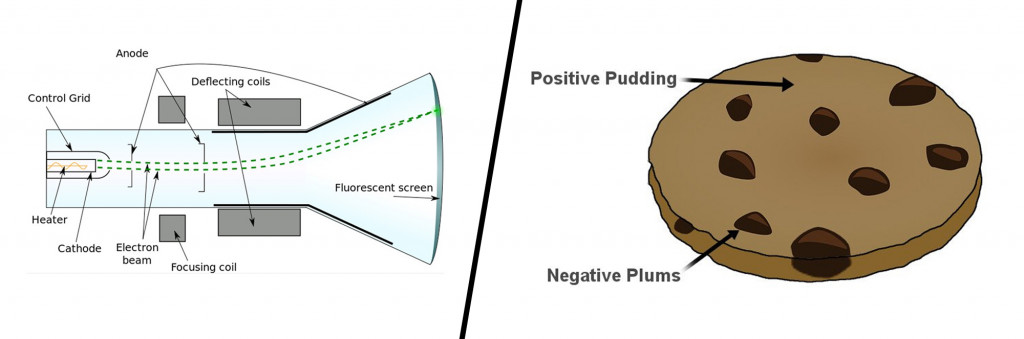
До конца 19 века атомы представлялись неделимыми частицами, но первым, кто разрушил это представление, был английский физик Джозеф Джон Томсон и его надежная катодно-лучевая трубка. Внутри почти вакуумной стеклянной трубки видимый пучок частиц или катодных лучей генерировался путем приложения высокого напряжения к металлическим электродам. Поток частиц, образовавшихся из металла, отклонялся от отрицательного заряда в сторону положительного заряда.
Повторив этот эксперимент несколько раз с другими металлами, он придумал первую атомную модель. Его знаменитая модель сливового пудинга описывала атом как частицу, состоящую из положительно заряженной массы (пудинг) с крошечными отрицательными зарядами, встроенными в нее (как сливы).
Модель катодно-лучевой трубки и сливового пудинга
Эрнест Резерфорд
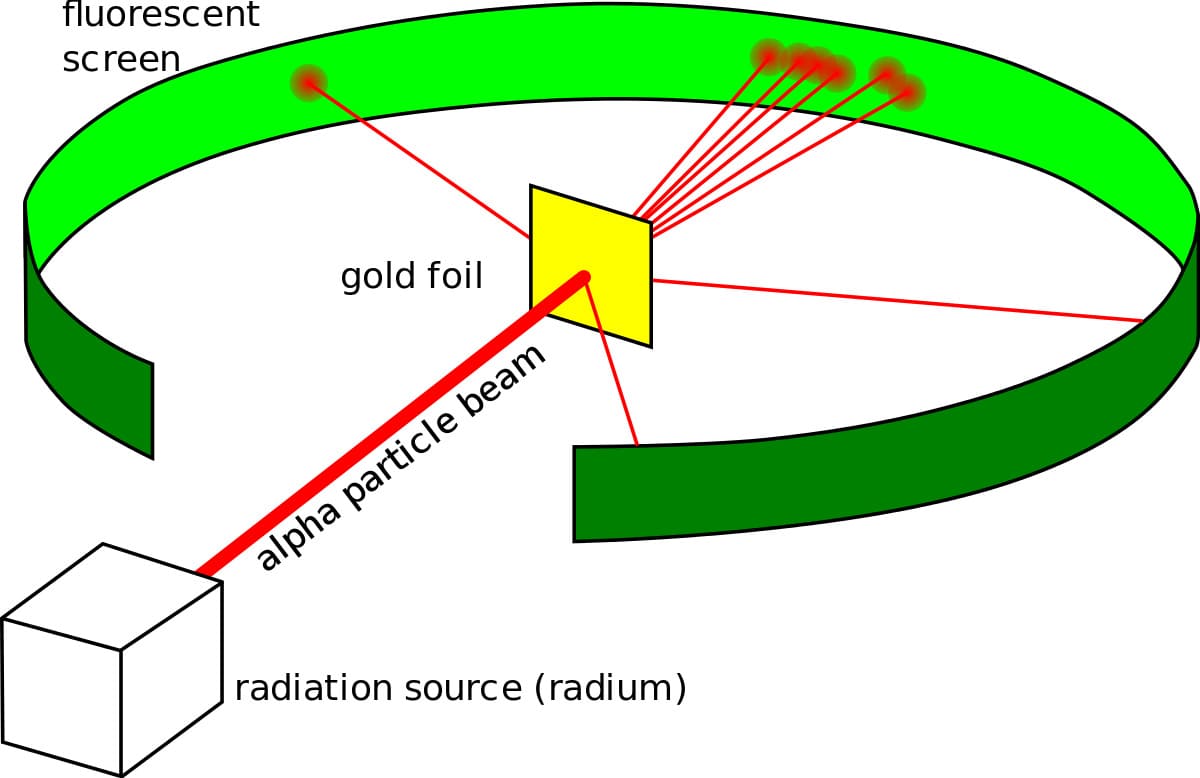
После некоторого первоначального сопротивления эта модель стала довольно популярной в научном мире. Тем не менее уроженец Новой Зеландии Эрнест Резерфорд не был в этом уверен. В начале 1900-х годов радиоактивность была в моде, и Резерфорд во время своей работы по радиоактивному распаду открыл альфа, бета и гамма-лучи. Он хотел разработать метод альфа-частиц и использовать его для исследования структуры атома.
Он сделал то, что делал каждый физик в то время, он поставил эксперимент. Эксперимент с золотой фольгой, также известный как эксперименты Гейгера-Марсдена, состоял из тонкой золотой фольги с круглым экраном, покрытым сульфидом цинка за ней, который вспыхивал каждый раз, когда в нее попадала альфа-частица. Резерфорд ожидал, что частицы вылетают из фольги и ударяются об экран позади нее. Хотя большинство частиц действительно вели себя так, как ожидалось, некоторые из них отклонились на угол более 90 градусов.
Эксперимент Гейгера-Марсдена с золотой фольгой.
Нильс Бор
Через год после публикации атомной теории Резерфорда Нильс Бор обнаружил несоответствие в этой модели. Если бы электроны вращались вокруг положительно заряженного центра, то в какой-то момент эти электроны потеряли бы свою энергию и упали на ядро, сделав атомы нестабильными. Но этого не происходило, атомы были довольно стабильны (кроме радиоактивных).
Несмотря на то, что модель Бора не соответствует действительности для сложных многоэлектронных систем, она по-прежнему является наиболее популярным представлением атомной структуры в большинстве учебников.
Атомная модель Шредингера
Как бы мы ни старались, сложностей квантовой механики не избежать. С установлением квантового поведения таких сущностей, как электрон, стало совершенно ясно, что атомная модель Бора не удовлетворяет принципу неопределенности Гейзенберга. Согласно принципу неопределенности, невозможно узнать точное положение и траекторию движения электронов в атоме, а значит, они не могут существовать на фиксированных орбитах, как предполагал Бор.
Объединив концепцию двойственности волна-частица и принцип неопределенности, Эрвин Шредингер придумал квантово-механическую модель атома. В этой модели электроны вращались вокруг ядра не по круговым орбитам, а в виде электронных облаков на атомной орбитали, которая представляет собой область внутри атома, где вероятность нахождения электрона наиболее высока. Он также сформулировал волновые уравнения Шредингера, которые помогут нам точно рассчитать энергию уровней электронов в атоме. Эта новая и усовершенствованная атомная модель не говорит нам, где находится электрон, но где он может находиться.
Человечество всегда мучилось вопросами: Из чего состоят окружающие нас вещи? И почему они ведут себя по-разному?
И каждый шаг в развитии атомной теории приближал нас к пониманию секретов субатомных частиц, управляющих нашим живым и ярким миром.