какие молекулы покидают жидкость при испарении
Поглощение энергии при испарении жидкости и выделение ее при конденсации пара
Содержание
Явление перехода жидкости в газообразное состояние называется парообразованием. Одним из его способов является испарение. Испарение происходит с поверхности жидкости, и его скорость зависит от определенных факторов: рода жидкости, температуры, площади поверхности жидкости и наличии ветра.
Но ведь, дуя на горячий чай в чашке, мы не стараемся добиться его быстрейшего испарения – мы хотим его остудить. И он действительно быстрее остывает. С одной стороны, он отдает какое-то количество теплоты окружающему более холодному воздуху, а с другой – свою роль здесь играет испарение.
Значит, при испарении изменяется температура. Она же тесно связана с внутренней энергией тела. В данном уроке мы рассмотрим, какие изменения происходят с внутренней энергией жидкости и с чем они связаны. Так мы подойдем к обратному испарению процессу – конденсации, и узнаем, что происходит с энергией в этом случае.
Поглощение энергии при испарении
При испарении из жидкости способны вылететь быстро движущиеся молекулы. Значит, внутри ее в это время остаются более медленные молекулы. Средняя скорость движения молекул в жидкости уменьшается. Таким образом, средняя кинетическая энергия молекул жидкости тоже уменьшается. Она же является частью внутренней энергии жидкости.
Внутренняя энергия испаряющейся жидкости уменьшается.
Если нет притока энергии к жидкости извне, испаряющаяся жидкость охлаждается.
Чтобы доказать это на практике, проведем простой опыт (рисунок 1). Возьмем термометр, который показывает нам комнатную температуру (рисунок 1, а).
Теперь смочим кусок материи эфиром и обмотаем им шарик термометра (рисунок 1, б). Температура термометра заметно снизилась.
Эфир испаряется довольно быстро. При этом он отнимает часть внутренней энергии от шарика термометра, который из-за этого охлаждается.
Если мы нальем эфир на руку, то тоже почувствуем охлаждение. Чтобы заметить понижение температуры при испарении жидкости, не обязательно использовать сложные вещества. Вспомните, как летом в жару вы выходите из воды? Что вы чувствуете? Прохладу. Испаряясь с нашего тела, вода забирает некоторое количество теплоты. По этой же причине прогулка в промокших ботинках в прохладную погоду легко может стать причиной простуды.
Но почему же тогда мы не замечаем изменения температуры воды в стакане? Испарение происходит, но температура не изменяется. Давайте объясним это.
В подобных случаях испарение идет очень медленно. Температура же поддерживается за счет количества теплоты, получаемого из окружающего воздуха.
Конденсация
Мы назваем пар насыщенным, если число молекул, вылетающих из него, уравнивается числом молекул, возвращающихся обратно в жидкость. Когда молекулы пара возвращаются в жидкость – это и есть не что иное, как процесс перехода из газообразного состояния в жидкое.
Конденсация – это явление превращения пара в жидкость.
Молекулы жидкости, покинувшие ее в процессе испарения, находятся в воздухе в состоянии непрерывного теплового движения. Так как движение молекул хаотичное, то какая-то их часть вновь попадает в жидкость.
Термин “конденсация” происходит от латинского “конденсаре” – сгущать.
Выделение энергии при конденсации пара
Конденсация пара происходит с выделением энергии.
Скорость конденсации зависит от:
Когда пары воды поднимаются над землей, они попадают в более холодные слои воздуха. Пар конденсируется, и образуются облака. Они состоят из мельчайших капелек воды.
В теплое время года по вечерам часто выпадает роса. Водяной пар, находящийся в воздухе, охлаждается и конденсируются. Так образуются маленькие капельки жидкости на окружающей растительности.
Испарение и конденсация
Урок 12. Физика 8 класс (ФГОС)
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности
Конспект урока «Испарение и конденсация»
На прошлых уроках мы с вами говорили о том, что существует три агрегатных состояния вещества — твёрдое, жидкое и газообразное.
И выяснили, что при агрегатных превращениях возможны переходы вещества из одного агрегатного состояния в другое.
На этом уроке мы рассмотрим процесс превращения жидкости в газ, и обратное превращение вещества из газообразного состояния в жидкое.
Задумывался ли кто-нибудь из вас над вопросом: почему сохнет мокрая одежда? И почему в ветреную погоду она высыхает значительно быстрее, чем в тихую и прохладную? А если оставить открытым флакон духов, то очень скоро он может оказаться пустым. Почему? Попытаемся ответить на эти и некоторые другие вопросы.
Для начала давайте вспомним, что молекулы вещества в любом его агрегатном состоянии находятся в непрерывном движении. Их скорости меняются самым случайным образом.
Так, например, молекула жидкости, имеющая большую скорость, несомненно обладает и большой кинетической энергией. Такая молекула может преодолеть силы притяжения к другим молекулам и покинуть жидкость. А так как молекулы с большой энергией есть всегда, то со временем количество жидкости будет уменьшаться, а над жидкостью будет образовываться пар.
Явление превращения жидкости в пар называется парообразованием.
Водяной пар невидим. А то, что мы свами часто ошибочно называем паром — например, белёсую струю, выходящую из кипящего чайника, — это не пар, а туман. Он состоит из крошечных капелек воды, образовавшихся при конденсации пара. Но об этом явлении мы поговорим позже.
Отличают два вида парообразования — это испарение и кипение. Они осуществляются при разных условиях.
Испарение — это парообразование, идущее со свободной поверхности жидкости.
А от чего зависит скорость испарения жидкости? Чтобы ответить на этот вопрос, давайте с вами проведём следующий опыт. На стекло нанесём тампоном влажные пятна одинаковых размеров в такой последовательности: подсолнечное масло, вода, ацетон. И проследим, какая жидкость испарится первой.
Через некоторое время мы заметим, что первым исчезнет пятно ацетона, затем воды, и позже всех — подсолнечного масла. Следовательно, скорость испарения зависит от рода жидкости. Это и понятно, ведь у разных жидкостей силы взаимодействия молекул неодинаковые.
Продолжим опыт. Одну стеклянную пластинку возьмём холодную, а другую нагреем. И нанесём на них две одинаковые капли воды.
С нагретого стекла капля исчезнет быстрее, чем с холодного.
И это неудивительно, поскольку чем выше температура жидкости, тем больше скорость движения её молекул, и, соответственно, их кинетическая энергия. Следовательно, большее число молекул способно преодолеть силы притяжения и выйти за пределы поверхности жидкости.
Значит, скорость испарения жидкости зависит от её температуры: чем она выше, тем скорость испарения жидкости больше.
А теперь капнем на стекло две капли ацетона. Размажем одну каплю так, чтобы образовалось пятно, и проследим за изменениями.
Через некоторое время мы заметим, что пятно ацетона испарится быстрее, чем капля. Это объясняется тем, что площадь поверхности пятна больше, чем капли. Следовательно, большее число молекул сможет оказаться на поверхности и, преодолев силы притяжения, вылететь из неё. Значит, чем больше площадь свободной поверхности жидкости, тем больше скорость её испарения.
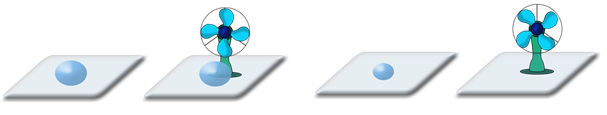
И наконец, на два стекла нанесём по капле воды, но одно стекло будем обдувать вентилятором.
Капля со стекла, обдуваемого вентилятором испарится гораздо быстрее. Почему? Всё дело в том, что при испарении молекулы не только покидают поверхность жидкости, но и возвращаются обратно. А поток воздуха уносит вылетевшие из жидкости молекулы, освобождая место другим. Таким образом, скорость испарения зависит от движения воздуха над свободной поверхностью жидкости.
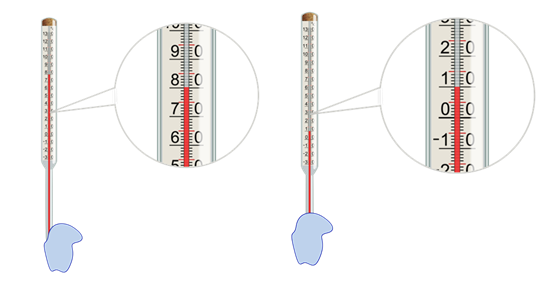
А теперь выясним, что же происходит с жидкостью в сосуде при испарении. Для этого проделаем такой опыт. Возьмём термометр и обмотаем его конец ватой, смоченной водой, а лучше спиртом.
Мы практически сразу заметим, как столбик жидкости в термометре начнёт опускаться. Это свидетельствует об уменьшении температуры жидкости при испарении.
Объясняется этот факт следующим образом. При испарении жидкость покидают молекулы, обладающие наибольшей энергией. Это означает, что внутренняя энергия оставшейся части жидкости уменьшается. Поэтому, если нет притока энергии к жидкости извне, температура испаряющейся жидкости уменьшается.
Мы рассмотрели процессы испарения жидкостей. Однако у вас может возникнуть закономерный вопрос: «А испаряются ли твёрдые тела?».
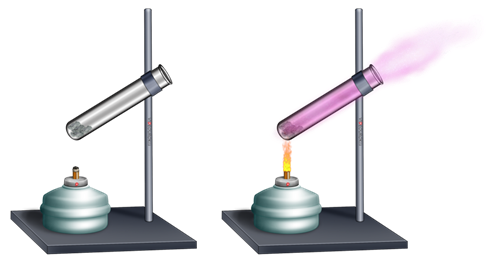
Для ответа на него, проведём следующий опыт. Поместим в пробирку кристаллики йода и будем нагревать над пламенем спиртовки. Через некоторое время мы заметим, как кристаллики йода начнут испаряться.
Значит, твёрдые тела тоже испаряются. Этим и объясняется то, что в ясный морозный день исчезает иней на деревьях, а бельё способно высохнуть даже в очень сильный мороз.
В самом начале мы говорили о том, что очень часто люди ошибочно называют паром туман, который состоит из крошечных капелек воды.
Так же все вы не раз наблюдали, как вечером, после жаркого летнего дня, выпадает роса. Это водяной пар, содержащийся в воздухе, при охлаждении превращается в жидкость, и капельки воды оседают на листьях и траве.
Процесс превращения вещества из газообразного состояния в жидкое называют конденсацией (от латинского «сгущать»).
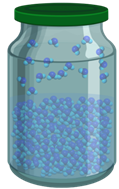
Если процесс испарения идёт быстрее, чем процесс конденсации, то масса жидкости в сосуде уменьшается. Но почему тогда в плотно закрытой банке с водой уровень воды остаётся неизменным? Разве в закрытом сосуде молекулы не вылетают из воды?
Вылетают, конечно. Но из закрытого сосуда они вылететь не могут, поэтому, полетав над жидкостью, многие молекулы возвращаются обратно в жидкость. То есть одновременно с испарением происходит и конденсация.
А то, что уровень жидкости в закрытом сосуде остаётся неизменным, означает, что в таком сосуде процессы парообразования и конденсации идут с одинаковой скоростью. Говорят, что в этом случае наступает динамическое равновесие между жидкостью и паром. При динамическом равновесии масса жидкости в закрытом сосуде не изменяется, хотя жидкость продолжает испарятся.
Пар, находящийся в состоянии динамического равновесия со своей жидкостью, называется насыщенным паром.
Пар, который не находится в состоянии динамического равновесия со своей жидкостью, называют ненасыщенным паром.
А теперь давайте поставим наш закрытый сосуд, в котором жидкость и пар находятся в состоянии динамического равновесия, над спиртовкой и будем нагревать его.
При увеличении температуры, количество молекул, способных вылететь с поверхности жидкости, возрастает. Поэтому в начале количество молекул, покидающих жидкость, будет больше, чем тех, которые возвращаются обратно. Соответственно, нарушается динамическое равновесие и пар перестаёт быть насыщенным.
Однако через какое-то время равновесие вновь восстановится. Но так как число молекул в единице объёма пара увеличится, то увеличится и плотность насыщенного пара. А мы уже знаем, что при увеличении плотности газа возрастает и его давление. Значит, с увеличением температуры, плотность и давление насыщенного пара увеличиваются.
Испарение: определение, условия и особенности процесса
Содержание:
Испарением в физике (впрочем, и не только в ней) называют фазовый переход любой жидкости в парообразное или газообразное состояние. Простейший пример, с которым сталкивается каждый человек – испарение воды, когда мы ее сильно нагреваем, к примеру, делая себе чай, из нее идет пар. Пар этот и есть та самая вода, которая из жидкого состояния перешла в парообразное. Особенности процесса испарения разных жидкостей хорошо изучены физиками, а само испарение широко применяется в промышленности и в быту, встречается также и в природе.
Определение
Классическое определение звучит так: испарение – это переход из жидкости в газ. При этом это термодинамический процесс, то есть такой, который происходит под воздействием температурных колебаний. Именно вследствие испарения количество любой жидкости в любой незакрытой емкости будет постепенно уменьшаться.
Какие же причины испарения? Физика объясняет это явление разницей температур на грани фазового перехода: жидкость обычно несколько холоднее окружающего воздуха. Если нет каких-то внешних влияний, испарение жидкостей происходит крайне медленно. Молекулы покидают жидкость вследствие диффузии, они переходят через полупроницаемую для жидкостей, но непроницаемую для газовых веществ поверхность раздела фаз массового потока.
Важно знать, что испарение всегда происходит только с поверхности жидкости, в этом основное отличие испарения от других форм парообразования. Атомы и молекулы испаряются не все сразу, а небольшими слоями, постепенно. Но, разумеется, со временем они могут испариться полностью.
Еще одной интересной особенностью испарения является тот факт, что оно может иметь разную направленность тепловых потоков. Они могут идти:
Направленность тепловых потоков при испарении зависит от характера жидкости, температуры окружающего воздуха и фазового раздела. Эти три величины и их соотношение формируют формулу испарения.
Испарение на молекулярном уровне
В жидкостях молекулы, хотя и расположены близко друг к другу, тем не менее, они не имеют твердой связи между собой, как в твердых телах. Поэтому они находятся в непрерывном движении, в ходе которого часто сталкиваются друг с другом, меняют свое направление и скорость своего движения. Часть молекул, которые оказались близко к поверхности могут и вовсе покинуть жидкость, если проникнут через зону фазового перехода. И тогда произойдет испарение. Как видите, обязательным условием для этого физического процесса является непрерывное движение молекул в жидкости. Если движущаяся молекула обладает достаточной кинетической энергией и скоростью, то она может преодолеть притяжение соседних частиц и вылететь на поверхность.
Почему же испарение усиливается при нагревании жидкости? При нагревании движение молекул в воде, или другой жидкости заметно ускоряется, и все больше молекул начинают гонять аки «Шумахеры», в результате вылетая на поверхность.
При этом в какой-то момент может произойти такое явление как «испарительное охлаждение жидкости», когда нагретую жидкость уже покинули все самые быстрые молекулы и происходит снижении температуры самой жидкости. В частности это явление объясняет, почему человеку, даже облитому теплой водой постепенно будет становиться холодно – все быстрые молекулы этой теплой воды испарятся, а оставшаяся вода быстро охладится без своих «молекул-гонщиков».
Кипение гейзеров, отличный пример испарения в природе.
Испарение и кипение: в чем отличие?
В начале статьи мы писали, что испарение особенно заметно при кипении воды, когда мы, к примеру, делаем себе чай. На самом деле испарение может происходить и без кипения, просто тогда оно не будет для нас заметно. Например, вода в речке или озере непрерывно испаряется, хотя мы этого и не замечаем. Что же касается кипения, то оно является, по сути, катализированным испарением, когда сам процесс становится заметным невооруженным глазом и во много раз ускоренным.
Но кипение происходит только при определенных температурах, причем в разных жидкостях разные температуры кипения (например, у воды температура кипения 100 °C), в то же время испарение происходит всегда, независимо от температуры жидкости. В этом и заключается их отличие.
Факторы, влияющие на скорость испарения
Учеными выделены такие основные факторы, которые имеют влияние на скорость испарения:
Роль испарения
И испарение, и кипение распространенные физические явления в нашей жизни. Мы постоянно сталкиваемся с ними в нашем быту, испарение активно используется в промышленности и природных условиях, как именно, читайте далее.
Испарение в организме человека, в животных и растениях
Аналогично это работает и у животных, а некоторые порой даже стремятся ускорить процесс испарения. Так, например собаки для этой цели в жаркую погоду открывают рот и высовывают язык. Именно гортань и язык собаки наиболее подходят для испарения влаги и охлаждения тела животного.
Что же касается растений, то и они обладают схожим механизмом. Во избежание перегрева на Солнце они запускают процесс испарения ранее поглощенной воды, таким образом, охлаждаясь. Именно поэтому очень важно в жаркую погоду усиленно поливать культурные растения, предотвращая их выгорание или засыхание, ведь в такие дни влага особенно нужна растениями не только для питания, но и для охлаждения.
Испарение в природе и окружающей среде
Роль испарения в природе просто огромна, так как без этого физического явления была бы невозможна сама Жизнь на нашей планете. Именно испарение лежит в основе естественного круговорота воды, который обеспечивает экосистему Земли необходимыми питательными элементами и разносит жизненно важную влагу по всему миру. Испарение воды с поверхности рек, озер, морей и океанов создает дождевые тучи, которые затем, проливаясь дождем, питают растения и деревья.
Именно благодаря испарению на Земле идут дожди, а о том, как они важны и как трудно без них приходится порой, спросите об этом жителей Северной Африки или Центральной Индии, которые часто страдают от засухи.
Испарение в промышленности и быту
Вот лишь несколько примеров использования испарения в промышленности.
Промышленная техника, работающая на основе процессов испарения, конструируется по одному и тому же принципу: в ней всегда максимально увеличена площадь поверхности жидкости, чем обеспечивается наиболее оптимальный теплообмен с газовой средой.
Видео
И в завершение образовательное видео по теме нашей статьи.
ФИЗИКА
Испарение и конденсация. Насыщенный пар. Влажность воздуха.
Испарение – это процесс перехода жидкости в пар (газообразное состояние).
Испарение происходит при любой температуре жидкости.
Молекулы жидкости при тепловом движении движутся с разными скоростями. Самые быстрые молекулы способны преодолеть притяжение остальных молекул и выскочить из жидкости.
Эти молекулы образуют пары в воздухе.
Скорость испарения жидкости зависит от:
— температуры (чем выше температура жидкости, тем большей скоростью обладают ее молекулы)
— от площади поверхности испаряющейся жидкости (чем больше площадь поверхности, тем большее число быстрых молекул покидает жидкость)
— от наличия ветра над поверхностью жидкости
Так как при испарении жидкость покидают наиболее быстрые молекулы, обладающие соответственно большей кинетической энергией, средняя кинетическая энергия молекул жидкости уменьшается, значит температура жидкости при испарении понижается.
Рассмотрим процесс образования насыщенного пара:
В сосуд наливаем жидкость и закрываем его. Жидкость в сосуде начинает испаряться, и плотность пара над жидкостью в сосуде увеличивается.
В результате теплового движения часть молекул водяного пара возвращается в жидкость. Чем больше плотность водяных паров в сосуде, тем большее число молекул пара возвращается в жидкость.
Через некоторое время в сосуде устанавливается динамическое равновесие между жидкостью и паром:
число молекул, покинувших жидкость за какой-то отрезок времени, становится равным числу молекул, возвращающихся в жидкость за такой же отрезок времени.
В сосуде образовался насыщенный пар.
Насыщенный пар – это пар, находящийся в динамическом равновесии со своей жидкостью.
Давление и концентрация молекул (плотность) насыщенного пара при постоянной температуре не зависят от занимаемого паром объема.
Давление насыщенного пара зависит только от его температуры.
Давление насыщенного пара растет как вследствие повышения температуры жидкости, так и вследствие увеличения концентрации молекул пара.
Пар называется ненасыщенным, если его давление меньше давления насыщенного пара при данной температуре.
При нагревании жидкости растворенный в жидкости газ начинает собираться в пузырьки по всему объему жидкости.
В дальнейшем испарение происходит не только с поверхности жидкости, но и внутрь пузырьков.
Внутри пузырьков образуется насыщенный пар.
С повышением температуры жидкости давление насыщенного пара в пузырьках растет, что ведет к увеличению объема пузырьков.
Под действием выталкивающей силы пузырьки всплывают к поверхности жидкости, лопаются и выбрасывают пар.
Кипение жидкости начинается при температуре, когда давление насыщенного пара в пузырьках становится равным давлению в жидкости.
Давление в жидкости = гидростатическому давлению (давлению высоты столба жидкости) + внешнему атмосферному давлению.
Температурой кипения называется температура жидкости, при которой давление ее насыщенного пара равно или больше внешнего давления.
Температура кипения жидкости повышается с ростом внешнего атмосферного давления и понижается при его уменьшении.
Например:
В автоклавах для стерилизации медицинских инструментов создается повышенное давление, и кипение воды происходит при температуре значительно выше 100С.
На высокогорье, где атмосферное давление ниже нормального, температура кипения воды меньше, чем 100С.
Для поддержания кипения к жидкости надо подводить теплоту, которая расходуется на парообразование, т.к. внутренняя энергия пара больше внутренней энергии жидкости такой же массы.
В процессе кипения температура жидкости остается постоянной.
Влажность воздуха – это содержание водяного пара в воздухе.
Атмосферный воздух состоит из смеси газов и водяных паров.
Влажность воздуха характеризуется следующими величинами:
1. Абсолютная влажность воздуха – это масса водяных паров, содержащихся в 1 куб. метре воздуха при данных условиях.
Абсолютная влажность воздуха может оцениваться:
Парциальное давление водяного пара – это давление, которое производил бы водяной пар, если бы остальные газы воздуха отсутствовали.
Y =P/P0*100%
В прогнозе погоды указывается величина относительной влажности воздуха в процентах!
Прибор для измерения относительной влажности воздуха называется психрометром.