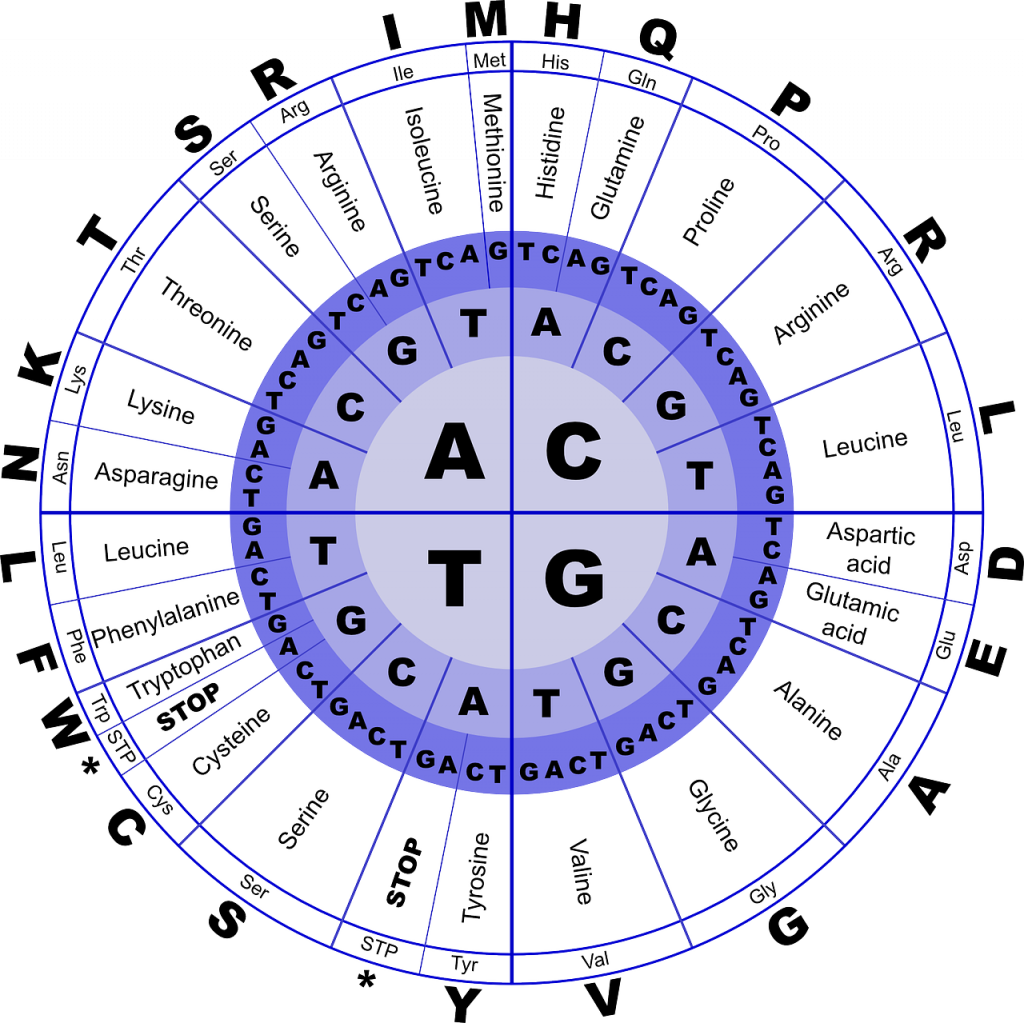
какие молекулы являются мономерами белка
Какие молекулы являются мономерами белка
Подробное решение параграф § 10 по биологии для учащихся 10 класса, авторов Пасечник В.В., Каменский А.А., Рубцов A.M. Углубленный уровень 2019
Вопрос 1. Из каких мономеров состоят белковые молекулы?
Мономерами молекул белков являются аминокислоты.
Вопрос 2. Какую роль играют белки в организме человека?
Роль белков для организма заключается в том, что они служат материалом для построения клеток, тканей и органов, образования ферментов, большинства гормонов, гемоглобина и других веществ, выполняющих в организме важнейшие функции. Также белки участвуют в защите организма от инфекций, а также способствуют усвоению витаминов и минеральных веществ. Наша жизнедеятельность связана с непрерывным расходом и обновлением белка. Чтобы уравновесить эти процессы, потери белка нужно ежедневно восполнять.
Вопрос 3. Какие продукты питания богаты белками?
Творог нежирный, мясо животных и птиц, большая часть сортов рыбы, морепродукты, яичный белок, соя, горох, фасоль, орехи. В этих продуктах содержание белка равно 15 гр на 100 гр продукта.
Вопрос 4. Какие органические вещества называют белками?
Белки — это полимеры, состоящие из ковалентно связанных между собой мономеров–аминокислот, имеющих сходное, но не одинаковое строение.
Вопрос 5. В чём заключаются структурные особенности аминокислот как мономеров белков?
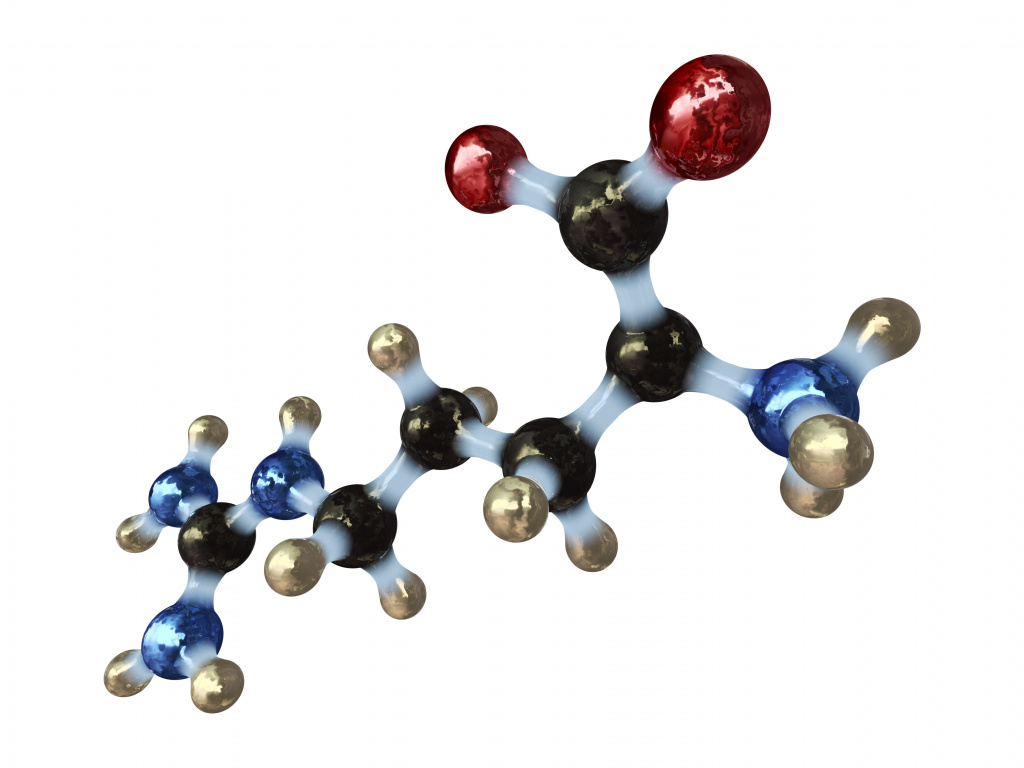
Молекула аминокислоты состоит из двух частей. Одна из них у всех подобных веществ одинакова: она содержит аминогруппу —NH2 и карбоксильную группу —СООН, которые присоединены к одному и тому же атому углерода. Другая часть этой молекулы, присоединённая к этому же атому углерода, называется боковым радикалом. У разных аминокислот он имеет разную структуру.
Вопрос 6. Как образуется пептидная связь?
Пептидная связь образуется в результате взаимодействия α — аминогруппы (—NH2) одной аминокислоты с α — карбоксильной группой (—СООН) другой аминокислоты.
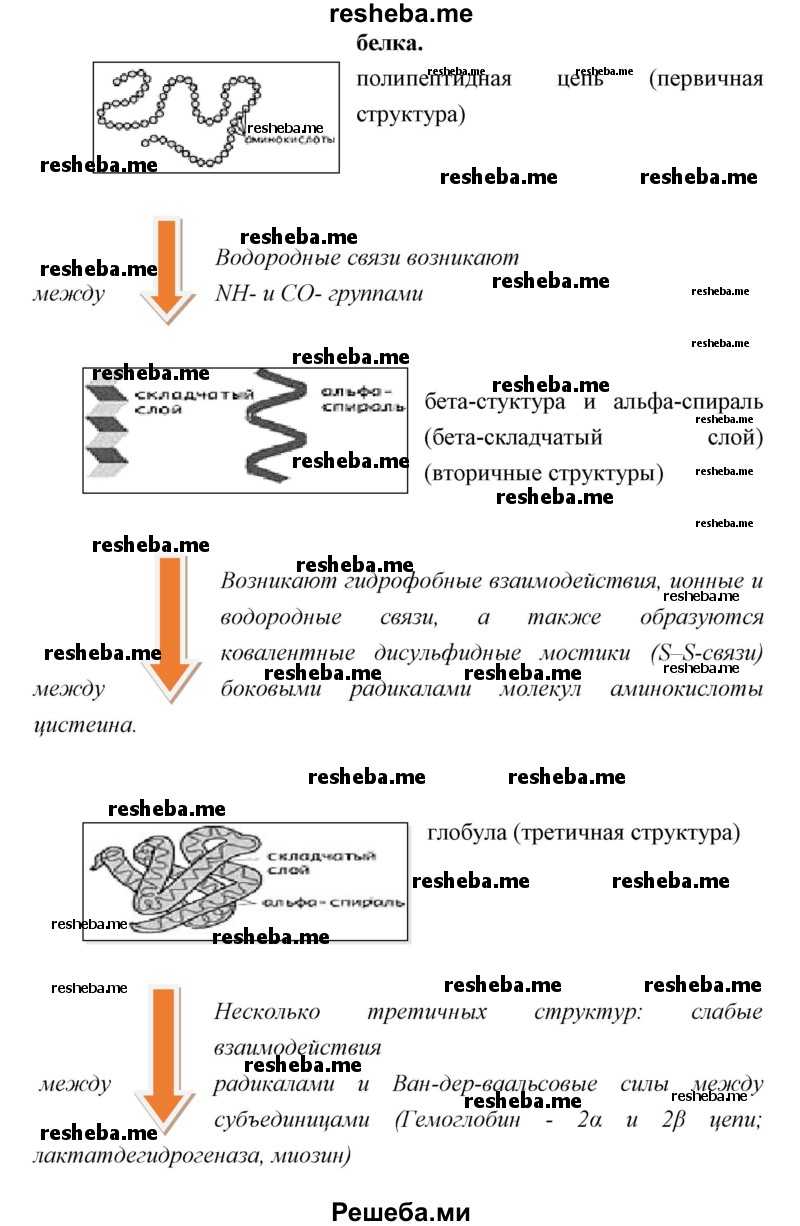
Вопрос 7. Что представляет собой первичная структура белка и от чего она зависит?
Первичная структура белка — это определенная последовательность ковалентно связанных пептидными связями аминокислот, составляющих белок. Эта последовательность, как правило, записывается, начиная с N — конца полипептидной цепочки.
Первичная структура белков, программируется последовательностью нуклеотидов в ДНК. Выпадение, вставка, замена нуклеотида в ДНК приводит к изменению структуры синтезируемого белка.
Вопрос 8. Что такое денатурация белка? Что её может вызвать?
Денатурация белка — любые изменения в его биологической активности и/или физико — химических свойствах, связанные с потерей четвертичной, третичной или вторичной структуры с сохранением первичной. Её можно вызвать механически (сильное перемешивание или встряхивание), физически (нагревание, охлаждение, облучение, обработка ультразвуком) и химически (кислоты и щёлочи, поверхностно — активные вещества, мочевина).
Вопрос 9. Изучите статью параграфа «Строение белков» и иллюстрации к ней. Обобщите для себя в виде ментальной карты, как образуются вторичная, третичная и четвертичная структуры белка.
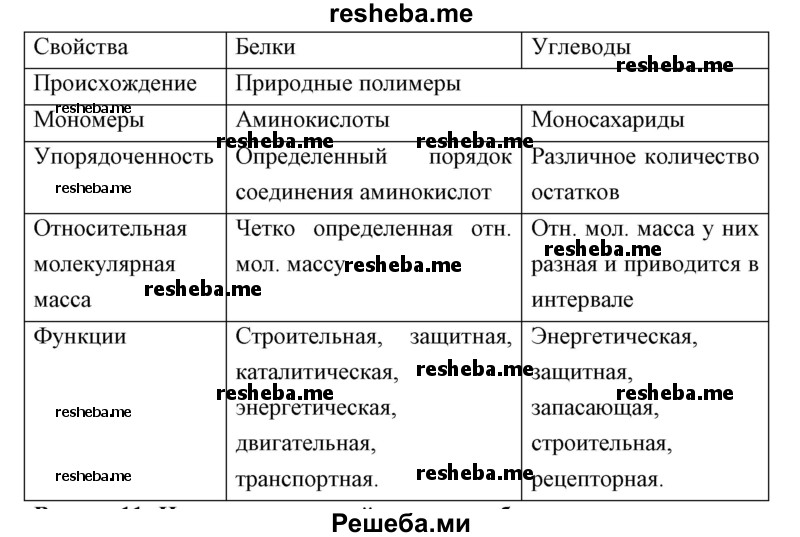
Вопрос 10. Составьте сравнительную таблицу свойств белков и углеводов.
Вопрос 11. Наверняка каждый из нас пробовал незамысловатые, но питательные блюда из куриных яиц. Кто — то любит их в варёном виде, кто — то в виде омлета или глазуньи. Чем можно объяснить изменение внешнего вида белка куриного яйца после его кулинарной обработки? Можно ли вернуть варёному яйцу первоначальную консистенцию, и если нет, то почему?
Изменение внешнего вида яичных белков при кулинарной обработке яиц объясняется свертыванием белка, или денатурацией белка.
Первоначальную консистенцию варёное яйцо принять уже не может — это самый известный случай необратимой денатурации белка в быту. Под воздействием высокой температуры растворимый в воде прозрачный белок овальбумин становится плотным, непрозрачным и нерастворимым.
Белок: мономер, строение и функции
Строение
Классификация
Сами же белки классифицируются по аминокислотному составу. Они могут быть полноценными, если содержат полной набор аминокислот, и неполноценным, если одна или несколько аминокислот отсутствуют. Если белок состоит исключительно из аминокислот, его называют простым. В случае, когда присутствует простетическая группа, которая также называется неаминокислотным компонентом, их называют сложными. Неаминокислотная группа может быть представлена в виде металлопротеинов, углеводов (гликопротеинов), липидов (липопротеинов) и нуклеиновых кислот (нуклеопротеинов).
Элементарная часть
Сами аминокислоты состоят из трех обязательных частей. Таким образом, можно сказать, что мономером белка является радикал, различающий между собой виды аминокислот, а также неизменяемые карбоксильная и амино- группы. По количеству входящих в состав карбоксильных и аминогрупп аминокислоты подразделяют на нейтральные, основные и кислые. Нейтральные имеют по одной карбоксильной и аминогруппе. В формуле основных содержится более одной аминогруппы, а в кислых аминокислотах, наоборот, имеется более чем одна карбоксильная группа.
Пептидная связь
Еще одна классификация
Как уже упоминалось выше, мономеры белков состоят из амино- и карбоксильной групп и радикала, которые образуют между собой прочные связи. Также могут присутствовать и другие вещества, однако именно от R-группы в основном зависят свойства всей молекулы, и существует еще один тип классификации. Какой? Мономеру белка свойственно иметь различные радикалы, по их типу и можно разделить все аминокислоты на гетероциклические, ароматические и алифатические. Алифатический радикал может содержать функциональные группы, которые придают особые свойства. Это амино-, карбоксильная, тиольная (-SH), гидроксильная (-OH), амидная (-C0-NH2) и гуанидиновая группы.
Разные радикалы
Организация молекул белка в пространстве
Пространственная организация белковых молекул имеет четыре уровня.
Так как мономерами молекул белков являются аминокислоты, то первичная структура представлена в виде полипептидной цепи, состоящей из аминокислотных остатков, которые объединены пептидной связью. Несмотря на кажущуюся простоту, именно первичная структура определяет, какую функцию сможет выполнять белок. Мономер в составе цепи должен быть на своем месте, замена даже одного из них изменит назначение всей молекулы. Например, если шестую глутаминовую кислоту в гемоглобине заменить на валин, вся молекула в целом перестанет функционировать, и транспорт кислорода будет нарушен. Такая замена приводит к развитию у человека серповидноклеточной анемии.
Вторичная структура характерна упорядоченным свертыванием цепи в спираль, по внешнему виду напоминающую растянутую пружину. Связи, возникающие между мономерами белков, являются водородными и укрепляют структуру. Эти связи появляются между амино- и карбоксильными группами. Водородные связи слабее пептидных, но делают всю конфигурацию более жесткой и устойчивой за счет многократного повторения. Для некоторых белков, например фиброина (паутина, шелк), кератина (ногти и волосы) и коллагена, дальнейшей компактизации не происходит.
Третий уровень
При попадании в водный раствор радикалы-гидрофобы стараются скрыться от воды путем группировки внутри глобул, а гидрофильные R-группы взаимодействуют с диполями воды (гидратация), напротив, оказываются на поверхности. Некоторые белки имеют дополнительную стабилизацию третичной структуры за счет дисульфидных ковалентных связей, которые возникают между двумя остатками цистеина за счет наличия атомов серы. На третичной структуре заканчивается компактизация белков-ферментов, антител и некоторых гормонов.
Четвертичная структура
Последняя степень компактизации присутствует в сложных белках, в составе которых имеется две и более глобул. Удерживание субъединиц происходит за счет ионных, гидрофобных и электростатических взаимодействий. Также возможно образование дисульфидных связей. Четвертичную структуру имеет белок гемоглобин, образованный двумя альфа-субъединицами, содержащими 141 аминокислотный остаток, и бета-субъединицами, в составе которых насчитывается 146 остатков. Каждая субъединица связана также с молекулой гема, в которой содержится железо.
Свойства белков
Так как мономером молекулы белка является аминокислота, то именно от них, наряду со структурной организацией, зависят и свойства. Белки проявляют как кислотные, так и основные свойства, которые определяется R-группами аминокислот: если в составе больше основных аминокислот, то и основные свойства выражены ярче. Буферные свойства белков определяется способностью присоединять и отдавать протон (H+). Гемоглобин, содержащийся в эритроцитах, является одним из мощнейших буферов, помимо связывания кислорода он исполняет функции регуляции уровня pH крови.
Денатурация
Защита и обмен веществ
Без участия белков в организме не происходит ни одного процесса. Их строительная функция заключается в участии в формировании внеклеточных и клеточных структур, они присутствуют в составе мембран клеток, волос, ногтей и сухожилий. Также выполняют и транспортную функцию: гемоглобин осуществляет перенос кислорода и углекислого газа, а белки мембран клеток активно и избирательно проводят перенос нужных веществ в клетку и из нее во внешнюю среду.
Некоторые гормоны имеют белковую природу и участвуют в регуляции обмена веществ. К примеру, инсулин производит регулировку в крови уровня глюкозы, а наряду с этим способствует образованию гликогена и оптимизирует синтез жиров из углеводов.
Защитная функция белков состоит в образовании антител в случае, если организм атакован чужеродными белками и микроорганизмами. Антитела способны находить и обезвреживать их. При ранах и порезах из фибриногена образуется фибрин, который помогает остановить кровотечение.
Другие функции
На белках лежит также и сигнальная функция. В клеточных мембранах содержатся белки, которые могут менять свою третичную структуру в зависимости от воздействия внешней среды. Это является основой приема и передачи в клетку сигналов из внешней среды.
Ни человек, ни животные не могут запасать белки (исключением является казеин молока и альбумин яиц), но белки способствуют накоплению в организме некоторых веществ. К примеру, во время распада гемоглобина железо не покидает организм, а образует комплекс с ферритином. Распад одного грамма белка дает организму и 17,6 кДж энергии, в этом заключается их энергетическая функция. Однако, как правило, организм «старается» не расходовать для этого такой важный материал, и сначала распадаются жиры и углеводы.
Аминокислоты – чьи мономеры?
Отказ от ответсвенности
Обращаем ваше внимание, что вся информация, размещённая на сайте Prowellness предоставлена исключительно в ознакомительных целях и не является персональной программой, прямой рекомендацией к действию или врачебными советами. Не используйте данные материалы для диагностики, лечения или проведения любых медицинских манипуляций. Перед применением любой методики или употреблением любого продукта проконсультируйтесь с врачом. Данный сайт не является специализированным медицинским порталом и не заменяет профессиональной консультации специалиста. Владелец Сайта не несет никакой ответственности ни перед какой стороной, понесший косвенный или прямой ущерб в результате неправильного использования материалов, размещенных на данном ресурсе.
Мономеры – это повторяющиеся звенья макромолекул органических соединений под названием биополимеры. К биополимерам относят полисахариды, нуклеиновые кислоты и белки. Аминокислоты являются мономерами белков, моносахариды – полисахаридов, нуклеотиды – нуклеиновых кислот.
Полимеры могут разрушиться до мономеров, из которых сложена их молекула. Такой процесс происходит в пищеварительной системе живых существ. Крупные вещества расщепляются до мелких, которые способны всосаться в кровь. В дальнейшем они используются для формирования новых макромолекул, необходимых организму.
Состав аминокислот
В состав аминокислот входят по одной или по две аминогруппы и карбоксильной группы. Первые обладают щелочными, а вторые кислотными свойствами. Этим обусловлены амфотерные свойства аминокислот, за счет которых они выполняют функции буферных соединений.
Внимание! У большинства аминокислот есть 1 карбоксильная и 1 аминогруппа. Они являются нейтральными.
Как аминокислоты образуют белки?
При дальнейшем объединении аминокислот посредством пептидных связей образуется полипептидная цепь. Ее называют первичной структурой белка.
Сколько аминокислот образуют все многообразие белков?
Существует 26 аминокислот. В образовании всех белков участвуют лишь 20 из них. Протеиногенные, или мажорные аминокислоты бывают заменимыми и незаменимыми.
Аминокислоты заменимые
Заменимые аминокислоты поступают в организм с пищей и образуются в нем из других аминокислот. Всего их 12:
Аминокислоты незаменимые
Незаменимые аминокислоты организмом не вырабатываются, но необходимы ему для полноценной жизнедеятельности, поэтому должны поступать с пищей. Всего их 8:
Внимание! Без аминокислот невозможна жизнедеятельность организма. Без них он не сможет производить белки, которые составляют основу всех его тканей. Кроме того, белки участвуют почти во всех физиологических процессах.
Отказ от ответсвенности
Обращаем ваше внимание, что вся информация, размещённая на сайте Prowellness предоставлена исключительно в ознакомительных целях и не является персональной программой, прямой рекомендацией к действию или врачебными советами. Не используйте данные материалы для диагностики, лечения или проведения любых медицинских манипуляций. Перед применением любой методики или употреблением любого продукта проконсультируйтесь с врачом. Данный сайт не является специализированным медицинским порталом и не заменяет профессиональной консультации специалиста. Владелец Сайта не несет никакой ответственности ни перед какой стороной, понесший косвенный или прямой ущерб в результате неправильного использования материалов, размещенных на данном ресурсе.
Тест по биологии Химический состав клетки — белки, нуклеиновые кислоты и АТФ 10 класс
Тест по биологии Химический состав клетки — белки, нуклеиновые кислоты и АТФ 10 класс. Тест включает два варианта, в каждом по 11 заданий.
Вариант 1
А1. Мономерами белков являются
1) ДНК и рРНК
2) моносахариды
3) аминокислоты
4) нуклеотиды
А2. Первичной структурой белка является
1) α-спираль, прошитая водородными связями
2) последовательность аминокислотных остатков в полипептидной цепи
3) взаимное расположение нескольких белковых цепей
4) пространственная конфигурация α-спирали, образованная за счет ковалентных полярных, неполярных и ионных связей
А3. Третичной структурой белковой молекулы является
1) α-спираль, прошитая водородными связями
2) последовательность аминокислотных остатков в полипептидной цепи
3) взаимное расположение нескольких белковых цепей
4) пространственная конфигурация α-спирали, образованная за счет ковалентных полярных, неполярных и ионных связей
А4. Функции ферментов в клетке заключаются в
1) транспорте веществ
2) ускорении химических реакций
3) защите от вирусов и чужеродных белков
4) сокращении мышечных волокон
А5. Потеря белком своих природных свойств — это
1) инициация
2) денатурация
3) ренатурация
4) трансляция
А6. Определите молекуле какого вещества принадлежит изображенный на рисунке нуклеотид
1) ДНК
2) РНК
3) АТФ
4) белок
А7. Мономером всех видов РНК является
1) нуклеотид
2) рибоза
3) аминокислота
4) урацил
А8. Молекулы иРНК в отличие от тРНК
1) служат матрицей для синтеза рРНК
2) образуют рибосомы
3) служат матрицей для синтеза белка
4) образуют липиды и углеводы
А9. Универсальным источником энергии для всех реакций, протекающих в клетке, является
1) рРНК
2) АТФ
З) тРНК
4) ДНК
В1. Функциями белков в клетке являются
1) информационная
2) запасающая, энергетическая
3) транспортная, каталитическая
4) регуляторная, защитная
5) структурная, двигательная
6) передача наследственной информации
В2. Установите соответствие между химическим веществом, его функциями, свойствами и особенностями строения.
ОСОБЕННОСТИ СТРОЕНИЯ И ФУНКЦИИ
А. Является хранителем наследственной информации
Б. Передает наследственную информацию из ядра к рибосоме
В. Содержит пиримидиновое азотистое основание — урацил
Г. Состоит из двух полинуклеотидных цепей, закрученных в спираль
Д. Состоит из одной полинуклеотидной цепи
А. Состоит из нуклеотидов АТГЦ
ВЕЩЕСТВО
Запишите выбранные цифры под соответствующими буквами.
Вариант 2
А1. Количество видов аминокислот, входящих в состав белка
1) 60
2) 20
3) 15
4) 10
А2. Вторичной структурой белковой молекулы является
1) α-спираль, прошитая водородными связями
2) последовательность аминокислотных остатков в полипептидной цепи
3) взаимное расположение нескольких белковых цепей
4) пространственная конфигурация α-спирали, образованная за счет ковалентных полярных, неполярных и ионных связей
А3. Четвертичной структурой белковой молекулы является
1) α-спираль, прошитая водородными связями
2) последовательность аминокислотных остатков в полипептидной цепи
3) взаимное расположение нескольких белковых цепей
4) пространственная конфигурация α-спирали, образованная за счет ковалентных полярных, неполярных и ионных связей
А4. При нарушении третичной и четвертичной структуры молекул белка в клетке перестают функционировать
1) АТФ
2) липиды
3) ферменты
4) углеводы
А5. Белком, увеличивающим скорость химической реакции в клетке, является
1) витамин
2) фермент
3) гормон
4) нуклеотид
А6. Связь, возникающая между азотистыми основаниями двух комплементарных цепей ДНК
1) ковалентная полярная
2) водородная
3) ковалентная неполярная
4) ионная
А7. Мономером ДНК является
1) нуклеотид
2) дезоксирибоза
3) аминокислота
4) тимин
А8. Определите, молекуле какого вещества принадлежит изображенный на рисунке нуклеотид.
1) ДНК
2) РНК
3) АТФ
4) белок
А9. Синтез АТФ происходит в
1) ядре
2) митохондриях
3) ядрышке
4) рибосомах
В1. Нуклеотид ДНК клетки состоит из
1) рибозы и урацила
2) азотистого основания
3) остатка азотной кислоты
4) дезоксирибозы
5) остатка фосфорной кислоты
6) аминокислоты
В2. Установите соответствие между химическим веществом, его функциями, свойствами и особенностями строения.
ОСОБЕННОСТИ СТРОЕНИЯ И ФУНКЦИИ
А. Состоит из одной полинуклеотидной цепи
Б. Входит в состав рибосом
В. Состоит из нуклеотидов АТГЦ
Г. Состоит из двух полинуклеотидных цепей, закрученных в спираль
Д. Является хранителем наследственной информации
Е. Состоит из нуклеотидов АУГЦ
ВЕЩЕСТВО
Запишите выбранные цифры под соответствующими буквами.
Ответы на тест по биологии Химический состав клетки — белки, нуклеиновые кислоты и АТФ 10 класс
Вариант 1
А1-3
А2-2
А3-4
А4-2
А5-2
А6-1
А7-1
А8-3
А9-2
В1. 345
В2. А1 Б2 В2 Г1 Д2 Е1
Вариант 2
А1-2
А2-1
А3-3
А4-3
А5-2
А6-2
А7-1
А8-2
А9-2
В1. 245
В2. А2 Б2 В1 Г1 Д1 Е2
Какие молекулы являются мономерами белка
«Жизнь, есть способ существования белковых тел»
Ни один из известных нам живых организмов не обходится без белков. Белки служат питательными веществами, они регулируют обмен веществ, исполняя роль ферментов – катализаторов обмена веществ, способствуют переносу кислорода по всему организму и его поглощению, играют важную роль в функционировании нервной системы, являются механической основой мышечного сокращения, участвуют в передаче генетической информации и т.д.
Белки (полипептиды) – биополимеры, построенные из остатков α-аминокислот, соединенных пептидными (амидными) связями. В состав этих биополимеров входят мономеры 20 типов. Такими мономерами являются аминокислоты. Каждый белок по своему химическому строению является полипептидом. Некоторые белки состоят из нескольких полипептидных цепей. В составе большинства белков находится в среднем 300-500 остатков аминокислот. Известно несколько очень коротких природных белков, длиной в 3-8 аминокислот, и очень длинных биополимеров, длиной более чем в 1500 аминокислот. Образование белковой макромолекулы можно представить как реакцию поликонденсации α-аминокислот:
Аминокислоты соединяются друг с другом за счёт образования новой связи между атомами углерода и азота – пептидной (амидной):
Из двух аминокислот (АК) можно получить дипептид, из трёх – трипептид, из большего числа АК получают полипептиды (белки).
Функции белков в природе универсальны. Белки входят в состав мозга, внутренних органов, костей, кожи, волосяного покрова и т.д. Основным источником α — аминокислот для живого организма служат пищевые белки, которые в результате ферментативного гидролиза в желудочно-кишечном тракте дают α — аминокислоты. Многие α — аминокислоты синтезируются в организме, а некоторые необходимые для синтеза белков α — аминокислоты не синтезируются в организме и должны поступать извне. Такие аминокислоты называются незаменимыми. К ним относятся валин, лейцин, треонин, метионин, триптофан и др. (см. таблицу). При некоторых заболеваниях человека перечень незаменимых аминокислот расширяется.
Ферменты катализируют реакции расщепления сложных молекул (катаболизм) и их синтеза (анаболизм), а также репликации ДНК и матричного синтеза РНК. Известно несколько тысяч ферментов. Среди них такие, как, например пепсин, расщепляют белки в процессе пищеварения.
Так, белок эритроцитов крови гемоглобин соединяется в легких с кислородом, превращаясь в оксигемоглобин. Достигая с током крови органов и тканей, оксигемоглобин расщепляется и отдает кислород, необходимый для обеспечения окислительных процессов в тканях.
· Сократительная функция (актин, миозин) – в результате взаимодействия белков происходит передвижение в пространстве, сокращение и расслабление сердца, движение других внутренних органов.
В комплексе с липидами белки участвуют в построении мембран клеток и внутриклеточных образований.
Выполняют белки-регуляторы обмена веществ. Они относятся к гормонам, которые образуются в железах внутренней секреции, некоторых органах и тканях организма.
Например: казеин, яичный альбумин, белки яйца обеспечивают рост и развитие плода, а белки молока служат источником питания для новорожденного.
Разнообразные функции белков определяются α-аминокислотным составом и строением их высокоорганизованных макромолекул.
Физические свойства белков
Белки – очень длинные молекулы, которые состоят из звеньев аминокислот, сцепленных пептидными связями. Это – природные полимеры, молекулярная масса белков колеблется от нескольких тысяч до нескольких десятков миллионов. Например, альбумин молока имеет молекулярную массу 17400, фибриноген крови – 400.000, белки вирусов – 50.000.000. Каждый пептид и белок обладают строго определенным составом и последовательностью аминокислотных остатков в цепи, это и определяет их уникальную биологическую специфичность. Количество белков характеризует степень сложности организма (кишечная палочка – 3000, а в человеческом организме более 5 млн. белков).
С точки зрения пищевой ценности белков, определяемой их аминокислотным составом и содержанием так называемых незаменимых аминокислот, белки подразделяются на полноценные и неполноценные. К полноценным белкам относятся преимущественно белки животного происхождения, кроме желатины, относящейся к неполноценным белкам. Неполноценные белки — преимущественно растительного происхождения. Однако некоторые растения (картофель, бобовые и др.) содержат полноценные белки. Из животных белков особенно большую ценность для организма представляют белки мяса, яиц, молока и др.
В состав многих белков помимо пептидных цепей входят и неаминокислотные фрагменты, по этому критерию белки делят на две большие группы — простые и сложные белки (протеиды). Простые белки содержат только аминокислотные цепи, сложные белки содержат также неаминокислотные фрагменты (Например, гемоглобин содержит железо).
По общему типу строения белки можно разбить на три группы:
1. Фибриллярные белки — нерастворимы в воде, образуют полимеры, их структура обычно высокорегулярна и поддерживается, в основном, взаимодействиями между разными цепями. Белки, имеющие вытянутую нитевидную структуру. Полипептидные цепи многих фибриллярных белков расположены параллельно друг другу вдоль одной оси и образуют длинные волокна (фибриллы) или слои.
2. Глобулярные белки — водорастворимы, общая форма молекулы более или менее сферическая. Среди глобулярных и фибриллярных белков выделяют подгруппы. К глобулярным белкам относятся ферменты, иммуноглобулины, некоторые гормоны белковой природы (например, инсулин) а также другие белки, выполняющие транспортные, регуляторные и вспомогательные функции.
3. Мембранные белки — имеют пересекающие клеточную мембрану домены, но части их выступают из мембраны в межклеточное окружение и цитоплазму клетки. Мембранные белки выполняют функцию рецепторов, то есть осуществляют передачу сигналов, а также обеспечивают трансмембранный транспорт различных веществ. Белки-транспортеры специфичны, каждый из них пропускает через мембрану только определённые молекулы или определённый тип сигнала.
Белки – неотъемлемая часть пищи животных и человека. Живой организм отличается от неживого в первую очередь наличием белков. Для живых организмов характерно огромное разнообразие белковых молекул и их высокая упорядоченность, что и определяет высокую организацию живого организма, а также способность двигаться, сокращаться, воспроизводиться, способность к обмену веществ и к многим физиологическим процессам.
Фишер Эмиль Герман, немецкий химик-органик и биохимик. В 1899 начал работы по химии белков. Используя созданный им в 1901 эфирный метод анализа аминокислот, Ф. впервые осуществил качественные и количественные определения продуктов расщепления белков, открыл валин, пролин (1901) и оксипролин (1902), экспериментально доказал, что аминокислотные остатки связываются между собой пептидной связью; в 1907 синтезировал 18-членный полипептид. Ф. показал сходство синтетических полинептидов и пептидов, полученных в результате гидролиза белков. Ф. занимался также изучением дубильных веществ. Ф. создал школу химиков-органиков. Иностранный член-корреспондент Петербургской АН (1899). Нобелевская премия (1902).
Разнообразные функции белков определяются α-аминокислотным составом и строением их высокоорганизованных макромолекул.
Выделяют 4 уровня структурной организации белков:
2. Вторичная структура –
Молекула белка стремится не только к реализации своей биоактивности, но и к наиболее компактной структуре, позволяющей ей максимально реализовать свои функции.
Посмотрите учебный видеоматериал: