какие морфологические свойства имеют колонии s pneumoniae на кровяном агаре
Пневмококковая инфекция
Пневмококковая инфекция обусловлена патогенным микроорганизмом Streptococcus pneumoniae. Этот возбудитель является главной причиной острых внебольничных пневмоний, занимает ведущее место в этиологии бактериальных менингитов, острых средних отитов, синуситов, вызывает первичный сепсис, заболевания кожи, суставов и другие инфекции, пневмококки являются этиологической причиной пневмонии в 20–75% случаев. Риносинусит имеет пневмококковую этиологию в 20–43% случаев, средний отит – 30–50%.
Ежегодно в США диагностируется около 4 млн. случаев внебольничной пневмонии и более 3 млн. в странах Европейского союза. В России число таких больных превышает 1,5 млн. человек в год, а заболеваемость составляет 14–15 случаев на 1000 населения. По данным Министерства обороны РФ у военных срочной службы в течение 2000–2003 гг. заболеваемость пневмонией превышала показатель 40 случаев на 1000 военнослужащих.
Заболеваемость пневмококковым менингитом в США определяется на уровне 1–2 случая на 100 тыс. населения с уровнем летальности 19–46% в различных возрастных группах. В России, по данным Референс-центра по надзору за гнойными бактериальными менингитами за 2010 г., общий уровень заболеваемости составил 0,19 на 100 тыс. населения (с колебаниями по Федеральным округам от 0,11 до 0,30 на 100 тыс. населения), с летальностью 13%.
В тоже время, пневмококк относится к нормальным обитателям ротоглотки и частота здорового носительства в популяции может достигать 40–70%. При этом возможно как одновременное носительство различных серотипов пневмококка, так и смена одного серотипа другим в течение непродолжительного времени. Заболевание пневмонией, отитом, синуситом, как правило, возникает при попадании микроба в нижние или верхние дыхательные пути на фоне нарушения защитных механизмов организма человека (снижение уровня общего и местного иммунитета, нарушение мукоцилиарного клиренса и др.). При генерализации процесса развивается сепсис, менингит, абсцессы внутренних органов, поражения сердца (эндокардит), почек, суставов.
Резервуаром пневмококковой инфекции является человек. Вместе с тем, пневмококковая патология встречается у диких и домашних копытных животных (овец, коз, телят и т. д.), преимущественно в виде пневмонии или сепсиса. Выделенный возбудитель от животных не отличается по свойствам от пневмококка, вызывающего заболевание у людей.
Основной путь передачи инфекции – воздушно-капельный, иногда контактный. Отмечены случаи внутриутробного заражения. Пик заболеваемости приходится на холодные сезоны года и носит спорадический характер. Среди заболевших преобладают мужчины. Наиболее уязвимыми возрастными контингентами являются дети до 5 лет и лица пожилого возраста (старше 65 лет). Пневмококковая инфекция наиболее тяжело, с генерализацией инфекционного процесса, протекает у лиц старших возрастов, особенно при наличии сопутствующих хронических патологий (хроническая обструктивная болезнь легких, злокачественные новообразования, алкоголизм, сахарный диабет, заболевания сердечно-сосудистой системы, почек и печени и др.), а также иммунодефицитов различного генеза.
Показания к обследованию. Пациенты при подозрении на крупозную пневмонию, острый бронхит; отит, синусит; менингит, менингоэнцефалит; септическое состояние; поражения кожи, подкожной клетчатки, соединительной ткани (редкая локализация инфекции); конъюнктивит (редкая локализация инфекции).
Дифференциальная диагностика проводится с микробными агентами:
Материал для исследования
Этиологическая лабораторная диагностика включает выявление пневмококков методом микроскопии, посев исследуемого материала с дальнейшей культуральной и биохимической идентификацией возбудителя, определением антибиотикочувствительности; обнаружение специфических генетических фрагментов пневмококка и его АГ, обнаружение специфических АТ.
Сравнительная характеристика методов лабораторной диагностики и особенности интерпретации их результатов. Микроскопические исследования используют для выявления пневмококков в разных видах биологического материала: мокроте, плевральной жидкости, отделяемом из уха, придаточных пазух, СМЖ, крови. Диагностическая ценность обнаружения в мазке мокроты диплококков «сходных с пневмококками» до сих пор остается дискуссионной. Большинство исследователей считают, что это исследование может использоваться только при соблюдении ряда жестких условий:
Для посева с дальнейшей культуральной и биохимической идентификацией возбудителя, определением антибиотикочувствительности используют различные виды материала: мокрота, бронхоальвеолярный лаваж, отделяемое из уха и придаточных пазух, кровь, ликвор, плевральная жидкость.
При наличии роста на чашках проводится обязательная количественная оценка бактериального роста и выделение чистой культуры предполагаемого возбудителя для дальнейшей идентификации.
Принадлежность к виду Streptococcus pneumoniae подтверждается:
Оценка результатов культурального исследования. Для нестерильных локусов:
Для стерильных локусов:
Для определения чувствительности к антибиотикам используются несколько методов.
Наиболее важным при тяжелых пневмококковых инфекциях является определение чувствительности пневмококков к пенициллину и другим бета-лактамным антибиотикам (аминопенициллинам, карбапинемам, цефалоспоринам) – основным препаратам выбора. В качестве скринингового теста для определения чувствительности к этим препаратам используется диско-диффузионный метод.
В исследование обязательно включают изучение чувствительности к макролидам, линкозамидам, стрептограминам. Данные препараты часто используются для лечения внегоспитальной пневмококковой пневмонии и заболеваний верхних дыхательных путей. Пневмококки могут быть устойчивыми только к 14- и 15-членным макролидам, при сохранении чувствительности к 16-членным макролидам и линкозамидам, а могут быть устойчивыми ко всем представителям этих классов.
Определение устойчивости к хинолонам, хлорамфениколу, тетрациклину, котримоксазолу, рифампицину, ванкомицину, позволяет более полно характеризовать фенотип возбудителя. При этом необходимо учитывать, что ранние хинолоны (офлоксацин), которые применяются в отношении пневмококков, резистентных к пенициллину, в последнее время показывают рост устойчивости к этому препарату. Для преодоления устойчивости используют новые фторхинолоны с повышенной антипневмококковой активностью: спарфлоксацин, моксифлоксацин и др.
Примерно от 5 до 15% культур пневмококков в России демонстрируют полирезистентные свойств, т. е. одновременной устойчивостью к 3 и более классам препаратов.
Для обнаружение АГ пневмококка в пробах биологических жидкостей пациента применяют методы латекс-агглютинации и ИХА. Наборы реагентов, основанные на реакции латекс-агглютинации или коагглютинации, предназначены для работы с материалом, полученным из стерильных локусов (кровь, ликвор), при работе с нестерильными локусами эти наборы могут давать ложноположительный результат. Чувствительность и специфичность наборов разных производителей составляет 94–100% и 85–98%, соответственно. Набор реагентов с использованием ИХА позволяет определить наличие указанного АГ у больных пневмонией (в моче) и менингитом (в СМЖ). Этот тест рекомендован как дополнительный метод диагностики пневмоний. При исследовании проб пациентов с высоким уровнем назофарингеального носительства возможны ложноположительные результаты.
Для обнаружения специфических генетических фрагментов пневмококка применяют ПЦР, в качестве мишеней используют специфические фрагменты генов, кодирующих факторы патогенности: пневмолизин (Ply), аутолизин (LytA), пневмококковый поверхностный АГ (PsaA), пневмококковый поверхностный протеин А (PspA), марганец-зависимая супероксид-дисмутаза (sodA), поверхностный пенициллин-связывающий белок 2b (Pbp2b), Spn9802, Spn9828. Для повышения специфичности исследования применяется мультиплексная ПЦР, при которой проводится одновременная индикация нескольких генов патогенности с сохранением высокой чувствительности реакции.
Остается проблемой установление диагностически значимых количественных показателей, позволяющих дифференцировать заболевание от носительства при исследовании материала из нестерильных локусов.
Метод исследования продуктов АНК при мультилокусном секвенировании-типировании для генетического типирования пневмококков основан на секвенировании внутренних фрагментов семи генов «домашнего хозяйства» (housekeeping genes), специфичных для возбудителя. Метод чаще используется для генетического типирования пневмококка, чем для идентификации.
Использование метода секвенирования участка 16S рибосомальной РНК для идентификации пневмококков затруднено сходством с некоторыми видами стрептококков, входящих в группу Mitis. Гомология ДНК-ДНК между стрептококками, входящими в группу Mitis, составляет 40–60%, тогда как сходство сиквенсов 16S рРНК генов между S.mitis, S.oralis и S.pneumoniae может достигать более чем 99%. Сравнение участков 16S рРНК между штаммами S.pseudopneumoniae и S.pneumoniae (суммарный размер 1 468 пар нуклеотидов) показало 99,7% совпадение сиквенса, различие отмечено только в 5 парах нуклеотидов.
Для исследования используют также методы РНК-ДНК и ДНК-ДНК гибридизации, в основе которых лежит способность нуклеиновых кислот к гибридизации (TaqMan принцип). Готовый набор реагентов для идентификации «AccuProbe Streptococcus pneumoniae culture identification test» (Gen-Probe, USA) построен на этом принципе с использованием в качестве мишени участка гена 16S рРНК. Для детекции участков рибосомальной РНК исследуемого штамма употребляется одноцепочечная ДНК в качестве зонда, которая комплиментарна выбранной специфичной для пневмококка мишени 16S рРНК и содержит хемолюминесцентную метку. При совпадении нуклеотидов мишени рРНК с нуклеотидами ДНК-зонда образуется устойчивое образование в форме ДНК-РНК гибрида. После добавления селектирующего реагента, дифференцирующего гибридизированные и негиброидизированные пробы, меченые гибриды ДНК-РНК могут быть выявлены с помощью люминометра. Если использовать AccuProbe в качестве референтного стандарта, чувствительность и специфичность бактериологических методов идентификации составляет: для желчного теста 98,8% и 82,6%, для реакции набухания капсулы с Omni сывороткой 99,2 и 74,4%; 87,9 и 59,3% для теста с оптохином.
Обнаружение АТ редко используются при проведении лабораторной диагностики пневмококковой инфекции. Это связано с отсутствием надежных доступных методик, имеющих достаточную чувствительность и специфичность и ролью временного фактора, поскольку для выявления роста титров АТ необходимо значительное время от начала заболевания. В настоящий момент используются определения АТ против четырех АГ пневмококка (С-антигена, капсульных полисахаридов, фосфорилхолина и пневмолизина). Чувствительность метода для С-антигена и капсульных полисахаридов составляет 89% и 97% соответственно. Наиболее распространенные методы определения – ИФА и РИФ (МФА). При применении МФА в качестве АГ рекомендуется использовать аутоштамм пневмококка, выделенный от данного больного. В случае отсутствия аутоштамма применяют смесь штаммов из наиболее часто встречающихся на данной территории серотипов. Выявление минимального диагностического титра АТ к пневмококку у детей до 3 лет 1:320 и 1:640 у взрослых свидетельствует о пневмококковой этиологии перенесенного заболевания.
Какие морфологические свойства имеют колонии s pneumoniae на кровяном агаре
Впервые пневмококк выделил Пастер (1881) во время работы над антирабической вакциной и первоначально считал его возбудителем бешенства. Этиологическую роль пневмококка в развитии пневмоний у человека доказали К. Френкель и А. Вайхзельбаум (1884).
Бактерии пневмококка не содержат группового Аг и серологически неоднородны — по Аг капсульных полисахаридов выделяют 84 серовара. Известны штаммы, колонизирующие организмы человека и животных.
Эпидемиология пневмококка
Пневмококк — один из основных возбудителей внебольничных бактериальных пневмоний (2-4 случая на 1000 человек). Ежегодно в мире регистрируют не менее 500 000 случаев пневмококковых пневмоний, причём наиболее подвержены инфекции дети и лица преклонного возраста.
Резервуар пневмококковой инфекции — больные и носители (20-50% детей дошкольного возраста и 20-25% взрослых), основной путь передачи пневмококка — контактный, а в период вспышек также воздушно-капельный. Пик заболеваемости приходится на холодное время года.
В подавляющем большинстве случаев клинические формы пневмококковой инфекции развиваются при нарушениях резистентности организма (в том числе вследствие Холодовых стрессов), а также на фоне сопутствующей патологии (серповидноклеточной анемии, болезни Ходжкена, ВИЧ-инфекции, миеломы, сахарного диабета, состояний после спленэктомии) или алкоголизма.
Морфология пневмококка. Культуральные свойства пневмококка
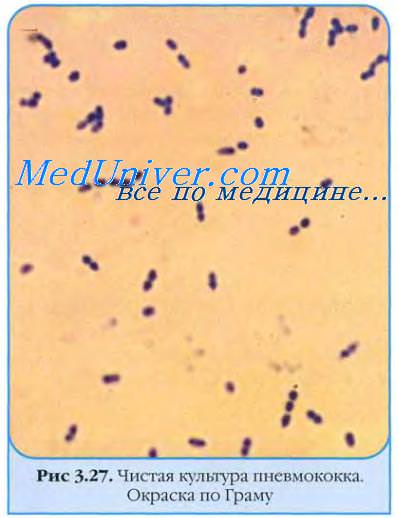
Пневмококки представлены овальными или ланцетовидными кокками диаметром около 1 мкм. В мазках из клинического материала пневмококки располагаются парами, каждая пара окружена толстой капсулой (рис. 12-10).
Образование капсул пневмококками стимулирует внесение в среду крови, сыворотки или асцитической жидкости. На агаре пневмококки образуют нежные полупрозрачные, чётко очерченные колонии диаметром около 1 мм; иногда они могут быть плоскими с углублением в центре. Подобно прочим стрептококкам, колонии никогда не сливаются между собой. На КА колонии окружает зона а-гемолиза в виде зеленоватой обесцвеченной зоны.
Определение чувствительности Streptococcus spp.
Для определения чувствительности стрептококков используют следующие питательные среды:
Определение чувствительности Streptococcus pneumoniae
Бета-лактамные антибиотики (в частности пенициллин) являются препаратами выбора для терапии пневмококковых инфекций. В то же время критерии интерпретации результатов определения чувствительности пневмококков к этим препаратам постоянно пересматриваются в связи с появлением новых клинических и экспериментальных данных об эффективности различных бета-лактамов при пневмококковых инфекциях, вызванных штаммами с различным уровнем чувствительности к пенициллину.
Механизм резистентности S.pneumoniae к пенициллину и другим бета-лактамным антибиотикам обусловлен изменением пенициллиносвязывающих белков (ПСБ) клеточной стенки. В результате ступенчатых мутаций уменьшается сродство ПСБ к бета-лактамным антибиотикам.
При этом установлено, что при лечении инфекций дыхательных путей, вызванных штаммами S.pneumoniae с промежуточным уровнем резистентности к пенициллину, бета-лактамные антибиотики остаются клинически эффективными, но применение их при менингите приводит к неудаче терапии.
В связи с этим при разработке критериев интерпретации результатов определения чувствительности S.pneumoniae к бета-лактамным антибиотикам было проведено подразделение штаммов по источникам выделения (инфекции дыхательных путей, ликвор) и пересмотрены критерии оценки чувствительности к амоксициллину, цефотаксиму и цефтриаксону. Критерии интерпретации результатов определения чувствительности к пенициллину не пересмотрены.
Следует обратить внимание на несколько важных особенностей определения чувствительности S.pneumoniae:
Поэтому определение чувствительности пневмококков к пенициллину и другим бета-лактамным антибиотикам подразумевает последовательное (выделение S.pneumoniae из нестерильных локусов) или одновременное (при тяжелых инфекциях, выделении пневмококков из крови и ликвора) выполнение двух исследований:
Скрининг на наличие пенициллинорезистентности у штаммов S.pneumoniae
Постановка теста
Методика проведения исследования не отличается от обычной процедуры определения чувствительности пневмококков к АБП ДДМ.
Какие морфологические свойства имеют колонии s pneumoniae на кровяном агаре
4.2. МЕТОДЫ КОНТРОЛЯ. БИОЛОГИЧЕСКИЕ И МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Лабораторная диагностика внебольничной пневмонии пневмококковой этиологии
1. Разработаны Федеральной службой по надзору в сфере защиты прав потребителей и благополучия человека (Ю.В.Демина), ГБОУ ВПО ПГМУ им.ак.Е.А.Вагнера Минздрава России (И.В.Фельдблюм, Ю.А.Захарова, В.В.Николенко, Н.Н.Воробьева, С.О.Голоднова, А.В.Климашина), МБУЗ «Городская клиническая больница N 8» г.Челябинска (О.А.Орлова), ФБУН «Центральный научно-исследовательский институт эпидемиологии» Роспотребнадзора (В.В.Малеев, Г.А.Шипулин, С.Б.Яцышина, К.О.Миронов), «Научно-исследовательский институт антимикробной химиотерапии» ГБОУ ВПО «Смоленская ГМА» Минздрава России (Р.С.Козлов, С.А.Рачина), ФГБУ «Научно-исследовательский институт эпидемиологии и микробиологии им.Н.Ф.Гамалея» Минздрава России (И.С.Тартаковский), ФГБУЗ «Научно-исследовательский институт детских инфекций» ФМБА России (С.В.Сидоренко, В.В.Гостев, М.О.Волкова).
2. Утверждены и введены в действие Руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главным государственным санитарным врачом Российской Федерации А.Ю.Поповой 20 октября 2016 г.
1. Область применения
1.2. Методические рекомендации предназначены для специалистов организаций, осуществляющих лабораторную диагностику заболеваний органов дыхания, индикацию патогенов инфекций верхних и нижних дыхательных путей.
2. Термины и сокращения

3. Общие положения
По данным федерального статистического наблюдения (форма N 2 «Сведения об инфекционных и паразитарных заболеваниях»), за 2011-2014 гг. заболеваемость ВП в России находилась на уровне 310-380 на 100 тыс. населения (600-750 случаев на 100 тыс. детей в возрасте до 14 лет).
У отдельных категорий граждан, в частности у военнослужащих срочной службы, медицинских работников, заболеваемость пневмококковыми пневмониями превышает уровень заболеваемости среди населения в целом.
Дети первых лет жизни являются основными источниками пневмококковой инфекции, заражая окружающих взрослых. Так, при средней частоте носительства у взрослых в 5-7%, среди взрослых, проживающих с детьми, она может достигать 30%.
По данным отчетной формы государственного статистического наблюдения в России (ф-2), пневмококковая этиология ВП подтверждается лишь в 1,3% случаев.
Создавшаяся ситуация требует поиска новых диагностических подходов и разработки алгоритмов выявления S. pneumoniae, включая стандартизацию бактериологических и серологических тестов, внедрение в работу практической медицины современных молекулярно-биологических и иммунохроматографических способов детекции возбудителя.
4. Биологические свойства Streptococcus pneumoniae, общая характеристика методов лабораторной диагностики
На плотных питательных средах пневмококк образует мелкие (1-2 мм в диаметре), округлые, блестящие, бесцветные колонии с ровным краем, мягкой консистенции, которые в большинстве случаев через 24 часа инкубации имеют сферическую форму с уплощенным центром, образующимся в результате аутолиза (шероховатая R-форма).
На 5%-м кровяном агаре вокруг колоний пневмококка характерно образование зеленящей зоны альфа-гемолиза. Наиболее вирулентные капсульные бактерии могут располагаться в виде капель росы, в последующем принимая сливной рост (мукоидная М-форма). Гладкие, компактные, точечные колонии (S-форма) преобладают у авирулентных штаммов.
Рост S. pneumoniae на жидких питательных средах характеризуется диффузным помутнением бульона без образования пленки.
Биохимическая активность пневмококка во многом совпадает с активностью других зеленящих стрептококков: он разлагает глюкозу, лактозу, мальтозу, сахарозу, не ферментирует маннит, салицин и сорбит, однако в отличие от других представителей зеленящих форм стрептококков не обладает способностью к росту при температуре 45°С.
Видовая специфичность пневмококка выражается в способности ферментировать инулин, чувствительности к оптохину и солям желчных кислот (дезоксихолату и таурохолату натрия). Вместе с тем в последние годы появились изоляты, устойчивые к оптохину (до 10% от всей популяции).
Вирулентность пневмококка в первую очередь обусловлена наличием полисахаридной капсулы, обеспечивающей антифагоцитарную активность, а также протеина адгезии, протеазы секреторного IgA, тейхоевой кислоты и фрагментов пептидогликана, активизирующих комплемент по альтернативному типу.
В зависимости от химического строения капсульного полисахарида выделяют более 90 серологических типов S. pneumoniae: серогруппы (обозначаются цифрами, например: серогруппа 6) и входящие в них серотипы (обозначаются буквами, например: серотип 6А). Определение серологических типов проводится с использованием серологических методик, основанных на реакции набухания капсулы в присутствии иммунной сыворотки или в реакции латкес-агглютинации. Альтернативным способом определения серогрупп (серотипов) является детекция специфических локусов бактериальной ДНК, вовлеченных в биосинтез капсульного полисахарида, с помощью различных ПЦР-методик или секвенирования ДНК.
Более 90% инвазивных заболеваний вызывается 23 серотипами возбудителя, которые входят в широко используемую в настоящее время полисахаридную вакцину (1, 2, 3, 4, 5, 6В 7F, 8, 9N, 9V, 10А, 11А, 12F, 14, 15В, 17F, 18С, 1-9F, 19А, 20, 22F, 23F, 33F).
Микроскопическое исследование относится к простым ускоренным методам обнаружения S. pneumoniae, позволяющим получить предварительный результат. Бактериоскопия окрашенного по Граму мазка определяет морфотип потенциального бактериального патогена. Ценность метода и решаемые задачи различаются в зависимости от того, из какого локуса организма отобран клинический материал.
Модифицированным вариантом микроскопии в комбинации с серологической диагностикой S. pneumoniae является метод Нейфельда или феномен набухания капсулы при взаимодействии с неразведенной специфической антипневмококковой сывороткой (I, II, lll типов) в присутствии синьки Лёффлера. Метод основан на способности капсул пневмококков увеличиваться в объеме в присутствии гомологичной антисыворотки, что регистрируют светооптической микроскопией. При положительном результате наблюдается резкое увеличение капсул пневмококков. При отрицательном результате капсулы едва заметны. Реакция набухания специфична и не дает положительного результата с другими капсульными бактериями, однако с его помощью невозможно идентифицировать не имеющие капсулы S. pneumoniae.
Пневмококки, имеющие капсулу, также можно визуализировать по методу Бурри-Гинса. По Бурри материал перемешивают с тушью, на фоне которой будут выделяться неокрашенные бактерии и капсулы. В модификации Гинса приготовленный по Бурри препарат дополнительно окрашивается фуксином Циля, при этом бактерии приобретают ярко малиновую окраску, а их капсулы остаются неокрашенными.
У пациентов, принимавших антибактериальные препараты, данные методы могут давать ложно-отрицательные результаты, поскольку в этом случае в клиническом материале могут присутствовать пневмококки, лишенные капсулы. Следует помнить, что при переходе S. pneumoniae из S в R-форму капсульные антигены утрачиваются.
Бактериологический метод позволяет выделить «чистую» культуру возбудителя, провести его видовую идентификацию и серотипирование, определить чувствительность к антимикробным препаратам.
Основной сложностью при выделении культуры пневмококка является требовательность к условиям культивирования и склонность микроорганизма к быстрому аутолизу (саморазрушению). Ограничением метода может быть сложность получения мокроты и значительная продолжительность исследования (результат определяется спустя 48-72 часа с момента забора биологического материала). Диагностическая ценность будет ниже при исследовании крови и широком использовании антимикробных препаратов на догоспитальном этапе (низкий уровень высеваемости).
Необходимо помнить, что в современной популяции до 10% изолятов пневмококков устойчивы к оптохину, они также резистентны и к бета-лактамным антибиотикам. В то же время рост некоторых «зеленящих» стрептококков подавляется оптохином.
Принадлежность S. pneumoniae, устойчивых к оптохину, необходимо подтверждать с использованием комплекса тестов, дифференцирующих между собой различные виды стрепрококков, с помощью тест-систем коммерческого производства, разрешенных к применению в Российской Федерации.
К сожалению, один из современных методов идентификации бактерий по белковому профилю, MALDI-масс-спектрометрия, не может быть использован для идентификации S. pneumoniae в связи с высоким сходством белкового профиля различных видов гемолитических стрептококков.
К способам обнаружения антигена пневмококка с целью его ускоренного выявления может быть отнесен метод латекс-агглютинации, основанный на выявлении пневмококковых капсульных полисахаридных антигенов с применением поливалентной специфической пневмококковой сыворотки. Антиген, содержащийся в исследуемом образце, взаимодействует со специфичными гомологичными антителами, которыми покрыты латексные частицы. В присутствии гомологичного антигена латексные частицы агглютинируют. В отсутствии антигена, они остаются в виде гомогенной суспензии.
В последние годы все большую популярность приобретают быстрые тесты «у постели больного», в частности иммунохроматографический экспресс-тест для выявления пневмококкового клеточного полисахарида (с-полисахарида) в моче.